Доказательная медицина и онкология
Как отметил первый лектор Александр Петрачков, медицина не всесильна, и пока не может справиться со всеми онкологическими заболеваниями. Существуют практически неизлечимые виды рака, например опухоли головного мозга и рак поджелудочной железы. Однако благодаря профилактике многие злокачественные образования можно предотвратить. Профилактика включает в себя три составляющие.
Первичная профилактика позволяет снизить факторы риска развития раковых заболеваний. Назовем основные факторы:
- Возраст.
- Вирусы и инфекции.
- Генетика. Необходимо регулярно обследоваться, если ближайшие родственники болели раком.
- Алкоголь и сигареты.
- Иммунодефицит.
- Радиация.
- Ультрафиолетовое излучение.
- Хронические воспаления. Так, если не лечить изжогу, она может привести к осложнению — пищеводу Барретта. Он в свою очередь может стать причиной рака пищевода.
- Красное мясо. Постоянное его употребление может привести к раку толстой кишки.
Вторичная профилактика призвана выявить раковые заболевания на ранних стадиях. В частности, методы скрининга помогают в своевременной диагностике и лечении.
Третичная профилактика позволяет снизить риск появления раковых клеток после лечения.
Врач-онколог рассказал о профилактике распространенных видов опухолей:
- Рак шейки матки. Чаще всего вызван вирусом папилломы человека. Плохо поддаётся лечению, но его можно предотвратить вакцинацией детей в возрасте 10 — 12 лет.
- Рак груди. Причина заболевания у 80% пациентов — мутация в гене. Первичная профилактика малоэффективна, поэтому применяется вторичная — рентгеновская маммография и МРТ молочной железы.
- Рак толстой кишки. Одна из немногих опухолей, причину которой можно распознать. Причина — это полипы в кишечнике, профилактика — их удаление.
- Рак лёгких. Фактор риска — табак, поэтому первичная профилактика — отказ от курения, а вторичная — исследования групп риска при помощи компьютерной томографии.
- Меланома. В большинстве случаев возникает из-за ультрафиолетового излучения. Профилактика — ежегодный осмотр кожи представителей группы риска: людей со светлой кожей, веснушками и родинками, пожилых и тех, у кого в детстве было много солнечных ожогов.

Доказательная медицина — это принцип медицинской практики, основанный на добросовестном, явном и разумном использовании современных научных данных в выборе лечения. Какой препарат использовать, нужна ли операция или лучевая терапия?
У доказательной медицины три составляющие: первая — убедительные доказательства, вторая — индивидуальный опыт врача, третья — ожидание и желание пациента.
Убедительные доказательства можно получить, если провести корректное исследование. Каким оно может быть?
- Рандомизированное клиническое исследование — это золотой стандарт доказательной медицины. Применяется метод ослепления: пациент не знает, какое лечение получает. Есть и двойное ослепление — сам доктор не знает, какое лечение получает пациент.
- Мультицентровое исследование — проводится в нескольких больницах.
- Исследования при помощи плацебо — препарат сравнивается с пустышкой.
Доказательная медицина — это ступень к персонализированной медицине. Врачи могут выбирать вид лечения для конкретной опухоли и стадии из арсенала доказанных методов. Если у врача есть результаты исследований и данные метаанализа — статистический синтез данных разных, но подобных научных работ — он знает, какие могут быть осложнения от выбранного лечения. И может предупредить пациента.
Потребность в доказательной медицине возникает всегда и при любых обстоятельствах, если речь идет о медицине, а не о шаманстве, гомеопатии либо БАДах. Последние имеют отношение к вере, и в лучшем случае – к психосоматике и эффекту плацебо, но не к современной медицине в западном понимании этого слова.
Доказательная медицина – это единственная медицина, принятая в западном мире, все остальное медициной не является. Во всем цивилизованном мире существуют стандарты лечения, которые принимаются (сертифицируются) на основании проведенных клинических исследований. Для лечения заболеваний и для получения разрешения на лекарство требуется доказательная база, базирующаяся на статистике. Это и есть доказательная медицина.

Как пример, рассмотрим вариант подхода доказательной медицины. Фармацевтическая компания заинтересована выпустить новый препарат для лечения, скажем, рака желудка. Для этой цели компания проводит работу по принятому международному протоколу. Сначала препарат проходит клинические исследования в пробирке, потом на животных и, наконец, на людях. Такие исследования занимают в среднем 7-8 лет, после чего препарат получает разрешение на продажу, в случае, если доказана сигнификативность – т.е. эффективность лекарства в сравнении с плацебо, либо с другим препаратом, использующимся для данного заболевания. В случае, когда сигнификативность доказана, обычно препарат получает разрешение на использование в клинической медицине от американского управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), а потом получает подобную сертификацию от европейского и японского управлений, а также от других подобных организаций, в соответствии с географией использования.
Если та же фармкомпания, работающая по принципам доказательной медицины, намерена получить разрешение на использование того же препарата для лечения другого заболевания (например, не рака желудка, а рака груди) – она должна провести почти ту же работу, исключая, разве что первичные исследования in vitro (в пробирке) и in vivo (на животных). Если сигнификативная эффективность будет доказана и для другого заболевания – будет получено разрешение.
Получение разрешения от FDA – это как раз то, что превращает результаты исследования в лекарство, в отличие от гомеопатии, БАДов и народных рецептов, которые лекарствами не являются.
В случае с БАДами следует доказать лишь то, что они не наносят вреда. Если производитель положит в капсулу мел, то БАД будет разрешен к применению, но лекарством не станет.
Или, скажем, модная история с так называемыми "гепатопротекторами". Они есть во всем мире, но на западе продаются в качестве БАДов, а не лекарств.
Важно понимать, что доказательная медицина является единственной официальной медициной, как минимум в странах Запада. Все что не базируется на принципах доказательной медицины, – не медицина.
Согласно принципам доказательной медицины, изначально на стадии разрешения препарата к использованию эффективность лечения определяет регулятор. Как пример – американское управление FDA как самый крупный в мире. Затем Европейская служба сертификации, Японская и т.д. Многие страны, как, например, Израиль, автоматически подтверждают к использованию препараты, сертифицированные FDA либо Европейским регулятором.
Работая с пациентами из бывших Союзных Республик, я, к сожалению, очень часто сталкиваюсь с тем, что местные врачи пренебрегают принципами доказательной медицины. У нас в Израиле, например, лечение не по принципам доказательной медицины является уголовным преступлением. У врача есть все шансы лишиться за это лицензии и даже сесть в тюрьму. Лечение по принципу "мне кажется" или "на основании моего опыта/ интуиции" судом принято не будет. Врачу потребуется доказать, что его действия соответствовали принципам и основам доказательной медицины.
Ко мне в клинику обращаются пациенты из России и стран бывшего Советского Союза за вторым мнением. И в очень большом проценте случаев мы вынуждены констатировать, что лечение давалось либо рекомендуется не по принципам современной доказательной медицины, а на основании каких-то "своих наработок" на местах.
Как пример, возьмем распространенное заболевание – рак груди. Не метастатический, 1-2 стадия. В определенных ситуациях принципы доказательной медицины предписывают провести пациенту неоадъювантную химиотерапию и лишь после этого делать операцию. А не наоборот. Или женщине по принципам доказательной медицины положено после операции провести сеансы радиотерапии на прооперированную область и на подмышечную область, а ей делают только на прооперированную область. В результате болезнь метастазирует.
Если существует статистически подтвержденный опыт, основанный на миллионах клинических случаев, то игнорировать его – значит с большой вероятностью навредить пациенту, нарушив тем самым клятву Гиппократа.
Если кому-то будет интересно, то о самых последних новостях доказательной медицины в лечении ряда тяжелейших заболеваний я рассказываю в эфире телеканала Iton-TV.
Данная статья была написана для издания "Директор Клиники"
В октябре 2018 года Илья Фоминцев приезжал в Краснодар с лекцией о проблемах диагностики рака. Эволюция Юга.ру пообщалась с онкологом о распространенных мифах, в которые верят даже врачи, о том, почему рак не развивается по стадиям, почему не всегда нужно удалять рак простаты и какие проблемы в российской медицине мешают спасать жизни.

— В России в среднем четверть людей, доживающих до 75 лет, заболевают раком. Это данность. Но каждый человек может повлиять на собственную жизнь и уменьшить шансы заболеть, исключив некоторые факторы риска. Например, бросить курить или не допускать ожирения.
Есть виды рака, которые можно вообще исключить, вовремя приняв меры по защите, — это рак, вызванный ВПЧ (вирусом папилломы человека) . Он передается половым путем, и от него существует вакцина. То есть если привить человека до первых половых контактов, то это гарантированно защитит от рака шейки матки и рака полового члена.
Окружающая среда также влияет, влияют канцерогены. Но надо понимать, что не все, что в интернете называют канцерогенами, ими является. Вообще, слишком сильно заморачиваться на окружающей среде не стоит. Нет данных, что люди, живущие в деревнях на природе, болеют раком значительно реже, чем остальные.
Есть панические мнения, что рак молодеет и стал настоящей эпидемией XXI века. Как вы относитесь к таким высказываниям?
— Есть виды рака, заболеваемость по которым заметно снизилась за последние 50 лет. С середины прошлого века заболеваемость раком желудка стала падать во всем мире — из-за распространения холодильников. В холоде не выживают бактерии, которые размножаются на еде и провоцируют развитие этой опухоли.
В ранней диагностике рака многие видят спасение. Правда ли, что чем раньше обнаружен рак, тем лучше для пациента?
Миф о последовательной стадийности живет в головах не только пациентов, но и многих врачей до сих пор. Долгое время медики во всем мире так и полагали, но потом накопились исследования и данные о том, что стадийности нет. Рак четвертой стадии — это агрессивная опухоль, повлиять на которую мы либо не можем вообще, либо в очень ограниченном диапазоне. Его бесполезно диагностировать раньше, чем он даст свою симптоматику.
Рак первой стадии — опухоль максимально неагрессивная, ее даже можно вовсе не удалять. Такие новообразования часто встречаются в щитовидной железе или простате . Да, вы можете сделать скрининг и обнаружить такой рак. Но с ним можно жить до глубокой старости и умереть по другим причинам. Во всем мире давно отказались от планового скрининга этих видов рака — он выявляется очень часто, и за этим следует агрессивное лечение, которое ухудшает жизнь пациента.
В своей лекции Илья Фоминцев говорил о том, что идея о стадийности привела к распространению калечащей хирургии — врачи считали, что чем больше органов удалить вместе с опухолью, тем благоприятней будет исход. Например, удаляли не просто опухоль в молочной железе, но и всю железу, мышцы и лимфоузлы. Когда в конце XX века начались исследования о рецидивах рака, стало понятно, что такая стратегия спасает пациентов далеко не всегда.
Если ранняя диагностика не панацея, то зачем делать скрининг?
— Скрининг есть смысл делать на те виды рака, где он доказанно имеет больше пользы, чем вреда. К ним можно отнести рак молочной железы, рак шейки матки, рак легких и колоректальный рак. Их можно вовремя выявить на 2-й и 3-й стадии.
Колоректальный рак, к примеру, чаще всего развивается через доброкачественные полипы . Вы можете предотвратить развитие, если врачи вовремя найдут их и удалят.
Скрининг — это процесс, направленный на выявление бессимптомного рака. Важно понимать, чем отличается скрининг от диагностики. Если у вас появилось уплотнение, или что-то болит, или проявляются другие неприятные симптомы — это обязательный повод для диагностики. Если же никаких жалоб нет, но вы находитесь в группе риска, то вам нужно пройти плановое скрининговое обследование.
Рекомендации по скринингу самых распространенных видов рака:
— рак молочной железы: рентген-маммография, МРТ молочной железы раз в 1-2 года (начиная с 50 лет);
— колоректальный рак: iFOBT (анализ на скрытую кровь в кале), колоноскопия 1 раз в год (с 50 лет);
— рак шейки матки: цитологическое исследование раз в 3 года, тестирование на ВПЧ раз в 5 лет (с 25 лет);
— рак легких: низкодозная КТ, рентген раз в 5 лет. Для курильщиков и тех, кто взаимодействует с химическими канцерогенами, — ежегодно.
Роль скрининга у нас в стране выполняет диспансеризация, но нет контроля качества результатов. Я проехал практически все регионы РФ, и в подавляющем большинстве маммография делается из рук вон плохо. Часто она вообще делается в одной проекции, то есть это половина маммографии. У нас есть огромное количество женщин, напуганных диагнозом мастопатия. Диагноз, который ставится всегда, если обнаружено что-то, что вроде не рак, а разбираться особенно не хочется.
Тоже самое с раком легких — далеко не все врачи знают, что делать с результатами компьютерной томографии, с помощью которой выявляются подозрения на рак. Нет методичек о том, как дальше наблюдать пациента.
Какие возможности позаботиться о себе есть у среднестатистического человека?
— Я всем советую пройти простой тест на нашем сайте. Он позволяет вывести для вас персональные рекомендации, говорит о факторах риска и о том, какие анализы стоит сдать.
Второй вопрос, где найти хорошего врача. С 4 февраля 2019 года мы запустим независимую платформу по рейтингу врачей на нашем же сайте. Сервис будет работать на пожертвования и только в интересах пациента.
Как насчет онкомаркеров как способа обнаружить рак?
— Онкомаркеры — вещества, которые образуются как в здоровых, так и раковых тканях организма. Их нормальный уровень не говорит о том, что рака нет, их повышенный уровень не говорит о том, что рак есть. Анализы на онкомаркеры используют только для контроля за существующими процессами.
Когда мы точно знаем, что есть опухоль, состояние которой можно отслеживать по онкомаркерам, мы их используем вместе с другими контрольными механизмами. Если вам назначают тесты на онкомаркеры с целью проверить, есть ли у вас рак, то ваш доктор либо безграмотный, либо мошенник.
Вы один из немногих популяризаторов доказательной медицины в России. Откуда взялся этот термин и почему медики России его принимают неохотно?
Петр Сергеевич, заслуженный академик, 30 лет работающий в профессии, может глубоко заблуждаться и быть неправ. Но для нашей системы такие мысли — кощунство.
У нас в России вообще нет понимания того, как надо разговаривать с пациентом о диагнозе и прогнозах . Доказательная медицина имеет четкие регламенты и на этот счет. Вплоть до прописанных методик поведения во всех случаях. Эти навыки можно оттачивать, их можно сдавать на экзаменах.
Ежегодно фонд оплачивает десяти молодым врачам обучение в ординатуре, платит стипендию и организует образовательные курсы, которых нет в стандартной программе обучения врачей в России. Всего резиденты проекта учатся пять лет: два в ординатуре и еще три уже в процессе работы в клиниках. Все услуги фонда совершенно бесплатны для участников программы, единственное условие для выпускников — после окончания обучения они должны работать в российских клиниках.
Вы часто критикуете медицинские вузы и образование в целом. На вашей лекции в Краснодаре было много студентов-медиков. Как вы оцениваете их знания?
— Их знания такие же, как и у их сверстников во всех остальных вузах страны. Никакие. Но это не их вина, а вина их преподавателей. Я специально задавал некоторые вопросы про элементарную терминологию, и большая часть слушателей-студентов услышала эти термины от меня впервые.
Что нужно российской медицине, чтобы взять курс на исправление ошибок?
— Здесь нужны регуляторные изменения от Минздрава. Большая часть приказов министерства направлена на контроль. В итоге лучшим методом управления считается назначение бесконечного числа ответственных и их наказание после проверок.
Приводит это к печальным последствиям — врачи до последнего не признают своих ошибок и делают все, чтобы их скрыть. А врачебные ошибки — это то, что должно разбираться, анализироваться, это двигает медицину вперед. Сокрытие ошибок — это неверные истории болезней, диагнозы и методы лечения. Это огромная проблема.

Лизавета Бабицкая и Полина Полещук
Вы начали работу в марте этого года. Оглядываясь назад, расскажи, что на первых этапах запуска было сложнее всего?
Полина Полещук: Мне как редактору сложнее всего искать людей, которые могут писать адекватные тексты. Еще трудно даются согласование материалов, выстраивание форматов и рубрик. Изначально рубрикатор был не совсем понятен аудитории. Теперь названия рубрик отвечают на конкретные вопросы, а материалы внутри них решают конкретные проблемы пользователя.
Вы пишете не только об онкологии, но и в целом о медицине, вопросах этики, опыте врачей. Как подбираете темы для материалов?
Изначально, когда мы еще в магистратуре по научной коммуникации обсуждали структуру издания, решили, что будем задействовать достаточно широкий набор тем. Безусловно, ядром являются вопросы онкологии, но даже вокруг этой темы сегодня по-прежнему существует очень много заблуждений, мифов. И закрыть на них глаза было бы глупо. До сих пор существует очень мало русскоязычных источников по теме онкологии, а из тех, что есть, как минимум половина основана на источниках, к которым в научном сообществе возникает очень много вопросов. Это и журналистская или блогерская отсебятина, и невнятные псевдоисследования, и частный опыт и прочее в этом же духе.
Работать с этой темой очень трудно. Чтобы написать одну инструкцию, которая касается онкологической тематики, нужно потратить неделю, изучить законодательство, поговорить с врачом. С той же маршрутизацией онкобольных ситуация разная в зависимости от региона. С доказательной медициной все складывается немного проще: сегодня есть много авторитетных врачей, которые ведут свои блоги, постоянно учатся, хорошо знают английский язык, чтобы изучать свежие научные статьи.
Profilaktika.Media. Источник: media.nenaprasno.ru
Что нужно прежде всего учесть, работая над материалами по теме онкологии?
Все авторы Profilaktika.Media учатся писать именно об онкологии — работать с источниками, находить компетентных врачей и так далее. Но, приступая к материалу, мы прежде всего отталкиваемся от наличия экспертов. Здесь нам помогает то, что у Фонда профилактики рака есть очень много проверенных врачей — словом, большая экспертиза.
С другой стороны, далеко не всем ученым нравится, когда пишут простым языком об их сфере и ежедневном труде. Но если мы действительно хотим делать материалы для широкого круга читателей, особенно для такой уязвимой категории, как пациенты и их родственники, то нужно быть с ними на одной волне. Необходимо понимать, что это делается не для галочки, а для того, чтобы человек мог воспользоваться этим руководством.
У вас есть отдельная рубрика, где вы рассказываете истории людей, которые борются с раком. Насколько сложно выстраивать коммуникацию с пациентами? Ведь не всегда люди готовы к откровенному диалогу.
Стоит отметить, что в этой рубрике важна не только и не столько эмоциональная составляющая — понятно, что людям очень непросто. Здесь важно также понимать, с какими проблемами пациенты сталкиваются, какие вопросы их волнуют — это и в целом вопросы системы здравоохранения, и общение с врачами, и многое другое.
Если говорить о популяризации науки, знаний в широком смысле, можно вспомнить о такой проблеме. Многие просветители признают, что зачастую похожие проекты находят отклик у и так довольно эрудированных людей, и очень сложно пробиться и достучаться до умов широкой аудитории. Вы также изначально планировали, что проект будет ориентирован на широкий круг читателей. Как вы решаете для себя эту проблему? И кто сейчас преимущественно читает ресурс?
Еще на этапе планирования проекта мы долго спорили о том, какая у ресурса должна быть аудитория, высказывались разные точки зрения — это либо преимущественно врачи, либо студенты, либо вообще вся Россия. Ведь заболеть раком действительно может каждый. Однако писать слишком общо — неправильно, это как бы обо всем и ни о чем, для всех и для никого одновременно. В итоге мы сегментируем аудиторию. Ядро — это пациенты и их близкие. Родственники и друзья пациентов часто чуть ли не наравне с пациентами принимают на себя все заботы, связанные с больным. Им точно так же надо понимать, куда идти. В совокупности это та аудитория, которой тяжелее всего найти ответы на вопросы. Далее идет категория обычных людей — тех, кто боится заболеть или находится в группе риска. И наконец третья группа — врачи, которые в большей степени выступают как эксперты и наблюдатели.
У истоков Profilaktika.Media стояли студенты и выпускники магистратуры по научной коммуникации Университета ИТМО. Кто сейчас в команде?
Мы планируем, что Лиза Бабицкая будет в большей степени заниматься блоком по доказательной медицине. Кроме того, теперь с нами работает Анастасия Голубничая, корреспондент телеканала Санкт-Петербург, опытная журналистка, которая много работала с социальной сферой. Она начала с историй онкобольных и со временем будет больше времени уделять онкологической тематике.

Полина Полещук и Лизавета Бабицкая
Кстати, одним из самых популярных материалов за последнее время стал разбор о том, что делать, если в семье есть новорожденный. Как вы планируете развивать тематику, напрямую не связанную с онкологией, в том числе в целом блок по доказательной медицине?
Лизавета Бабицкая: Этот блок уже сейчас включает и интервью с экспертами, и разборы на отдельные темы, и многое другое. Прежде всего для нас это возможность привлечь аудиторию, которая интересуется не только вопросами, связанными с онкологией, или вовсе боится этой тематики. Читая материалы, посвященные общим, популярным вопросам, пользователи постепенно смогут расширить свои знания и в сопутствующих темах, понять, что мы действительно являемся экспертами в этой теме, у нас есть проверенные источники и специалисты, которые отвечают за свои слова.
Все люди, которых мы приглашаем в качестве экспертов, — практикующие врачи. Мне кажется, это также полезно читателям, потому что они могут узнать, к кому стоит обратиться по тому или иному вопросу. Так они могут быть уверены, что эти специалисты не пропишут, скажем, не к месту антибиотики или гомеопатию.
Как опыт, который вы получили во время обучения в магистратуре по научной коммуникации, помогает вам в работе?
В первую очередь хочется вспомнить о наукометрии. Когда мы пишем материалы или берем интервью у экспертов, мы всегда ссылаемся на источники. Источниками в данном случае могут быть как научные исследования, так и медицинские обзоры с проверенных ресурсов, например, от UpToDate, Medscape, Mayo Clinic, а также действующие гайдлайны.
Когда ты ссылаешься на научную статью, важно ее проверить. Она может быть совершенно ненаучной — со слабой методологией, ошибочной статистикой и без рецензирования. На результаты такой статьи ссылаться нельзя. К сожалению, часто таким подходом грешат исследования, проведенные в России. И это большая проблема. Например, сейчас я делаю материал, посвященный близорукости (миопии) у детей. Многие врачи в России до сих пор прописывают в этом случае зарядку для глаз. Хотя этот метод не позволяет скорректировать миопию. Сложность в том, что исследований, которые говорят о том, что это не работает, очень мало. Почему? За рубежом эту тему уже давно не исследуют, потому что уже поняли, что зарядка для глаз не позволяет скорректировать миопию. У нас, напротив, такие исследования проводятся, причем зачастую они отвечают интересам тех врачей, которым выгодно продвигать эту тему по коммерческим соображениям. Это сложная тема, но нам приходится объяснять все эти нюансы.
Возвращаясь к наукометрии, скажу, что важно анализировать статьи и понимать, каким из них стоит доверять. Это уже отдельное умение. Если взять тот же PubMed — очень известную медицинскую базу данных научных статей, на которую часто ссылаются даже пациенты — нужно помнить, что поиск в ней может быть опасен для тех, кто не владеет наукометрическим инструментарием и не может правильно оценить статью.
Ресурс UpToDate. Источник: uptodate.com
А как оценить статью и понять, что источник не заслуживает доверия?
Недавно вы объявили конкурс для авторов, которые хотели бы попробовать свои силы в проекте. Как планируете работать с ними в дальнейшем?
Полина: Мы получили порядка 15 заявок, и это очень приличный отклик. Сейчас мы как раз анализируем поступившие письма. Судя по тем анкетам, которые я видела, пишут люди с богатым бэкграундом, им искренне интересна журналистика и они действительно хотят учиться. С другой стороны, мы не называем себя суперэкспертами, но мы можем дать им возможность понять, что такое журналистика. Что это не обслуживание чьих-то интересов, не хождение у кого-то на поводу, а работа в рамках закона о СМИ, без цензуры, это прежде всего информирование, просвещение и умение отвечать за свои слова.
В дальнейшем авторы получат тестовое задание. Так мы посмотрим, как они работают с источниками, обрабатывают и анализируют информацию. При желании, если человеку понравится, он сможет остаться у нас на несколько месяцев, а впоследствии и присоединиться к команде.
Profilaktika.Media. Источник: media.nenaprasno.ru
Какие ключевые цели вы наметили для себя в ближайшей перспективе?
Как минимум у нас есть план на год. В этот срок мы планируем стать уважаемым изданием с аудиторией порядка 100 тысяч пользователей в месяц. Пусть это не так много, но лучше это будут действительно заинтересованные люди, живая и активная аудитория. Кроме того, мы хотим публиковать минимум один текст в день и выпускать в неделю минимум одну инструкцию либо статью о заболевании.
Сейчас мы развиваемся благодаря президентскому гранту. Это действительно хорошее подспорье, чтобы запуститься, но дальнейшее развитие проекта невозможно лишь на эти средства. Здесь нас хорошо поймут ученые, которые знают, как непросто постоянно отчитываться по грантам и заполнять кучу документов. На деньги гранта трудно быстро прокачать сайт и выдавать качественные материалы быстро.
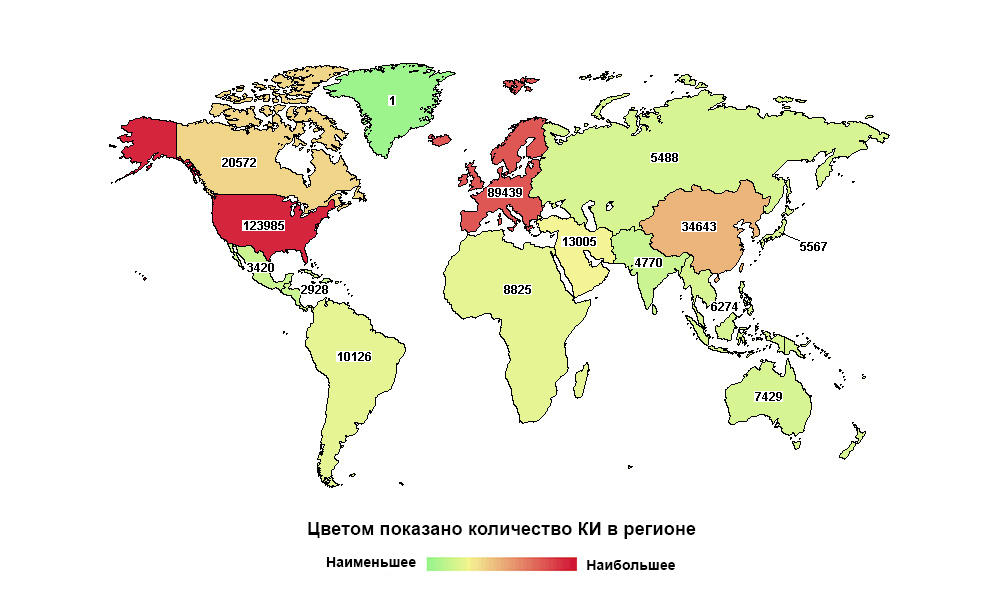
Россия далеко не на первом месте в мире, но первая по количеству исследований в своем макрорегионе
Для частных клиник практика необычная: минимум коммерческой выгоды, слишком много сложностей в организации процесса и строгие требования к лечебному учреждению. Обычно только крупным федеральным центрам удается им соответствовать.
А ведь для многих пациентов в России клиническое испытание препарата – единственный шанс получить бесплатное лечение от смертельной болезни. Но среди российских онкопациентов 30% просто не знают, что такое клиническое исследование, и лишь немногие принимали в них участие.
Поэтому мы хотим, чтобы как можно больше людей узнали и проверили: возможно, у них есть шанс получить препарат, который может спасти им жизнь.
В этой статье мы расскажем, зачем нужны и как устроены клинические исследования, кто и как может туда попасть.
Клиническое исследование/испытание (далее – КИ)– научное исследование с участием людей в качестве испытуемых, которое проводится с целью оценки эффективности и безопасности нового лекарственного препарата или расширения показаний к применению уже известного. Кроме лекарств, КИ могут также изучать эффективность и безопасность новых методов лечения и диагностики.
Медицина эволюционирует и превращается в точную науку, которая не обходится без статистики.
Когда медицина стала массовой, у врачей возникла необходимость вырабатывать действительно безошибочные тактики лечения. Определенные лекарства должны были помогать в заданных условиях большинству пациентов.
И именно клинические исследования – основа доказательной медицины.
До середины XX (!) века не было никакого регулирования исследований новых препаратов. Чтобы навести порядок, как часто бывает, понадобилась пара трагедий.

Мамы этих детей пили снотворное, не проверенное на людях
С тех пор лекарства перед регистрацией очень тщательно изучают. Регулируется это Международными гармонизированными трехсторонними правилами Надлежащей клинической практики (ICH Harmonized Tripartite Guideline for Good Clinical Practice, сокращённо — ICH GCP). С 1996-97 г. они действуют в США, Японии и ЕС, а с 2003 года введены и в России.
Весь процесс создания препарата можно поделить на 3 крупных фазы.
1. Поиск идеи и доклинические исследования – в пробирках и на животных.
2. Если на этом все не закончилось – то начинаются клинические исследования, с людьми: сначала осторожные, потом более массовые.
3. Затем препарат регистрируется в регуляторных органах, чтобы стать привычным наименованием в медицинских справочниках.
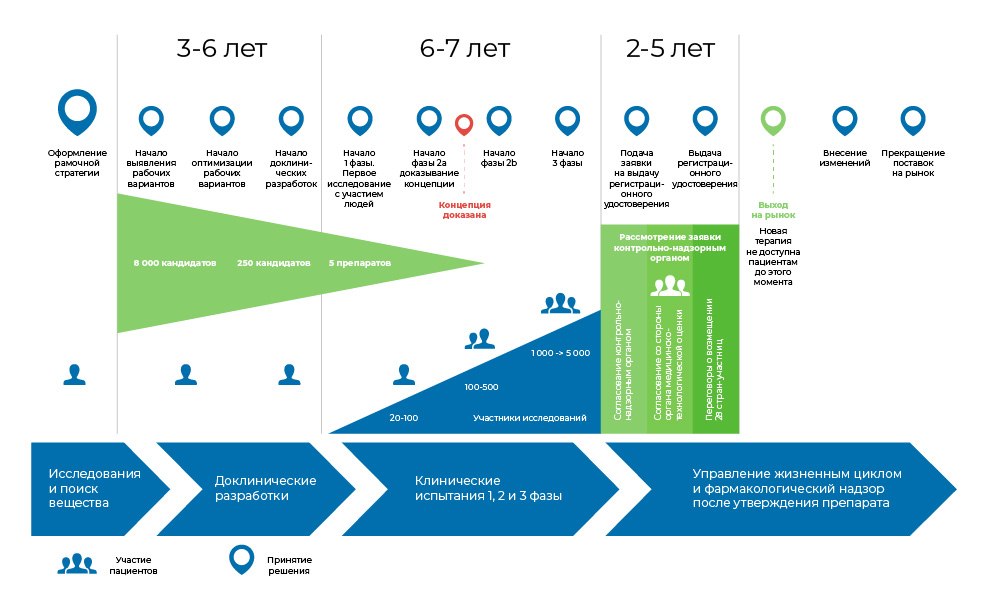
Процесс разработки медицинского препарата. С момента создания молекулы до момента начала продажи лекарства проходит от 8 до 20 лет.
Значит, это кому-нибудь нужно? Онкология — одна из самых вопиющих сфер медицины в плане неудовлетворенной потребности в лекарствах. По данным Всемирной организации здравоохранения, в 2018 году онкологические заболевания убили 9,6 миллиона человек. Часто опухоли обнаруживают на поздних стадиях, когда остается лишь паллиативное лечение.
При этом открытия в сфере молекулярной биологии и генетики позволили понять механизмы, которые способствуют развитию и прогрессированию рака, улучшилось понимание работы противоопухолевого иммунитета.
И сегодня разработка противоопухолевых препаратов – одно из самых наукоемких и востребованных направлений медицины.
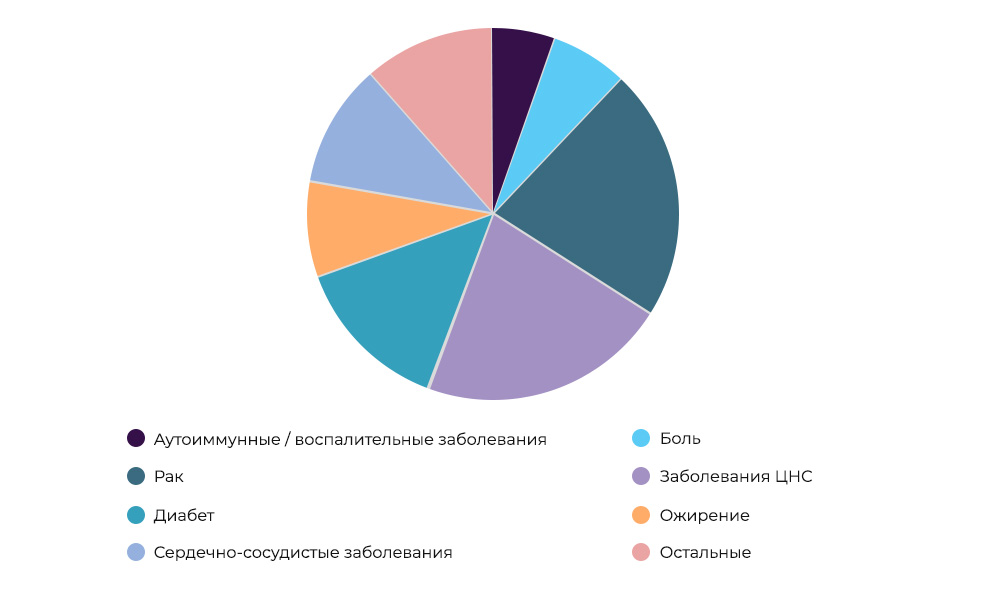
Исследования противораковых препаратов – 23% всех КИ в мире
Раньше многие фармкомпании проводили исследования самостоятельно, силами своего штата ученых. Сейчас медицинское учреждение, которое прошло аккредитацию и соответствует определенным требованиям, может стать площадкой и исполнителем для эксперимента.

Механизм работы таргетных препаратов при колоректальном раке. Раковые клетки прекращают делиться, либо приращивать к опухоли дополнительные кровеносные сосуды, либо препарат предохраняет соседние клетки от превращения в злокачественные
Чтобы найти такие вещества, а потом выбрать из кандидатов подходящие, требуется много ресурсов и времени на исследования in vitro и in silicio – то есть в пробирке или с помощью компьютерного моделирования.
Выбранное вещество запасают в нужном количестве – производят по специальным правилам (в России это ГОСТ Р 52249-2009), без примесей и нарушения технологии. И с этими пробирками ученые отправляются тестировать препарат на животных.
Мышь – двигатель прогресса. После проверки идей в пробирке ученый с запасом своего потенциального препарата идет в виварий – нужно проверить, как поведет себя прототип в теле млекопитающего (in vivo).
И до сих пор в медицине без опытов на животных – не обойтись. Львов и коней, правда, оставили в покое. Доклинические исследования во всем мире происходят, в основном, на мышах, морских свинках и кроликах.

Лабораторным мышкам даже поставили памятник в Новосибирском Академгородке
На этом этапе проверяют, насколько вреден/безопасен препарат:
- вызывает ли аллергию,
- оказывает ли токсичное влияние на ткани и органы,
- как влияет на способность животных к размножению и нормальному развитию плода и т.п.
Кроме того, наблюдают, как кандидат в лекарства ведет себя внутри организма зверька (фармакокинетика):
- скорость всасывания и нарастание концентрации в крови,
- каковы максимальная и минимальная доза,
- как быстро выводится из организма, и т.п.
Все эти данные нужны, чтобы решить: можно ли применять исследуемое вещество для людей. И если да – то сколько его нужно.
Неизбежное зло. Бюрократия. За правильным ходом КИ следят Департамент гос. регулирования обращения лекарственных средств Минздрава и Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор).
Если ученый пришел к моменту, когда нужно переходить к клиническим исследованиям на людях – пора готовить заявку на проведение КИ. Для этого ему нужно несколько документов.
- Досье исследуемого лекарственного препарата. Все, что уже выяснили о препарате: данные о фармакокинетике, эффективности, токсичности и т.п.
- Протокол исследования. В нем подробно описан план будущего исследования и методики оценки результатов;
- Брошюра исследователя. Краткая шпаргалка, чтобы понятно объяснить суть исследования волонтерам и пациентам и получить их информированное согласие.
Этический комитет. Следующий этап квеста – получить оценку и заключение комитета по этике.
Комитет по этике – это независимая группа врачей, ученых, медицинского персонала и неспециалистов (представителей общественности). Они изучают протокол исследования и информированное согласие, чтобы до старта исследования удостовериться, что между пациентом, исследователями, фармкомпанией и национальным компетентным органом регулирования достигнуто согласие, ничьи права не нарушены, никто не подвергается принуждению и никому не прищемили свободу воли.
После проверки всех документов и одобрения этического комитета потенциальный препарат переходит в стадию клинических испытаний – на людях.
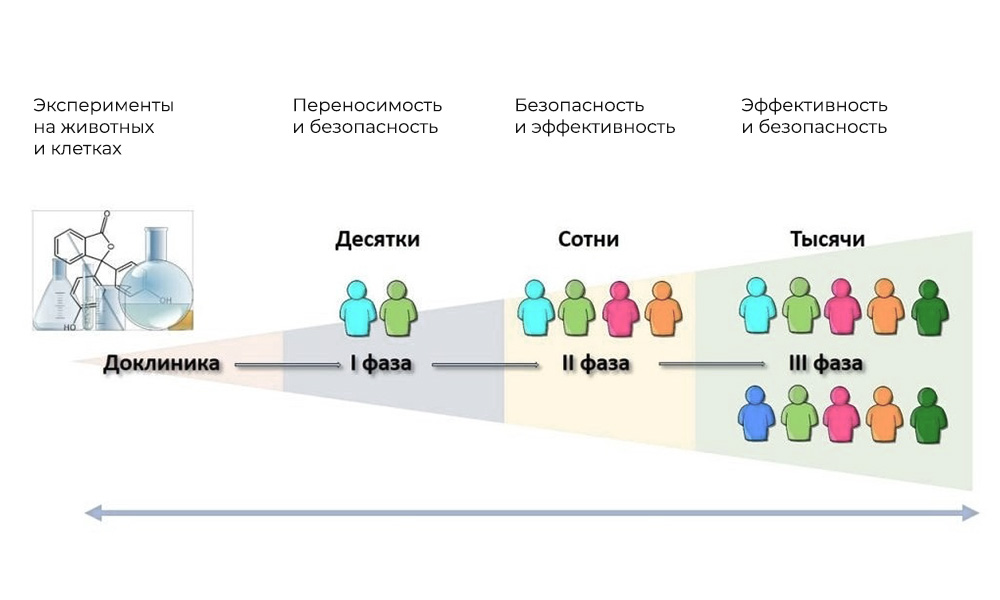
Основные фазы клинических исследований – на людях
Участники: 20 – 100 человек.
Длительность: от нескольких месяцев до 1 года.
Цель: изучить переносимость, фармакодинамику и фармакокинетику.
Проверяется, действует ли вещество на людей так же, как на животных, безопасно ли оно.
В первой фазе клинического исследования должны, теоретически, участвовать здоровые добровольцы, но в онкологии тестирование сильнодействующих веществ на здоровом организме нельзя назвать этичным. Поэтому участвуют люди с соответствующим заболеванием, против которого может быть эффективен будущий препарат.
Участникам постепенно вводят все бОльшие дозы препарата, начиная с минимальной и до максимально допустимой. После каждого введения отслеживается состояние пациента.
Оценивают фармакокинетику: скорость всасывания и экскреция (выделение неизменённого вещества), распределение по тканям и органам. Также оценивается фармакодинамика: действие препарата на клетки опухоли, на другие такни и органы, побочные эффекты. Выясняется предпочтительный вариант применения и уровень дозировки.
Кроме исследований с нарастающими дозами, в фазе I проверяют:
- действие пищи на препарат;
- взаимодействие с другими препаратами;
- влияние прочих заболеваний, которые могут повлиять на нужные дозы препарата (например, у пациента с почечной недостаточностью).
По данным FDA, первую фазу КИ успешно проходят 70% препаратов.
Участники: 100 – 500 пациентов.
Длительность: от нескольких месяцев до 2 лет.
Цель: проверка эффективности при определенных показаниях
Необходимо изучить, насколько новый препарат эффективнее по сравнению с плацебо или уже существующим лечением. Плюс, большее количество участников позволяет обнаружить более редкие побочные эффекты, которые не выявлены в фазе I.
Обычно на этой стадии исследования проводятся как двойные слепые рандомизированные плацебо-контролируемые.
Двойное ослепление: ни врач, ни пациент не знают, кто получает активное вещество, а кто – плацебо или оптимальное существующее на данный момент лечение.
Рандомизация подразумевает, что пациенты делятся на группы случайным образом – с помощью генератора случайных чисел. Повлиять на этот процесс не может ни врач, ни участник КИ.
Плацебо-контроль означает, что участники одной группы будут получать плацебо в таких же условиях, что и участники другой группы, которым дают активное вещество.

Всем – одинаковые на вид, вкус и запах лекарства.
Согласно данным FDA, лишь 33% препаратов, дошедших до фазы II, успешно проходят КИ и переходят в следующую фазу.
Количество участников: 300 – 3 000 и более.
Продолжительность: от года до нескольких лет.
Цель: подтверждение эффективности и безопасности исследуемого вещества на больших выборках.
Это самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Цель таких исследований — подтвердить эффективность и безопасность исследуемого вещества при применении большим количеством пациентов.
По результатам этой фазы производители препарата получают разрешение для вывода его на рынок.
В фазе III могут принимать участие тысячи пациентов из разных стран. Все должно быть спланировано до мелочей, чтобы во всех местах проведения исследования его дизайн и значимые условия были абсолютно одинаковыми.
Дизайн исследования настолько узкий, что в него может попасть не только умирающий, но и пациент с прогнозом на стойкую ремиссию. Препарат должен быть настолько безопасным, чтобы его можно было давать практически здоровому человеку – и качество жизни не снижалось.
Перед началом фазы III проводится множество консилиумов и обсуждений между исследователями и сторонними экспертами: очень важно продумать дизайн экспериментов так, чтобы не упустить важное и получить все нужные данные.
В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы.
Анализируется соотношение преимуществ и рисков. По результатам контролирующий орган принимает решение о том, можно ли выводить препарат на рынок. Для этого нужно, чтобы соблюдались условия:
- препарат более эффективен, чем ранее известные аналоги,
- дает меньше побочных эффектов/лучше переносится,
- эффективен, когда не работают ранее известные препараты,
- более выгоден экономически,
- проще в применении.
Процесс рассмотрения заявки надзорным органом занимает 12-18 месяцев.
По данным FDA, третья фаза клинических исследований заканчивается положительным результатом лишь в 25-30% случаев от всех, что были на старте третьей фазы.
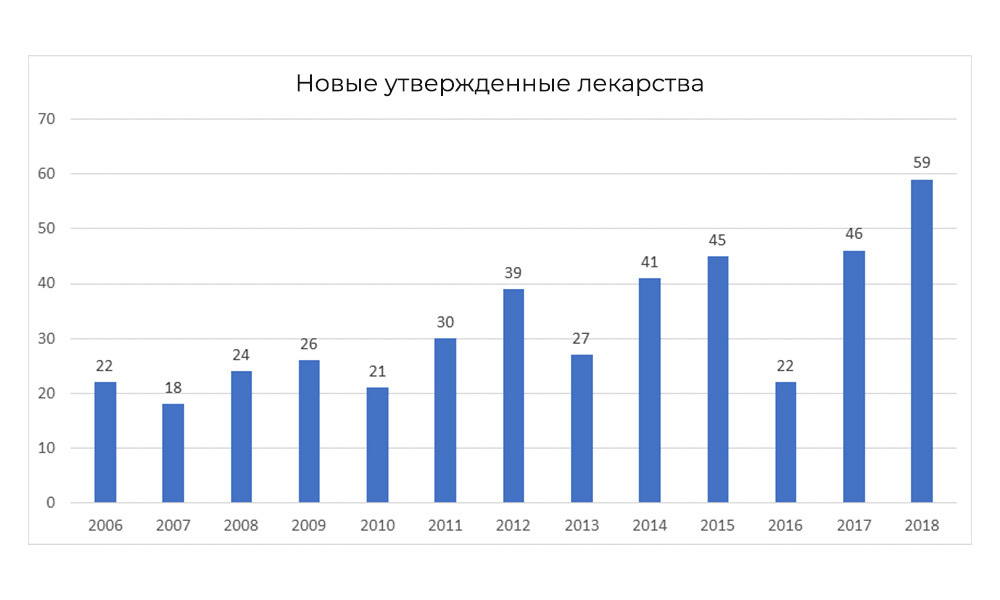
Тем не менее, в 2018 FDA побила собственный рекорд по числу одобренных препаратов
У контроля за новыми препаратами в России есть свои баги (или фичи, как посмотреть). По закону, одобренные зарубежные препараты должны пройти дополнительные клинические испытания в России: якобы, это повысит качество зарубежных препаратов.
Когда препарат уже прошел 3 фазы, вышел в продажу на мировой рынок, в нашей стране он еще может быть не зарегистрирован. Мы знаем, что он работает, в его инструкции на иностранных языках есть показания, подтвержденные 3 фазами исследований в США, или Канаде, или Европе.
Скажем, 12 показаний – 12 диагнозов, при которых препарат будет эффективен. Но в России еще не все эти показания подтвердили официально, только 6 из 12. И если у пациента именно тот вид рака, для лечения которого препарат еще пока официально не зарегистрирован в РФ, такой препарат бесплатно, в рамках ОМС, он не получит.
Это на 2-3 года замедляет пациентам доступ к новым лекарствам.
К сожалению, нас таких мало. Не всякая клиника может принимать у себя КИ.
Во-первых, у клиники должен быть сертификат GCP, Good Clinical Practice.
Во-вторых, исследователей должно быть минимум двое. У них тоже сертификаты, и не так-то просто их добыть: выдаются контролирующим органом страны-производителя препарата. В нашем случае это США и Франция. Проверяли двух врачей полгода.
В-третьих, сама клиника. Обязательно отделение реанимации, своя лаборатория, сертифицированные медсестры, правильная калибровка нужных автоматов, определенные помещения для хранения препаратов и документов, анонимные помещения, где нет камер – для пациентов. Чтобы запуститься в первый раз – пришлось переоборудовать некоторые кабинеты и палаты: вплоть до новых кроватей, все по дизайну КИ.

Для разных препаратов – разные холодильники
Словом, те клиники и врачи, которые хотят этим заниматься, должны еще постараться, чтобы создать определенные условия.
Набираем 2 или 3 группы пациентов, подписываем с ними информированное согласие.
Обычно на участие в клинических исследованиях люди соглашаются по 2 причинам:
- отсутствие эффективных методов лечения их болезни,
- желание сделать вклад в развитие науки.
В любом случае это исключительно добровольное решение. Исследователи обязаны в письменном виде предоставить пациенту информацию о цели КИ, о том, как оно будет проводиться, какое лекарство будет применяться, и т.п. Все это отражено в особом документе —информированном согласии. Каждый участник исследования застрахован от причинения вреда жизни и здоровью.
Наши пациенты пока ни разу не отказывались – для них это невероятный шанс получить лечение, причем бесплатное, когда остальные методы терапии уже исчерпали себя.
Но онкологических пациентов у нас много. Если клиент признается, что денег на лечение нет – мы обязательно проверяем требования к участникам исследования. Вполне возможно, что ему найдется место.
В данный момент открыт набор в 18 крупномасштабных исследований.
Конечно, масштабы в частной клинике – совсем не то, что в большом НИИ, но обычно 3-4 пациента в неделю попадают в протокол исследования. Это немало: не менее 10 человек в месяц, которые получают самое продвинутое передовое лечение – бесплатно.
И у них самих появляется дополнительный шанс, и будущие пациенты скорее смогут получить этот препарат, когда закончится КИ.
Пациенты вовсе не обязательно постоянно находятся в клинике – если это не запрещено дизайном КИ и пациент чувствует себя хорошо – он участвует амбулаторно. Приходит, получает свою капельницу и уходит. Есть и такие, кому лучше остаться в клинике, под присмотром.
В результате долгих месяцев скрупулезного выполнения длинного списка требований, постоянного мониторинга состояния пациента, консолидации данных по десяткам параметров мы делаем исследования, которые будут опубликованы, а пользоваться результатами – расширенной возможностью применения новых препаратов – будут все врачи из всех онкоцентров страны. И несколько десятков человек получают шанс на лечение прямо сейчас.
Надеемся, этот текст был для вас просто интересным чтением.
Читайте также: