Дофамин и злокачественные опухоли
Адреналин, норадреналин, дофамин, серотонин – это биогенные амины, являющиеся гормонами и нейромедиаторами. Их содержание значительно увеличивается в биологических жидкостях при некоторых нейроэндокринных новообразованиях.
Катехоламины (эпинефрин, норэпинефрин), серотонин (5-гидроксиприптамин) и их метаболиты (ВМК, ГВК, 5-ОИУК).
Синонимы английские
Catecholamines (epinephrine/adrenaline, norepinephrine/noradrenaline, dopamine), serotonine (5-hydroxytryptamine; 5-HT) and metabolites (vanillylmandelic acid /VMA, homovanillic acid/HVA, 5-hydroxyindoleacetic acid/5-HIAA).
Высокоэффективная жидкостная хроматография.
Пг/мл (пикограмм на миллилитр), нг/мл (нанограмм на миллилитр), мг/сут. (миллиграмм в сутки).
Какой биоматериал можно использовать для исследования?
Суточную мочу, венозную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона бананы, авокадо, сыр, кофе, чай, какао, пиво в течение 48 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Отменить (по согласованию с врачом) симпатомиметики за 14 дней до исследования.
- Исключить (по согласованию с врачом) прием мочегонных препаратов в течение 48 часов до сбора мочи.
- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
- Исключить физическое и эмоциональное перенапряжение в течение 24 часов до исследования.
- Исключить физическое и эмоциональное перенапряжение во время сбора суточной мочи (в течение суток).
- Не курить в течение 24 часов до исследования.
- Не курить в течение всего периода сбора суточной мочи.
Общая информация об исследовании
Нейроэндокринные опухоли (апудомы) – новообразования, происходящие из эндокринных клеток, диффузно расположенных в различных тканях и органах (APUD). К ним относятся феохромоцитома, нейробластома, гастринома, випома, карциноид и некоторые другие новообразования. В редких случаях выявляется наследственный синдром множественной эндокринной неоплазии (МЭН), для которого характерно одновременное наличие нейроэндокринных опухолей в разных органах и тканях (например, феохромоцитома + медуллярный рак щитовидной железы + нейромы слизистых оболочек + ганглионейромы кишечника). Феохромоцитома является гормонально активной опухолью клеток симпатоадреналовой системы, которая вырабатывает катехоламины. В 90 % случаев феохромоцитомы возникают в мозговом веществе надпочечников. Гораздо реже они локализуются вне надпочечников: в 8 % – в аортальном поясничном параганглии, менее чем в 2 % случаев – в брюшной и грудной полостях (параганглиях, мочевом пузыре, воротах печени и почек) и менее чем в 0,1 % случаев – в области шеи (бифуркация сонной артерии). Патогенез и клиническая картина заболевания обусловлены избыточным поступлением в кровь адреналина, норадреналина. Катехоламины синтезируются из аминокислоты тирозина и обеспечивают регуляцию основных физиологических параметров организма (частота дыхания и сердечных сокращений, артериальное давление, почечный кровоток), а также участвуют в процессах высшей нервной деятельности (формирование настроения, мотивации). В норме уровень катехоламинов повышается при воздействии стрессовых факторов и остается низким в покое. Опухоли нейроэндокринного происхождения характеризуются неконтролируемой секрецией катехоламинов, в результате чего их концентрация, а также уровень их метаболитов в крови и моче многократно возрастает. В большинстве случаев феохромоцитома секретирует оба вида катехоламинов. Некоторые опухоли продуцируют только один из этих моноаминов, очень редко преобладает дофамин. Кроме катехоламинов, феохромоцитома может синтезировать серотонин, адренокортикотропный гормон, вазоактивный интестинальный пептид, соматостатин и другие гормоны. Соответствий между размерами опухоли, уровнем катехоламинов в крови и клинической картиной не существует. Мелкие опухоли могут синтезировать и секретировать в кровь большое количество катехоламинов, тогда как крупные опухоли метаболизируют катехоламины в собственной ткани и секретируют лишь небольшую их часть. Чаще встречается так называемая пароксизмальная форма феохромоцитомы, при которой секреция норадреналина происходит не постоянно, а эпизодически. Так как норадреналин достаточно быстро метаболизируется, наиболее точный результат анализа будет получен при взятии мочи во время или сразу после эпизода гипертонического криза, а не в межприступный период. В межприступный период следует измерять концентрацию основного метаболита норадреналина – ванилилминдальной кислоты. Она не подвергается дальнейшим биохимическим превращениям и может быть использована для оценки концентрации норадреналина, даже если его секреция носит пульсовый характер. Нейробластома тоже является нейроэндокринной опухолью, для которой характерна секреция избытка адреналина, норадреналина и их метаболитов. Однако при диагностике нейробластомы гораздо важнее уровень дофамина и его конечного метаболита гомованилиновой кислоты. Повышение ее концентрации в моче обнаруживается в 90 % случаев нейробластомы. Для карциноидных опухолей разной локализации характерна секреция серотонина. Серотонин не является катехоламином, но также относится к группе биогенных аминов с гормональной и нейромедиаторной активностью. Он синтезируется из аминокислоты триптофана и хранится в энтерохромаффинных клетках желудочно-кишечного тракта (80-95 % от общего количества), различных структурах головного мозга, тучных клетках кожи, тромбоцитах и некоторых других эндокринных органах. Серотонин понижает порог болевой чувствительности, регулирует функцию гипофиза, влияет на сосудистый тонус, свертываемость крови, моторику и секреторную активность желудочно-кишечного тракта. При карциноидных опухолях в моче повышается концентрация продукта метаболизма серотонина – 5-гидроксииндолуксусной кислоты. Анализ суточной мочи на 5-гидроксииндолуксусную кислоту характеризуется высокой чувствительностью (75 %) и специфичностью (88-100 %), что позволяет считать этот тест одним из основных способов подтвердить диагноз "карциноидная опухоль". Однако следует отметить, что существуют не секретирующие серотонин карциноиды, а симптомы заболевания неспецифичны и у части пациентов длительно могут отсутствовать. При хирургическом удалении и эффективном лечении нейроэндокринных опухолей уровень гормонов и их метаболитов нормализуется. Сохранение повышенной концентрации вазоактивных пептидов и продуктов их метаболизма свидетельствует о неэффективности терапии, наличии метастазов или о том, что опухоль не удалось удалить полностью.
Для чего используется исследование?
- Для диагностики феохромоцитомы, параганглиом, нейробластомы и карциноидных опухолей;
- для контроля за лечением нейроэндокринных опухолей;
- для оценки эффективности проводимой терапии апудом; для диагностики рецидивов нейроэндокринных опухолей.
Когда назначается исследование?
- При подозрении на феохромоцитому (приступы головных болей, учащенного сердцебиения, усиленная потливость, боли в животе, тошнота);
- при обследовании пациентов с тяжелой стойкой артериальной гипертензией, кризовым течением и при неэффективности стандартной гипотензивной терапии;
- при любой форме артериальной гипертонии у детей;
- при повышении АД после назначения бета-адреноблокаторов или ганглиоблокаторов;
- при наследственной предрасположенности к синдромам множественных эндокринных неоплазий, даже при отсутствии симптомов новообразований;
- при симптомах нейробластомы (чаще у детей) – признаках сдавливания окружающих тканей, боли в костях, хромоте, диарее/запоре, потере массы тела;
- при симптомах карциноидной опухоли: чувстве прилива крови к коже лица и шеи, потливости, головной боли, диареи, боли в животе, чувстве перебоев в работе сердца, одышке;
- при пеллагре (гиповитаминоз РР, связанный с повышенной продукцией серотонина из триптофана при карциноиде);
- при выявлении новообразований в области надпочечников при ультразвуковом исследовании, компьютерной или магнитно-резонансной томографии;
- после удаления апудомы (нейроэндокринной опухоли); при мониторинге состояния пациентов с МЭН-синдромами.
Что означают результаты?
Возраст
Референсные значения, пг/мл
Ряд злокачественных новообразований в большей или меньшей степени имеют структурное и функциональное сходство с исходной тканью или органом, находившихся под влиянием эндогенных гормонов.
Оказалось, что подобная гормональная зависимость различной выраженности сохраняется и в таких опухолях.
Было также установлено, что введение гормонов, или наоборот, исключение тем или иным путем их действия способно изменить рост некоторых новообразований.
На этом основано применение в онкологии гормонов, а также их синтетических агонистов и антагонистов в качестве противоопухолевых средств.
В настоящее время известно около 100 гормонов млекопитающих, которые химически подразделяются на пептиды и гликопротеиды (либерины, статины, инсулин, гормоны аденогипофиза и др.), производные тирозина (катехоламины и дофамин, тиреоидные гормоны) и дериваты холестерина (минерал- и глюкокортикоиды, прогестины, андрогены и эстрогены).
Для понимания механизмов действия гормональных препаратов на злокачественный рост, выбора метода эндокринного воздействия на опухоль, своевременного выявления возможных побочных эффектов терапии необходимо иметь основные представления о гормонах и их физиологическом действии на организм.
Метаболизм гормонов
Биосинтез гормонов осуществляется в специализированных клетках, протекает спонтанно, закреплен генетически и характеризуется следующими особенностями.
Пептидные гормоны кодируются одним (инсулин) или двумя (хорионический гонадотропин, лютеинизирующий гормон (ЛГ)) генами и образуются по общим принципам биосинтеза белка с участием РНК, рибосом и комплекса Гольджи по схеме препрогормон — прогормон — активный гормон.
Прогормон и/или активный гормон пакуется в клеточные секреторные пузырьки, выделение активного гормона из них идет по-разному в различных тканях или на разных стадиях гормонального ответа.
Стероидные гормоны синтезируются по иному пути. Сырьем служит холестерин (в коре надпочечников и гонадах — при образовании минералокортикоидов, глюкокортикоидов, прогестинов, андрогенов и эстрогенов).
Стероиды чаще секретируются в готовом виде и относительно свободно диффундируют через клеточные мембраны. Стероидогенез предусматривают участие множества ферментов (например, при продукции эстрогенов — не менее шести) и, соответственно, регулируется многими генами.
Различия в генетических программах синтеза гормонов предопределяет возможность развития эндокринных паранеоплазий. Так как биосинтез пептидных гормонов кодируется только одним-двумя генами, то он часто происходит эктопически, в опухолевых клетках, поскольку требует растормаживания только одной-двух генетических программ.
Поэтому пептидные гормоны часто являются источником паранеоплазий. А вот биосинтез стероидов в опухолях не характерен из-за множества генов, участвующих в их образовании. Однако возможна продукция избытка активного стероидного гормона из прогормона в неопухолевых тканях.
Примером служит гиперэстрогенемия при ожирении и печеночной патологии, когда происходит избыточное превращение лило- или гепатоцитами андростендиона в эстрогены, что имеет важное значение в патогенезе и лечении рака молочной железы.
Производные тирозина — катехоламины и дофамин — подвергаются при биосинтезе (в мозговом веществе надпочечников, парааортальных ганглиях плода и новорожденного, апудоцитах) гидроксилированию и декарбоксилированию и пакуются в специальные секреторные гранулы. В щитовидной железе тирозиновые остатки формируют йодтиронины — тетра- и трийодтиронин и находятся в составе особого белка тиреоглобулина.
Хранение и секреция гормонов в кровь представляют важный этап их метаболизма и бывает весьма различной. Так, тиреоглобупин щитовидной железы содержит двухнедельный запас тиреоидных гормонов. Другие пептидные гормоны запасаются в еще меньших количествах.
Практически, не запасаются стероидные гормоны. Например, семенники содержат тестостерона не более 15-17% от их суточной потребности, поэтому стероидогенез в них характеризуется высокой постоянной интенсивностью и легко нарушается при острых поражениях яичек, например, орхите.
Секреция гормонов в условиях физиологической нормы должна обеспечить определенный базальный их уровень в циркулирующих жидкостях. Этот процесс, как и биосинтез, находится под контролем специфических факторов и зависит от концентрации гормонов в крови.
Белковые гормоны и производные тирозина, как правило, поступают в кровь неравномерно. Стероидные гормоны, наоборот, на основе разницы в концентрациях, освобождаются в кровь постоянно, в импульсном режиме, когда гормон поступает в кровоток дискретными порциями-толчками.
В более долговременном плане, освобождение гормонов в кровь подчиняется определенным биоритмам — циркадному (околосуточному), околомесячному и сезонному. Нет сомнений, что биоритмологические подходы при проведении гормонотерапии могут, вероятно, значительно повлиять на ее результаты при лечении гормонозависимых опухолей.
Транспорт гормонов осуществляется с током крови, лимфы и межклеточной жидкости. Пептидные гормоны распространяются в свободном виде, а тиреоидные и стероидные, в силу гидрофобности, требуют переносчиков. Наиболее известные транспортеры гормонов — тироксин-, тестостерон-, и кортикостероидсвязывающие глобулины, а также альбумин, который неспецифически связывает тиреоидные и многие стероидные гормоны.
Последние могут также переноситься липопротеидами высокой плотности. В этой связи, при проведении гормонотерапии важно помнить, что снижение продукции переносящих белков и липопротеидов (при печеночно-почечной недостаточности и др.) может приводить к развитию токсических реакций и не оказывать ожидаемого лечебного эффекта.
Инактивация гормонов — важный этап их метаболизма. Время полужизни всех гормонов в крови весьма короткий (порядка 3-7 мин), что позволяет эндокринной системе оперативно менять гормональный фон. Для этого химический сигнал-гормон должен своевременно прекращать свое действие — инактивироваться.
Основной путь инактивации пептидных гормонов — протеолиз неспецифическими протеолитическими ферментами клеток-мишеней. Их метаболиты выводятся с мочой и желчью преимущественно в форме свободных аминокислот, их солей и небольших пептидов. Тирозиновые гормоны инактивируются специфическими ферментами тканей-мишеней и печени.
При этом разрушение катехоламинов ведет к экскреции с мочой продуктов их распада (ванилилминдальная и гомованилиновая кислоты и др.), концентрации которых измеряют в диагностических целях. Тиреоидные гормоны метаболизируются в тканях-мишенях и печени.
Стероиды подвергаются метаболизму в печени с образованием гидрофильных парных соединений с серной или глюкуроновой кислотой и выделением их в желчь и мочу. Содержание продуктов распада стероидов в моче измеряется в диагностических целях.
Механизмы действия гормонов
Известно, что гормоны реализуют свое действие на физиологические процессы через активность и количество соответствующих молекул, а процесс формирования гормонального ответа носит многоэтапный характер.
Развитие и функционирование гормонозависимых структур полностью контролируется соответствующим гормоном, гормоночувствительные проявляют свои функции и без гормонов, но степень их выраженности модулируется ими в разном диапазоне.
Рецепторы (белки) являются необходимыми периферическими представителями гормона, связываются только со специфическими по отношению к ним гормоном и определяют исходную физиологическую чувствительность реагирующей «лежи к нему. Если рецепторный белок в клетке отсутствует, то она резистентна к действию физиологических концентраций гормона.
Распределение гормональных рецепторов в организме неравномерно. Так, тиреоидными рецепторами располагает каждая клетка, рецепторы к глюкокортикоидам и катехоламинам имеют очень широкий круг органов и тканей, половые гормоны имеют рецепторы в органах репродуктивной системы, а рецепторы глюкагона, например, сосредоточены, практически исключительно, в печени.
Достигая клеток-мишеней, гормоны взаимодействуют с мембранными (поверхностными) и/или внутриклеточными рецепторами. Взаимодействие гормонов с соответствующими поверхностными рецепторными белками сводится к их обратимому связыванию и образованию специфических комплексов (рис. 9.23).

Рис. 9.23. Механизм реализации гормонального эффекта через рецепторы мембраны клетки.
Они через изменение активности аденилатциклазы увеличивают содержание внутри клетки циклического аденозинмонофосфата (цАМФ). В свою очередь, цАМФ активирует протеинкиназы, и, соответственно, — определенные ферменты и белки.
Одним из основных путей воздействия гормонов на пролиферацию и другие функции клеток считают цитозольный, когда гормональный эффект реализуется через внутриклеточные рецепторы (рис. 9.24).

Рис. 9.24. Внутриклеточный механизм действия гормонов. С — стероидный гормон; Р — рецептор гормона цитоплазматический; ЯР — ядерный рецептор гормона.
В этом случае после проникновения через наружную клеточную мембрану гормон связывается со специфическими белками (рецепторами) в цитозоле (цитоплазме) гормоночувствительных клеток и этот комплекс перемещается в ядро.
До недавнего времени считалось, что пептидные и катехоламиновые гормоны действуют на мишени исключительно с поверхности — не проникая внутрь клеток (дистантный механизм действия), а стероидные и тиреоидные — только через внутриклеточные рецепторы (внутриклеточный механизм действия).
Рецепторы гормонов имеются не только в клетках здоровых тканей, но обнаружены и в злокачественных опухолях. Очевидно, что при злокачественных новообразованиях специфический ответ опухоли на введение гормонов будет определяться наличием в ней соответствующих рецепторов.
В злокачественных опухолях идентифицированы самые разнообразные рецепторы. Так, рецепторы кортизона выявлены в лимфоцитах при лейкозе (при котором эффективна глюкокортикоидная терапия), рецепторы андрогенов — в клетках рака предстательной железы, рецепторы эстрогенов (ER+) и прогестерона (PgR+) содержат 70-80% аденокарцином эндометрия и около 60-70% — всех раков молочной железы.
Более того, в некоторых опухолях можно выявить несколько типов рецепторов гормонов. Например, в злокачественных опухолях молочной железы, наряду с ER+ и PgR+, выделены рецепторы кортикостероидов, тестостерона, пролактина, инсулина и соматотропина. Взаимодействие этих рецепторов с соответствующими гормонами и их влияние на метаболизм опухолевых клеток интенсивно изучается.
Установлена прямая зависимость в опухоли между уровнем рецепторов (в частности ER и PgR) и клинической динамикой опухолевого процесса, что позволяет не только определять план лечения, но и прогнозировать течение заболевания.
Так, рак молочной железы без рецепторов ER и PgR (менее 10 f/mol белка) отличается более высокой потенцией роста, короткими ремиссиями и худшим прогнозом, чем при наличии рецепторов. Как правило, богатые рецепторами опухоли лучше реагируют на гормональное лечение, чем бедные. Отмечена взаимосвязь между повышением выживаемости больных и высоким уровнем рецепторов в опухоли.
Классификация гормонов
Поведение человека, связанное с пищевыми, половыми, непроизвольными двигательными формами активности, эмоциями и поддержанием температурного и метаболического гомеостаза. контролируются лимбической системой и прежде всего отделом промежуточного мозга — гипоталамусом.
Тесные связи гипоталамуса со структурами ЦНС физиологически выражается в регуляции теплоотдачи и теплопродукции, аппетита и насыщения, жажды и диуреза, индукции изменений кровяного давления. Гипоталамус имеет существенное значение в поддержании оптимального уровня обмена веществ и энергии.
Под контролем гипоталамуса находятся такие железы внутренней секреции, как гипофиз, щитовидная и половые железы, надпочечники, поджелудочная железа. Ему принадлежит главная роль в формировании основных влечений организма — мотиваций.
Дирижирующие воздействия гипоталамуса на обмен веществ осуществляются по принципу компенсации отклонений метаболических констант от установочных точек, за счет координированного ответа эндокринной и автономной нервной системы.
Иначе говоря, клетки гипоталамуса выполняют функцию рецепторов, воспринимающих изменение гомеостаза, и обладают способностью трансформировать гуморальные изменения внутренней среды в нервный процесс.
Таким образом, уникальное положение гипоталамуса и нейросекреторные потенции его нейронов делают этот небольшой отдел мозга, составляющий всего 0,8% его объема, главным нейроэндокринным регулятором, т.е. местом трансформации нервного импульса в специфический гормональный сигнал, носителем которого являются рилизинг-гормоны (нейрогормоны).
Стимуляторы секреции тропных гипофизарных гормонов носят название либерины (при неидентифицированной структуре — рипизинг-факторы). Ингибиторы секреторной деятельности гипофиза — статины (при неидентифицированной структуре — ингибитинг-факторы).
В настоящее время известны следующие виды нейрогормонов:
• Тиролиберин — стимулирует секрецию тиреотропного гормона (ТТГ) и пролактина.
• Гонадолибврин — стимулирует секрецию ЛГ и фолликулостимулирующего гормона (ФСГ).
• Кортиколиберин — стимулирует секрецию адренокортикотропного гормона (АКТГ) и меланинстимулирующего гормона (МСГ).
• Соматолиберин — стимулирует секрецию соматотропного гормона (СТГ).
• Соматостатин — подавляет секрецию СТГ и, в меньшей степени, ТТГ.
• Дофамин — подавляет секрецию пролактина и, по-видимому, является главным физиологическим регулятором его секреции.
Кроме того, нейросекреторные клетки гипоталамуса вырабатывают множество нейропептидов паракриннопо местного действия, которые очень важны в регуляции поведения и гомеостаза (нейропиптиды, опиоидные пептиды, неиротензин и др.) и биогенные амины (дофамин, серотонин, норадреналин, ацетилхолин, гистамин).
Гипоталамические либерины служат и секреторными, и митогенными стимуляторами для клеток гипофиза.
Их действие осуществляется через G-белки путем повышения в кпетках концентраций цАМФ и кальция и соответствующих протеинкиназ. Статины тоже опосредуют свое действие через G-белки, приводящее к понижению уровня внутриклеточной цАМФ и кальция. Многие гормоны этой группы синтезированы и доступны как лекарства.
Регуляция секреции гипоталамических нейрогормонов осуществляется нейромедиаторами адренергической и холинергической природы (синтезируются структурами гипоталамуса), рядом аминокислот, веществами с морфиноподобным действием (эндорфины и энкефалины).
Функциональная активность гипоталамических нейроэндокринных клеток может непосредственно контролироваться различными отделами головного мозга через нервные импульсы, поступающие по различным афферентным путям.
Кроме того, между гипоталамусом и гипофизом существует обратная связь, с помощью которой регулируются их секреторные функции. Книзу гипоталамус соединяется ножкой с гипофизом посредством нервных проводников и портальной системы сосудов, через которые гипоталамические гормоны попадают в гипофиз.
Общепринято деление гипофиза на две доли, различные по развитию, строению и функциям: переднюю — аденогипофиз (около 75% общей массы железы) и заднюю — нейрогипофиз. Кровоснабжение гипофиза осуществляется ветвями внутренней сонной артерии и артериального круга большого мозга.
Кровь, предварительно пройдя через гипоталамус, обогащается гипоталамическими рилизинг-гормонами, попадает к аденогипофизу. Отток крови, насыщенной гормонами гипофиза, осуществляется по системе вен, которые впадают в венозные синусы твердой мозговой оболочки и далее в общий кровоток.
Таким образом, портальная система гипофиза с нисходящим направлением тока крови от гипоталамуса является морфофункциональным компонентом сложного механизма нейрогуморального контроля тропных функций аденогипофиза.
Гормоны аденогипофиза управляют периферическими эндокринными железами, ростовыми и анаболическими процессами, обменом веществ и размножением (рис. 9.25).

Рис. 9.25. Гипоталамо-гилофизарная система (объяснения в тексте).
В передней доле гипофиза вырабатываются адренокортикотропный, тиреотропный (тиреотропин, ТТГ), понадотропные (гонадотропины, ГТГ) — фолликулостимулирующий и лютеинизирующий гормоны, соматотропный гормон (гормон роста, соматотропин, СТГ), меланинстимулирующий гормон и пролактин.
Задняя доля служит резервуаром для хранения нейрогормонов вазопрессина (АДГ) и окситоцина (Оке), которые синтезируются в ядрах гипоталамуса и поступают сюда по аксонам нейронов.
Гормоны гипофиза в зависимости от строения и функций делятся на ряд групп:
1. Группа СТГ. К нему относятся СТГ и пролактин, представляющие собой попипептиды и характеризуются значительным сходством первичной структуры.
Метаболическое действие СТГ включает широкий спектр эффектов, опосредованных через инсулиноподобные факторы роста (соматомедины).
Соматомединов известно до семи, но наибольшее физиологическое значение имеют соматомедин С (инсулиноподобный фактор роста I (ИРФ-I)) и соматомедин А (инсулиноподобный фактор роста II (ИРФ-II)). СТГ стимулирует рост практически всех мягких тканей, оказывает лимфопролиферативное (и иммуностимулирующее) действие, способствует гипертрофии миокарда и почек, эритропоэзу, заживлению ран.
Гормон пролактин, главная его мишень — молочные железы. Пролактин стимулирует развитие альвеолярного аппарата и рост молочных желез во время беременности и лактацию после родов, а также контролирует рост и созревание желтого тела. Доказано, что рецепторы пролактина присутствуют на Т-лимфоцитах, то есть он влияет на иммунные реакции.
2. Группа гликопротеидных гормонов включает ЛГ, ФСГ и ТТГ.
ЛГ и ФСГ (гонадотропные гормоны, гонадотропины) регулируют синтез и секрецию половых гормонов и гаметогенез у особей обоего пола. В яичниках ЛГ стимулирует овуляцию с образованием желтого тела и секрецию прогестерона и эстрогенов.
ФСГ стимулирует секрецию эстрогенов, рост и созревание фолликулов. В яичках ЛГ стимулирует секрецию клетками Лейдига тестостерона. ФСГ не влияет на синтез андрогенов, но необходим для сперматогенеза в клетках.
ТТГ является главным регулятором морфогенеза фолликулярного аппарата щитовидной железы и стимулятором синтеза и секреции тиреоидных гормонов.
3. Группа производных проопиомеланокортина. Основными гормонами данной группы являются АКТГ и МСГ.
Такие же связи существуют между тиреоидными гормонами и ТТГ, между гормонами коры надпочечников и АКТГ. Гормоны, подавляющие секрецию СТГ и пролактина, пока не обнаружены, хотя недавно было установлено, что ИФР-1 тормозит секрецию СТГ.
Гормоны периферических эндокринных желез могут подавлять не только секрецию соответствующих тройных гормонов гипофиза, но и секрецию либеринов гипоталамуса. Например, эстрогены подавляют как секрецию ЛГ и ФСГ, так и секрецию гонадолиберина.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
27 февраля 2015
- 52624
- 42,6
- 5
- 20
Дофамин не наркотик, он — мотиватор.
![]()
Виктор Лебедев
![]()
Вера Башмакова![]()
Ольга Волкова
- Медицина
- Нейробиология
- Нейромедиаторы
Мозг человека — хитросплетение множества нервных волокон, по которым идут разнообразные сигналы. Несмотря на свою электрическую природу, сигнал может передаться от одной клетки к другой только при помощи особых веществ — нейромедиаторов. Именно они в месте соприкосновения двух нейронов — синапсе — осуществляют передачу информации. Одним из нейромедиаторов является дофамин; с этим веществом связаны важнейшие биологические процессы в мозге и серьезные заболевания.
Три пути
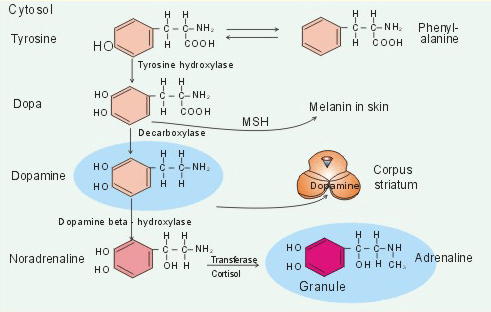
Рисунок 1. Синтез дофамина. На схеме также показаны пути синтеза других нейромедиаторов.
Если в нервной системе играет важную роль какое-то вещество, то должны быть и рецепторы к нему — точка приложения вещества. Сейчас насчитывают 5 типов дофаминовых рецепторов. Называются они до скучного предсказуемо: DRD1, DRD2, DRD3, DRD4 и DRD5. Рецепторы DRD1 и DRD5 относятся к одной группе, а остальные типы — к другой. При взаимодействии дофамина с рецепторами первой группы запускается каскад реакций, приводящий к росту внутриклеточной концентрации циклического аденозинмонофосфата (цАМФ), а при реакции с другими типами рецепторов количество цАМФ снижается. То есть взаимодействие дофамина с разными группами рецепторов приводит либо к активации, либо к ингибированию клеточной активности. А это в свою очередь оказывает влияние на поведение человека [1].
Дофаминовые шоссе проложены в мозге по трем основным направлениям (рис. 2). Первая дорога (мезолимбический путь) ведет из вентральной области покрышки (ventral tegmental area, VTA) в лимбическую систему — часть мозга, в которой формируются наши эмоции и желания. Вторая трасса проложена между VTA и лобной корой (мезокортикальный путь): здесь осуществляются когнитивные процессы, а также процессы, связанные с мотивацией и эмоциями. Легко заметить, что мезолимбический и мезокортикальный пути осуществляют схожие функции. Они отвечают за формирование желаний, за мотивацию и эмоциональные реакции у всех людей. Есть еще третий путь — нигростриарный, связывающий черное вещество (substantia nigra) с полосатым телом (striatum). У нигростриарного пути особенная функция: в нервной системе он запускает двигательную активность, снижая напряжение в мышцах.
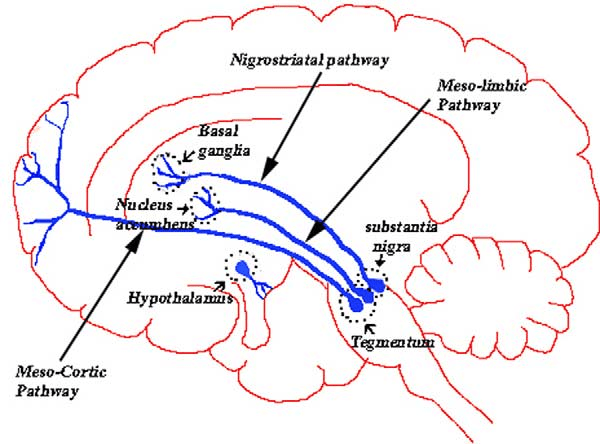
Рисунок 2. Дофаминовые пути. Нигростриарный путь контролирует движения, мезолимбический и мезокортикальный пути вовлечены в высшие психические функции.
Молекулярный пряник
Часто можно прочесть, что дофамин является нейромедиатором удовольствия, но это не совсем верно. Дофамин помогает мозгу выбрать правильные стратегии поведения и создает мотивацию для конкретных действий. В этих процессах задействованы мезолимбические и мезокортикальные дофаминовые волокна.
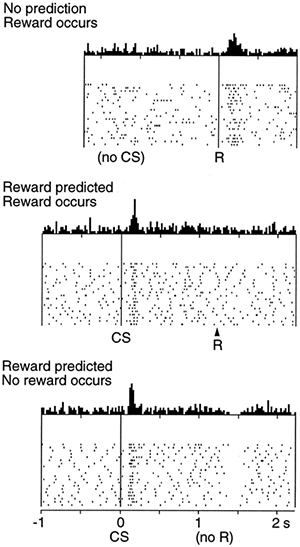
В наглядном изложении участие дофамина в процессе обучения будет выглядеть следующим образом. Человек красит забор и получает за это деньги. Есть действие (красить забор) и награда (деньги), которые мозг увязывает между собой. Первое денежное вознаграждение за покраску забора приводит к выбросу дофамина. В дальнейшем выделение дофамина по времени будет сдвигаться не к получению зарплаты за работу, а к самой работе. Так образуется мотивация, основанная на выгоде, на получаемых положительных эмоциях. Если после действия, к которому была сформирована мотивация, ожидаемая награда не поступила, то количество дофамина в соответствующих структурах головного мозга снижается, уменьшая ценность этого действия. Если Вы красите забор, а Вам за это не платят или платят слишком мало, то в конце концов Вы оставите кисть и краску (рис. 3). Эти простые механизмы управляют всей нашей жизнью — от похвалы в детском саду до голосования против того кандидата, который нас не устраивает. Примечательно, что при получении награды и ее отсутствии задействованы нейроны с разными типами дофаминовых рецепторов (рис. 4а и 4б). В случае получения награды меняется активность нейронов с дофаминовым рецептором 1-го типа, а при ее отсутствии — с дофаминовым рецептором 2-го типа [2].
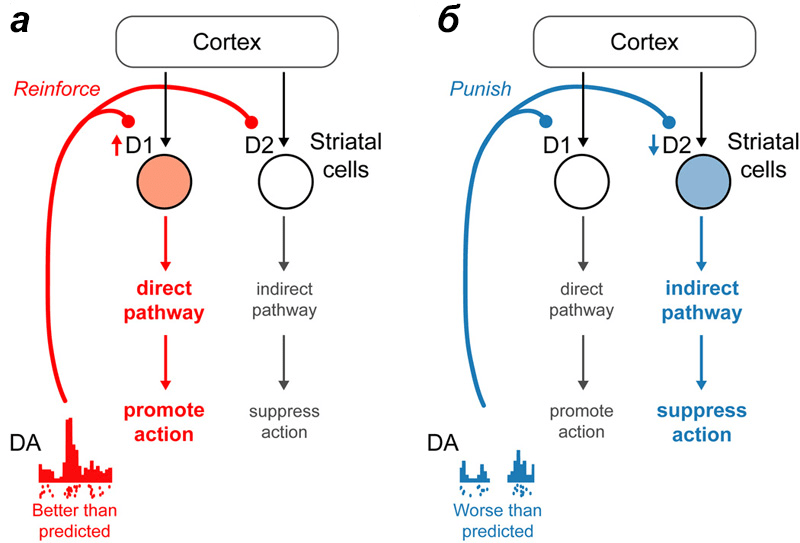
Рисунок 4. Вовлечение разных дофаминовых путей при обучении. При получении награды большей, чем ожидалось, происходит возбуждение нейронов с дофаминовыми рецепторами I типа. При награде менее значимой, чем раньше, снижается активность клеток с дофаминовыми рецепторами II типа.
Кроме этого существуют такие схемы дофаминовых путей, которые реагируют возбуждением на отрицательные стимулы [3]. С учетом этого становится ясно, что дофамин связан не с удовольствием, а с мотивацией и формированием целенаправленного поведения. Дофаминовые волокна проникают в различные отделы мозга — в префронтальную кору, отвечающую за планирование и обучение, в гиппокамп (центр нашей памяти) — и формируют устойчивые функциональные связи между нейронами для осуществления поведенческих программ.
Нарушения в различных дофаминовых путях приводят к различным заболеваниям.
Наблюдательный доктор
Болезнь Паркинсона — это заболевание, при котором поражаются структуры мозга, входящие в состав нигростриарного дофаминового пути. При болезни Паркинсона в нейронах черного вещества накапливается белок α-синуклеин, что приводит к нарушению функционирования клеток и их гибели. Под микроскопом скопления белка видны в виде гранул — так называемых телец Леви (рис. 5).
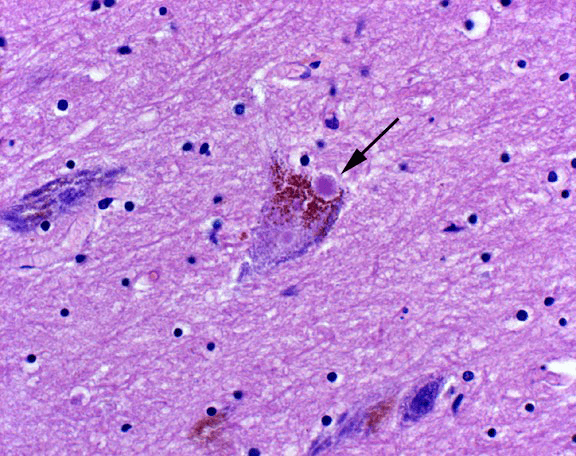
Рисунок 5. Нейрон с тельцем Леви — патологическим скоплением белка α-синуклеина в цитоплазме.
Чтобы понять, что происходит при болезни, для начала надо разобраться с нормой. У здорового человека сигналы из черного вещества по отросткам дофаминовых нейронов поступают в полосатое тело. Туда же, но по глутаматным путям, идут импульсы с моторных центров коры головного мозга. По дофаминовым путям приходят сигналы, влияющие на тонус мышцы и делающие движения плавными. Глутаматные сигналы — это резкие сокращения скелетной мускулатуры. При болезни Паркинсона происходит постепенное отмирание дофаминовых нейронов, постепенно снижается интенсивность импульсов. Это долго происходит незаметно, оставшиеся клетки используют резервы мощности. Рано или поздно мощность сигнала падает критически. Как правило, это происходит при гибели 3/4 нейронов черной субстанции. Появляются признаки болезни — нарастающее повышение мышечного тонуса и дрожание рук. На ранних этапах заболевания у пациента сохраняется способность к целенаправленным действиям, но чем дальше оно прогрессирует, тем сложнее человеку совершать простые бытовые действия, например, держать ложку.
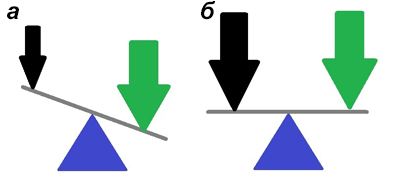
Рисунок 6. Патофизиология нарушений при болезни Паркинсона. а — До лечения: глутаматный сигнал (зеленая стрелка) не меняется при болезни Паркинсона, интенсивность дофаминового воздействия (черная стрелка) падает, возникает функциональное преимущество глутаматной системы. б — После применения лекарств сила дофаминового сигнала возрастает, система приходит к равновесию. Двигательные нарушения уменьшаются.
рисунок автора статьи.
Болезнь Паркинсона проявляется не только специфическими двигательными расстройствами. Кроме черного вещества в патологический процесс вовлекаются другие отделы мозга; это приводит к возникновению так называемых немоторных (non-motor) симптомов болезни Паркинсона. Нарушения сна, сниженное настроение, тревога, набор или снижение веса, проблемы со зрением, замедление мышления и даже деменция — список симптомов внушителен, и часто пациенту мешают жить даже не двигательные нарушения, а именно немоторные проявления болезни.
Одним из главных лекарств от болезни Паркинсона является леводопа — L-изомер диоксифенилаланина (L-DOPA), который проникает в мозг лучше, чем сам дофамин. Однако в мозг проникает относительно небольшая часть леводопы, а оставшееся количество начинает превращаться ферментами периферических тканей в дофамин путем декарбоксилирования. Избыток дофамина может привести к падению давления, обморокам и другим неприятным побочным эффектам. Чтобы избежать этого, в дополнение к леводопе назначают ингибиторы периферической L-DOPA-декарбоксилазы. Существуют противопаркинсонические препараты, где леводопа уже совмещена с ингибитором фермента, и они повышают эффективность лечения (рис. 6).
Дофаминовая гипотеза
Другим заболеванием, которое тесно связано с дофамином, является шизофрения. В ходе обсуждения происхождения, диагностики и лечения этой болезни ломались копья не одного поколения врачей, ученых, психологов, журналистов и прочих причастных. Чтобы не уходить в дебри этого спора, стоит дать краткое описание современного подхода к шизофрении. Во-первых, шизофрения существует, и это болезнь. Во-вторых, у нее есть четкие диагностические критерии, с которыми знаком любой врач-психиатр. Несмотря на разнообразие клинических проявлений, шизофрения хорошо распознается специалистами. Кроме диагностики разработано лечение и доказано, что оно успешно работает. Это в-третьих. Но к лечению мы еще вернемся.
Знакомые побочные эффекты
Проблема применения препаратов разных поколений связана с тем, что типичные антипсихотики вызывают двигательные побочные эффекты чаще, чем атипичные [6]. Побочные эффекты часто возникают в виде мышечной скованности и дрожания рук, что очень напоминает болезнь Паркинсона. Комплекс этих симптомов так и называется — лекарственный паркинсонизм. Антипсихотик блокирует все рецепторы в мозге без разбора и рано или поздно добирается до нигростриарной системы, снижая воздействие дофаминовых сигналов на двигательные структуры нервной системы. Пациент может жаловаться на мышечную скованность, дрожание рук, и это одни из самых неприятных побочных эффектов, которые часто приводят к отказу от лечения. В самом начале истории применения антипсихотиков врачи считали, что пока у человека не развились двигательные расстройства, доза препарата не может считаться адекватной. К счастью, сейчас выработаны и применяются разумные схемы лечения психических расстройств, и у препаратов из новой группы антипсихотиков меньше выражены двигательные побочные эффекты.
Читайте также:




