Доброкачественные опухоли и вич
Помимо повышенной склонности к инфекциям, у больных СПИДом повышается склонность к образованию как доброкачественных, так и злокачественных опухолей, поскольку контроль за новообразованиями также осуществляет иммунная система, в частности лимфоциты СD4.
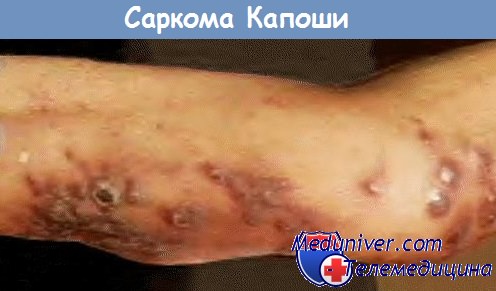
Саркома Капоши – это сосудистая опухоль, способная поражать кожу, слизистые и внутренние органы. Клинические проявления саркомы Капоши разнообразны. Начальные проявления выглядят как небольшие красно-лиловые узлы, возвышающиеся над поверхностью кожи, которые возникают чаще всего на открытых участках, наиболее подверженых воздействию прямого солнечного света. При прогрессировании узлы могут сливаться, обезображивая при этом кожу и, при расположении на ногах, ограничивая физическую активность. Из внтуренних органов саркома Капоши чаще всего поражает желудочно-кишечный тракт и легкие, но иногда и головной мозг и сердце.
Лимфомы – являются поздними проявлениями ВИЧ-инфекции. Лимфомы могут поражать как лимфатические узлы, так и внутренние органы, в том числе головной и спинной мозг. Клинические проявления зависят от расположения лимфомы, однако почти всегда сопровождаются лихорадкой, похуданием, потливостью по ночам. Лимфомы могут проявляться быстро растущими объемными образованиями в полости рта, эпилептическими припадками, головной болью и др.
Другие злокачественные образования – у ВИЧ-инфицированных возникают с той же частотой, что и в общей популяции. Однако у больных ВИЧ они имеют быстрое течение и плохо поддаются лечению.
Неврологические нарушения
Деменция – это прогрессирующее снижение интеллекта, которое проявляется нарушением внимания и способности сосредоточиться, ухудшением памяти, затруднением при чтении и решении задач.
Кроме того, проявлениями СПИД-дементного синдрома служат двигательные и поведенческие нарушения: нарушение способности поддерживать определенную позу, сложности при ходьбе, тремор (подергивания различных частей тела), апатия.
На поздних стадиях СПИД-дементного синдрома может присоединяться недержание мочи и кала, в некоторых случаях развивается вегетативное состояние.
Выраженные СПИД-дементный синдром развивается у 25% ВИЧ-инфицированных.
Причина синдрома окончательно не установлена. Полагают, что он обусловлен прямым воздействием вируса на головной и спинной мозг.
Причинами эпилептических припадков может быть как оппортунистические инфекции, поражающие головной мозг, так и новообразования или СПИД-дементный синдром.
Чаще всего причинами служат: токсоплазменный энцефалит, лимфома головного мозга, криптококковый менингит и СПИД-дементный синдром.
Частое осложнение ВИЧ-инфекции, которое может возникнуть на любой стадии. Клинические проявления разнообразны. На ранних стадиях она может протекать в виде прогрессирующей мышечной слабости, незначительного нарушения чувствительности. В дальнейшем проявления могут прогрессировать, присоединяются жгучие боли в ногах.
Жизнь с вич
Положительный анализ на ВИЧ… Что с этим делать? Как реагировать? Как жить дальше?
Во-первых, как можно быстрее постараться побороть панику. Да, СПИДсмертельное заболевание, но до развития СПИДа можно прожить 10, а то и 20 лет. К тому же, сейчас ученые во всем мире активно занимаются поиском эффективных лекарств, многие недавно разработанные препараты действительно значительно продлевают жизнь и улучшают самочувствие больных СПИДом. Никто не знает, до чего дойдет наука в этой области через 5-10 лет.
С ВИЧ необходимо научиться жить. К сожалению, жизнь никогда уже не станет прежней. Долгое время (возможно, многие годы) никаких признаков болезни может не возникать, человек ощущает себя полностью здоровым и полным сил. Но об инфицированности не стоит забывать. В первую очередь нужно обезопасить своих близких – они обязаны знать об инфицированности. Очень сложно бывает рассказать родителям, любимому человеку о ВИЧ-позитивном анализе. Но как бы сложно ни было, любимые люди не должны подвергаться риску, поэтому партнеру(ам) (как настоящим, так и бывшим) нужно обязательно сообщить о результате анализа. Любой секс, даже с презервативом, может быть опасен в отношении передачи вируса, пусть даже иногда опасность крайне мала. Поэтому при появлении нового партнера нужно дать человеку возможность самому сделать выбор. Нужно помнить, что опасен может быть не только вагинальный или анальный секс, но и оральный.
Несмотря на то, что признаков болезни может не быть, требуется регулярный контроль состояния. Обычно этот контроль осуществляется в специализированных СПИД-центрах. Своевременное выявление прогрессирования заболевания и начала развития СПИДа, а, следовательно, вовремя начатое лечение является основой успешного лечения в дальнейшем и замедления прогрессирования заболевания. Обычно проводится контроль уровня лимфоцитов CD 4, а также уровеня репликации вируса. Кроме того, оценивается общее состояние больного, возможное наличие оппортунистических инфекций. Нормальные показатели состояния иммунитета позволяют исключить наличие СПИДа, а, значит, позволяют вести нормальную жизнь и не пугаться любого насморка.
Большинство людей заражаются ВИЧ в молодом возрасте. Многие женщины хотят иметь детей. Они чувствуют себя абсолютно здоровыми и способными родить и вырастить ребенка. Запретить рождение ребенка не может никто – это личное дело матери. Однако прежде чем планировать беременность, нужно взвесить все “за” и “против”. Ведь ВИЧ с большой долей вероятности передается через плаценту, а также во время родов через родовые пути. Стоит ли подвергать ребенка врожденному носительству ВИЧ, росту под постоянным медицинским наблюдением, приему токсичных препаратов. Даже если ребенок не заразится, он рискует остаться без родителей, еще не достигнув совершеннолетия…
Когда уровень лимфоцитов CD 4 падает ниже 200/мкл, появляется оппортунистическая инфекция или какие-либо другие признаки снижения иммунного ответа диагностируют СПИД. Таким людям следует соблюдать ряд правил.
Правильное питание: не стоит соблюдать какие-либо диеты, любое недоедание может быть вредным. Питание должно быть калорийным и сбалансированным.
Отказаться от вредных привычек: алкоголя и курения
Умеренные физические упражнения способны позитивно влиять на иммунный статус ВИЧ-инфицированных
Следует обсудить со своим лечащим врачом возможность вакцинаций от некоторых инфекций. Не все вакцины можно применять у ВИЧ-инфицированных. В частности, нельзя использовать живые вакцины. Однако убитые вакцины, а также вакцины, представляющие собой частицы микроорганизмов, подходят многим ВИЧ-инфицированным людям в зависимости от их иммунного статуса.
Всегда необходимо обращать внимание на качество употребляемой пищи и воды. Фрукты и овощи необходимо тщательно мыть кипяченой водой, пища должна быть термически обработанной. Непроверенную воду необходимо обеззараживать, в некоторых странах с жарким климатом, даже водопроводная вода бывает заражена.
Общение с животными: лучше исключить любые контакты с незнакомыми (тем более бездомными) животными. По крайней мере, необходимо обязательно мыть руки после контакта с животным, даже с собственным. За своим домашним питомцем нужно следить особенно тщательно: стараться не допускать его общения с другими животными и не позволять трогать мусор на улице. После прогулки обязательно мыть, причем лучше в перчатках. Убирать за животным тоже лучше в перчатках.
Стараться ограничивать свое общение с заболевшими, простудившимися людьми. При необходимости общения стоит использовать маску, мыть руки после контакта с больными людьми.
У пациентов со СПИДом часто возникают опухоли, особенно саркома Капоши, неходжкинская В-клеточная лимфома, рак шейки матки у женщин и рак анальной области у мужчин. Подсчитано, что у 25-40% ВИЧ-инфицированных пациентов без терапии со временем развивается злокачественное новообразование.
Все эти опухоли, как полагают, вызваны онкогенными ДНК-вирусами, т.е. герпес-вирусом саркомы Капоши (KSHV), EBV (В-клеточная лимфома) и HPV (карцинома шейки матки и анальной области). Даже у здоровых людей любой из этих вирусов способен вызвать инфекцию, остающуюся латентной, если иммунная система функционирует нормально.
Повышенный риск развития опухолей при СПИДе существует главным образом вследствие реактивации вирусов и неспособности организма больного сдерживать развитие инфекции, а также из-за ослабления противоопухолевого иммунитета.
В начале эпидемии СПИДа до 30% гомо- или бисексуальных мужчин имели саркому Капоши, однако в последние годы с введением HAART наблюдается заметное уменьшение ее частоты — с 15 случаев на 1000 пациентов до менее 5 случаев.
Поражение при саркоме Капоши характеризуется пролиферацией веретенообразных клеток, экспрессирующих маркеры как эндотелиальных (сосудистых или лимфатических) клеток, так и клеток гладких мышц. В изобилии также присутствуют щелевидные сосудистые пространства, указывающие на то, что источником патологии могут быть примитивные мезенхимальные предшественники сосудистых каналов. Кроме того, при саркоме Капоши обнаруживаются хронические воспалительные клеточные инфильтраты.
Многие признаки саркомы Капоши свидетельствуют о том, что она не относится к злокачественным опухолям (несмотря на свое зловещее название). Так, веретенообразные клетки при многих саркомах Капоши имеют поликлональный или олигоклональный характер, хотя в запущенных случаях иногда становятся моноклональными. Веретенообразные клетки часто являются диплоидными, которым для пролиферации необходимы факторы роста.
Когда веретенообразные клетки имплантируют иммунодефицитным мышам, опухоль не образуется, но кратковременно индуцируется образование новых кровеносных сосудов, прерываемых щелевидными пространствами, и воспалительных инфильтратов в окружающих тканях. Эти элементы напоминают признаки саркомы Капоши человека, однако имеют мышиное происхождение, и, когда элиминируются клетки саркомы Капоши человека, воспалительные и неоваскулярные элементы также регрессируют.
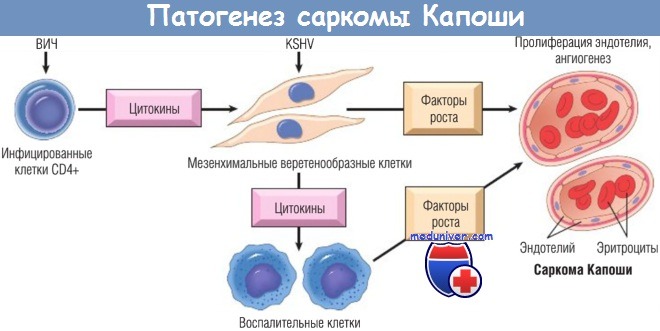
Патогенез саркомы Калоши.
Предполагаемая роль ВИН, герпес-вируса саркомы Капоши (KSHV) и цитокинов в развитии саркомы Капоши.
Цитокины образуются мезенхимальными клетками, инфицированными KSHV, или ВИЧ-инфицированными клетками CD4+.
В-клетки также могут быть инфицированы KSHV; вероятно, эти клетки связаны с лимфомами полостей тела, а также ассоциированы с KSHV-инфекцией, однако их роль при саркоме Капоши неясна.
ВИЧ — вирус иммунодефицита человека.
Существующая модель патогенеза саркомы Капоши, основанная на этих наблюдениях, заключается в том, что веретенообразные клетки продуцируют провоспалительные и ангиогенные факторы, которые мобилизуют воспалительные и неоваскулярные элементы, и последние секвестрируют факторы, способствующие выживаемости или росту веретенообразных клеток.
Однако что именно инициирует этот цикл? Существуют убедительные данные, что сам ВИЧ не является виновником и что саркому Капоши вызывает KSHV, называемый также герпес-вирусом человека 8-го типа (HHV-8). С помощью эпидемиологических и молекулярных исследований установлена связь между KSHV и развитием саркомы Капоши. ДНК KSHV обнаружена практически при всех саркомах Капоши, включая те опухоли, которые встречаются у ВИЧ-отрицательных лиц. KSHV локализован строго в веретенообразных клетках и вызывает преимущественно латентную инфекцию.
Однако для развития саркомы Капоши только KSHV-инфекции недостаточно, нужно участие кофакторов. При СПИДе в качестве такого фактора выступает ВИЧ. (Соответствующий кофактор при ВИЧ-отрицательной саркоме Капоши остается неизвестным.) Продолжается дискуссия о том, каким образом ВИЧ способствует развитию саркомы Капоши. Согласно простейшей модели, опосредованная ВИЧ иммуносупрессия дает возможность KSHV распространяться в организме-хозяине, получая доступ ко все большему числу веретенообразных клеток и направляя их по пути неконтролируемого роста.
Другая гипотеза заключается в том, что ВИЧ-инфицированные Т-клетки продуцируют цитокины или другие белки, способствующие пролиферации и выживаемости веретенообразных клеток. Ясно, что эти предположения не являются взаимоисключающими.
Также еще неизвестно, каким образом KSHV-инфекция приводит к развитию саркомы Капоши. Подобно другим герпес-вирусам, KSHV вызывает латентную инфекцию, во время которой образуется ряд белков, имеющих потенциальное значение в стимуляции пролиферации веретенообразных клеток и предотвращении апоптоза. К этим белкам относятся вирусный гомолог циклина D и различные ингибиторы р53. Такие белки могут давать латентно инфицированным клеткам преимущество в росте и выживаемости in vivo, стимулируя начало их пролиферации.
Кроме того, в небольшой субпопуляции клеток при саркоме Капоши происходит литическая вирусная репликация со смертью клеток и высвобождением прогени вируса. Литический цикл KSHV примечателен продукцией множества паракринных сигнальных молекул, включая вирусные гомологи цитокина IL-6 и различные хемокины. Возможно, последние играют существенную роль в индукции образования воспалительных инфильтратов, важного признака саркомы Капоши. Вклад вирусного IL-6 до сих пор неясен. Другой вирусный белок, продуцируемый во время литической инфекции, представляет собой конститутивно активный рецептор, связанный с G-белком.
Этот белок привлекает внимание, поскольку его экспрессия активирует высвобождение сосудистого эндотелиального фактора роста, способствующего ангиогенезу в окружающей ткани. Следует отметить, что экспрессия вирусного рецептора, связанного с G-белком, у трансгенных мышей приводит к образованию неоваскулярных пространств, отдаленно напоминающих таковые в саркоме Капоши. Таким образом, есть достаточные основания полагать, что и латентная, и литическая KSHV-инфекции вносят свой вклад в патогенез саркомы Капоши.
KSHV-инфекция не ограничена эндотелиальными клетками. Филогенетически вирус родственен подсемейству лимфотропных герпес-вирусов, соответственно его геном обнаруживается в В-клетках инфицированных индивидов. KSHV-инфекция у пациентов со СПИДом также связана с редкой В-клеточной лимфомой (называемой первичной лимфомой, связанной с полостями тела) и мультицентрической болезнью Кеслмена (В-клеточным лимфопролиферативным расстройством).
Саркома Капоши, ассоциированная со СПИДом, клинически отличается от спорадической формы. У ВИЧ-инфицированных индивидов опухоль обычно распространяется, поражая кожу, слизистые облочки, лимфоузлы и легкие. Эта опухоль имеет тенденцию к большей агрессивности, чем классическая саркома Капоши.
б) Лимфомы. Ассоциированные со СПИДом лимфомы разделяют на 3 группы в зависимости от локализации: системные лимфомы, первичные лимфомы ЦНС и лимфомы, связанные с полостями тела. Системные лимфомы поражают лимфоузлы и участки внутренних органов вне лимфоузлов. Частота системных лимфом — 80% всех связанных со СПИДом лимфом. ЦНС является наиболее часто поражаемой областью вне лимфоузлов, за ней следует ЖКТ, реже опухоль возникает практически в любом другом месте, включая глазницы, слюнные железы и легкие.
Подавляющее большинство таких лимфом представляют собой агрессивные В-клеточные опухоли, выявляемые на поздней стадии. ЦНС, помимо поражения системными неходжкинскими лимфомами, является также местом первичной локализации лимфоматоза у 20% пациентов с ВИЧ-инфекцией, у которых возникла лимфома. Первичную лимфому ЦНС регистрируют у пациентов со СПИДом в 1000 раз чаще, чем в общей популяции. Лимфомы, связанные с полостями тела, встречаются редко, однако привлекают внимание необычным проявлением в виде плевральных, перитонеальных и перикардиальных выпотов.
В основе патогенеза В-клеточных лимфом, ассоциированных со СПИДом, лежит, вероятно, длительная поликлональная активация В-клеток, вследствие чего появляются моноклональные или олигоклональные В-клеточные популяции. Предполагают, что в ходе безудержной пролиферации в некоторых клонах происходят мутации или хромосомные транслокации, затрагивающие онкогены или гены-супрессоры опухолей, с последующей неопластической трансформацией (см. главу 7). Есть морфологические данные об активации В-клеток в лимфоузлах; считают, что такая стимуляция В-клеток является многофакторным процессом.
У пациентов со СПИДом отмечаются высокие уровни различных цитокинов, некоторые из них, включая IL-6, являются факторами роста В-клеток. Кроме того, играет определенную роль EBV, известный как поликлональный В-клеточный митоген. 50% системных В-клеточных лимфом и практически все лимфомы, первично возникшие в ЦНС, латентно инфицированы.
Другим признаком, указывающим на инфекцию EBV, служит волосистая лейкоплакия полости рта (белые пятна на языке), возникающая в результате индуцированной EBV плоскоклеточной пролиферации слизистой оболочки рта. Если методом молекулярного футпринтинга EBV не определяется, вероятно, поликлональную активацию В-клеток инициировали другие вирусы и микробы. Отсутствуют доказательства того, что сам ВИЧ способен вызывать неопластическую трансформацию. Редкие эффузионные лимфомы, связанные с полостями тела, постоянно латентно инфицированы KSHV.
В результате увеличения продолжительности жизни пациентов со СПИДом количество лиц с неходжкинской лимфомой неуклонно растет. Считают, что у 6% всех пациентов со СПИДом в течение жизни развивается лимфома. Таким образом, риск возникновения неходжкинской лимфомы среди пациентов со СПИДом в
120 раз выше, чем в общей популяции. В отличие от саркомы Капоши иммунодефицит здесь прочно занял центральное место как предрасполагающий фактор. Предположительно пациенты с числом Т-клеток CD4+ менее 50 в 1 мкл относятся к группе крайне высокого риска.
в) Другие опухоли. У пациентов со СПИДом также повышена частота карциномы шейки матки и анальной области. Вероятно, это обусловлено реактивацией латентной инфекции, вызванной HPV, в результате иммуносупрессии. Считают, что этот вирус тесно связан с плоскоклеточной карциномой шейки матки и предшествующими ей дисплазией шейки матки и карциномой in situ. Ассоциированную с HPV цервикальную дисплазию регистрируют у ВИЧ-инфицированных женщин в 10 раз чаще, чем у неинфицированных женщин, поэтому гинекологическое исследование должно быть частью рутинного обследования ВИЧ-инфицированных женщин.
- Рекомендуем ознакомиться со следующей статьей "Болезни ЦНС при СПИДе"
Тем не менее, в последние десятилетия адекватная противовирусная терапия позволила не только улучшить результаты противоракового воздействия, но и в разы уменьшить вероятность развития злокачественного процесса у ответственного пациента.
Когда при ВИЧ появляются злокачественные опухоли
Рак и другие злокачественные опухоли развиваются при переходе ВИЧ-инфекции в позднюю стадию болезни, когда концентрация иммунных клеток устремляется к минимальной, позволяя активно и почти беспрепятственно размножаться разнообразной микрофлоре — от простейший и грибов до бактерий и вирусов.
Всё, что происходило в организме инфицированного пациента ранее, было обычной ВИЧ-инфекцией, появление рака или других опухолей, а также тяжёлых распространённых инфекций — это уже СПИД.
Благодаря лечению период от заражения вирусом иммунодефицита до последней стадии болезни растянулся почти на три десятилетия, тогда как в конце 1980-х годов занимал несколько лет.
Какие раки развиваются при ВИЧ-инфекции
В конце ХХ века выявление определённых, практически не встречающихся при нормальном иммунитете заболеваний и злокачественных процессов, позволяло ставить диагноз ВИЧ/СПИД без сложных лабораторных исследований. Такие процессы обозначили как ассоциированные с вирусом иммунодефицита или, по-современному, СПИД-индикаторные. В этот список наряду с необычными инфекциями включены инвазивный рак шейки матки, саркома Капоши и злокачественные лимфомы, вероятность которых у инфицированного пациента возрастает в сотни раз.
Значительно чаще, но не в сотни раз, при ВИЧ-инфекции вероятно развитие плоскоклеточного рака анального канала и рака вульвы, карциномы лёгкого и злокачественных опухолей яичка, плоскоклеточного рака головы и шеи, меланомы и рака кожи.
Для большинства злокачественных процессов доказана основополагающая патогенетическая роль вирусов, в первую очередь, папилломы человека (ВПЧ) и гепатита В, С и D. Способствует раннему развитию злокачественных новообразований носительство вирусов герпеса, особенно 4 типа — вируса Эпштейна-Барр. Традиционно значимы у ВИЧ-инфицированных факторы риска злокачественного перерождения клеток бронхолегочной системы — курение и наследственная предрасположенность.
Как ВИЧ-инфекция влияет на течение рака
Однозначно — очень неблагоприятно, усугубляя скорость прогрессирования и увеличивая массив опухолевого поражения. И хотя рак у ВИЧ-инфицированного пациента возникает много раньше, чем в общей популяции, практически в молодом возрасте, пациенты не могут похвастать исходным хорошим здоровьем.

Как ВИЧ сказывается на переносимости химиотерапии
В большинстве случаев злокачественный процесс на фоне ВИЧ-инфекции течёт агрессивнее, поэтому на первом этапе требует системного лечения с использованием противоопухолевых препаратов, гарантирующих разнообразный спектр токсических реакций. При этом ни в коем случае нельзя отказываться от специфической противовирусной терапии, также изобилующей неблагоприятными проявлениями.
В итоге переносимость противоракового лечения, проводимого на фоне ВААРТ, ухудшается, а продолжительность жизни пациентов не в пример короче, чем это могло быть в отсутствии ВИЧ. При активной противоопухолевой и противовирусной терапии больше года после выявления опухоли живёт только каждый четвёртый, пятилетку — всего 19%.
Существует ещё одна серьёзная проблема — клинического изучения эффективности противоопухолевой терапии у ВИЧ-инфицированных не проводится из-за малочисленности групп пациентов и, следовательно, сомнительной достоверности результатов. Поэтому очень важно в этот тяжёлый период найти клинику и специалистов одинаково высоко компетентных в вопросах лечения ВИЧ и противораковой химиотерапии.
Как лечат рак у ВИЧ-инфицированных
В большинстве случаев терапия рака не должна отличаться от таковой у пациентов с нормальными показателями иммунитета.
При технической возможности хирургической операции ВИЧ-пациенту от неё нельзя отказываться, поскольку излечение возможно только при удалении всех очагов рака. Если для злокачественной опухоли лимфатической системы признана необходимость высокодозной химиотерапии с трансплантацией стволовых клеток, то и инфицированный вирусом пациент должен получить программное лечение. При раке шейки матки практически невозможно обойтись без лучевой терапии.
ВИЧ-компрометированному пациенту потребуется ВААРТ и гораздо более серьёзное сопроводительное лечение. Чтобы провести химиотерапию без сокращения доз и интервалов необходима индивидуальная программа реабилитационного воздействия. Кроме того, пациент должен получать множество препаратов для лечения грибковых поражений и сдерживания вирусов герпеса, разнообразные антибактериальные средства, каждое из которых имеет собственную токсичность.

Такое комплексное воздействие способна осуществить только команда врачей разных специальностей, блестяще ориентированная как в потребностях онкологического пациента, так и в возможностях организма инфицированного.
ВИЧ-инфекция — один из факторов, который во много раз повышает вероятность развития рака. Выяснили, какие именно онкозаболевания чаще всего могут возникать при положительном ВИЧ-статусе, как их вовремя обнаружить, и на какие факторы риска еще нужно обратить внимание людям, живущим с ВИЧ.
Главная мишень вируса — CD4-Т-лимфоциты. Они передают сигнал другим клеткам, которые защищают организм от рака. В результате вмешательства вируса количество CD4-T-лимфоцитов постепенно уменьшается. Критически низкий уровень этих клеток - одна из причин отсутствия согласованной работы между звеньями иммунитета и главный механизм, приводящий к развитию СПИДа.
Иммунитет человека с ВИЧ-инфекцией перестает контролировать процессы избыточного клеточного деления и злокачественной трансформации клеток. Вместе с уменьшением количества CD4-T-лимфоцитов происходит накопление раковых клеток. В результате у человека развиваются несколько видов опухолей, которые называют СПИД-индикаторными: появление такого вида рака с очень большой вероятностью означает наличие у человека СПИДа.
Однако повышается риск появления не только СПИД-индикаторных опухолей, но и тех видов рака, которые развиваются из-за потери иммунного контроля над несколькими онкогенными инфекциями: вирусом герпеса человека 8 типа (ВГЧ-8), вирусом папилломы человека (ВПЧ), вирусами гепатита В и С (ВГВ, ВГС), вирусом Эпштейна-Барр (ВЭБ) и другими.
Все эти состояния развиваются у людей с ВИЧ-инфекцией преимущественно на фоне снижения количества CD4-T-лимфоцитов до уровня менее 200 клеток/мкл (при разбросе в норме от 500 до 1100 клеток), но также могут возникать при нормальном или близком к нормальному уровню CD4-T-лимфоцитов.
Саркома Капоши (СК) — СПИД-индикаторная опухоль, при которой происходит злокачественная трансформация клеток лимфатических и кровеносных сосудов. Риск развития СК у пациентов с ВИЧ-инфекцией увеличивается в несколько сотен раз. Различные белки ВИЧ-1 способны усиливать воспаление и нарушать регуляцию в эндотелиальных клетках. Это приводит к тому, что саркома Капоши может развиться до того, как уровень CD4-T-лимфоцитов упадет ниже 200 клеток/мкл. Еще одно обязательное условие для возникновения СК — наличие в организме вируса герпеса человека 8 типа.
Саркома Капоши развивается в виде папулы, пятна, узелка, бляшки коричневого, розового, красного или темно-красного цвета от нескольких миллиметров до нескольких сантиметров в диаметре. Обычно высыпания концентрируются на ногах, голове, шее, на слизистой оболочке — в области неба, десен, конъюнктивы.
До эры внедрения лекарств от ВИЧ — антиретровирусной терапии (АРТ) 5-летняя выживаемость (с момента диагностики опухоли) пациентов с саркомой Капоши составляла менее 10%. Применение АРТ значительно улучшило ситуацию — сейчас речь идет о 74%, — а также позволило снизить риск развития СК.
Более половины случаев СК (56%) диагностируются сейчас в локальной форме — до того, как опухоль распространится на лимфатические узлы, слизистую ЖКТ, печень, селезенку и другие органы. Прием антиретровирусной терапии помогает значительно замедлить прогрессию болезни и предотвратить распространение СК по всему организму.
К сожалению, обнаружить саркому Капоши до появления симптомов не получится
Однако, человеку с ВИЧ и его амбулаторному врачу-инфекционисту необходимо учитывать несколько факторов риска развития этой опухоли:
- Этническая принадлежность: люди еврейского или средиземноморского происхождения, а также экваториальные африканцы;
- Мужской пол;
- Иммунодефицит: Люди с уровнем CD4-клеток менее 200 кл/мкл, те, кто перенес трансплантацию органов или костного мозга или постоянно принимает глюкокортикостероиды;
- Сексуальная ориентация: мужчины, имеющие секс с мужчинами(МСМ), подвержены более высокому риску развития СК.
К онкологическим заболеваниям, ассоциированным с вирусом папилломы человека, относятся инвазивный рак шейки матки (ИРШМ), сквамозный (чешуйчатый) рак головы/шеи, рак анального канала, вульвы и влагалища. СПИД-индикаторной из них является только ИРШМ.
Распространенность генитальной онкогенной инфекции ВПЧ среди женщин, живущих с ВИЧ, в целом выше, чем у остального населения.
Вирус папилломы человека способен к самопроизвольной элиминации — исчезновению из организма. У ВИЧ-положительных женщин этот процесс занимает больше времени, что увеличивает вероятность появления патологических изменений в шейке матки.
Продолжительный прием АРТ приводит к более низкой распространенности ВПЧ высокого риска и поражений шейки матки и даже предотвращает новые случаи ИРШМ.
Раннее начало антиретровирусной терапии, приверженность лечению обеспечивают снижение вирусной нагрузки — количества вируса в крови. Эти меры очень эффективны в отношении местного иммунитета слизистой оболочки и профилактики ИРШМ.
Скрининг ИРШМ заключается в проведении ПАП-теста и ВПЧ-теста (ПЦР). Женщины с ВИЧ-инфекцией в возрасте от 21 до 29 лет должны пройти ПАП-тест во время первичной диагностики ВИЧ, затем — через 12 месяцев, если анализ не показал патологии. Некоторые эксперты рекомендуют делать следующий ПАП-тест через 6 месяцев после первого. Если результаты трех последовательных мазков без отклонений, повторные тесты следует проводить каждые 3 года. ВПЧ-тест не рекомендуется подключать к ПАП-тесту до 30 лет — высока вероятность положительного результата, при этом оснований для активных действий нет. Лечения ВПЧ не существует, а для развития РШМ требуется, как правило, от 10 лет.
После 30 лет ПАП-тест и ВПЧ-тест проводятся совместно
У пациентов с ВИЧ-инфекцией повышается риск развития:
- гепатоцеллюлярной карциномы (ГЦК), связанной с вирусами гепатита С и В (ВГВ и ВГС) — в три раза;
- рака желудка, ассоциированного с инфекцией H.pylori;
- лимфомы Ходжкина — 8-13 раз. Риск связан с сопутствующей Эпштейн-Барр-инфекцией. Важно, что повсеместное внедрение АРТ не повлияло на показатели заболеваемости лимфомой Ходжкина в популяции людей с ВИЧ.
К факторам риска развития ГЦК у пациентов с ВИЧ относятся: цирроз печени, ожирение, диабет, возраст старше 60 лет, мужской пол.
Скрининг ГЦК проводится с помощью анализа крови на альфа-фетопротеин (АФП), который может продуцироваться раковыми клетками, или инструментальных методик диагностики — УЗИ, КТ, МРТ.
В последние годы всё чаще используется фиброскан для оценки стадии фиброза и близости к циррозу, независимому фактору риска ГЦК.
Предотвратить появление гепатоцеллюлярной карциномы можно с помощью своевременной вакцинации и ревакцинации от вирусного гепатита В и контроля вирусной нагрузки.
Несмотря на появление АРТ, НХЛ остаются актуальной проблемой для людей, длительное время живущих с ВИЧ. Хотя в большом количестве случаев неходжкинские лимфомы являются СПИД-индикаторными, они способны развиваться при нормальном уровне CD4-клеток и являются одной из наиболее частых причин смерти среди ВИЧ-положительных.
Общая выживаемость у пациентов с этим диагнозом низкая: более половины умирают в течение пяти лет от момента постановки диагноза
Отсюда возникают факторы риска развития НХЛ при ВИЧ-инфекции:
- наличие ко-инфекции вирусными гепатитами В, C, H.pylori;
- наличие вирусной нагрузки вируса Эпштейна-Барр или цитомегаловируса;
- наличие аутоиммунных заболеваний до постановки диагноза ВИЧ-инфекция;
- наличие специфических изменений в протеинограмме до или во время ВИЧ-инфекции;
- наличие минимальной вирусной нагрузки ВИЧ, несмотря на АРТ;
- снижение CD4-Т-лимфоцитов.
К скринингу неходжкинских лимфом относятся мониторинг вирусной нагрузки ВЭБ, ВГС, ВГВ и проведение инструментальной диагностики (КТ, МРТ, УЗИ, ФГДС).
С помощью контроля факторов риска и своевременного скрининга можно не только найти опухоль на ранней стадии, но и предотвратить заболевание.
Если рак все же обнаружили, ни в коем случае нельзя прерывать антиретровирусную терапию — она проводится по жизненным показаниям, что означает высокую вероятность неблагоприятного исхода противоопухолевой терапии без сопутствующего противовирусного лечения.
Читайте также:

