Для чего берут пункцию спинного мозга при лейкозе
Казалось бы, о состоянии системы крови можно и нужно судить по общему анализу – с детства известной рутинной медицинской процедуре. Но на самом деле, данные этого анализа — отражение процессов, происходящих в кроветворной системе, и ее главном органе – костном мозге. Поэтому при подозрении на болезнь кроветворной системы анализируют состояние костного мозга. Пункция костного мозга – это вмешательство, которое позволяет получить 0,5-1мл. этой субстанции для дальнейшего исследования.
Что такое костный мозг и зачем его изучают?
Красный костный мозг находится в плоских костях – ребрах, грудине, позвонках, костях черепа и таза – и в эпифизах (концевых частях) трубчатых костей. Он состоит из двух типов клеток – стромы, или, говоря простым языком, основной структуры, и кроветворных ростков из которых, собственно, и формируются форменные элементы: эритроциты, лейкоциты и тромбоциты.

Все элементы крови развиваются из одинаковых стволовых клеток-предшественников. Созревая (в медицине этот процесс называется дифференцировкой), клетки формируют два ростка кроветворения: лимфоидный, из которого потом созревают лимфоциты и миелоидный, создающий остальные форменные элементы. Незрелые клетки крови называются бластами. Обычно 90% всех стволовых клеток находятся в состоянии покоя.
В организме взрослого мужчины в сутки созревает 300г. форменных элементов крови, то есть 9 кг за год и около 7 тонн за 70 лет жизни. Новые клетки формируются взамен состарившихся или погибших по другим причинам (например, в борьбе с инфекциями).
В норме количество вновь созревших клеток строго равно числу погибших. При гемобластозах (лейкозах) клетки кроветворного ростка мутируют, перестают реагировать на регуляторные сигналы организма, и начинают бесконтрольно делиться. Если активность этого процесса настолько велика, что вновь сформированные клетки не успевают созреть, лейкоз называется острым. Если преобладают зрелые формы – хроническим.
Прежде чем выйти в кровоток, измененные лейкозные клетки накапливаются в красном костном мозге. И только инфильтрировав (заполонив) его, поступают сосуды. Изменения в анализе крови далеко не всегда соответствуют происходящему в костном мозге: на некоторых стадиях развития лейкоза количество форменных элементов в крови может не только не увеличиваться, но и уменьшаться.
Именно по этим причинам пункцию костного мозга и миелограммы выполняют при подозрении на любые болезни кроветворной системы.
Как и для чего выполняют пункцию костного мозга?
Чтобы получить материал для исследования, нужно проткнуть (пунктировать) кость там, где она находится близко к коже. В зависимости от возраста (а количество костного мозга в разных анатомических структурах изменяется со временем), это могут быть:
- у детей младше 2 лет – пяточная или большеберцовая кость;
- у детей старшего возраста – гребень подвздошной кости;
- у взрослых – грудина или гребень подвздошной кости.
Прокол делают специальной иглой с ограничителем – иглой Кассирского. 
Она может выглядеть по-разному. Но суть в том, что ограничитель позволяет зафиксировать глубину прокола.
Иногда полученный материал бывает неинформативен. Тогда (и при некоторых других показаниях) делается трепанобиопсия – метод, при котором специальной толстой иглой одним блоком забирают не только красный костный мозг, но и участок костного фрагмента над ним. Такую биопсию обычно делают в области гребня подвздошной кости.

Место прокола закрывается стерильной повязкой или пластырем. Боль может беспокоить и некоторое время после процедуры. Если нет противопоказаний, можно принять обезболивающие. Место прокола нельзя мочить в течение суток, соответственно, не рекомендуют принимать душ или ванну. Какого-то дополнительного ухода после пункции костного мозга не требуется.
Процедура эта безопасна, единственное абсолютное противопоказание – тяжелые нарушения свертывающей системы крови, когда любая травма приводит к обширным гематомам. Относительные противопоказания (когда сравнивают возможную пользу и вред), это:
- острый инфаркт миокарда;
- декомпенсированная сердечнососудистая патология;
- декомпенсированный сахарный диабет;
- гнойные поражения кожи в области предполагаемой пункции.
- кровотечение;
- инфицирование;
- аллергия – при непереносимости обезболивающих средств;
- сквозной прокол грудины, перелом (если пункция выполняется из грудины).
Вероятность осложнений невелика – по данным Британского общества гематологов за время с 1995 по 2001 год на 54890 проведенных пункций пришлось 26 осложнений разной степени тяжести.
Расшифровка и оценка результатов: миелограмма.
В первую очередь, в счетной камере подсчитываются мегакариоциты и миелокариоциты.
Мегакариоциты – это крупные клетки с большими ядрами, предшественники тромбоцитов. Их должно быть более 20, но менее 50 в 1 мкл.
Далее в окрашенных мазках подсчитывают процентные соотношения клеток различных рядов кроветворения. Полученный результат называется миелограммой.

Чтобы оценить по миелограмме качество костного мозга, важно знать не только процентное и количественное содержание гемопоэтических (кроветворных) элементов, но и их соотношение. Вот расшифровка некоторых показателей.
Высчитывается по формуле: (Промиелоциты + миелоциты + метамиелоциты) / (Палочкоядерные + сегментоядерные нейтрофилы). Нормальное значение 0,6 – 0,8.
Формула расчета: (Полихроматофильные + оксифильные нормобласты) / (Все ядросодержащие клетки красного ростка этого пунктата). Норма 0.8 – 0.9 и снижение индекса говорит о чрезмерно медленном наполнении гемоглобином эритроцитов (например, при железодефицитной анемии).
Как и у любого инструментального исследования, референсные значения (нормы) миелограммы могут изменяться в зависимости от лаборатории и используемых аппаратов.
Особенности миелограммы при лейкозах.
Как при остром, так и при хроническом лейкозе усиленный рост патологических клеток сопровождается уменьшением количества эритроцитов и тромбоцитов на всех стадиях созревания.
Если в миелограмме видны признаки лейкоза, пунктат костного мозга дополнительно проходит иммуногистохимическое, цитохимическое и генотипическое исследования – они нужны чтобы определить характерные особенности мутации опухолевого клона. Это важно для выбора схемы лечения конкретного пациента.
Исследование костного мозга - наиболее информативный метод диагностики заболеваний, связанных с его поражением. Эта субстанция находится в трубчатых и плоских костях организма. Именно в ней происходит образование стволовых клеток, которые способны к дальнейшей дифференциации в зрелые клетки крови. Чаще всего анализ костного мозга проводят с целью подтвердить или опровергнуть диагноз рака крови.
Показания к процедуре
Для чего делают анализ костного мозга? Только при помощи этого метода можно диагностировать заболевания крови уже на ранних стадиях. Поэтому врачи направляют пациента на исследование при наличии у того следующих состояний:
- снижение количества эритроцитов и гемоглобина (анемия);
- увеличение количества лейкоцитов (лейкоцитоз);
- увеличение количества тромбоцитов (тромбоцитоз);
- уменьшение уровня тромбоцитов (тромбоцитопения);
- подозрение на наличие злокачественных заболеваний крови: рака крови (лейкемии), миелодиспластического синдрома, парапротеинемии;
- подозрение на наличие метастазов в костном мозге при онкологии других органов.
Исследование костного мозга - это инвазивная процедура, связанная с повреждением кожных покровов и требующая высокой квалификации специалиста. Поэтому данный метод применяется только при строгой необходимости. Лишь в том случае, когда остальные методы диагностики оказались неинформативными, или с наибольшей вероятностью пациент болен раком крови, врач отправляет больного сдать анализ костного мозга.
Также данный метод делается для контроля за терапией заболевания. Тогда анализ проводится перед и после курса терапии.
Пункцию делают, чтобы выяснить, пригодна ли ткань костного мозга для трансплантации.
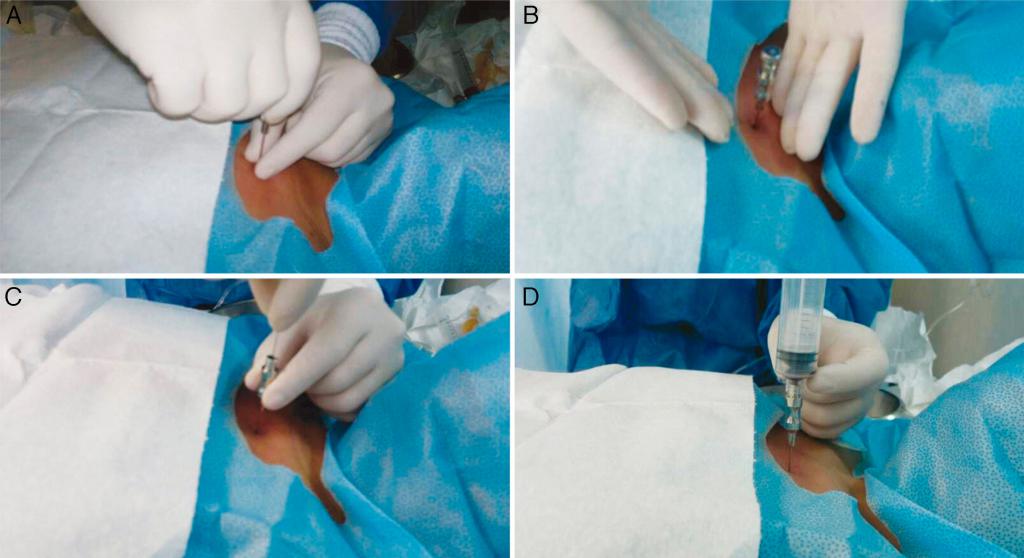
Техника проведения процедуры: первый этап
Суть метода заключается в проколе кости с взятием материала и последующим его исследованием при помощи микроскопа. То есть проводится пункция и анализ костного мозга.
Прокол делается специальной полой иглой посередине грудины на уровне прикрепления третьего ребра. В этом месте кость наиболее податлива.
Игла должна быть сухой и стерильной. С больного снимают всю одежду выше пояса. После место прокола обрабатывают раствором антисептика. Мужчинам сбривают волосы на груди.
Для предотвращения слишком глубокого проникновения иглы на нее надевают предохранитель. Глубина его фиксации подбирается индивидуально в зависимости от толщины подкожного жира пациента, его возраста.
Игла вводится одномоментно, перпендикулярно к туловищу пациента. При правильной технике должно появиться ощущение провала. Чтобы можно было забрать костный мозг для исследования, игла должна крепится абсолютно неподвижно. При метастазах рака в кость, воспалении костной ткани (остеомиелите) этого добиться сложно. Тогда предохранитель нужно сместить выше, а иглу продвинуть несколько глубже.
Далее к игле цепляется шприц и высасывается костный мозг в минимальном объеме (1 мл).
На этом первый этап анализа костного мозга практически окончен. Врачу осталось только вынуть иглу и заклеить место пункции пластырем.
Техника проведения процедуры: второй этап
На следующем этапе проводится собственно исследование костного мозга. Под микроскопом внимательно рассматриваются его клетки. Для этого материал размещают на предметное стекло. Так как костный мозг имеет свойство быстро сворачиваться, поверхность стекла протирают цитратом натрия.
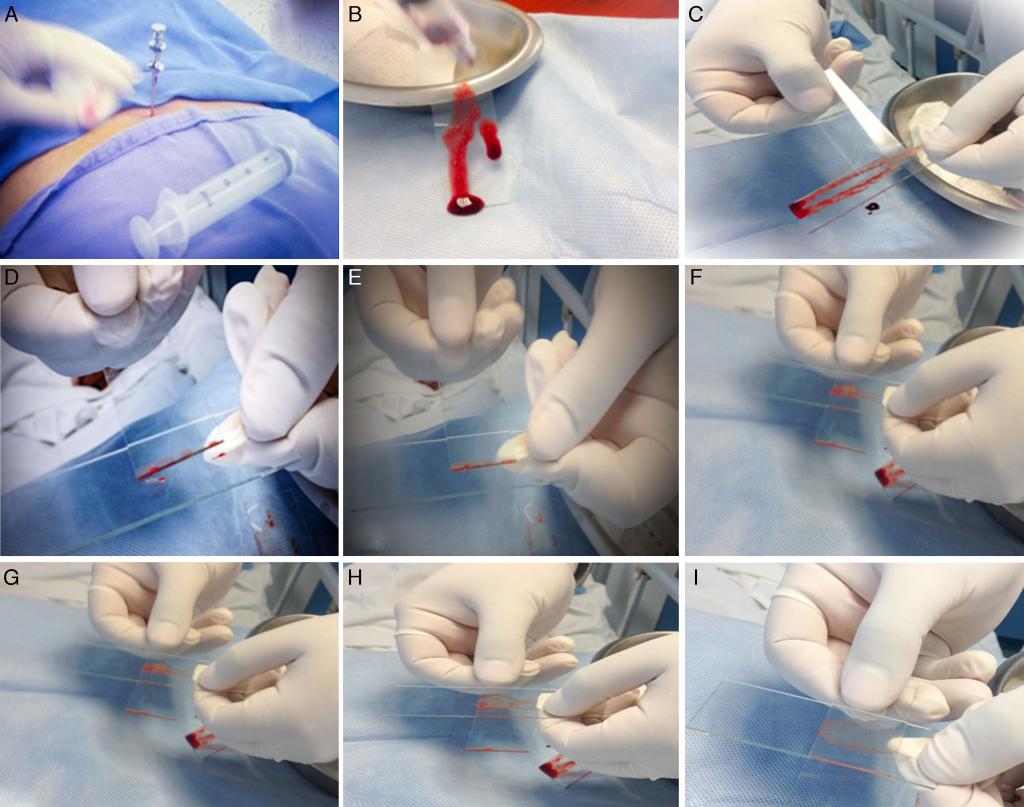
Данный анализ позволяет не только диагностировать рак костного мозга, но и установить его тип. От полученных результатов будет зависеть тактика дальнейшего лечения и прогноз для выздоровления.
Особенности трепанобиопсии
Недостаток пункции костного мозга заключается в том, что материал берется из жидкой его части. Поэтому повышается вероятность его смешивания с кровью. Это может исказить конечные результаты.
Трепанобиопсия - метод анализа твердой части костного мозга. Для ее осуществления используется троакар. Этот инструмент похож на иглу для стернальной пункции, но больших размеров.
В данном случае прокол делается не в грудину, а в верхнюю ость подвздошной кости. Пациент при этом лежит на боку или на животе. Врач перпендикулярно устанавливает иглу и резко вводит ее в кость вращательными движениями. Предварительно проводится местное обезболивание.
После взятия материала одна его часть помещается на предметное стекло, другая - во флакон с формалином.
Недостаток процедуры заключается в ее длительности. Она занимает около 20 минут, и все это время пациент должен лежать абсолютно неподвижно.
Некоторое время после процедуры возможны болезненные ощущения в области прокола. Однако они хорошо снимаются противовоспалительными средствами ("Нимесулидом", "Парацетамолом").
Пункции других костей
Рак крови - одно из наиболее распространенных онкологических заболеваний у детей. Как делается пункция и анализ костного мозга детям?
Так как у детей грудина мягче и податливей, чем у взрослых, более вероятно развитие осложнения в виде ее прокола насквозь. Поэтому маленьким пациентам выбираются другие кости для взятия костного мозга. Чаще всего - бедренная.
Прокол делается в участке кости, который расположен ближе к тазу. Пациент ложится на противоположный бок. Врач пунктирует не перпендикулярно, а под углом 60° к бедренной кости.
Также можно делать прокол над коленом. В этом случае пациент также лежит на боку, а под колено кладут валик. Игла вводится на глубину 2 см после предварительного обезболивания.

Виды исследования костного мозга
Как уже было написано выше, после взятия материала из кости, он отправляется в лабораторию для дальнейшего исследования. Есть два способа анализа под микроскопом: цитологический и гистологический.
Результаты цитологического анализа готовы уже на следующий день. Из них врач узнает о типе клеток, которые есть в костном мозге у пациента, их числе, особенностях формы и структуры.
Гистологический анализ делается дольше (до 10 дней), но является более информативным. С его помощью можно не только узнать о строении клеток, но и об их окружении (коллагеновых волокнах, сосудах, межклеточной жидкости).
После пункции врач узнает следующие показатели анализа костного мозга:
- особенности строения клеток кроветворной ткани;
- число этих клеток их процентное соотношение;
- наличие или отсутствие патологии;
- количество бластных клеток, то есть тех, что должны далее превратиться в зрелые клетки крови.
Последний показатель особенно важен при диагностике острых лейкозов. При этой патологии характерно резкое увеличение их количества.
Действия после процедуры
Анализ костного мозга - это серьезная процедура. Минимум час после нее врач внимательно наблюдает за пациентом. Он проверяет уровень артериального давления, пульса, меряет температуру и следит за общим состоянием.
Пациент может вернуться домой в день проведения процедуры. Но он должен исключить тяжелый физический труд, не садиться за руль, так как это приведет к ухудшению общего самочувствия.
Чтобы предотвратить ухудшение состояния после пункции, пациенту необходимо придерживаться ряда правил:
- исключить алкоголь и курение на несколько дней после процедуры;
- отменить купание на трое суток;
- прием любых лекарственных препаратов нужно согласовать с врачом;
- лечение народными методами также должно быть согласовано.
Отверстие после пункции не надо обрабатывать спиртом, зеленкой или любыми другими антисептиками.
Возможные осложнения
Сложности при анализе наступают крайне редко, если они выполняются квалифицированным специалистом. Многое зависит от того, как берут костный мозг на анализ, придерживаются ли стерильности, правильна ли техника.
При нарушении асептических условий возможно проникновение инфекции в организм пациента.
Слишком чувствительные пациенты могут потерять сознание. В худшем случае возможно резкое падение артериального давления с развитием шока.
Если врач нарушает технику процедуры, это приводит к перелому грудины или ее сквозному проколу.
В целом, это действительно безопасная и безвредная процедура. Она широко освоена большинством врачей. Поэтому правильная подготовка пациента в большинстве случаев позволяет избавиться от нежелательных явлений.
Рак костного мозга: анализ крови
Какие еще методы диагностики, кроме пункции и трепанобиопсии, применяются с целью постановки диагноза?
Первым делом врач должен провести тщательную беседу с пациентом. Только после детального разбора жалоб, анамнеза заболевания, наследственности назначают дополнительные методы обследования.
Вначале делается общий анализ крови. Он позволяет увидеть количество клеток крови (лейкоцитов, тромбоцитов и эритроцитов), процентное соотношение разных форм лейкоцитов, или лейкоцитарную формулу.
Далее проводится биохимический анализ крови, определение наличия в ней онкомаркеров.
Другие способы диагностики
Помимо диагностики рака костного мозга анализами крови, применяются такие обследования:
- общий анализ мочи - для определения работоспособности почек;
- рентгенография органов грудной полости - для поиска метастазов или, наоборот, локализации первичной опухоли;
- компьютерная томография и магнитно-резонансная томография - более информативный метод поиска метастазов;
- сцинтиграфия, суть которой заключается в накоплении радиоактивного препарата в клетках опухоли.
Но только анализ костного мозга позволяет поставить окончательный диагноз, а также уточнить тип рака.
Изменения в крови при острых лейкозах
Острый лейкоз - это одна из форм рака костного мозга. При этом заболевании бластные клетки в костном мозге полностью лишаются способности к превращению в зрелые клетки крови. Поэтому наблюдается чрезмерное количество бластов и сниженный уровень кровяных телец.
Показатели анализа крови при раке костного мозга по типу острого лейкоза характеризуются следующими особенностями:
- Прогрессирующее уменьшение количества эритроцитов и гемоглобина. Эритроциты снижаются до 1 × 10 12 /л при норме 5-5,5 × 10 12 /л. Уровень гемоглобина падает до 30-50 г/л при норме 140-150 г/л.
- Тромбоциты уменьшаются до 20 × 10 9 /л, в норме они должны быть 200-400 × 10 9 /л.
- Уровень лейкоцитов может быть разным в зависимости от формы лейкоза. Лейкопенические формы встречаются чаще, при них лейкоциты снижаются до 0,1–0,3 × 10 9 /л (норма - 4-9 × 10 9 /л).
- Наблюдается до 99 % бластных клеток при норме 1-5 %.
Существуют формы острых лейкозов, при которых бласты не определяются в крови. Тогда говорят об алейкемической форме заболевания. В таких случаях диагностика утруднена. Отличить лейкоз от апластической анемии поможет лишь исследование костного мозга.
Изменения в крови при хронических лейкозах
Результаты анализа крови при хроническом лейкозе зависят от типа заболевания. Выделяют миелолейкоз и лимфолейкоз.
Показатели анализа крови, как и симптомы, при раке костного мозга по типу хронического миелолейкоза зависят от стадии болезни. На начальном этапе, когда больного практически ничего не беспокоит, в крови обнаруживается небольшое увеличение уровня лейкоцитов (20,0–30,0 × 10 9 /л). Но на этой стадии диагноз ставится редко, так как у больного просто нет повода обратиться к врачу.
Чаще всего помощь необходима уже в более запущенных стадиях, при присоединении интоксикационного синдрома. Тогда уровень лейкоцитов доходит до 200,0–300,0 × 10 9 /л. Появляется большое количество молодых форм белых кровяных телец (промиелоцитов, миелоцитов).
В терминальных стадиях, когда состояние больного ухудшается, в анализе крове видно уменьшение уровня тромбоцитов (10–20 × 10 9 /л).
При хроническом лимфолейкозе повышается количество лимфоцитов. Это одна из форм лейкоцитов. Уровень последних тоже незначительно поднимается. Если своевременная терапия не проводится, лейкоцитоз нарастает и достигает таких же цифр, как при мелолейкозе.
Итоги
Общий анализ крови - информативный метод диагностики рака костного мозга или лейкоза. Но только цитологическое и гистологическое исследование костного мозга позволяет установить точный диагноз. Это доступный и высокоинформативный метод.
Несмотря на устрашающую на первый взгляд технику проведения, эта методика абсолютно безболезненна и практически безвредна. Только в экстраординарных случаях возможно развитие осложнений.
Поэтому каждый пациент, которому врач назначил анализ костного мозга, должен пройти данное обследование. Ведь польза от него во много раз превышает возможный вред.
Спинномозговая пункция позволяет выявить поражение центральной нервной системы (нейролейкоз) специфического характера. Первая диагностическая пункция проводится в первые дни индукционной терапии, что крайне важно в плане ранней диагностики нейролейкоза, когда клинико-неврологическая симптоматика может еще отсутствовать. При анализе ликвора в качестве нормы принимаются следующие показатели:
- 1. Люмбальное давление - 114,8±0,77 мм водн, ст.;
- 2. Цитоз - 2±0,09 клеток в 1 мм;
- 3. Общий белок - 14,5±0,6 мг %;
- 4. Сахар - 60,7±0,8 мг %;
- 5. Хлориды - 93,6±3,4 мг %;
- 6. Натрий - 322,0±1,1 мг %;
- 7. Калий - 10,8±0,1 мг %;
- 8. Кальций - 5,7±0,1 мг %;
- 9. Мочевая кислота - 2,3±0,1 мг %.
5. Рентгенологические исследования имеют важное значение при наличии болевого синдрома в трубчатых костях, суставах, по ходу позвоночного столба. При остром лейкозе у детей изменения в скелете могут быть в виде поперечных полос разрежения в метафизах, деструктивно-очаговых поражений в плоских и трубчатых костях, общего диффузного разрежения костной структуры и периостозов, изменений со стороны надкостницы.
Следует помнить, что данные изменения не являются сугубо специфическими для лейкоза и могут встречаться при различных патологических состояниях опухолевой и неопухолевой природы. Наиболее типичным именно для острого лейкоза является поражение тел позвоночного столба, что проявляется в виде бревиспондилии. Наиболее часто при вовлечении в процесс костной ткани наблюдается поражение тазобедренных суставов, головки и шейки бедренной кости.
6. В комплексе диагностических методов исследования определенное значение придается исследованию иммунологического статуса ребенка как в момент диагностики острого лейкоза, так и в процессе проведения противолейкозной терапии, и во время стойкой ремиссии.
Биохимическое исследование сыворотки крови осуществляется в динамике болезни на фоне проведения активной противолейкозной терапии, что позволяет вносить своевременные коррективы в лечение при развитии таких состояний, как гиперурикемия, токсико-аллергическое поражение печени, почек и т. д.
Исследование свертывающей и противосвертывающей систем крови важно, особенно в период проведения индукционной химиотерапии у больных с нелимфобластными вариантами острого лейкоза, течение которых сопровождается явлениями повышенной кровоточивости. У таких больных на фоне проводимого лечения нередко развитие тромбогеморрагических состояний, ДВС-синдрома, требующих неотложных терапевтических вмешательств.
Методы, направленные на контроль за функциональным состоянием кардио-респираторной системы, почек, печени, желудочно-кишечного тракта, эндокринной системы также применяются в различные периоды острого лейкоза. Однако следует подчеркнуть, что обилие современных инструментально-диагностических методов, которые применяются в онкогематологической практике, требует выбора наиболее значимых и информативных в каждом конкретном случае. Необходим индивидуализированный подход к каждому больному, что во многом определяется квалификацией и опытом лечащего врача.
лейкоз лейкемия заболевание кроветворение
Спасение от лейкоза - ранняя диагностика. Распознать лейкемию можно по первым симптомам, на которые родители не всегда обращают внимание. Если ребенок стал бледным, слабым, чаще хочет прилечь, необходимо сделать анализ крови.
Во всех случаях заболеваний у детей и при отсутствии должного эффекта от проводимой терапии следует проводить исследование периферической крови в динамике. При необычных реакциях со стороны крови необходима консультация гематолога.
При ОЛЛ в анализах крови общее число лейкоцитов может быть ниже 10х109 /л (у 45-55%), (10-50)х109/л (у 30-35% пациентов) и выше 50 109/л (у 20%). У всех больных выявляется анемия, причем у 75% больных уровень гемоглобина ниже 100 г/л. Происходит и значительное снижение количества тромбоцитов (у 75% пациентов).
Лейкоз, при котором в периферической крови выделяют патологические бластные клетки, называют лейкемическим. А лейкоз (или его фазу) с отсутствием бластных клеток в крови расценивают как алекемический.
Диагноз лейкоза может быть установлен только морфологически - по обнаружению несомненно бластных клеток в костном мозге. Острый лейкоз определяется при наличии более 30% бластных клеток в мазке костного мозга. Форму острого лейкоза устанавливают с помощью гистохимических методов.
Спинномозговая пункция при лейкозе - обязательная диагностическая процедура. Цель этой манипуляции заключается в раннем выявлении, профилактике и оценке эффективности лечения нейролейкоза.
Диагноз основывается на клинико-гематологической картине. Особое значение для диагностики имеет пункция костного мозга, исследование которого необходимо проводить при малейшем подозрении на острый лейкоз до назначения специфической терапии. Помимо морфологического исследования, необходимо проводить цитохимические исследования бластных клеток и имуноцитологическое их типирование.
Состоит из следующих этапов.
- 1. Индукция полной ремиссии с помощью 4-- 6 курсов поли-химиотерапии по различным программам с ранним началом профилактики специфического поражения ЦНС (нейролейкоз) с помощью интратекального введения метотрексата или метотрексата в комбинации с цитозаром (для больных группы повышенного риска).
- 2. Консолидация ремиссии (закрепление). Наступление полной ремиссии обязательно должно подтверждаться контрольным исследованием костного мозга. Для уменьшения числа оставшейся популяции лейкозных клеток проводится закрепляющий курс полихимиотерапии. В этот период дополнительно эндолюмбально вводят цитостатические препараты.
- 3. Поддерживающее лечение последовательным (каждые 1,5--2 мес) чередованием 6-меркаптопурина и метотрексата с применением циклофосфана 1 раз в 7-- 10 дней. Больным, относящимся к группе повышенного риска, в начальном периоде поддерживающего лечения проводится дистанционная гамма-терапия области головного мозга.
- 4. Реиндукция ремиссии: проведение 1 раз в 2--2,5 мес курса полихимиотерапии (как в период индукции ремиссии) или 5--7-дневного курса аспарагиназы. Возможно чередование такого курсового реиндукционного лечения. В этот период осуществляется весь комплекс гематологического обследования с продолжением химиопрофилактики нейролейкоза. При нелимфобластных лейкозах положительный эффект оказывает комбинация цитозара с рубомицином по программам 7+5 или 5+3. Эффективность терапии улучшается при использовании различных видов иммунокорригирующей терапии в период проведения поддерживающего и реиндукционного лечения.
При остром лейкозе показана срочная госпитализация. В отдельных случаях при точном диагнозе возможно цитостатическое лечение в амбулаторных условиях. В лечении ОЛЛ используются комбинации химиопрепаратов. Лечение обычно разбивается на 3 фазы. В первой фазе проводится индукционная терапия, в конце которой более чем у 90% больных мазки костного мозга соответствуют ремиссии. Вторая фаза лечения - это консолидация, которая заключается во введении химиопрепаратов и иногда облучении черепа для удаления лимфобластов, которые могут находиться в менингеальных оболочках центральной нервной системы. Третья фаза - поддерживающая терапия.
Особенность лечения заключается в том, что оно проводится длительное время. Поэтому интенсивный курс длится 8-9 месяцев, затем следует облучение головного мозга и после этого еще 2 года пациент принимает поддерживающую терапию уже дома. Именно такое лечение позволяет успешно преодолевать болезнь.
Лечение детей с лейкемией - кропотливый труд врачей и родителей.
Сегодня детские онкогематологи используют передовые методики и последние разработки в лечении лейкозов. Однако еще довольно редко проводится трансплантация костного мозга.
Лечение острого лимфобластного лейкоза
С 1990 года применяют современные терапевтические протоколы лечения острого лимфобластного лейкоза у детей ОЛЛ-БФМ-90 разработанные немецкими коллегами (1988, 1990, 1992 гг.). По протоколам среди детей, больных ОЛЛ, выделяют три группы риска:
- 1. Группа стандартного риска - дети от 1 года до 6 лет. Количество бластов на 8 день терапии в периферической крови не превышает 1000 в 1 мкл. (после 7-дневного приема преднизалона); отсутствует пре-Т иммунофенотип лейкоза (если у пациента не проводилось иммуноспецифическое исследование бластов, но имеется медиастенальная опухоль, то пациент в любом случае из стандартной группы риска); не имеется первичного поражения ЦНС; установлена полная ремиссия на 33 -й день лечения;
- 2. Группа среднего риска - дети до 1 года и старше 6 лет, количество бластов в периферической крови на 8-й день, после 7-дневной преднизолоновой профазы, не превышает 1000 в 1 мкл; полная ремиссия на 33-й день лечения;
- 3. Группа высокого риска - отсутствие полной ремиссии на 33-й день лечений.
Между 65 и 70 днем повторная контрольная костномозговая пункция для подтверждения ремиссии, если на 33 день в костном мозге 5% и более бластов (в гемограмме не более 20 х 109 /л лейкоцитов).
Классификация цитостатических средств
1 Антиметаболиты - нарушают синтез предшественников нуклеиновых кислот, путем конкуренции с последними в лейкозной клетке.
Метотрексат - антогонист фолиевой кислоты (эффект в стадии разгара и в качестве поддерживающей терапии, действует на S фазу).
Ланвис (Tioguaninum) (Glaxo Wellcome) - 1 табл. содержит 40 мг тиогуанина : 25 табл. в упаковке. Тиогуанин является сульфгидрильным аналогом гуанина и проявляет свойства пуринового антиметаболита. Являясь структурными аналогами пуриновых нуклеотидов, метаболиты тиогуонина включаются в пуриновый обмен и ингибируют синтез нуклеиновых кислот в опухолевых клетках.
6-Меркаптопурин (пуринетол) - антогонист пурина, вмешивается в обмен нуклеиновых кислот, действует на S фазу.
Цитозар (цитозинарабинозид) - систематический аналог пиримидина, препятствует превращению цитидина в диоксицитидин (на S фазу лейк. клетки).
2 Алкилирующие соединения - подавляют синтез ДНК и в меньшей степени РНК в лейкозной клетке.
Циклофосфан, обладающий цитостатическим и цитолитическим действием на лейкозные клетки.
3 Алколоиды растений.
Винкристин - практически воздействует на все фазы покоящейся клетки.
Этопозид (вепезид, VP -16) - из растений мондрагоры, предотвращает вхождение клетки в митоз.
4 Ферментные препараты.
L-аспарагиназа (краснитин) - разлагает аспарагин, необходимый для синтеза протеина, на аспарагиновую кислоту и амоний в лейкозной клетке, которая не способна к самостоятельному синтезу аспарагина и поэтому погибает от его эндогенного действия.
5 Противоопухолевые антибиотики.
Адриамицин, рубомицин - обладает цитостатическим действием, подавляет синтез нуклеиновых кислот путем взаимодействия с ДНК и РНК - полимеразами.
6 Гормональные препараты.
Преднизолон - обладает цитолитическим действием на лейкозные клетки (лимфобласты и недифференцируемые бласты) и не вызывает разрушения нормальных лимфоцитов.
Дозировка медикаментов осуществляется в соответствии с площадью поверхности тела пациента. Каждый раз перед началом нового этапа лечения вновь определяется площадь поверхности тела и рассчитывается соответственно доза препаратов. При эндолюмбальной инъекции и при облучении головы дозировка осуществляется в соответствии с возрастом.
Поли-химиотерапия больных со стандартным и средним факторами риска длится в течение 6-ти месяцев.
ПРОТОКОЛ I - (направлен на редукцию ремиссии).
Первая фаза. Преднизолон назначается из расчета 60 мг/м2 с 1-го по 28 день, затем снижение дозы на 50% каждые три дня до полной отмены. У пациента с высокой начальной массой лейкозных клеток или выраженной органомегалией начальную дозу необходимо назначать из расчета 20 мг/м2, до снижения уровня лейкоцитов в периферической крови ниже 20*109/л, чтобы избежать острого синдрома распада белков.
В зависимости от клинического ответа на терапию (уменьшение органов), лабораторных показателей (уменьшение числа лейкоцитов, содержания мочевой кислоты, мочевины, креатинина, калия) дозу преднизалона нужно быстро увеличивать до окончательной (60 мг/м2) не позднее 5-го дня терапии.
Винкристин вводится в дозе 1,5 мг/м2 внутривенно на 8, 15, 22, 29-й день.
Рубомицин вводится из расчета 30 мг/м2 внутривенно капельно в течении 1 часа на 8, 15, 22, 29-й день. Перед первым введением рубомицина делается ЭКГ и эхография сердца (препарат кардиотоксичен).
L-Аспариназа (L-ASP) - вводится в дозе 10000 ед/м2 внутривенно капельно в течении 1 часа на 8, 15, 18, 21, 24, 30, 33-й день.
Возможны тяжелые аллергические реакции, гипергликемия и нарушение свертывания крови. Необходимо проводить лабораторный контроль свертывания крови (фибриноген, АТ-Ш, плазминоген), уровня сахара. При развитии анафилаксии возможна замена на эрвиназу.
Профилактика нейролейкоза проводится эндолюмбальными введениями метотрексата в возрастной дозировке 1 раз в 2 недели.
Вторая фаза. Условия для начала фазы 2 протокола 1 следующие: полная ремиссия в костном мозге, менее 5% бластов в миелограмме; при начальном поражении ЦНС - полная ремиссия в ЦНС; при медиастенальной опухоли - уменьшение размеров опухоли до 30% ее начальной величины; удовлетворительное общее состояние; отсутствие тяжелой инфекции; креатинин в пределах возрастной нормы; лейкоциты более 2*109/л; гранулоциты - более 0,5*109/л.
Циклофосфан (ЦФ) - вводится в дозе 1000 мг/м2 внутривенно капельно в течении часа на 36-й и 64-й день лечения. Контроль диуреза и профилактика геморрагического цистита проводятся следующим образом: гидратация 3000 мл/м2 за 24 часа; фуросемид из расчета 0,5 мг/кг внутривенно на 6 и 12 час после циклофосфана; месна (урометоксан) 400мг/м2 внутривенно на 0,4 и 8 часу от начала инфузии циклофосфана.
6-Меркаптопурин (6-МП) - 60 мг/м2 в сутки внутрь, 36-63-й дни лечения.
Цитозар (ARA-C) - 75 мг/м2 в сутки внутривенно в виде 4 дневных блоков; 38-41 дни, 45-48, 52-55, 59-62 дни. После начала лечения цитозаровые блоки желательно не прерывать.
Если начало цитозаровых блоков откладывается или прерывается, одновременно прекращается прием 6-МП. Выпавшее в лечении 6-МП нужно подтянуть до общей плановой кумулятивной дозы, равной 1680 мг/м2.
ПРОТОКОЛ М - (направлен на консолидацию ремиссии).
Включает в себя 6-меркаптопурин, высокодозированный метотрексат, метотрексат эндолюмбально, лейковорин внутривенно. Начинается через 2 недели после завершения протокола 1. Основные условия для начала этого протокола: лейкоциты больше 1,5*109/л; гранулоциты больше 0,5*109/л; тромбоциты больше 50*109/л.
6-Меркаптопурин назначается из расчета 25 мг/м2 в день (внутрь), в течение 8 недель.
Метотрексат назначается в дозе 1 г/м2 (1/10 общей дозы, вводится в течение 30 мин; 9/10 общей дозы вводится в течение 35,5 ч.) путем непрерывной инфузии, на 8, 22, 36, 50 день от начала протокола М.
Лейковорин (антидот метотрексата) дается из расчета 15 мг/м2 внутривенно струйно или внутрь в таблетках на 42, 48, 54 час от начала введения.
МТХ интралюмбально вводится через 2 часа от начала внутривенной инфузии МТХ в возрастной дозировке.
ПРОТОКОЛ II - (также направлен на консолидацию ремиссии).
Первая фаза. Проводится через две недели после протокола М. Условия начала II протокола следующие: продолжается полная ремиссия; хорошее общее состояние больного; отсутствие инфекции; лейкоциты больше 2,5*109/л; гранулоциты больше 1*109/л; тромбоциты больше 100*109/л.
Дексаметазон 10 мг/м2 внутрь с 1 по 21 день от начала протокола, затем дозу уменьшают каждые 3 дня на 50% до полной отмены.
Винкристин 1,5 мг/м2 - 4 внутривенных введения с интервалом в одну неделю (максимальная доза 2 мг/м2).
Адриамицин (ADR) 30 мг/м2, инфузия в течение 1 часа. Перед 1 и 3 назначением необходимо провести ЭКГ и эхокардиографическое исследование: при признаках снижения сократительной функции миокарда следует прекратить дальнейшее применение ADR.
L-Аспарагиназа 10000 ЕД/м2 - инфузия в течение 1 часа на 8, 11, 15, 18 день.
Вторая фаза. Условия для начала второй фазы протокола II: хорошее общее состояние; отсутствие инфекций; нормальный возрастной уровень креатинина в сыворотке крови; лейкоциты больше 2*109/л; гранулоциты больше 0,5*109; тромбоциты больше 50*109/л.
Циклофосфан 100 мг/м2, инфузия в течение 1 часа на 36 день от начала протокола. Контроль диуреза и профилактика цистита такие же, как в протоколе 1.
6-Тиогуанин (6-TG) 60 мг/м2 внутрь в 36-49 дни, всего 14 дней.
Цитозар (ARA-C) 75 мг/м2 внутривенно двумя блоками через 4 дня: 38-41 день, 45-48 дни.
МТХ интралюмбально вводится в возрастных дозировках на 38 и 45 день от начала протокола.
Облучение головы. При хорошем клиническом состоянии облучение головы начинается с 38 дня протокола II для детей из групп среднего и высокого риска. Доза облучения зависит от возраста и от начального вовлечения ЦНС (от 12 до 18 Гр детям до 2 лет, от 18 до 24 Гр детям старше 2 лет).
В случае выявления нейролейкоза люмбальные пункции метотрексата осуществляются один раз в неделю, с одновременным введением цитозара, преднизолона. В конце полихимиотерапии подключается облучение головы.
Поддерживающая терапия проводится двумя препаратами сроком до 2-х лет.
6-Меркаптопурин 50 мг/м2 внутрь, ежедневно.
Метотрексат 20 мг/м2 внутрь 1 раз в неделю. В день приема необходимо контролировать общий анализ крови и регулировать дозу поддерживающей терапии в зависимости от уровня лейкоцитов.
Читайте также:

