Диссеминированный рак прямой кишки
Основной метод лечения рака прямой кишки — хирургический. При чем, этот метод предполагает калечащую операцию во время которой удаляется прямая кишка и, наиболее часто, при локализации в нижнеампулярном отделе — удаляется сфинктер. Больные вынуждены оставшуюся жизнь прожить с колостомой. И, к сожалению, колостомированный больной часто имеет психологический проблемы, а также проблемы, связанные с социальной и трудовой реабилитацией. Поэтому, если есть возможность этого избежать – нужно пробовать.

При обращении в клинику первичного больного проводится общая гипертермия с химиотерапией, чем мы добиваемся уменьшения размеров первичной опухоли и в последующем производится операция.
На лечение в клинику больные принимаются из любого региона России, СНГ и зарубежья. Пациенты могут приехать с сопровождающими, которым будет организовано проживание на территории больницы.
Рак прямой кишки: операции с сохранением функций сфинктера
Гипертермия с химиотерапией при раке нижнеампулярного и анального отдела прямой кишки позволяет в ряде случаев уменьшить опухоль настолько, что становится возможным провести сфинктеросохранную операцию и отказаться от вывода колостомы. После операции вновь проводится противоопухолевая терапия. Наблюдаем не только непосредственные результаты, но и хорошие показатели пятилетней выживаемости.
| Показатель выживаемости, % | 1 год | 3 года | 5 лет |
| Опухоли прямой кишки, 4-я стадия | 61,3 | 52,5 | 27,3 |
Результаты получены в клинике “К-тест” за 25 лет деятельности. Представленные цифры расчитаны для запущенного рака 4 стадии с обширными метастазами. Чем менее запущен рак, тем лучше показатели выживаемости.
Непосредственные результаты лечения гипертермией:
| Диагноз | Полная регрессия | Частичная регрессия | Стабили зация |
| Рак прямой кишки T2-4N0-2M1 в выборке – 245 чел. | 4,4 % | 26,7 % | 53,3 % |
Оценка проводилась через месяц после процедуры.
ПОЛНАЯ РЕГРЕССИЯ — полное исчезновение всех поражений.
ЧАСТИЧНАЯ РЕГРЕССИЯ — уменьшение размеров всех или отдельных очагов более чем на 50 %.
СТАБИЛИЗАЦИЯ — уменьшение очагов менее чем на 50 % при отсутствии новых поражений или увеличение не более чем на 25 %.
Рак прямой кишки с метастазами
Если к нам обращается больной с запущенной стадией, с неудалимой опухолью, то общая гипертермия является инструментом, с помощью которого удается перевести опухоль в операбельное состояние, уменьшить ее размеры, сделать выполнимой операцию. Здесь уже не идет речь о сфинктеросохранной операции, а о возможности сделать операцию в принципе, чтобы удалить опухоль.
Гипертермия с химиотерапией позволяет у части больных получать полную регрессию опухоли. Не только уменьшить размеры самой опухоли, провести операцию, но и уменьшить размеры метастазов рака в печени. Добиться исчезновения метастазов в печени или добиться частичной регрессии, когда метастазы в печени уменьшаются более, чем в два раза. Это говорит о серьезном повреждении жизнеспособности раковых клеток.
Если после 2-3 курсов проводимой химиотерапии в рамках стандартного лечения по ОМС нет заметной положительной динамики, улучшения самочувствия, уменьшения размеров опухоли и метастазов, то следует задуматься о необходимости усиления химиотерапии нагревом. Дальнейшее продолжение стандартной химиотерапии при отсутствии динамики, даже со сменой химиопрепаратов, приведет только к устойчивости опухоли прямой кишки к лекарствам.
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
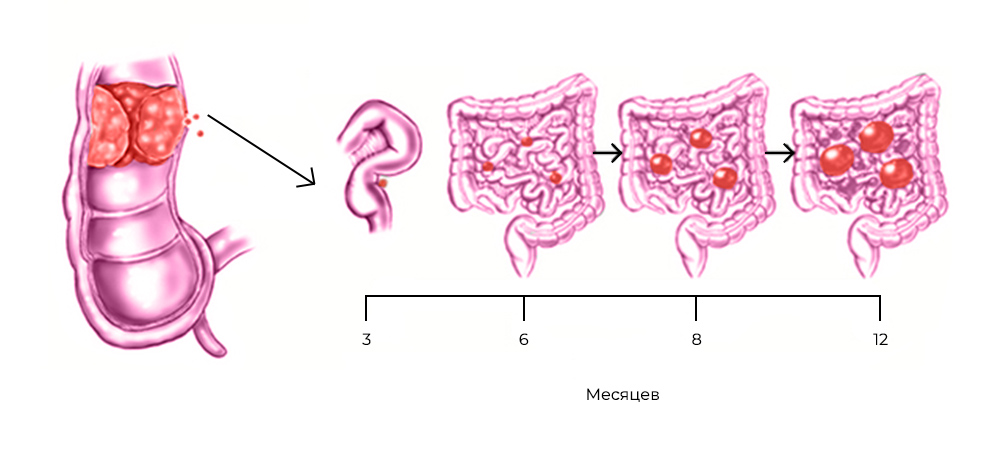
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
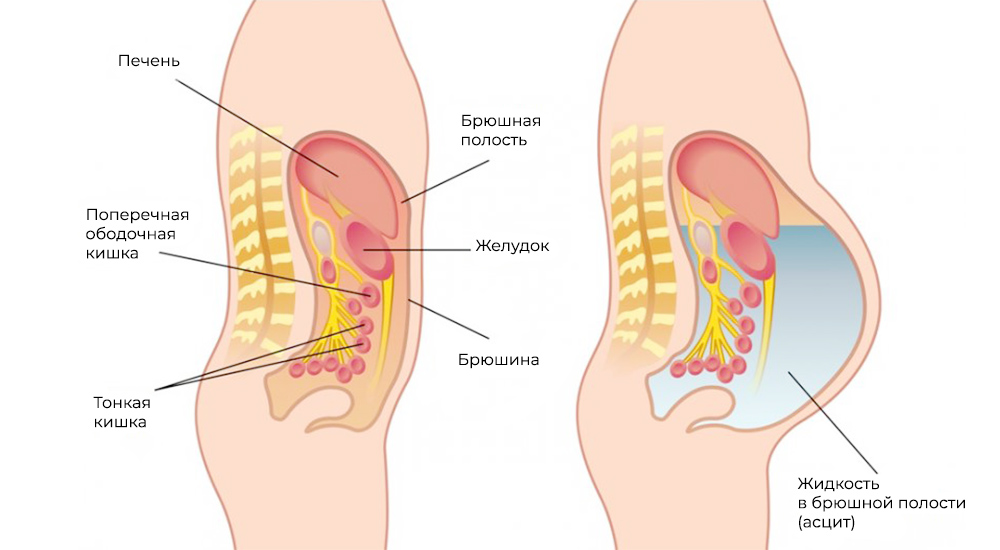
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
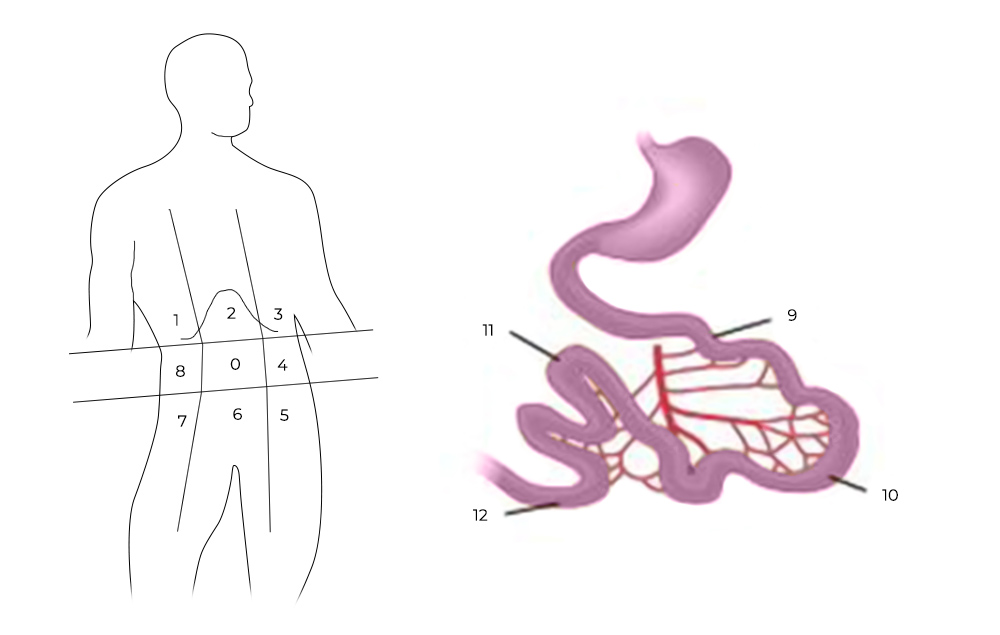
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
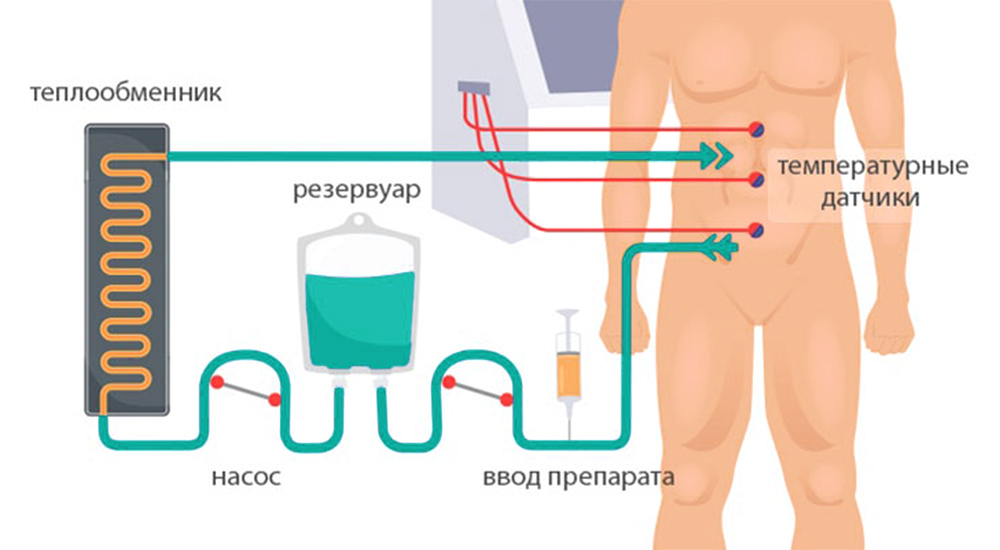
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
Рак ободочной и рак прямой кишки имеет много общих черт (например, этиопатогенез, симптомы, патоморфологические данные). Однако в отличие от рака ободочной кишки, рак прямой кишки - заболевание более сложное для лечения, поскольку связано с повышенным риском местного рецидива. Большая сложность объясняется непростыми анатомическими особенностями прямой кишки: ограничением костными структурами таза, расположением вблизи от других органов и мышц тазового дна, наличием анального сфинктера, нескольких уровней кровоснабжения и лимфоваскулярного оттока в различных направлениях в пределах единого фасциального пространства.
Лечение рака прямой кишки эволюционировало от хирургического до мультидисциплинарного. В то время как спектр методов лечения продолжает расширяться (радикальное или местное лечение, сфинктеросохраняющее или БПЭ, открытый доступ или лапароскопический и т.д.), опыт хирурга и хирургическая техника, так же как и оценка распространенности опухоли на предоперационном этапе оказывают важнейшее влияние на результат лечения.
В соответствии с рекомендациями NCI, для лечения рака прямой кишки (за исключением очень ранних стадий) показана предоперационная или послеоперационная лучевая терапия, в основном в комбинации с химиотерапией, так как она улучшает локальный контроль над опухолью, несмотря на то, что не всегда увеличивает общую выживаемость. Вопросы качества жизни (например, сохранение сфинктера, выведение стомы, мочеполовая функция) более актуальны в процессе принятия решений при раке прямой кишки, чем ободочной.
Определение проксимальной границы прямой кишки:
1. Анатомическое/интраоперационное: место слияния тений.
2. Эндоскопическое (наиболее важно для назначения неоадъювантной терапии): 15 см над краем анального канала по отметкам на ригидном ректоскопе.
Устаревшее (в связи с большой вариабельностью) определение: уровень тазовой брюшины, промонториум.
а) Эпидемиология. Ежегодная заболеваемость в США: 42000 новых случаев рака прямой кишки, 15000 смертей, обусловленных раком прямой кишки. Увеличивающийся риск заболеваемости после 50 лет, пик заболеваемости - седьмой десяток жизни, тем не менее, 5-10% больных моложе 50 лет.
б) Симптомы рака прямой кишки:
• Бессимптомное течение => выявление во время рутинного обследования.
• Примесь крови (наиболее часто), изменение частоты, консистенции и формы стула, запоры, боль в животе, тенезмы. Боль в прямой кишке, полости таза нетипична и является грозным симптомом.
• Осложнения: массивное кровотечение, толстокишечная непроходимость, прорастание в другие органы, перфорация, формирование свища (ректовагинального, прямокишечного и ректопузырного).
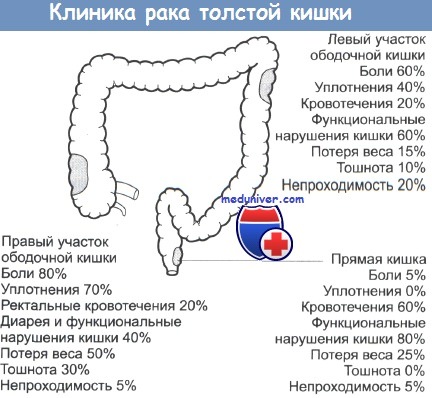
в) Дифференциальный диагноз:
• Рак анального канала: морфологический тип зависит от локализации, наиболее часто представлен плоскоклеточным раком (внимание: аденокарцинома из анальных желез).
• Аденокарцинома других первичных локализаций: рак предстательной железы, яичников и эндометрия. Опухоль (также аденокарцинома) может прорастать через стенку прямой кишки => для дифференциального диагноза необходимы оценка внешнего вида, гистологическое и иммуногистохимическое исследование.
• Редкие опухоли аноректум: карциноид, лимфома, ГИСТ, меланома, пресакральная опухоль (хордома, тератома и т.д.).
• Предраковые полипы: в частности ворсинчатые полипы, могут занимать большую площадь и всю окружность кишки.
• Доброкачественные заболевания: выпадение/инвагинация прямой кишки, синдром солитарной язвы прямой кишки, эндометриоз, воспалительные заболевания (лучевой проктит, ВЗК и др.).
г) Патоморфология рака прямой кишки
Макроскопическое исследование:
• Полиповидное легкоранимое образование или изъязвленный кратер с приподнятыми краями, различного размера и распространения по окружности кишки.
• Путь метастатической диссеминации:
1) лимфогенный => параректальные (мезоректум), латеральные (на стенках таза) и забрюшинные лимфоузлы;
2) гематогенный => система воротной вены => метастазы в печени => метастазы в легких;
3) гематогенный => система полой вены => метастазы в легких.
Микроскопическое исследование:
• Аденокарцинома в подавляющем большинстве случаев (> 95%). Редко подтипы: слизистый или перстневидноклеточный рак, железисто-плоскоклеточный рак. Мелкоклеточный рак (1%) - плохой прогноз!
• Рак в пределах слизистой оболочки (Тis) = carcinoma in situ = дисплазия высокой степени: рак не проникает сквозь мышечную пластинку слизистой. Инвазивный рак: прорастание в собственную мышечную пластинку слизистой и глубже.
• Такие особенности роста, как лимфоваскулярная инвазия, периневральная инвазия, наличие депозитов опухоли вне лимфоузлов - отрицательные прогностические факторы.
• Для адекватного стадирования опухоли необходимо исследование как минимум 12-15 лимфоузлов в удаленном препарате, но меньшее число после облучения.
• Дополнительные вторичные изменения после химиолучевой терапии включают в себя: фиброз тканей, остаточные поля слизи, облитерацию артериол.
д) Обследование при раке прямой кишки
Необходимый минимальный стандарт:
• Сбор анамнеза: специфические симптомы - кровотечение, запоры, изменение характера стула, боль, потеря веса, мочеполовая симптоматика, наличие нарушений сексуальной функции и функции сфинктера; семейный анамнез; сопутствующие заболевания.
• Клиническое обследование:
1. Пальцевое исследование прямой кишки:
а) Точное определение расположения опухоли:
1) По окружности: переднее, заднее, боковое, циркулярное.
2) По длине: расстояние от наиболее дистального полюса опухоли до края ануса и пуборектальной мышцы, расположение относительно простаты, достижимость верхнего полюса? Для дистально расположенных опухолей: оценка расстояния от межсфинктерной борозды, оценка сохранности функции сфинктера.
б) Клиническое стадирование опухоли: подвижная, малоподвижная, неподвижная, почти обтурирующая просвет.
2. Ригидная ректороманоскопия: достаточна для установления диагноза (и взятия биопсии), должна быть повторена перед плановой операцией, в частности после неоадъювантного лечения — оценка расстояния от края ануса до нижнего полюса опухоли, локализация, распространенность по окружности, протяженность опухоли и сохранность просвета кишки, состояние свободного от опухоли сегмента прямой кишки.
3. Исследование живота: вид, увеличение органов и т.д.
4. Пальпация паховых лимфоузлов: обязательна при всех низкорасположенных опухолях прямой кишки и анального канала; увеличенные лимфоузлы - грозный симптом.
• Биопсия: гистологическое подтверждение клинического диагноза является основой для планируемого лечения.
• Полное исследование толстой кишки (предпочтительно колоноскопия) в обязательном порядке при плановых операциях => выявление синхронных опухолей или полипов, выявление сопутствующих заболеваний толстой кишки.
• Оценка местной распространенности и стадии опухоли:
- ЭРУЗИ: оценка критерия Т (точность 80-95%), критерия N (точность 65-81%), метод не применим для оценки собственной фасции прямой кишки (циркулярная/латеральная граница резекции).
- МРТ: оценка циркулярной границы (точность 60-90%), но менее точна в отношении критерия Т (75-85%).
• Определение системной распространенности:
- КТ органов брюшной полости/малого таза, поиск отдаленных метастазов (печень, забрюшинные лимфоузлы), признаки вовлечения мочевой системы (гидронефроз/гидроуретер? размытость слоя между прямой кишкой и предстательной железой?). - Рентгенография органов грудной клетки (или КТ): наличие метастазов, их резектабельность?
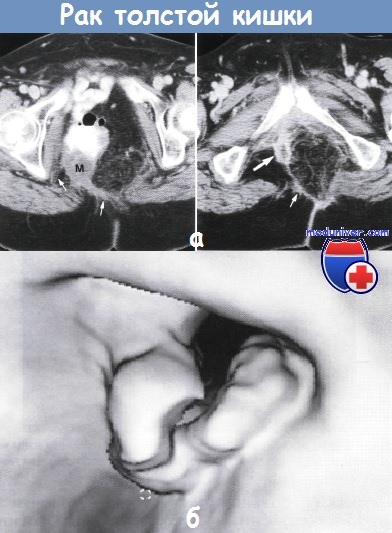
а - Рецидив рака прямой кишки после брюшно-промежностной резекции. Изображение через вертлужную впадину: в расширенной петле тонкой кишки установлено неоднородное образование (М) размером 3 см.
Опухоль инфильтрирует жировую клетчатку (показано стрелками) и правую стенку таза.
Изображение в области седалищно-лонных ветвей — небольшое мягкотканное образование (показано большой стрелкой) и тяжи опухоли (маленькая стрелка), инфильтрирующие тазовую клетчатку. Компьютерная томография
б - Рак толстой кишки.Виртуальная колоноскопия.
Дополнительные исследования (необязательные):
• Опухолевые маркеры: РЭА
• Лабораторные исследования: анемия, функция печени (альбумин, ПТИ, АЧТВ), функция почек.
• ПЭТ(?): при подозрении на отдаленные метастазы.
• КТ органов грудной клетки не является рутинным исследованием, требуется в некоторых протокольных исследованиях.
• Урологическое/гинекологическое обследование при наличии специфических симптомов.
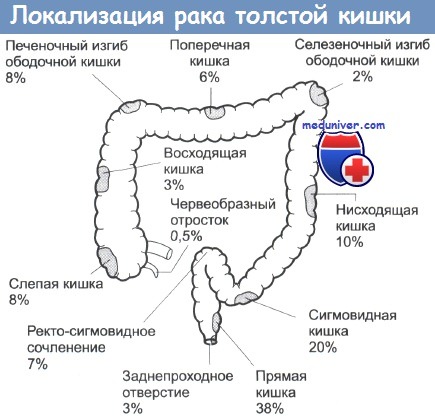
е) Классификация рака прямой кишки:
• Основанная на локализации: низко - (0-5 см), средне - (5-10 см) или верхнеампулярный (10-15см).
• Основанная на стадии опухоли: локализованный, местнораспространенный (размер, прорастание в другие структуры), метастазы.
• Основанная на системе TNM.
• Ранние благоприятные формы: uT1 -2N0, вовлечение 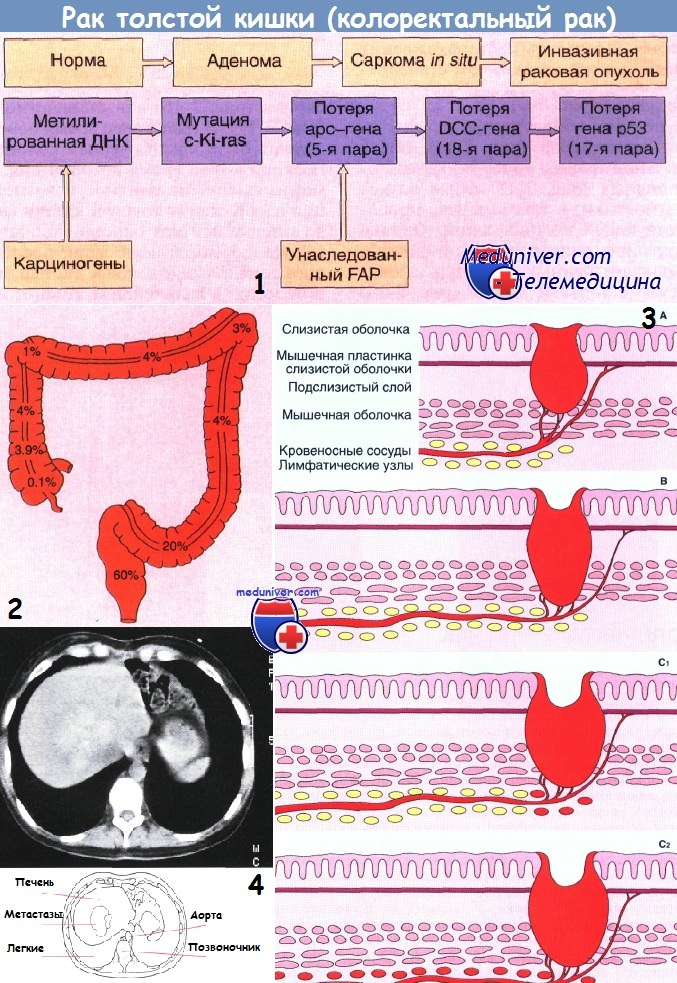
1 - Прогрессирование генетического дефекта, ведущее к развитию колоректального рака. Считают, что такая последовательность событий встречается часто, но необязательно включает все приведенные изменения и не всегда соответствует указанному порядку событий.
2 - Схема, иллюстрирующая частоту встречаемости рака в разных частях толстой кишки.
3 - Стадии развития рака толстой кишки по Дьюку (схема):
А — опухоль ограничена стенкой кишки;
В — прорастание мышечного слоя без вовлечения в процесс лимфатических узлов;
С1 — прорастание всех слоев стенки кишки с вовлечением ближайших лимфатических узлов;
С2 — то же, что и при стадии С1, плюс поражение отдаленных лимфатических узлов.
4 - Метастазы с центральным кальцинозом у больного с желтухой, вызванной диссеминированным колоректальным раком (без клинических симптомов поражения толстой кишки). Компьютерная томография.
ж) Лечение без операции рака прямой кишки:
- Неоперабельные больные с сопутствующими заболеваниями или массивным метастатическим поражением печени.
- Иноперабельные/инкурабельные больные с местнораспространенной опухолью контроль симптомов.
- Неоадъювантная химиолучевая терапия (комбинированное лечение) для достижения локального контроля над опухолью:
• Короткий курс лучевой терапии (25 Гр) в течение недели с последующей операцией.
• Облучение в течение 6 недель (50,4 Гр) с последующей радикальной операцией через 6-12 недель.
• Полный клинический ответ, подтвержденный эндоректальным УЗИ, в 15-25% случаев => несмотря на то, что операция по-прежнему рассматривается как стандарт лечения, больному может быть предложен неоперативная/выжидательная тактика => повторное клиническое, эндоскопическое, эндосонографическое обследование через короткие промежутки времени, операция при признаках рецидива.
- Мелкоклеточный рак: системное заболевание, плохой прогноз => химиолучевая терапия, хирургическое вмешательство обычно безуспешно.
з) Операция при раке прямой кишки
Показания:
• Любой рак прямой кишки (за исключением абсолютных противопоказаний) с/без неоадъвантной химиолучевой терапии.
• Даже при наличии генерализации желательно достижение локального контроля над опухолью, поскольку возможно выполнение условно радикальной метаста-зэктомии.
Хирургический подход при раке прямой кишки:
1. Радикальное лечение (с целью достижения локального и общего контроля над опухолью):
• Местное иссечение: вариант для ранних форм с хорошим прогнозом => трансанальное местное иссечение или трансанальное эндомикрохирургическое иссечение (ТЭМ).
• Радикальная операция (онкологическая резекция с лимфаденэктомией): тотальная/частичная мезоректумэктомия (ТМЭ), брюшно-промежностная экстирпация (БПЭ) или сфинктеросохраняющая операция с первичным анастомозом (одно/двухэтапное лечение).
• Эвисцерация таза.
• Редкие варианты доступа: по Краске (задняя проктотомия), по Йорку-Мейсону (задняя анопроктотомия).
2. Экстренное лечение:
• Временные меры: установка стента или проксимальная стома.
• Окончательная операция: как при плановом вмешательстве или операция по Гартману.
3. Паллиативное лечение:
• Проксимальная стома.
• Стентирование.
• Локальная деструкция: электрокоагуляция, лазер, внутриполостная лучевая терапия.
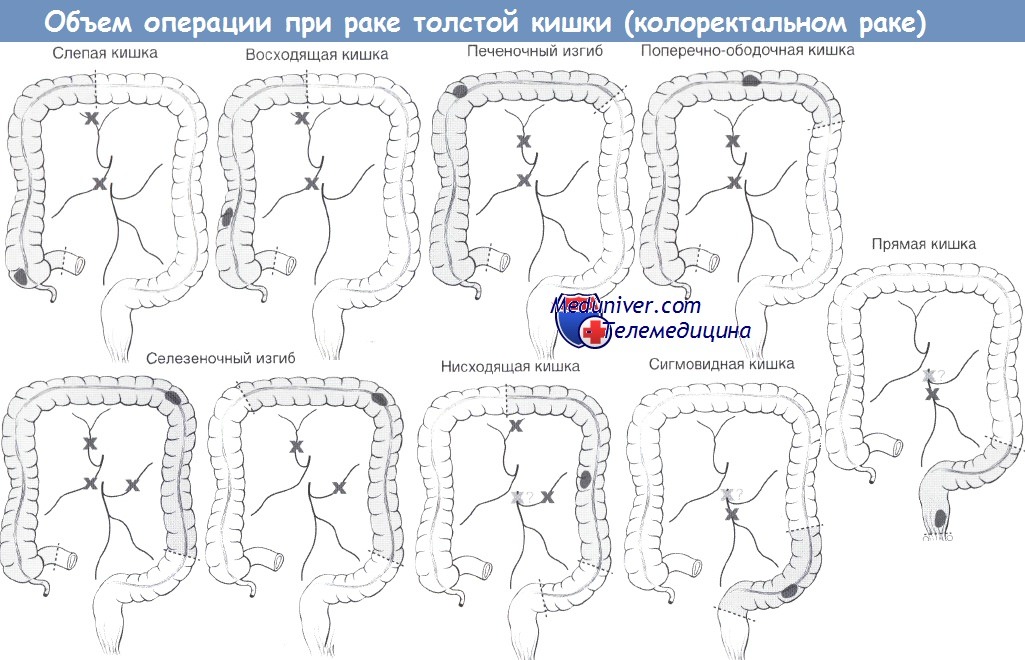
и) Результаты:
• Радикальная операция: частота местных рецидивов без нео/-адъювантного лечения наблюдение, Т2 => химиолучевая терапия или радикальная операция, Т3 => радикальная операция.
В дальнейшем: онкологическое наблюдение, возможно дополненное ЭРУЗИ. При возникновении рецидивов - их лечение.
Читайте также:

