Диссеминация злокачественных новообразований что это
Диссеминация – это распространение возбудителя инфекции или клеток опухоли из первичного очага заболевания по всему органу или организму. Осуществляется это посредством кровотока и лимфатической системы. После диссеминации обычно происходит процесс генерализации, представляющий собой развитие множества очагов. Такие вторичные проявления называются метастазами.
Виды очагов заболеваний и их характеристика
Наличие в организме очагов с размерами патологических теней от 1 до 10 мм означает, что происходит диссеминация. Это могут быть участки, различные по патогенезу и морфологической структуре. Они бывают воспалительные и невоспалительные, фиброзированные. В целом, могут представлять собой скопление тканей и клеток. В области воспалительных очагов возникает процесс перифокального характера. Кроме того, такие участки имеют свойство сливаться. При этом они начинают напоминать инфильтративно-пневмонический процесс. При поражении легких отмечается двусторонняя патология. Здесь следует упомянуть о некоторых различиях в диагнозе. Раньше такие процессы принято было называть диффузными легочными заболеваниями. Однако не всегда может наблюдаться тотальное поражение. В связи с этим название "диссеминированный" в этом случае подходит больше. Изменения при этом могут не являться диффузными.
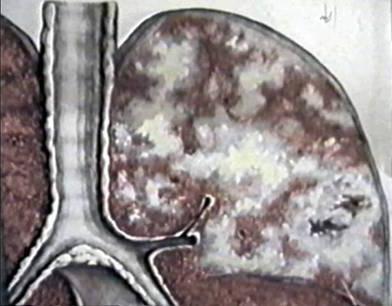
Симптомы
Диссеминация - это рентгенологическое определение, которое включает в себя около ста различных заболеваний. Они могут протекать со всевозможными симптомами. Диссеминация в легких обычно сопровождается воспалительным процессом плевры. Симптомы при этом носят двоякий характер. При воспалительных заболеваниях возникает синдром интоксикации и гипоксии. На фоне диссеминированного рака легких и карциноматоза – дыхательная недостаточность, прогрессирующая с дальнейшим развитием патологии. Легочная диссеминация трудно диагностируема. Именно поэтому существует большая вероятность ошибки. Для более точного диагноза необходимо полное обследование пациентов.
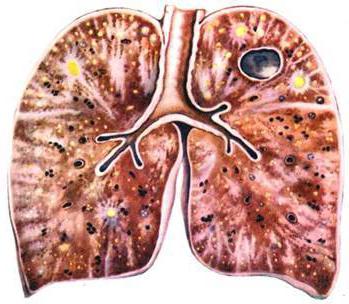
Классификация патологий
Заболевания, при которых происходит диссеминация, это:
- альвеолиты (токсический фиброзирующий, экзогенный аллергический альвеолиты, синдром Хаммена-Рича, микролитиаз, протеиноз);
- гранулематозы (пневмокониоз, саркоидоз, диссеминированный туберкулез, пневмомикозы, гистиоцитоз);
- воспаления, сопровождающиеся опухолевыми образованиями (карциноматоз, бронхоальвеолярный, метастатический рак);
- редкие заболевания (синдром Гудпасчера, идиопатический гемосидероз, лейомиоматоз);
- интерстициальные фиброзы, которые образуются при поражении иных органов и систем (коллагеноз, лучевые повреждения, кардиогенный склероз, а также склероз с заболеванием печени).
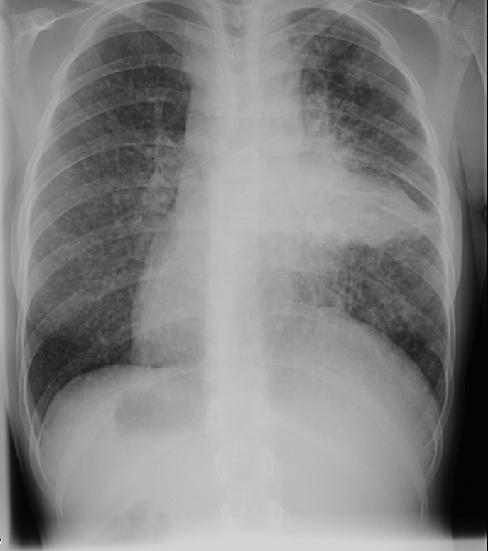
Признаки
Наряду с общими, наблюдаются и индивидуальные признаки, свидетельствующие о развитии диссеминированных процессов. Знание и умение распознавать их значительно облегчают диагностику. При фиброзе легких происходит умеренное сужение легочных полей. Также снижается их прозрачность. Изменения туберкулезной формы располагаются в верхних отделах легких. А вот пневмосклероз диффузного характера более выражен в нижней части. Метастазы рака располагаются поодиночке в среднем отделе легких, а при карциноматозе наблюдается большое количество узлов. При туберкулезе очаги имеют различные размеры, их локализация субплевральная. В случае пневмокониоза патологический процесс прогрессирует в нижних лимфатических узлах, потом возникают гранулемы, далее ткани склерозируются. Остальные процессы диссеминации значительно хуже диагностируются, поэтому необходим комплекс лабораторных обследований.
Статьи
Особенности кистозно-солидных образований
- Солидное образование (рак) – это самое опасное состояние, при котором шансы излечиться от недуга минимальны; оно имеет твердую оболочку и заполнено тканью.
- В отличие от него, кистозное новообразование легко поддается лечению, оно мягкое, может расти и уменьшаться.
- Кистозно-солидное образование является промежуточным звеном между ними. Оно может появиться в любом органе, меняться в размерах или оставаться неизменным, а также содержать в себе как ткань, так и жидкую субстанцию.
Классификация солидных образований
Любое солидное образование (онкология) относится к одной из следующих категорий: доброкачественное или злокачественное.
Медленно растет, может самостоятельно уменьшаться без дополнительного вмешательства. Отсутствуют метастазы.
Основная проблема, которую несет данное солидное образование (рак) – это сдавливание собой соседних органов или тканей.
Состоит из неустанно делящихся клеток, изменивших свой вид и структуру, может дорасти до немалых размеров.
Явление проявляет себя крайне агрессивным образом, распространяет метастазы даже на самых ранних стадиях недуга.
Основные причины возникновения солидных образований при раке
Солидное образование – это рак, который может появиться практически в любой системе организма. Однако существует ряд причин, которые, по заявлениям специалистов, являются своеобразными провокаторами и стимулируют появление и распространение метастазов.
Солидное образование (рак) может возникнуть вследствие следующих явлений:
- неблагоприятная экологическая обстановка, в особенности, в густонаселенных мегаполисах и городах с крупными заводами и фабриками;
- обилие стрессов и чрезмерная психологическая нагрузка;
- алкоголизм и табакокурение;
- плохая наследственность;
- слабая иммунная система;
- частые переломы и иные травмы.
Порядок диагностики солидных образований
Диагностируется любое солидное образование (рак) посредством нескольких методов. Они могут быть задействованы как в комплексе, так и по отдельности.
- УЗИ внутренних органов – дает возможность определить точную локализацию, размеру, структуру и форму образования. Сообщает о разновидности опухоли, что позволяет подбирать схему лечения.
- Биопсия – осуществляется с помощью тонкой иглы, вводимой в область образования и использующей его частички. Определяет степень злокачественности и уровень агрессии опухоли.
- Общий анализ и биохимия крови – рассказывают о наличии воспалительных процессов, сбоев в работе гормонов и патологий в организме.
- Компьютерная томография – самый востребованный вид диагностики. Солидное образование – это рак, лечение которого подбирается индивидуально, в зависимости от ряда показателей. КТ дает возможность выявить точное расположение опухоли и сообщить предельно точные данные о ней.
Лечение солидного онкологического заболевания
Солидное образование – это рак, крайне серьезный недуг, требующий основательного подхода и высочайшего уровня квалификации. Только действительно опытные специалисты в состоянии осуществить точную диагностику и подобрать наиболее подходящее лечение, которое зависит от локализации, размеров и иных особенностей конкретной опухоли.

Опухоли — это патологические образования, которые образуются из-за нарушения роста и дифференцировки клеток. Они могут развиваться практически из любой ткани: эпителиальной, нервной, соединительной, кроветворной и др. В зависимости от того, из какой ткани развилось новообразование выделяют солидные опухоли и гемобластозы.
- Как диагностируют солидный рак
- В каких органах чаще всего развивается солидный рак
- Способы лечения солидного рака
- Химиотерапия при раке
- Иммунотерапия
- Чем опасен солидный рак
- Прогнозы на выздоровление при солидном раке
К группе гемобластозов относят лейкозы, лимфомы и миеломы. Их особенностью является повсеместное распространение по организму, без образования локализованных очагов.
Солидные опухоли могут быть доброкачественными и злокачественными.
- Доброкачественные опухоли состоят из высокодифференцированных зрелых клеток, растут относительно медленно, не прорастают в окружающие ткани, не дают метастазов и чаще всего не представляют смертельной опасности, за исключением опухолей головного и спинного мозга. Иногда они могут самопроизвольно исчезать. Некоторые доброкачественные опухоли могут озлокачествляться (малигнизироваться) и превращаться в рак.
- Злокачественные солидные опухоли (саркомы, карциномы, глиомы) состоят из низко или умеренно дифференцированных клеток. Они быстро увеличиваются в размерах, прорастают окружающие ткани, разрушая их, а также могут давать метастазы (очаги отсеивания, расположенные вдали от первичного новообразования) и оказывают системное воздействие на организм. Они опасны для здоровья и несут смертельную угрозу.
Как диагностируют солидный рак
Методы диагностики солидного рака можно разделить на несколько групп:
Методы, позволяющие обнаружить наличие образования. В некоторых случаях, если рак располагается поверхностно, его можно увидеть во время осмотра или пропальпировать. В остальных случаях на помощь приходят методы медицинской визуализации — УЗИ, КТ, МРТ, рентгенологическое исследование, ПЭТ, эндоскопическое исследование и другие. В некоторых случаях обнаружить рак помогают лабораторные анализы, в частности определение онкомаркеров — особых молекул, количество которых повышается при возникновении той или иной формы новообразования.

Методы, позволяющие верифицировать диагноз. Окончательный диагноз можно поставить только после морфологического исследования опухолевой ткани. Для этого фрагмент новообразования изучают под микроскопом после специального окрашивания. В ряде случаев для уточнения диагноза и определения молекулярно-генетического профиля образования проводят дополнительное тестирование, например, иммуногистохимическое исследование, молекулярно-генетическое тестирование. Это позволит подобрать оптимальную схему лечения, учитывая прогностические особенности рака.
После постановки диагноза необходимо определить стадию заболевания. Здесь на помощь приходят методы лучевой диагностики (то же УЗИ, КТ, МРТ), которые позволяют верифицировать размеры рака, его взаимоотношения с рядом расположенными тканями, вовлечение в процесс лимфатических узлов и наличие метастазов.
В каких органах чаще всего развивается солидный рак
Солидный рак может развиться в любом органе, в котором есть эпителиальные ткани. Чаще всего диагностируются опухоли молочной железы, легких, предстательной железы, желудочно-кишечного тракта.
Способы лечения солидного рака
В рамках лечения солидного рака применяются те же подходы, которые используются во всей онкологии. Ключевыми методами является хирургия, лучевая терапия и химиотерапия.
Хирургические операции в онкологии делятся на две большие группы — радикальные и паллиативные.
Радикальные вмешательства предполагают полное удаление опухоли в пределах здоровых тканей и зоны возможного метастазирования. Здесь выделяют:
- Типовые операции — удаление ткани пораженного органа в оптимальном объеме для достижения радикальности. Также выполняется необходимая лимфодиссекция.
- Комбинированные радикальные вмешательства — удаляется первично пораженный орган, и проводится частичная резекция соседних органов и тканей, на которые распространился рак.
- Расширенные операции — помимо затронутых органов и стандартных групп лимфатических узлов, на которые распространяется рак, удаляют дополнительные группы лимфатических узлов.
Раньше проведение обширных радикальных операций зачастую приводило к инвалидизации больного. Сейчас же идет тенденция не только к его излечению, но и сохранению приемлемого качества жизни. Поэтому совершенствуются хирургические технологии органосохраняющих методик и реконструктивных операций после удаления рака.
- Паллиативные вмешательства. Они проводятся при наличии отдаленных метастатических очагов. На первом этапе предполагается удаление первичного опухолевого очага в радикальном объеме. Вторым этапом проводятся попытки лечения метастазов, если это возможно. В целом такие операции не подразумевают полного излечения и проводятся для улучшения состояния больного и облегчения тягостных симптомов.
- Симптоматические паллиативные операции. Они выполняются по жизненным показаниям, при развитии осложнений рака. Ликвидации опухоли они не предусматривают и направлены восстановление жизненно важных функций, например, дыхания, отведение кишечного содержимого, возобновление пассажа желчи, остановку кровотечения и др.
Лучевая терапия предполагает использование ионизирующего излучения в дозировках, приводящих к гибели раковых клеток. Все методы можно разделить на три большие группы — дистанционная лучевая терапия, контактная лучевая терапия и системная лучевая терапия.
При дистанционной лучевой, терапии источник ионизирующего излучения находится за пределами тела пациента на определенном расстоянии. При таком лечении используется сложное высокотехнологичное оборудование, которое генерирует определенный вид ионизирующего излучения (ИИ). При помощи специальных технологий производят распределение его дозы таким образом, чтобы максимально полно облучить рак и минимально затронуть не вовлеченные в процесс ткани.
При контактной лучевой терапии ИИ располагается либо непосредственно возле раковой опухоли, либо в ее толще. Здесь выделяют:
- Аппликационную ЛТ. Таким методом лечатся поверхностно расположенные опухоли, например, рак кожи, рак вульвы или рак влагалища.
- Внутриполостная ЛТ — ИИ вводят в полость полого органа (матка, желудок, мочевой пузырь и др) с помощью специального аппликатора, заполненного радиоактивным материалом. Таким методом лечится рак полых органов.
- Внутритканевая ЛТ — ИИ вводят непосредственно в раковую опухоль с помощью игл или трубочек, заполненных радиоактивным материалом. Таким методом может лечиться рак простаты, рак тела матки, рак шейки матки, рак желудка и др.
Как правило, контактную лучевую терапию сочетают с дистанционной ЛТ, что позволяет максимально сфокусировать воздействие ионизирующего излучения на раковой опухоли, при этом минимально затронув окружающие ткани.
Эффективность этого метода лечения основана на том, что опухоли захватывают определенные молекулы и используют их для своего дальнейшего роста. Если на эти молекулы присоединить радиоактивные изотопы, они избирательно накопятся в опухолевой ткани и разрушат ее. Как правило, таким образом проводят лечение отдаленных метастазов.
Химиотерапия при раке
Для лечения рака разработано большое количество химиотерапевтических препаратов. По оказываемому эффекту их разделяют на цитостатические и цитотоксические препараты. Цитостатики нарушают процессы размножения раковых клеток, что в конечном итоге приводит к их гибели. Цитотоксические препараты направлены на непосредственное уничтожение клеток. Химиотерапия при раке предполагает несколько курсов лечения, которые чередуются с перерывами. Это связано с двумя моментами:
- Раковые клетки имеют жизненный цикл, который состоит из активной фазы и фазы покоя. Химиотерапия действует только на активные клетки.
- Химиотерапия оказывает токсическое действие на организм, поэтому нужно время для его восстановления.
Химиотерапии солидного рака проводится в рамках комбинированного лечения совместно с хирургией или лучевой терапией. Ее преимуществом является системное воздействие на организм, что помогает уничтожить как злокачественные клетки, которые остались в первичном очаге после удаления опухоли, так и метастазы.
Иммунотерапия
Иммунотерапия является одним из новых методов лечения солидного рака. Суть метода заключается в коррекции противоопухолевого иммунного ответа, что позволит организму уничтожить рак с помощью собственных ресурсов. Вторым направлением иммунотерапии является работа с самой опухолью, которая вырабатывает определенные вещества, делающие ее незаметной для иммунной системы. Если рак демаскировать, иммунитет его уничтожит.
Чем опасен солидный рак
Солидный рак зачастую характеризуется агрессивным течением и, за редким исключением, метастазированием. При отсутствии лечения, первичная опухоль будет разрастаться, захватывая новые ткани и нарушая работу вовлеченных органов. Это чревато самыми разнообразными осложнениями, начиная от кровотечений и заканчивая кишечной непроходимостью, нарушением дыхания, болевым синдромом, неврологическими проявлениями.
По мере нарастания опухолевой массы, рак оказывает системное воздействие на организм — развивается истощение и слабость. В конце концов при отсутствии специальной помощи человек погибает.
Прогнозы на выздоровление при солидном раке
Прогноз на выздоровления при солидных опухолях определяется видом рака, степенью его дифференцировки и стадией на момент установки диагноза. Чем раньше начато лечение, тем более благоприятный прогноз.
Диссеминация опухоли по висцеральной плевре, сходные патологические изменения на париетальной и медиастинальной поверхности плеврального листка, вызывает появление у больных своеобразных жалоб. Вначале они патогномоничны и сходны появлению признаков сухого плеврита, а спустя непродолжительное время — выпотного. В начальном периоде такого поражения боли обычно беспокоят при глубоком дыхании и движении. С накоплением экссудата в плевральной полости, разобщающего ее висцеральный и париетальный листки, боли проходят. На короткий период времени наступает относительное благополучие, которое сменяется ухудшением самочувствия с своеборазными клиническими проявлениями.
Это вызвано прогрессирующем увеличением количества экссудата в плевральной полости с коллабированием пораженного опухолью легкого, появлением и нарастанием расстройств дыхания. Неуклонная тенденция к увеличению такого плеврита является его характерной чертой. В значительных объемах он приводит не только к сдавлению легкого, но и органов средостения, значительно смещая его в здоровую сторону. Такие больные занимают вынужденное положение — сидят или лежат с поднятой верхней половиной туловища, избегают малейших физических напряжений.
Переход отдельных метастазов опухоли с париетальной плевры на анатомические структуры грудной стенки, включая ребра, приводит к появлению особенно мучительных болей, которые не всегда четко локальны, политопны. Они особенно выражены в наиболее пораженных участках ребер, как правило не соответствуют расположению первичной опухоли в той или иной доле легкого.
Лимфогенное метастазирование рака легкого с поражение лимфатических узлов средостения, составляющее одну из черт далеко зашедшей стадии развития заболевания, приводит к своеобразным изменениям и сопровождается возникновением характерных симптомов. Основу их появления и развития представляет прогрессирующее увеличение и слияние в конгломераты пораженных метастазами лимфатических узлов, а также самой опухоли с вовлечением в бластоматозный процесс рядом расположенных анатомических образований средостения.
При поражении метастазами группы бифуркационных лимфатических узлов возможно сдавление или прорастание опухолью начальных отделов главных бронхов и киля бифуркации трахеи. Это сопровождается появлением нарастающих, вплоть до значительно выраженных расстройств дыхания. Опухолевые разрастания в просвете дыхательных путей вызывают ощущение инородного предмета, побуждает к частому, не приносящему удовлетворения кашлю. Постоянное раздражение слизистой оболочки дыхательных путей в близрасположенных к месту поражения отделах в короткое время может вызывать болезненные ощущения в трахеи и за грудиной. Частичное перекрытие просвета трахеи над ее бифуркацией растущей раковой опухолью приводит к возникновению эпизодов удушья, отчасти напоминающих клинические проявления бронхиальной астмы.
Сдавление или прорастание пораженными метастазами стенки верхней полой вены, встретившееся у 8% больных, оперированных в клинике, сопровождается характерными гемодинамическими расстройствами. При этом приток венозной крови к правым отделам сердца, происходит ее застой в вышележащих венозных коллекторах. Клинические признаки такого поражения известны давно и получили название "синдром верхней полой вены". В тяжелой степени при этом появляется отек кожи лица, шеи, верхней половины туловища, правой руки. Компенсаторно расширяются коллатеральные вены кожи и подкожной клетчатки передней поверхности груди. Они выглядят извитыми, кровенаполненными, нередко окружены петехиальными кровоизлияниями.
Кожи лица, шеи и верхней половины туловища приобретает цианотичный оттенок. Нарушение кровотока при сдавлении верхней полой вены с сопровождающим его отеком слизистой дыхательных путей приводит к одышке, появлению кашля с отделением небольшого количества слизистой мокроты. Стремление таких больных избавится от чувства тяжести, шума и боли в голове, облегчить дыхание вынуждает занимать положение с возвышенным размещением верхней половины туловища.
Метастазирование рака легкого по регионарным коллекторам в группу преаортокаротидных лимфатических узлов, часть из которых располагается в области так называемого "аортального окна" у места ответвления от ствола левого блуждающего нерва возвратного — нижнего гортанного, часто приводит к нарушению функции последнего. Тогда вследствие возникающего при этом пареза левой голосовой связки больные отмечают вначале временную, переходящую утрату звучности голоса, а затем —устойчивую его осиплость. Помимо этого неполное смыкание голосовой щели нарушает процесс нормального откашливания, приводит к развитию трахеита и бронхита.
Прогрессирующий рост метастазов рака легкого в бифуркационных и особенно околопищеводных лимфатических узлов средостения может привести к смещению, сдавлению пищевода и даже прорастанию его стенки опухолью. Подобные изменения имелись у 9,5% больных, оперированных по поводу рака правого легкого. Клинические проявления такого поражения не всегда выражены достаточно отчетливо. Лишь отдельные больные отмечали при этом появление неприятных ощущений в груди при приеме пищи.
У нескольких больных опухоль из пораженных метастазами лимфатических узлов переходила на стенку аорты. Для нисходящего ее отдела признаком такого поражения являлись боли, обусловленные сдавлением конгломератом лимфатических узлов близрасположенных здесь корешков спинного мозга.
Распространение метастазов рака легкого в пределах лимфатических коллекторов средостения в восходящем направлении приводит к поражению надключичных лимфатических узлов. Тогда больные отмечают появление в одной или обеих надключичных областях одиночных или множественных округлых образований, определяемых под кожей на ощупь или видимых глазом. Как правило, вначале эти образования безболезненны и мало беспокоят. С течением времени они увеличиваются, формируют плотный, малоподвижный конгломерат. Давление надключичных лимфатических узлов на нервы плечевого сплетения может вызвать чувство парастезии и появление боли в руке.
Гематогенное метастазирование рака легкого — несомненный признак далеко зашедшей стадии заболевания —при всем многообразии его возможных проявлений имеет некоторые общие закономерности. Они связаны, главным образом, преимущественным и частым поражением определенных органов. Наиболее часто гематогенные метастазы обнаруживают в позвоночнике, крупных костях, печени, почках, надпочечниках, головном мозге. Несколько реже —в противоположном легком.
В зависимости от формирования одиночных или множественных метастазов, поражения ими одного или нескольких органов, клинические проявления рака легкого у таких больных заметно различаются. Нередко развитие одиночного, солитарного метастаза, особенно сопровождающегося характерными и выраженными признаками локального поражения, может полностью отвлечь внимание больного от других нарушений здоровья, связанных с первичной опухолью в легком.
Метастазы в позвоночник, кости скелета — обычно сопровождаются рано возникающими и прогрессирующими мучительными местными и иррадиирующими болями. Такие боли не поддаются устранению болеутоляющими средствами, не покидают больных как в дневное, так и ночное время суток. Нарастающая деструкция, сопутствующая росту и развитию гематогенного метастаза, нередко приводит к патологическому перелому кости. Давление метастаза на корешки спинного мозга вызывает тяжелые невралгические боли, а в отдельных случаях нарушает функцию спинного мозга, приводя к параличу нижних конечностей.
Метастазирование в печень приводит к возникновению своеобразных неприятных или болевых ощущений в области правого подреберья. Чаще всего они мало беспокоят больных, но при вовлечении в патологический процесс желчевыводящих путей с появлением нарастающей желтушности кожных покровов всегда вызывает у них серьезную тревогу.
Гематогенные метастазы в почку или надпочечник, как правило длительное время развиваются бессимптомно. Иногда, при этом отмечают кратковременные болевые эпизоды, напоминающие приступы мочекаменной болезни. Солитарный метастаз рака легкого в головной мозг может располагаться в любой из его областей, в зависимости от этого сопровождаясь своеобразными клиническими проявлениями. Поражение лобной доли длительное время протекает почти бессимптомно или с не всегда отчетливыми, общими признаками поражения центральной нервной системы: головными болями, сонливостью, апатией и утратой интереса к происходящему. Позднее у части больных возникает сменяющее друг друга чувство немотивированной тревоги, неспособности критически оценивать свои поступки.
Поражение мозжечка головного мозга вызывает ощущение головокружения, приводит к расстройству координации движений и походки, которая становится неустойчивой, шаткой. Вовлечение в патологический процесс других областей головного мозга может сопровождаться разнообразными клиническими симптомами, многие из которых очень характерны для первичной опухоли. По этой причине некоторое число больных раком легкого с солитарным метастазом опухоли в головной мозг направляется для обследования и лечения в неврологические или нейрохирургические стационары.
Некоторые своеобразные симптомы и клинические проявления у больных раком легкого возникают в результате воздействия на их органы биологически активных продуктов метаболизма злокачественной опухоли. Круг таких паранеопластических расстройств может быть весьма выражен, а часть из них с устойчиво наблюдаемой группой признаков, объединяют в отдельные синдромы присущие раку легкого.
Слабость, повышенная утомляемость, снижение трудоспособности, похудание — наиболее общие и частые признаки результа такого воздействия. Они характерны не только для далеко зашедших стадий заболевания, но систематически могут быть отмечены уже при начальных его проявлениях, нередко —при отсутствии местных клинических признаков развивающейся в легком опухоли. Совокупность этих изменений описана А.И.Савицким в 1951 году в виде синдрома "малых признаков рака легкого".
Патогенез паранеопластических расстройств, возникающих у больных раком легкого, весьма многообразен и продолжает изучаться. Основу его составляет воздействие на организм больного многочисленных продуктов метаболизма злокачественной опухоли в легком. Среди них отмечена гиперпродукция циркулирующего в крови паратиреоидного гормона, приводящего к гиперкальцемии. Нередко повышается содержание гонадотропного, соматотропного гормонов, а также липотропина, продуктов метаболизма АКТГ, инсулиноподобных веществ и других.
Бисенков Л.Н., Гришаков С.В., Шалаев С.А.

КЛЕТКИ ДВИГАЮТСЯ СКРЫТНО
Раннее распространение опухолевых клеток из первичного новообразования невозможно обнаружить даже с помощью современных визуализирующих техник с высокой разрешающей способностью (МРТ, ПЭТ).
Подбор пациентов для адъювантной терапии, цель которой — предотвратить развитие метастазов, происходит без четкого знания о том, был ли выход опухолевых клеток из первичной опухоли, осели ли они в отдаленных тканях и органах. Эта неопределенность приводит к гиперлечению цитостатиками — токсическими агентами, вызывающими тяжелые побочные эффекты. Известно, что при обнаружении метастазов шансы значительного увеличения продолжительности жизни снижаются с 90% до почти 5% на фоне ограничения вариантов лечения.
Поздний метастатический рецидив обусловлен главным образом феноменом ранней диссеминации опухолевых клеток, которая часто происходит до операции.
Еще в 1929 году русский профессор Яков Зильберберг, допуская возможность гематогенного распространения клеток рака молочной железы (РМЖ), считал операцию фактором, содействующим массивному поступлению опухолевых клеток в кровь. А Бронислав Билынский в 1963 году опубликовал данные о том, что местные рецидивы развиваются у 13,3% пациенток, которым удалили молочную железу, причем в большинстве случаев болезнь возвращается в первые 2 года после вмешательства.
Установлено, что опухолевые клетки могут ежедневно выходить из растущего опухолевого узла в количестве от нескольких тысяч до нескольких миллионов на 1 г ткани.
После выхода из первичной опухоли клетки оседают главным образом в костном мозге и сохраняют потенциал превращения
в настоящие метастазы. Достаточное кровоснабжение костного мозга, развитая сеть капилляров и синусов, насыщенность клеточными элементами и особенности микроокружения — оптимальные условия для жизни и последующего метастазирования.
Выявлять опухолевые клетки в костном мозге с помощью традиционной гистологической техники нереально, но можно идентифицировать благодаря высокочувствительным специфическим технологиям (иммуноцитохимический метод с применением моноклональных антител; проточная цитофлуориметрия; молекулярный анализ, в частности обратнотранскриптазная полимеразная цепная реакция; флуоресцентная гибридизация in situ; иммуномагнитный анализ, включая методику иммуномагнитного обогащения).
В 2002 году Вольф Бернардс с соавторами представили новую модель течения опухолевого процесса: способность к метастазированию появляется рано, во время формирования первичной опухоли.
Опухолевые клетки в латентном состоянии, часто в течение длительного времени, — все еще загадка и весьма серьезная проблема клинической онкологии.
Андрэс Нилсен с соавторами сообщили: приблизительно у 39% женщин 40–49 лет имеет место клинически скрытый РМЖ, и только у 1,8% из той же возрастной группы диагностируют данную онкопатологию.
Микроскопическую карциному (часто менее 1 мм в диаметре) обнаруживают в щитовидной железе более чем у 38% людей 41–60 лет, погибших из-за травмы, но рак диагностируют только у 0,5% лиц этого возраста.
КЛЕТКИ ЦИРКУЛИРУЮТ В ПЕРИФЕРИЧЕСКОЙ КРОВИ
В 1865 году Герхард Тирч обнаружил инвазию вен и лимфатических сосудов раковыми клетками. О выявлении атипических клеток в крови пациента со множественным раком кожи в 1869-м сообщил Томас Эшворт. Первое систематическое исследование раковых клеток, обнаруженных в периферической крови онкобольных, приведено в 1934 году в работе Джона Пула и соавторов, которые установили присутствие таких клеток в венозной крови 42,5% пациентов.
ДИССЕМИНИРОВАННЫЕ ОПУХОЛЕВЫЕ КЛЕТКИ В КОСТНОМ МОЗГЕ
О наличии опухолевых клеток в костном мозге больных с различными формами новообразований впервые сообщил Ренат Рейч в 1935 году, позже это подтвердил Александр Сендберг в 1958-м. Современные исследователи отмечают, что у 25–60% пациентов с категорией М0 в костном мозге обнаруживают диссеминированные опухолевые клетки — ДОК (Аликс Панабьерес с соавт., 2008; Том Мюллер с соавт., 2010; Вуд Жанни с соавт., 2011). ЦОК и ДОК отнесены к категории т. н. минимальной остаточной болезни (МОБ), которая в англоязычной литературе обозначается как minimal residual disease — MRD (Клаус Пентель, 2008).
Концепция определения микрометастазов в костном мозге пациентов с солидными опухолями была введена в клиническую онкологию более четверти века назад Клаусом Пентелем и рядом других исследователей. Они показали, что, несмотря на полную резекцию первичной опухоли, у пациенток с РМЖ сохраняется риск появления метастазов, обусловленных скрытыми опухолевыми клетками в костном мозге. Кстати, именно последний играет ведущую роль среди отдаленных органов как индикатор развития МОБ. Кроме того, является общим homing-органом для ДОК, выходящих из различных типов эпителиальных опухолей (прежде всего это касается молочной железы, легкого, предстательной железы, толстого кишечника).
В 1% биоптатов костного мозга от 10 112 пациентов с неизвестными первичными негематологическими опухолями были обнаружены метастазы (Чао Ксиао с соавт., 2009). При этом у пациентов, имеющих метастатические опухоли, дочерние клетки в костном мозге выявили в 3,7% случаев.
Первичную опухоль диагностировали во время аутопсии у 49,5% больных с положительным костным мозгом (больше всего было опухолей легкого, органов ЖКТ и молочной железы).
Надо отметить, что аспирационная биопсия костного мозга и его исследование — рутинные диагностические методы для пациентов с лейкозами и лимфомами. Пока анализ клеточного состава пунктатов костного мозга не включен в обычное клиническое обследование людей с солидными опухолями. Зато анализ периферической крови привычен и сопряжен с меньшей стрессовой нагрузкой.
Естественно предположить, что выявление и характеристика ДОК и ЦОК дают онкологам инструмент для создания системы мониторинга диссеминации опухолевых клеток в костный мозг и кровь, идентификации терапевтических мишеней на диссеминированные и циркулирующие опухолевые клетки, позволяя существенно улучшить эффективность лечения.
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ЦОК И ДОК
Хотя большинство опухолей подвергается радикальному хирургическому вмешательству — т. н. резекции R0, — у многих пациентов со временем появляются отдаленные метастазы. Причина — пред- или послеоперационная диссеминация опухолевых клеток, не выявленных до вмешательства. Свыше 20 лет назад такие клетки или их кластеры получили название микрометастазов и были включены в систему TNM 6-й редакции (2002) и оставлены в 7-й (2009), с присвоением следующих обозначений по категории рМ: изолированные опухолевые клетки, найденные в костном мозге гистологическими методами, — М0(i+); а также негистологическими (молекулярными) — M0(mol+). Фактически эти клетки называют изолированными или диссеминированными в зависимости от того, находятся они в крови или в костном мозге. Присутствие их в организме онкобольного расценивается как МОБ.
Адъювантная химиотерапия, призванная элиминировать микрометастазы, в плане подавления их роста часто неэффективна. Клетки микрометастазов резистентны в силу того, что они не являются активно пролиферирующими или защищены благодаря взаимодействию с факторами микроокружения в очаге метастазирования.
Большое влияние на повышение интереса к проблеме МОБ при солидных опухолях сыграли решения 22-го Международного симпозиума по раку молочной железы (Сан-Антонио, штат Техас, США, 1999). Проанализировав результаты исследований, участники симпозиума пришли к заключению, что идентификацию клеток микрометастазов в костном мозге можно рассматривать как новое поколение методов скрининга и мониторинга злокачественных опухолей.
Метаанализ результатов исследований пациенток, страдающих РМЖ, проведенный Джозефом Брауном с соавторами (2005), продемонстрировал, что присутствие ДОК в костном мозге способно предсказать не только развитие метастазов в костях скелета, но и появление их в других тканях и органах. Основываясь на этих и иных данных, отображающих клиническое значение определения ДОК/ЦОК у больных РМЖ, в 2007 году указанные клетки были впервые рекомендованы АSCO как потенциальные опухолевые маркеры (Фром Гэррис с соавт., 2007). Было сделано заключение, что наличие опухолевых клеток в костном мозге у пациентов, не получавших адъювантную системную терапию, прогнозирует статистически значимый больший риск возвращения заболевания.
Необходимо обратить внимание, что ЦОК могут быть источником не только будущих истинных метастазов, но и опухолевой тромбоэмболии.
В реанимационном отделении при интенсивной терапии состояние больной продолжало ухудшаться, на 4-е сутки после операции она умерла.
При патолого-анатомическом исследовании с последующей микроскопией гистологических препаратов установлены множественные опухолевые эмболы в сосудах сердца, легких, мягкой мозговой оболочки. В печени на всем протяжении взятых многочисленных срезов — метастатическое поражение ткани органа структурами инфильтрирующего протокового РМЖ, занимающее 75–80% площади микроскопических препаратов.
Островки сохраненных гепатоцитов были с выраженными дистрофическими изменениями. Печеночные триады охвачены опухолевой тканью.
Массивное диффузное опухолевое поражение печени, вероятнее всего, развилось ранее и стало источником опухолевых эмболов, поступающих
в кровоток по системе печеночных и нижней полой вены.
Случай из практики . Больная С., 1972 г. р., завершила лечение РМЖ (радикальная мастэктомия, 6 курсов адьювантной полихимиотерапии и хирургическая кастрация). Жаловалась на периодические боли в костях. При стандартном обследовании (остеосцинтиграфия, рентгенография, КТ) очаговых изменений, характерных для метастазов, не обнаружено. Сделана стернальная пункция и трепан-биопсия крыла подвздошной кости. Микроскопически в костном мозге выявили диссеминированные опухолевые клетки.
Пациентка продолжила специальное лечение.
ПОРОГ ЦОК, ЗА КОТОРЫМ ЖИЗНЬ НА ВОЛОСКЕ
Нет сомнения в том, что раннее выявление ДОК у пациентов с солидными опухолями поможет идентифицировать тех, кто нуждается в системной терапии после успешной хирургической резекции первичного новообразования; а определение клиренса ДОК/ЦОК станет промежуточной оценкой течения клинического процесса и эффективности противоопухолевых агентов.
В 2011 году в Гамбурге (Германия) прошел мировой саммит по ЦОК, его посвятили практической полезности ЦОК для создания лекарств и разработки диагностических приемов. В том же году в Сан-Диего (США) провели третий саммит по ЦОК, рассмотрели технологии и техники реализации проблемы ЦОК в клинике. В 2012 году в США состоялась вторая конференция по проблеме клинического применения ЦОК для выбора методов лечения и мониторинга реакции опухоли на терапию.
Сегодня установлен порог количества опухолевых клеток в периферической крови — 5 ЦОК в 7,5 мл крови (позволяет оценивать течение процесса и определять степень риска развития рецидива и метастазов). Наличие свыше 5 опухолевых клеток в том же количестве периферической крови ассоциируется с плохим прогнозом. Полученные данные позволяют считать, что выявление ЦОК в крови может быть быстрым и более аккуратным показателем для предсказания эффективности терапии, чем нынешний золотой стандарт — МРТ, которую выполняют через 10–12 недель после лечения для контроля состояния опухоли. Клиническая ценность поиска ЦОК уже доказана у пациенток, страдающих РМЖ; для злокачественных опухолей других локализаций ее еще предстоит доказать. Важный вывод: определение ЦОК будет более информативным и полезным при опухолях, ассоциированных с вовлечением в процесс костного мозга.
Достижение на современном этапе — установление корреляции между уровнем ангиогенеза в опухоли и появлением опухолевых клеток в костном мозге при РМЖ и раке желудка. Обнаружено также усиление ангиогенеза в новом для опухолевых клеток месте (в частности, в костном мозге у пациенток, страдающих РМЖ).
Примечательно наблюдение Мишеля Лидена (2014). Костномозговые клетки-предшественники в ответ на факторы роста, продуцируемые первичной опухолью, экспрессируют рецептор фактора роста эндотелия сосудов 1 (Flt-1), направляются в отдаленные органы и изменяют локальное микроокружение, формируя т. н. предметастатическую нишу; по сути — готовят базу для принятия опухолевых клеток и формирования истинных метастазов.
ДОК характеризуются дефицитом экспрессии молекул главного комплекса гистосовместимости 1-го класса, которые участвуют в опосредованном Т-лимфоцитами узнавании опухолевых клеток. Эти особенности фенотипа ДОК, вероятно, могут объяснить, почему на протяжении многих лет они игнорируются иммунной системой и сохраняются при лечении, основанном на активной иммунизации противоопухолевыми вакцинами. Работы вышеупомянутого Мишеля Лидена, опубликованные в 2013 году, посвящены возможной связи ДОК и ЦОК со стволовыми клетками опухоли. Как известно, опухолевые стволовые клетки, наличие которых показано в ряде исследований (Грег Кларк с соавт., 2014), являются редкой самообновляющейся популяцией, необходимой для инициации и поддержания роста новообразования.
Правомерен вопрос: есть ли среди ДОК стволовые метастатические клетки? Клаус Пентель (2013) приводит ряд доказательств такой возможности: наличие ДОК в костном мозге коррелирует с появлением метастазов; большинство ДОК и ЦОК — непролиферирующие клетки, они резистентны к химиотерапии, что характерно для опухолевых стволовых клеток, и могут существовать в костном мозге пациентов с опухолями долгие годы после операции; ДОК и ЦОК у страдающих РМЖ имеют фенотип стволовых клеток первичной опухоли; 2 фактора стволовых клеток — EGF и FGF2 — были необходимы для роста in vitro ДОК, полученных из костного мозга больных. Приведенные факты интересны, но вопрос о возможной стволовой природе ДОК, в частности об использовании ими костного мозга в качестве ниши, все еще открыт.
Для поиска ЦОК сегодня применяют несколько приборов. Но только один коммерчески доступный — CellSearch (Veridex LLC) — одобрен в 2004 году Управлением по продуктам питания и лекарственным средствам США (FDA) для мониторинга лечения пациенток с РМЖ (к настоящему времени — также с колоректальным и раком предстательной железы).
Существуют и другие методы выявления ЦОК (ПЦР-анализ, проточная флуориметрия, лазерная сканирующая цитометрия, ЦОК-микрочипы и EPISPOT); положительные и отрицательные характеристики каждого интенсивно изучаются. Это чрезвычайно важные работы, т. к. включение оценки микрометастазов, в частности ДОК и ЦОК, в рутинную клиническую практику сдерживается главным образом отсутствием стандартных методов и приемов.
Сегодня почти все онкологи признают, что исследования проблемы ЦОК и ДОК должны продолжаться и углубляться. Особое внимание следует обратить на поиск высокочувствительных методов идентификации опухолевых клеток, на стандартизацию их применения и разработку единых протоколов исследования для получения сравнительной оценки результатов.
В ВГМУ успешно реализуются проекты по изучению и разработке методов молекулярно-генетической идентификации циркулирующей опухолевой РНК и ДНК в периферической крови у онкопациентов и в стернальном пунктате костного мозга. Результатом станет создание и освоение производства оригинальных и не имеющих аналогов в Беларуси и странах ближнего зарубежья тест-систем на основе метода ПЦР.
Материал рассчитан на врачей-онкологов, общей практики, маммологов.
Евгений Шляхтунов, доцент кафедры онкологии с курсами лучевой диагностики и лучевой терапии ВГМУ, кандидат мед. наук
Читайте также:

