Дендритные клетки при миеломе
Aктуальность. На современном этапе, по данным ВОЗ, успешность имплантации составляет 96-97%, тем не менее, остаются малоизученными вопросы установки имплантов у пациентов, страдающих онкологическими заболеваниями, остеопорозом, у которых на фоне приёма препаратов для специфического лечения развивается серьезный побочный эффект – ассоциированный с бифосфонатами (БТС) остеонекроз челюстей (BRONJ) 1. Несмотря на то, что количество таких больных небольшое, вопросы лечения этой категории пациентов требуют особых подходов при выборе лечения, разработки новой стратегии, фундаментальных представлений о клеточных взаимодействиях, роли иммуноцитов в барьерных свойствах покровных тканей. На современном этапе отсутствуют установки каких-либо стандартов оказания медицинской помощи этой категории больных [11, 23, 27]. Бифосфонаты в основном используется благодаря бесспорным свойствам ингибировать резорбцию кости остеокластами при лечении различных заболеваний, таких как остеопороз, множественная миелома, опухоли, которые метастазируют в кости и злокачественная гиперкальциемия [13, 21].
Применение этих препаратов остро дискутируется, анализируется количество результатов, которые получены in vitro и in vivo в естественных условиях в экспериментах на животных [5, 16].
Существующее положение в стоматологическом менеджменте оказания услуг и помощи больным с онкологией, остеопорозами определило направление наших исследований, посвящённых получению новых данных для четкого понимания механизмов остеонекроза челюстей. Продолжение исследований и разработка практических рекомендаций может привести к новым знаниям в области стоматологии, поэтому изучение механизмов эпителио-мезенхимальных взаимодействий в тканях полости рта является наиболее актуальным [6, 9, 17, 25].
Целью нашего исследования является морфологический анализ материала больных с онкопатологией, в частности, с миеломой, а также остеопорозом для разработки новых данных для дополнений к современной классификации методов хирургического лечения больных на фоне приёма бифосфонатов (BRONJ), и возможности получения прогностической оценки вероятности успеха после установки имплантов.
Материал и методы. Материалом для анализа послужили данные исследований с 2000 года по 2015 год, содержащие сведения о состоянии слизистой оболочки полости рта у больных с онкопатологией, миеломой, остеопорозом, с адентией локальной и генерализованной, врождённой и приобретённой в результате травм в возрасте от 20 до 85 лет, имеющие дефекты зубных рядов с атрофией или без изменений челюстей, удалявших зубы, или утративших зубы в результате кариеса, а также пародонтита или пародонтоза. В качестве контроля исследована СОПР людей без сопутствующей патологии, получивших в результате травмы утрату одного или нескольких зубов. В работе использованы результаты собственных исследований 2-х случаев миеломы с проявлениями остеонекроза и при отсутствии внешних признаков остеонекроза в условиях репаративной регенерации после установки имплантов, а также в период ремиссии миеломной болезни.
Весь спектр клинических обследований слизистой оболочки полости рта проводился в динамике – в процессе подготовки и установки имплантов. Решающим параметром для возможности установки имплантатов являлось наличие достаточного объема кости в области предполагаемой имплантации. Установка внутрикостных имплантатов требует достаточного количества и качества костной ткани в необходимом участке челюсти. При недостатке кости, в зависимости от морфологии дефекта, выбирали метод наращивания гребня. Преимущественно использовали теменные кортикальные костные трансплантаты, подбородочные и взятые с ветви, которые имеют внутримембранное происхождение и потому резорбируются меньше, чем имеющие энхондральные источники развития. Эта особенность репаративной регенерации объясняется быстрой реваскуляризацией и медленной резорбцией костей внутримембранного происхождения.
Все пациенты были условно разделены на группы:
1) согласно возрастной классификации периодизации Г. Крайга: ранняя взрослость – 20–39 лет, средняя взрослость – 40–59 лет, поздняя взрослость – 60 лет и более с учётом сопутствующей патологии и наличием или отсутствием хирургического вмешательства по удалению зубов (табл.1).
Распределение материала по возрастным группам и патологии
по удалению постоянных зубов
Папиллома на СОПР
2) по локализации и характеру дефектов зубных рядов в соответствии с классификацией Е.И. Гаврилова (табл. 2).
Распределение пациентов по классификации зубных рядов с дефектами
Количество наблюдений по классам, абс.
4) по характеру и степени атрофии челюстей с частичной или полной адентией в соответствии с классификациями Келлера и Шредера (табл. 3).
Распределение пациентов по характеру и степени атрофии челюстей с частичной или полной адентией
Количество наблюдений по типам, абс.
5) при планировании дентальной имплантации в соответствии с классификацией М.З. Миргазизова (табл. 4).
Распределение пациентов по видам дентальной имплантации
Кол-во наблюдений по классам (М.З. Миргазизов, 2003)1, абс.
1 Все классы характеризовались следующими свойствами костной ткани: Q1–2, V1–2, T1–2.
где Q – качество кости (1-4); V – объем кости (1- 4); T– топографические особенности зоны имплантации (1-4).
1 – нормальные параметры (благоприятные условия);
2 – незначительные отклонения, требующие учета без вмешательств);
6) контрольная группа – 36 практически здоровых людей 20–85 лет, утративших зубы в результате травмы, и которым проводилась предимплантационная подготовка полости рта.
Все пациенты обследованы согласно протоколу с заполнением медицинской карты стоматологического больного формы № 043/у, забор биоптатов производили в рамках Хельсинской декларации с информированного согласия пациентов или, в случае недееспособности, опекунов (2000) и с разрешением этического комитета ФГАОУ ВПО Дальневосточный Федеральный Университет.
Для морфологического исследования при удалении зубов или их корней, имплантации и микрохирургических пародонтологических операций иссекались фрагменты слизистой оболочки десны объемом 1 мм3. Забор материала производился во время хирургического или в ранние сроки после травматического удаления зубов, всего изучено 2879 биопсий. Также материал забирали во время подготовки пациента к установке имплантов (при коррекции атрофии челюстей) и в случае отторжения имплантов (4 случая за период с 2011 по 2015 гг.) для получения полной характеристики взаимодействия эффекторных иммуноцитов в слизистой оболочке полости рта. Параллельно проводился цитологический анализ с поверхности слизистой оболочки полости рта для расширения диагностического ресурса успешности имплантации и прогнозирования исходов и перспектив установки имплантов, а также для разработки мер профилактики осложнений имплантации.
Основным методом морфологического исследования явилось иммуногистохимическое фенотипирование на основе кластеров дифференцировки (Cluster of Differentiation – CD) – T-лимфоцитов (СD4+/СD8+), CD34, клеток Лангерганса (СD68+), интерстициальных макрофагов (СD163+). Интенсивность пролиферативных процессов в эпителиальной пластинке оценивалась по митотическому индексу посредством маркера Ki-67: количество митозов на 100 клеток. Апоптоз изучен Тunel методом для световой микроскопии. Также для изучения апоптических процессов при подготовке полости рта и при имплантации получена характеристика Р53. Иммуноморфологическое исследование проводили в лабораториях патоморфологии и иммунной гистохимии университета г. Ниигата (Япония) и Международном медицинском научно-образовательном центре (IMERC, Ниигата, Япония).
Кроме того, при анализе биопсий использовались рутинные методики (окраски гематоксилином и эозином, по Ван-Гизону, Victoria blue, по Браше и альциановым синим).
Изучение гистологических срезов и мазков-отпечатков осуществлялось с помощью микроскопа Olympus BX52 с оригинальным программным обеспечением для морфометрии.
Статистическая обработка полученных данных, проверка статистической значимости различий между группами по параметрам распределения и сравнение групп выборок проведено с применением методов вариационной статистики, параметрических и непараметрических методов корреляционного анализа.
Результаты собственных исследований. Установлены особенности слизистой оболочки больных миеломной болезнью, пациентов с онкопатологией, а также с остеопорозами, которые заключаются в большем, по сравнению с нормой, количеством апоптозирующих клеток не только в ростковых слоях эпителиальных пластов, но и в собственной пластинке слизистой оболочки полости рта, при этом отмечается сниженная пролиферативная активность кератиноцитов (рис. 1а, 1б, 1в). Также нами отмечена лимфоцитарная инфильтрация.
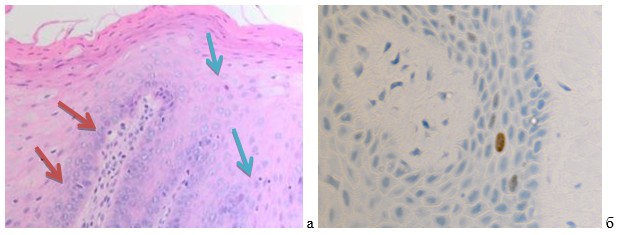
Рис. 1а-б. Слизистая оболочка десны человека 56 лет при миеломной болезни в зоне установки импланта
Наблюдается апопотоз эпителия в камбиальном и шиповатом слоях, а также в собственной пластинке. А) Апоптозирующие клетки указаны красными стрелками. Лимфоцитарная инфильтрация (указано зелёными стрелками). Микрофото. А-окраска г/э; б) ИГХ (Ki67). Ув.х 400.
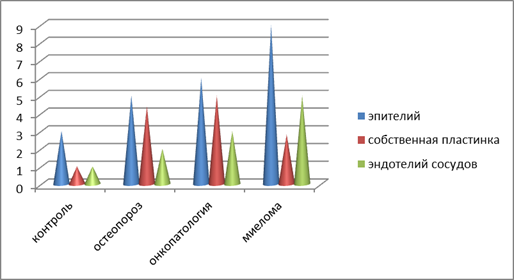
Рис. 1в. Диаграмма уровня апоптоза в структурах слизистой оболочки на фоне различной патологии пациентов при имплантации
Методом иммунной гистохимии выявлены отклонения в содержании макрофагов CD68 в слизистой оболочке обследованных больных. Учитывая, что CD68 играет роль в фагоцитарной активности тканевых макрофагов, как во внутриклеточном лизосомальном метаболизме, так и во внеклеточных взаимодействиях клетка-клетка и клетка-патоген, анализ результатов показал, что защитные свойства ткани снижены (рис. 2а). На фоне снижения количества CD68, отмечается многочисленная инфильтрация как эпителиальных пластов, так и прилежащей соединительной ткани эффекторных антигенпрезентирующих иммуноцитов (рис. 2 б, 2в, 2 г).
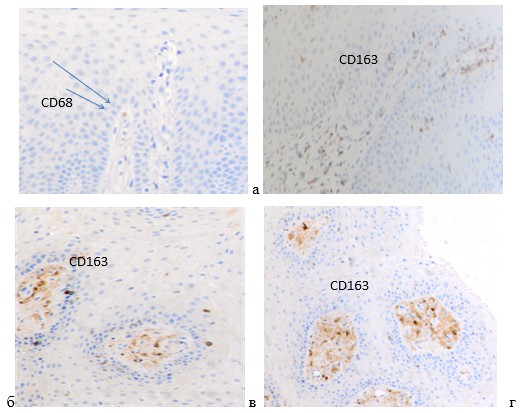
Рис. 2. Слизистая оболочка десны человека. ИГХ. А) CD68; б, в, г) СD 163.
Микрофото. Ув. 400
При этом нами отмечено, что количество эффекторных клеток CD163 преобладает в собственной пластинке слизистой оболочки десны в зоне имплантации.
Маркёр Р53 позволил выявить клетки преимущественно в базальных камбиальных слоях эпителия (рис. 3), что соответствует данным анализа апоптоза в различных пластинках слизистой оболочки с учётом того, что ядерный белок р53 активируется при повреждениях генетического аппарата, а также при стимулах, которые могут привести к подобным повреждениям, или являются сигналом о неблагоприятном состоянии клетки (стрессовом состоянии). Учитывая отсутствие реституции эпителиоцитов в период острой миеломы, до явных морфологических проявлений, трансформация в клетках связана, скорее всего, с нарушением регуляции синтеза сигнальных межклеточных мессенджеров. Об этом свидетельствует и миграция дендритных антиген представляющих клеток в большей степени из эпителиальных пластинок в подлежащую соединительную ткань. И мы считаем, что данное утверждение, как раз в связи с фактом функции белка р53, которая не проявляется при наличии стволовых клеток, свидетельствует об утрате камбиального регенераторного потенциала с последующим отсутствием дифференцировки и специализации клеток, выполняющих барьерные функции, что и приводит в последующем к нарушению и отсутствию физиологической и репаративной регенерации, сопровождаясь обнажением костной ткани, а затем её некрозом. Данные о том, что в регуляции активности белка р53 ведущая роль принадлежит посттрансляционным модификациям белка и его взаимодействиям с другими белками, объясняют, почему наблюдается уменьшение концентрации свободных рибонуклеотидов, которое, по нашему мнению, происходит потому, что отсутствует свой собственный камбий в эпителиальной пластинке слизистой оболочки. Поэтому этот факт мы считаем как ещё одно косвенное свидетельство уменьшения камбия и отсутствие его пролиферации в период до развития яркой картины разрушения мягких тканей и остеонекроза.
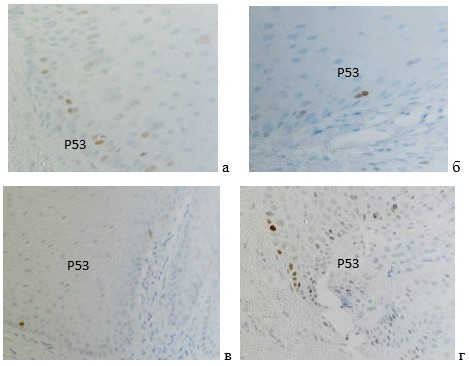
Рис. 3. Слизистая оболочка десны человека. ИГХ. Р53. Микрофото. Ув. 400
Установлено, что высокая активность CD34 проявляется в эндотелии кровеносных сосудов всех калибров, включая мелкие капилляры 5-7 ммк (рис. 4).
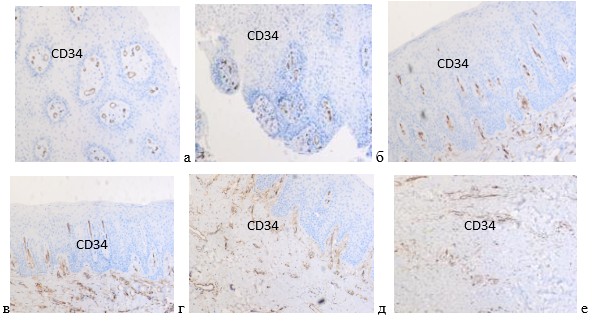
Рис. 4. Слизистая оболочка десны человека. ИГХ. CD34. Микрофото. Ув. 400
Так как CD34 является мембранным белком и представлен молекулами межклеточной адгезии, вероятно, опосредованно способен связывать стволовые клетки со стромальными клетками. Служит белковым скаффолдом для присоединения специфичных гликанов, который позволяет стволовым клеткам прикрепляться к лектинам, вырабатываемыми клетками стромы, или связываться с селектинами сосудистого эндотелия.
Обсуждение собственных результатов. Известно, что бисфосфонаты являются первичными агентами в эффективном фармакологическом арсенале против RANKL - остеокласт-опосредованной потери костной массы путем подавления экспрессии генов NFATc1 и Caii при остеопорозе, болезни Педжета, злокачественных новообразованиях с метастазами в кости, мульформной миеломы и гиперкальциемии при злокачественных новообразованиях [7, 10, 15]. Также их назначают при несовершенном остеогенезе и профилактике остеопороза [8]. Однако ограничить патогенез деструкции кости только депрессией остеокластов и снижением ангиогенеза недостаточно, необходимы дальнейшие более глубокие исследования, чтобы патогенетически обоснованно применять бифосфанаты [26]. Структурно-функциональные корреляции, молекулярные и клеточные механизмы, лежащие в основе действия бисфосфонатов также рассматриваются в плане поиска новых молекулярных мишеней. Выявленные нами особенности пролиферативной активности кератиноцитов и распределения иммуноцитов в эпителиальной пластинке слизистой оболочки показали, что в патогенезе остеонекроза челюстей на фоне длительного приёма бифосфанатов механизм повреждения ткани челюсти и развития остеонекроза связан не только с влиянием бифосфонатов на активность остеокластов и ингибированием резорбции кости. Наши данные по иммуноцитам согласуются с данными о том, что содержание интерлейкина (ИЛ) -6 и остеопротегерина в слизистой оболочке у пациентов с некрозом были значительно повышены в сравнении с данными у больных без патологии, в то время как концентрация гидроксиметилглутарил кофермента А редуктазы и VEGF значительно уменьшалась [18, 24]. Результаты нашего исследования свидетельствуют о важности мониторинга оценки лечения бисфосфонатами на основе выявления соотношения и распределения количества иммуноцитов в структурах слизистой оболочки, а также производства IL-6, RANKL, остеопротегерина, и VEGF, для того, чтобы выявить начальные микроскопические и биохимические изменения, ведущие к остеонекрозу [19]. Ранняя диагностика может предотвратить или уменьшить заболеваемость вследствие деструктивных поражений костной ткани челюсти [12, 14, 16, 20].
Заключение. Механизм остеонекроза челюстей у стоматологических пациентов с онкопатологией, миеломной болезнью, остеопорозом связан с нарушениями в системе взаимодействия антигенпрезентирующих макрофагов CD68, эффекторных макрофагов CD163, повышенным апоптозом, сниженным регенераторным потенциалом и отсутствием реституции, которая может быть связана с нарушением не только межклеточных эпителио-мезенхимных взаимодествий, но и синтезом сигнальных молекул. Наиболее показательны отклонения в активности клеток, маркирующихся Р53, которые могут служить ярким критерием доклинических проявлений морфологических изменений в системе эпителио-мезенхимных взаимодействий в слизистых оболочках десны в зоне имплантации. Появление большого количества клеток, меченных Р53, свидетельствует о развитии повышенного апоптоза, как отклонения от нормальной физиологической и даже репаративной регенерации, отсутствии реституции, снижении регенераторного потенциала и исчезновении собственных камбиальных кератиноцитов, а также нарушении выработки факторов дифференцировки лимфоцитов вследствие апоптоза эффекторных кератиноцитов. Отсутствие барьерных тканей, ведёт к микробной контаминации костной ткани челюсти и остеонекрозу на фоне нарушения остеосинтеза.
Работа выполнена при поддержке научного фонда ДВФУ, в рамках государственного задания 2014/36 от 03.02.2014 г. и Международного гранта ДВФУ (соглашение № 13-09-0602-м от 6 ноября 2013 г.).
Рецензенты:
Красников Ю.А., д.м.н., профессор школы искусства, культуры и спорта, Дальневосточный федеральный университет, г. Владивосток;
Скляр Л.Ф., д.м.н., доцент ГБУЗ ККБ №2 центр СПИД, г. Владивосток.

Миелома — злокачественная опухоль, подавляющая нормальное кроветворение, разрушающая кости и вырабатывающая патологические белки, повреждающие внутренние органы. Когда говорят о миеломе крови или костей, или позвоночника, или костного мозга, то имеют ввиду одно заболевание с разнообразными проявлениями.
Относящееся к гемобластозам или онкогематологическим процессам, то есть злокачественным болезням крови и лимфатической ткани заболевание имеет много названий: множественная миелома, миеломная болезнь и генерализованная плазмоцитома, плазмоцитарная миелома.
- Причина миеломы
- Что происходит при миеломе?
- Диагностика миеломной болезни
- Когда диагноз миеломы не вызывает сомнений
- Симптомы миеломы
- Лечение миеломной болезни у молодых
- Лечение миеломы у пожилых
- Прогноз при миеломной болезни
Причина миеломы
Миелома состоит из изменённых плазматических клеток. В нормальном костном мозге плазматические клетки рождаются из В-лимфоцитов, но число их ограничено всего 5%, большее количество — уже патология.
Определённой ясности с первопричиной развития плазматической опухоли нет, в инициации процесса подозревают плохую наследственность и склонность к аллергии против собственных тканей, радиацию и работу с токсичными веществами, под подозрение попал и вирус герпеса 8 типа.

Миеломная болезнь поражает трёх из 100 тысяч россиян, как правило, пожилых — преимущественно на седьмом десятке жизни, у молодых до 40 лет заболевание встречается очень редко.
Среди страдающих заболеваниями крови и лимфатической ткани плазмоцитому имеет 10-13%, но из всех существующих в природе злокачественных процессов на больных плазмоклеточной опухолью приходится не более одного процента.
Что происходит при миеломе?
По какой-то причине в костном мозге появляются ненормальные клетки, размножаясь, они нарушают нормальное кроветворение, что проявляется анемией. Недостаток эритроцитов сказывается на работе всех органов, но особенно сильно на легочной ткани и головном мозге, что проявляется недостаточностью их функций.
Функция нормальных плазматических клеток — выработка антител-иммуноглобулинов для защиты от болезнетворных агентов. Миеломные плазмоциты тоже вырабатывают иммуноглобулины, но дефектные парапротеины, не способные к иммунной защите.
В костях миеломные клетки стимулируют остеокласты, вызывая остеолизис — разъедание кости. Из разрушенной кости кальций выходит в плазму, накапливаясь, приводит к гиперкальциемии — тяжёлому состоянию, требующему принятия срочных мер.
Диагностика миеломной болезни
Диагноз устанавливается по анализам крови, где находят парапротеины и определяют их суммарную и видовую концентрацию. Парапротеины обозначают как иммуноглобулины — IgA, IgG и IgМ. Плазмоциты вырабатывают иммуноглобулины по собственному усмотрению и в разном количестве, по их изменению продукции патологических белков впоследствии оценивают эффективность лечения и активность заболевания.
Степень агрессивности плазматических клеток выясняют при микроскопии костного мозга, его получают из грудины при стернальной пункции или при биопсии тазовой кости. Особенно актуально исследование при невысокой продукции парапротеинов или при изменении характера течения болезни.

Часто заболевание случайно обнаруживается во время обычной рентгенографии органов грудной клетки по литическим дефектам ребер. На первом этапе необходимо выявить все деструктивные изменения в костях, чтобы в дальнейшем следить за процессом и результатами терапии, что позволяет высокочувствительная низкодозная КТ всего скелета.
При МРТ изучается состояние плоских костей — черепа и таза, что обязательно при тлеющей и солитарном варианте опухоли. МРТ помогает оценить не только дефекты кости, но и наличие опухолевой инфильтрации мягких тканей, вовлечение в процесс спинного мозга.
Обязательно проводится анализ на кариотип для выявления генетических аномалий, влияющих на прогноз в отношении жизни больного и эффективность лечения.
Когда диагноз миеломы не вызывает сомнений
Характерные особенности клеток определяют течение процесса от медленной и практически доброкачественной гаммапатии или тлеющей миеломы до стремительного плазмоклеточного лейкоза.
Не всегда изначально удаётся классифицировать заболевание, что усложняет выбор оптимальной терапии. В 2014 году международный консенсус определил критерии, облегчающие постановку точного диагноза и отделяющие один вариант опухолевого процесса от других.
В первую очередь, в костном мозге определяют процент плазматических клеток, так при симптоматической миеломной болезни их должно быть более 10%, а 60% говорит о высокой агрессивности опухоли.
- М-протеин в крови, то есть IgA или IgG;
- легкие цепи иммуноглобулинов;
- в моче белок Бенс-Джонса;
- очаги в костях скелета.
При недостаточности специфических критериев диагностике помогают неспецифические, но часто встречающиеся последствия деятельности плазмоцитов и парапротеинов на органы-мишени:
- повышение уровня кальция крови в результате массивного разрушения костей;
- снижение гемоглобина при опухолевом замещении костного мозга;
- повышение креатинина крови — маркёра почечной недостаточности.
Симптомы миеломы
Замечено, что каждый пул плазматических клеток производит иммуноглобулины с персональными особенностями и по своему графику, отчего клинические проявления очень своеобразны и глубоко индивидуальны. Нет двух одинаковых больных, тем более невозможно найти двух похожих пациентов по диагностическим критериям. Тем не менее, выделяют несколько типов заболевания.
По количеству поражений опухоль может быть генерализованной или множественной и солитарной — с единственным очагом.
По течению различают вялотекущую или тлеющую, она же индолетная, и симптоматическую плазмоцитому, протекающую с явными клиническими проявлениями.

Основное проявление симптоматической миеломы — боли в костях вследствие их разрушения, которые появляются не сразу и часто даже не в первый год заболевания. Болевой синдром возникает при вовлечении в опухолевый процесс надкостницы, пронизанной нервными окончаниями. При медленно текущем процессе до выявления опухоли может пройти несколько лет, поскольку ничего кроме эпизодов слабости у пациента не возникает.
В развёрнутой стадии с множественными поражениями на первый план выходят в разных комбинациях и с индивидуальной интенсивностью переломы в местах деструкции костей и проявления почечной недостаточности, или амилоидоз органов.
Лечение миеломной болезни у молодых
Вялотекущий вариант миеломной болезни не всегда требует лечения, поскольку не угрожает жизни, а терапия совсем не безвредна. В данном случае наблюдение за течением процесса более выгодно пациенту, нежели токсичная химиотерапия. Регулярные обследования позволяют вовремя диагностировать активизацию процесса.
Симптоматическая миелома разделяется по стадиям от I до III по уровню в крови специфического микроглобулина и альбумина, стратегия при стадии I и II-III различается только используемыми препаратами и их комбинациями.
При любой стадии основное и определяющее тактику — состояние пациента и его возраст. Так сохранным больным до 65-летнего возраста и без тяжёлых хронических болезней предлагается агрессивная химиотерапия высокими дозами с пересадкой собственных стволовых клеток крови, по-научному, аутологичной трансплантацией.
Физически сохранные пациенты от 65 до 70-летия тоже могут претендовать на высокодозную химиотерапию, но уже не комбинацией лекарств, а единственным препаратом — мелфаланом.
До начала высокодозной химиотерапии проводится несколько курсов полихимиотерапии обычными дозами, затем специальным препаратом стимулируется выработка костным мозгом собственных стволовых клеток, которые собираются и консервируются. Затем пациент получает очень высокие дозы цитостатиков, в результате чего гибнут все клетки крови — опухолевые и нормальные. Нормальные, заблаговременно законсервированные кровяные элементы и вводят пациенту.
Лечение миеломы у пожилых
Пациенты старше 65 лет и помоложе, но с сопутствующими болезнями, влияющими на общее состояние и активность, тоже на первом этапе проходят цикловую химиотерапию, в том числе с использованием таргетных препаратов. Результат лечения оценивается по анализам крови и костного мозга, где определяют концентрацию специфических для заболевания белков и процент опухолевых клеток.
На результате лечения отражается не только возраст, но и наличие нескольких хронических болезней, астенизация, подразумевающая физическое ослабление с похуданием или без оного.
В последние годы спектр химиопрепаратов существенно расширился за счёт таргетных средств, продемонстрировавших хороший непосредственный результат и увеличение продолжительности жизни участников исследований.
Поражения скелета подлежат длительной терапии бисфосфонатами, уменьшающими болевой синдром, предотвращающими переломы и гиперкальциемию. На отдельные опухолевые очаги воздействуют ионизирующим излучением, обязательна лучевая терапия при угрозе сдавления спинного мозга и поражении шейного отдела позвоночника.

Прогноз при миеломной болезни
Кроме возраста пациента и его физического состояния на прогнозе миеломы и продолжительности жизни отражается чувствительность опухоли к лекарственному лечению и биологические характеристики плазматических клеток, в частности генетические аномалии с делецией участков хромосом и амплификацией — удвоением генов.
Множественная миелома (ММ) характеризуется выраженной вариабельностью течения, прогноза и результатов терапии. До недавнего времени применение мелфалана в комбинации с преднизолоном (схема МП) было наиболее распространенным методом лечения. Однако у многих больных на фоне этой терапии не удается достичь состояния полной клини-ко-гематологической ремиссии в течение длительного периода.
В настоящее время наметилась тенденция к увеличению частоты и длительности ремиссии, общей продолжительности жизни на фоне интенсивной химиотерапии при множественной миеломе. В последние годы альтернативным методом лечения является использование различных протоколов полихимиотерапии и прежде всего схем VAD (винкристин, адриамицин, дексаметазон), комбинации идарубицина с дексаметазоном, VMCP (винкристин, мелфалан, циклофосфан, преднизолон), BVAP (кармустин, винкристин, адриамицин, преднизон), Dexa-BEAM (BCNU, этопозид, цитозар, мелфалан, дексаметазон) или первичной высокодозной терапии мелфаланом (60—100 мг/м2).
Особый интерес представляет моно- или комбинированная терапия принципиально новыми классами препаратов: ингибиторами диацетилазы гистонов, ангиогенеза (талидомид, леналидомид), протеасом (велькейд), индукторами апоптоза (триоксид арсения).
Положительное влияние этих программ уже доказано. Полученные многими авторами данные воспринимаются как достаточно убедительные для более широкого применения не только химиотерапии, но и трансплантации гемопоэтических стволовых клеток у больных множественной миеломой. В связи с этим рассматривается использование следующиих видов трансплантации гемопоэтических стволовых клеток : аутологичной, аллогенной от родственного и неродственного доноров, сингенной.
Это связано с более легкой доступностью гемопоэтических стволовых клеток из крови больных множественной миеломе, меньшей примесью злокачественных клеток и травматичностью при сборе трансплантата. Однако для получения аутотрансплантата ГСК важно добиться редукции количества плазматических клеток в костный мозг по крайней мере до 20 % от исходного уровня. При уровне плазматических клеток в костный мозг не более 20 % ауто-трансплантации гемопоэтических стволовых клеток может быть выполнена больным множественной миеломой на любом этапе лечения.
Больные с множественной миеломой наиболее часто являются кандидатами на проведение двойных (тандем) трансплантаций. Это связано с отсутствием данных о преимуществе однократной ауто-трансплантации гемопоэтических стволовых клеток по сравнению со стандартной химиотерапией при множественной миеломе.
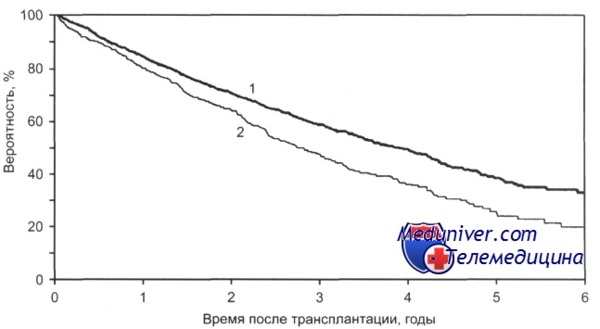
Общая выживаемость после ауто-ТГСК больных с множественной миеломой в зависимости от срока выполнения трансплантации с момента постановки диагноза.
1 — 18 мес и менее (n = 3277); 2 - более 18 мес (n = 1038); р = 0,0001.
Сравнивали эффективность стандартной и высокодозной цитостатической терапии с ауто-трансплантацией гемопоэтических стволовых клеток. Были получены следующие отдаленные результаты — достижение ПР и ПР + ЧР (частичная ремиссия) соответственно: после VAD — у 5 и 34 % больных, после однократной ауто-трансплантации гемопоэтических стволовых клеток — у 26 и 75 % больных, после тандема ауто-трансплантации гемопоэтических стволовых клеток —у 41 и 83 % больных.
Медиана общей и безрецидивной выживаемости после тандема ауто-трансплантации гемопоэтических стволовых клеток составила 68 и 43 мес, а 5-летняя общая и безрецидивная выживаемость были равны соответственно 58 и 42 %.
Общеизвестных критериев, определяющих показания к трансплантации гемопоэтических стволовых клеток при множественной миеломе, не существует. Принятие решения в пользу выполнения трансплантации гемопоэтических стволовых клеток во многом зависит от индивидуальных взглядов авторов, их опыта в этой области и наличия необходимых условий для проведения трансплантации гемопоэтических стволовых клеток.
Основными прогностическими факторами, влияющими на отдаленные результаты при выполнении трансплантации гемопоэтических стволовых клеток у больных с множественной миеломой, являются возраст, стадия болезни, повышенный уровень b2-микроглобулина в плазме крови и моче, повреждение функции почек, индекс Карновского, верификация цитогенетических нарушений, к которым относятся t(4;11), изменения в хромосомах 11q, -13 и 13q, гиподиплоидия.
Наиболее часто используемым режимом кондиционирования при ауто-трансплантации гемопоэтических стволовых клеток у больных с множественной миеломой является мелфалан в дозе 180—220 мг/м2, назначение которого предпочтительнее по сравнению с режимом кондиционирования тотальное облучение тела (ТОТ) + мелфалан.
По данным CIBMTR, 3-летняя общая выживаемость у больных с множественной миеломой при проведении ауто-трансплантации гемопоэтических стволовых клеток в первые 18 мес с момента постановки диагноза составила 55 %, в то время как после 18 мес — 43 %, однако эти показатели не имеют статистически достоверного различия.
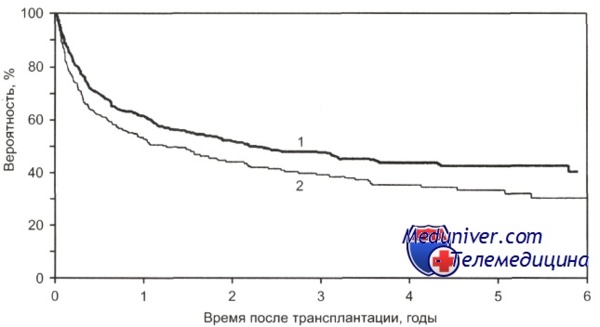
Общая выживаемость больных с множественной миеломой в зависимости от срока выполнения алло-ТГСК. от HLA-совместимого сиблинга с момента постановки диагноза.
1 — 18 мес и менее (n = 642);
2 — более 18 мес (n = 258); р = 0,0035.
Таким образом, несмотря на имеющиеся успехи в лечении больных множественной миеломой, достижение ПР при множественной миеломе до сих пор остается трудноразрешимой задачей. С этим связано стремление к совершенствованию методов терапии в первую очередь путем внедрения алло-ТГСК, несмотря на отсутствие в прошлом данных о преимуществе алло-ТГСК по сравнению с ауто-ТГСК у больных с множественной миеломой.
Вероятность достижения полной ремиссии может быть увеличена с 18 % после однократной ауто-трансплантации гемопоэтических стволовых клеток до 70 % у больных, получивших тандем ауто-трансплантации гемопоэтических стволовых клеток и алло-трансплантации гемопоэтических стволовых клеток с режимом кондиционирования с уменьшенной интенсивностью дозы от неродственного донора.
Для наиболее эффективного применения алло-трансплантации гемопоэтических стволовых клеток при множественной миеломе анализируют следующие факторы: миелоаблативные режимы кондиционирования против режимов кондиционирования с уменьшенной интенсивностью дозы, сроки проведения трансплантации (терапия первой линии или отсроченное выполнение).
Для профилактики развития рецидива после ауто-трансплантации гемопоэтических стволовых клеток возможно назначение иммуномодулирующей терапии: интерферон, талидомид, велькейд. В качестве адоптивной иммунотерапии больным множественной миеломой после алло-трансплантации гемопоэтических стволовых клеток вводят донорские лимфоциты, при этом достижение длительной ремиссии у значительного количества больных, вероятно, связано с инфузией CD4+-клеток.
Читайте также:

