Цитологическое исследование при лейкозе
Клинический анализ крови при остром лейкозе. У большинства больных острым лейкозом (ОЛ) на момент диагностики заболевания имеется нормохромная нормоцитарная анемия, в большей степени выраженная при остром миелобластном лейкозе. При развитии геморрагических осложнений может отмечаться гипохромия вследствие дефицита железа. Количество лейкоцитов периферической крови варьирует в очень широких пределах (от 1 • 10 9 /л до 200 • 10 9 /л), но чаще остается на сублейкемическом уровне и не превышает 20-30 • 10 9 /л.
У 20% пациентов количество бластных клеток превышает 50 • 109/л, а у 10% бласты в периферической крови отсутствуют (при этом обычно отмечаются панцитопения и относительный лимфоцитоз). При уровне лейкоцитов выше 100 • 10 9 /л резко повышается риск развития лейкостатических осложнений (неврологические нарушения, острый респираторный дистресс-синдром, у мужчин, кроме того, приапизм).
Тромбоцитопения выявляется у подавляющего числа больных острым лейкозом и более выражена при остром миелобластном лейкозе (ОМЛ) (у половины больных число тромбоцитов менее 50 • 10 9 /л). В то же время у 1-2% пациентов отмечается тромбоцитоз (более 400 • 10 9 /л).
У части больных может отмечаться увеличение протромбинового и парциального тромбопластинового времени; при остром промиелоцитарном лейкозе часто наблюдается снижение уровня фибриногена и другие признаки синдрома ДВС. Следует отметить, что развитие синдрома ДВС возможно при любом варианте острого лейкоза.
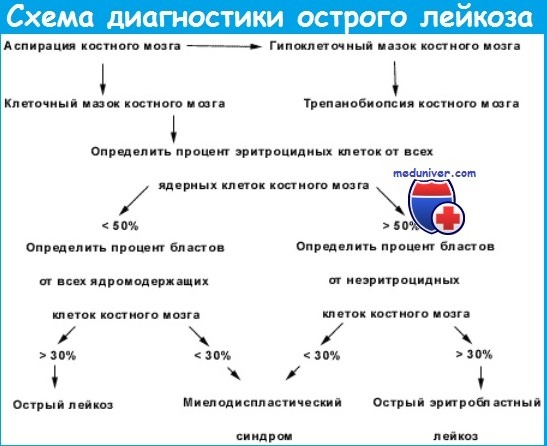
Миелограмма при остром лейкозе. Исследование аспирата костного мозга необходимо для диагностики и установления варианта острого лейкоза. Количество миелокариоцитов обычно повышено, мегакариоциты отсутствуют или их количество снижено. При подсчете миелограммы выявляется не менее 20% бластов, сужение нормальных ростков гемопоэза. Для верификации варианта острого лейкоза необходимо проведение цитохимических, иммунологических и цитогенетических исследований, результаты которых имеют прогностическое значение и позволяют планировать лечебную тактику.
Цитологическое исследование спинномозговой жидкости при остром лейкозе выполняется у всех больных острым лейкозом до начала лечения. При отсутствии патологии при остром лимфобластном лейкозе, миеломонобластных и монобластных острых лейкозов в дальнейшем проводится профилактика нейролейкоза. При развитии нейролейкоза проводят его лечение, результаты которого оцениваются на основании анализа клеточного состава спинномозговой жидкости.
Биохимические исследования при остром лейкозе. В большинстве случаев биохимические показатели находятся в пределах нормальных величин, однако при отдельных вариантах острого лейкоза (ОЛЛ, монобластный лейкоз) может отмечаться нарушение функции почек (повышение уровня креатинина) вследствие их инфильтрации опухолевыми клетками. Специфическая инфильтрация почек и/или их увеличение могут быть документированы с помощью УЗИ или компьютерной томографии. В ряде случаев (при остром лейкозе с гиперлейкоцитозом, острый лимфобластный лейкоз с органомегалией) уже в дебюте заболевания выявляется синдром лизиса опухоли.
Чаще, однако, этот синдром наблюдается при быстром лизисе клеток на фоне химиотерапии и характеризуется гипокальциемией, гиперкалиемией, повышением уровня ЛДГ и гиперурикемией с развитием почечной недостаточности.
Инструментальные исследования при остром лейкозе не имеют решающего значения при остром лейкозе, однако их результаты могут влиять на характер проводимого лечения и прогноз заболевания. Так, рентгенография органов грудной клетки позволяет выявить увеличение лимфатических узлов средостения, пневмонию; электрокардиография — нарушения ритма и/или проводимости, обусловленные специфической инфильтрацией миокарда, антрациклиновой кардиомиопатией и т. д.
Казалось бы, о состоянии системы крови можно и нужно судить по общему анализу – с детства известной рутинной медицинской процедуре. Но на самом деле, данные этого анализа — отражение процессов, происходящих в кроветворной системе, и ее главном органе – костном мозге. Поэтому при подозрении на болезнь кроветворной системы анализируют состояние костного мозга. Пункция костного мозга – это вмешательство, которое позволяет получить 0,5-1мл. этой субстанции для дальнейшего исследования.
Что такое костный мозг и зачем его изучают?
Красный костный мозг находится в плоских костях – ребрах, грудине, позвонках, костях черепа и таза – и в эпифизах (концевых частях) трубчатых костей. Он состоит из двух типов клеток – стромы, или, говоря простым языком, основной структуры, и кроветворных ростков из которых, собственно, и формируются форменные элементы: эритроциты, лейкоциты и тромбоциты.

Все элементы крови развиваются из одинаковых стволовых клеток-предшественников. Созревая (в медицине этот процесс называется дифференцировкой), клетки формируют два ростка кроветворения: лимфоидный, из которого потом созревают лимфоциты и миелоидный, создающий остальные форменные элементы. Незрелые клетки крови называются бластами. Обычно 90% всех стволовых клеток находятся в состоянии покоя.
В организме взрослого мужчины в сутки созревает 300г. форменных элементов крови, то есть 9 кг за год и около 7 тонн за 70 лет жизни. Новые клетки формируются взамен состарившихся или погибших по другим причинам (например, в борьбе с инфекциями).
В норме количество вновь созревших клеток строго равно числу погибших. При гемобластозах (лейкозах) клетки кроветворного ростка мутируют, перестают реагировать на регуляторные сигналы организма, и начинают бесконтрольно делиться. Если активность этого процесса настолько велика, что вновь сформированные клетки не успевают созреть, лейкоз называется острым. Если преобладают зрелые формы – хроническим.
Прежде чем выйти в кровоток, измененные лейкозные клетки накапливаются в красном костном мозге. И только инфильтрировав (заполонив) его, поступают сосуды. Изменения в анализе крови далеко не всегда соответствуют происходящему в костном мозге: на некоторых стадиях развития лейкоза количество форменных элементов в крови может не только не увеличиваться, но и уменьшаться.
Именно по этим причинам пункцию костного мозга и миелограммы выполняют при подозрении на любые болезни кроветворной системы.
Как и для чего выполняют пункцию костного мозга?
Чтобы получить материал для исследования, нужно проткнуть (пунктировать) кость там, где она находится близко к коже. В зависимости от возраста (а количество костного мозга в разных анатомических структурах изменяется со временем), это могут быть:
- у детей младше 2 лет – пяточная или большеберцовая кость;
- у детей старшего возраста – гребень подвздошной кости;
- у взрослых – грудина или гребень подвздошной кости.
Прокол делают специальной иглой с ограничителем – иглой Кассирского. 
Она может выглядеть по-разному. Но суть в том, что ограничитель позволяет зафиксировать глубину прокола.
Иногда полученный материал бывает неинформативен. Тогда (и при некоторых других показаниях) делается трепанобиопсия – метод, при котором специальной толстой иглой одним блоком забирают не только красный костный мозг, но и участок костного фрагмента над ним. Такую биопсию обычно делают в области гребня подвздошной кости.

Место прокола закрывается стерильной повязкой или пластырем. Боль может беспокоить и некоторое время после процедуры. Если нет противопоказаний, можно принять обезболивающие. Место прокола нельзя мочить в течение суток, соответственно, не рекомендуют принимать душ или ванну. Какого-то дополнительного ухода после пункции костного мозга не требуется.
Процедура эта безопасна, единственное абсолютное противопоказание – тяжелые нарушения свертывающей системы крови, когда любая травма приводит к обширным гематомам. Относительные противопоказания (когда сравнивают возможную пользу и вред), это:
- острый инфаркт миокарда;
- декомпенсированная сердечнососудистая патология;
- декомпенсированный сахарный диабет;
- гнойные поражения кожи в области предполагаемой пункции.
- кровотечение;
- инфицирование;
- аллергия – при непереносимости обезболивающих средств;
- сквозной прокол грудины, перелом (если пункция выполняется из грудины).
Вероятность осложнений невелика – по данным Британского общества гематологов за время с 1995 по 2001 год на 54890 проведенных пункций пришлось 26 осложнений разной степени тяжести.
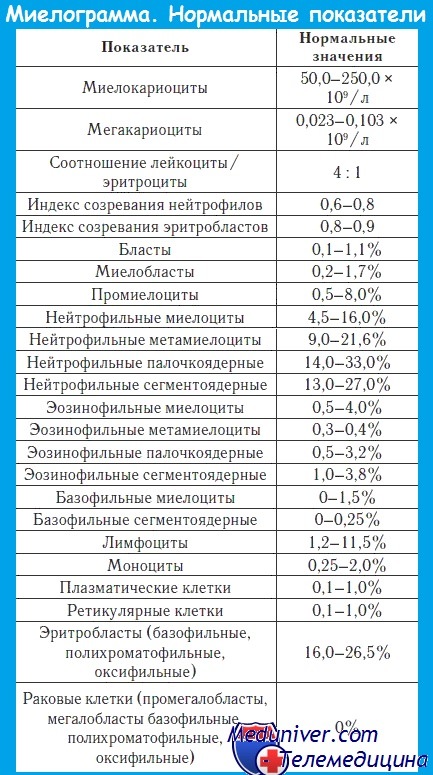
Расшифровка и оценка результатов: миелограмма.
В первую очередь, в счетной камере подсчитываются мегакариоциты и миелокариоциты.
Мегакариоциты – это крупные клетки с большими ядрами, предшественники тромбоцитов. Их должно быть более 20, но менее 50 в 1 мкл.
Далее в окрашенных мазках подсчитывают процентные соотношения клеток различных рядов кроветворения. Полученный результат называется миелограммой.

Чтобы оценить по миелограмме качество костного мозга, важно знать не только процентное и количественное содержание гемопоэтических (кроветворных) элементов, но и их соотношение. Вот расшифровка некоторых показателей.
Высчитывается по формуле: (Промиелоциты + миелоциты + метамиелоциты) / (Палочкоядерные + сегментоядерные нейтрофилы). Нормальное значение 0,6 – 0,8.
Формула расчета: (Полихроматофильные + оксифильные нормобласты) / (Все ядросодержащие клетки красного ростка этого пунктата). Норма 0.8 – 0.9 и снижение индекса говорит о чрезмерно медленном наполнении гемоглобином эритроцитов (например, при железодефицитной анемии).
Как и у любого инструментального исследования, референсные значения (нормы) миелограммы могут изменяться в зависимости от лаборатории и используемых аппаратов.
Особенности миелограммы при лейкозах.
Как при остром, так и при хроническом лейкозе усиленный рост патологических клеток сопровождается уменьшением количества эритроцитов и тромбоцитов на всех стадиях созревания.
Если в миелограмме видны признаки лейкоза, пунктат костного мозга дополнительно проходит иммуногистохимическое, цитохимическое и генотипическое исследования – они нужны чтобы определить характерные особенности мутации опухолевого клона. Это важно для выбора схемы лечения конкретного пациента.
Медицинский эксперт статьи

Диагноз острого лимфобластного лейкоза ставят на основании данных анамнеза, физикального обследования и лабораторных исследований.
Общий анализ крови: количество лейкоцитов может быть нормальным, сниженным или повышенным; часто, хотя и не всегда, обнаруживают бластные клетки; характерны гипорегенераторная нормохромная анемия и тромбоцитопения.
Биохимический анализ крови: характерно повышение активности ЛДГ; определяют также показатели функций почек и печени.
Миелограмма: костномозговую пункцию необходимо проводить минимум из двух точек (у детей до 2 лет это пяточные кости или бугристости большеберцовых костей, у детей старшего возраста - задние и передние ости подвздошных костей) для забора достаточного количества диагностического материала. Забор материала желательно проводить под общей анестезией. Необходимо сделать 8-10 мазков из каждой точки, а также собрать материал для иммунофенотипирования, цитогенетического и молекулярно-генетического исследований.
Спинномозговая пункция - обязательное диагностическое мероприятие, проводимое специалистом в условиях седации и при наличии в периферической крови тромбоцитов в количестве не менее 30 000 в мкл (при необходимости перед пункцией проводят трансфузии тромбоцитарной массы). Для приготовления цитопрепарата необходимо не менее 2 мл спинномозговой жидкости.
Желательно (а при наличии неврологической симптоматики - обязательно) проведение КТ головного мозга.
Ультразвуковое исследование позволяет определить размеры инфильтрированных паренхиматозных органов и увеличенных лимфатических узлов брюшной полости, малого таза и забрюшинного пространства, размеры и структуру яичек.
Рентгенография грудной клетки позволяет обнаружить увеличение средостения, выпотной плеврит. Рентгенографию костей и суставов выполняют по показаниям.
Чтобы уточнить диагноз и исключить поражения сердца, проводят электрокардиографию и эхокардиографию. Показаны консультации окулиста, оториноларинголога (осмотр глазного дна, придаточных пазух носа).
Специальные методы диагностики
Диагностика острого лимфобластного лейкоза основана на оценке опухолевого субстрата - костного мозга, ликвора.
Цитологическое исследование костного мозга позволяет обнаружить гиперклеточность, сужение ростков нормального кроветворения и инфильтрацию властными клетками - от 25% до тотального замещения костного мозга опухолью.
Морфологическое сходство злокачественных лимфобластов и нормальных клеток-предшественников требует определения процентного соотношения лимфобластов в мазках костного мозга, окрашенных по Романовскому-Гимзе. Морфологическая классификация острого лимфобластного лейкоза, согласно критериям группы FAB (Франко-Американо-Британская кооперативная группа), предусматривает на основании определения размеров, строения ядра, наличия включений и других признаков подразделение бластов на группы L1, L2 и L3 Более 90% случаев острого лимфобластного лейкоза у детей относят к варианту L1, 5-15% - к L2, менее 1% - к L3. В настоящее время острый лейкоз со зрелым В-фенотипом (L3) относят к группе неходжкинских лимфом (в данном разделе этот вариант не рассматривается).
Цитохимическое исследование - следующий обязательный этап диагностики. С помощью цитохимического окрашивания выявляют принадлежность клеток к определённой линии дифференцировки. Обязательно используют окрашивание на миелопероксидазу (реакция клеток, принадлежащих к лимфоидной линии дифференцировки, отрицательна). ШИК-реакция на гликоген помогает дифференцировать лимфоидные бласты вследствие характерного гранулярного окрашивания цитоплазмы. Окраска Суданом чёрным положительна в миелоидных клетках с типичным расположением гранул. Кислую фосфатазу обнаруживают при Т-клеточном лейкозе.
Иммунофенотипирование - одно из основных исследований, определяющее клеточную принадлежность бластной популяции и прогноз заболевания. Специфические поверхностные и цитоплазматические антигены Т- и В-лимфоцитов используют в качестве маркёров для идентификации, определения происхождения и стадии дифференцировки лимфоидных клеток. Использование панели моноклональных антител к кластерам дифференцировки и определение процентного соотношения их экспрессии в властной популяции позволяет указать, к Т- или В-линии относится лейкемический клон у данного больного. На результатах иммунофенотипирования властных клеток, согласно современной классификации, основан диагноз острый лимфобластный лейкоз.
Цитогенетические и молекулярно-генетические методы в последние годы широко применяют для изучения лейкемических клеток. Методы позволяют оценить состояние хромосомного аппарата - количество хромосом и их структурные изменения (транслокации, инверсии, делеции). Цитогенетические аномалии и ДНК-индекс (соотношение количества ДНК в лейкемических клетках и в клетках с нормальным диплоидным кариотипом) - значимые прогностические факторы. Выявление клональных аномалий, характерных для клеток опухоли данного пациента, позволяет отслеживать количество этих клеток в динамике заболевания на молекулярно-генетическом уровне и определять минимальную резидуальную клеточную популяцию. Идентификация и молекулярная характеристика генов, регуляция или функция которых может быть повреждена в результате хромосомных изменений, способствует пониманию молекулярных основ злокачественной трансформации.
Важный прогностический фактор - оценка минимальной резидуальной болезни. то есть оценка количества остаточных лейкемических клеток у пациента в ремиссии. Техника выявления минимальной резидуальной болезни заключена в определении клеток с аномалиями кариотипа с помощью цитогенетических методов (можно обнаружить одну аномальную клетку на 100 нормальных) или полимеразной цепной реакции (ПЦР позволяет обнаружить одну патологическую клетку из 10 5 нормальных). Очень чувствительный метод - проточная цитофлюориметрия, позволяющая обнаружить клетки с аномальным иммунофенотипом. Высокий уровень минимальной резидуальной болезни после индукции ремиссии или перед поддерживающей терапией коррелирует с плохим прогнозом.
Прогностические факторы исхода терапии острого лимфобластного лейкоза
Алло-ТГСК – трансплантация аллогенных гемопоэтических стволовых клеток
Ауто-ТГСК – трансплантация аутологичных гемопоэтических стволовых клеток
АЧТВ – активированное частичное тромбопластиновое время
БРВ – безрецидивная выживаемость
ВКЛ – волосатоклеточный лейкоз
ВОЗ классификация – классификация Всемирной организации здравоохранения
Г-КСФ – гранулоцитарный колониестимулирующий фактор
ИТ – индукционная терапия
ИТК – тирозинкиназный ингибитор
КИ – клинические исследования
КМ – костный мозг
КТ – компьютерная томография
ЛБ – лимфома Беркитта
ЛБЛ – лимфобластная лимфома
МОБ – минимальная остаточная болезнь
НХЛ – неходжкинские лимфомы
ОАК – общий (клинический) анализ крови
ОВ – общая выживаемость
ОЛ – острый лейкоз
ОЛЛ – острый лимфобластный лейкоз
ОМЛ – острый миелоидный лейкоз
ОРДС – острый респираторный дистресс-синдром
ОТ-ПЦР – полимеразная цепная реакция с обратной транскрипцией
ПР – полная ремиссия
ПЦР – полимеразная цепная реакция
ПЭТ/КТ – позитронно-эмиссионная компьютерная томография
ТГСК – трансплантация гемопоэтических стволовых клеток
УДД – уровень достоверности доказательств
УЗИ – ультразвуковое исследование
УУР – уровень убедительности рекомендаций
ХМЛ – хронический миелолейкоз
ЦНС – центральная нервная система
CD – кластер дифференцировки
ECOG (Eastern Cooperative Oncology Group status) – шкала оценки состояния пациента по критериям Восточной кооперативной онкологической группы
EWALL – Европейская исследовательская группа по изучению острого лимфобластного лейкоза
FISH-исследование – исследование методом флуоресцентной гибридизации in situ
GMALL – Немецкая исследовательская группа по изучению острого лимфобластного лейкоза
GRAALL – Французская исследовательская группа по изучению острого лимфобластного лейкоза
MD Anderson CRC – Американская исследовательская группа онкологического научного центра имени М.Д. Андерсона
Ph+ ОЛЛ или Ph-позитивный ОЛЛ – острый лимфобластный лейкоз, при котором определеяется транслокация t(9;22)
Ph– ОЛЛ или Ph-негативный ОЛЛ – острый лимфобластный лейкоз, при котором не обнаруживается транслокация t(9;22)
RALL – Российская исследовательская группа по лечению острого лимфолейкоза у взрослых
TdT – терминальная дезоксинуклеотидилтрансфераза
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
1. 2020 Клинические рекомендации "Острые лимфобластные лейкозы" (Общероссийский национальный союз "Ассоциация онкологов России"; Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество").
Определение
Острые лимфобластные лейкозы (далее – ОЛЛ)/острые лимфобластные лимфомы (ЛБЛ) – это гетерогенная группа злокачественных клональных заболеваний системы крови, происходящих из клеток-предшественниц гемопоэза преимущественно лимфоидной направленности дифференцировки и характеризующиеся чаще всего исходным поражением костного мозга (далее – КМ), вытеснением нормального кроветворения и вовлечением в процесс различных органов и систем организма (центральная нервная система (далее – ЦНС), яички, лимфатическая ткань любой локализации), а также возможностью исходного поражения органов лимфатической ткани без вовлечения КМ.
Терминология
Острые лимфобластные лейкозы – это гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации в Т- или В-клетках-предшественницах.
Ph-негативные острые лимфобластные лейкозы – это группа, объединяющая несколько подтипов острых лимфобластных лейкозов, при которых не обнаруживается филадельфийская хромосома (Ph-t(9;22)). В нее включены все В-клеточные и Т-клеточные острые лимфобластные лейкозы и лимфобластные лимфомы.
Ph-позитивный острый лимфобластный лейкоз – это вариант острого лимфобластного лейкоза, при котором методом стандартного цитогенетического исследования (G-banding) или методом FISH определяется транслокация t (9;22). Диагноз Ph-позитивного острого лимфобластного лейкоза не может быть основан только на методе молекулярной детекции химерного транскрипта. Цитогенетическое или FISH (метод флуоресцентной гибридизации in situ) исследования являются обязательными. Методом полимеразной цепной реакции определяется вариант химерного транскрипта, который в дальнейшем используется для мониторинга минимальной остаточной болезни.
Полная ремиссия – это состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается 5% и менее бластных клеток при нормальном соотношении всех ростков кроветворения, при количестве нейтрофилов в периферической крови более 1,0×10 9 /л, при количестве тромбоцитов более или равном 100×10 9 /л, при отсутствии экстрамедуллярных очагов лейкемического роста. Констатация морфологически полной ремиссии (соответственно, оценка резистентности) осуществляется либо после первой фазы индукционной терапии, либо после второй. При отсутствии полной ремиссии после завершения двух этапов индукционной терапии регистрируется рефрактерная форма острого лимфобластного лейкоза. В этой связи необходимо подчеркнуть, что у ряда пациентов после завершения второй фазы индукционной терапии на фоне восстановления кроветворения после цитостатического воздействия в ранние сроки после его завершения может определяться увеличенный процент бластных клеток (до 10–12 %). В этом случае (особенно если полная ремиссия была зафиксирована после первой фазы индукционной терапии) через неделю на фоне восстановленного кроветворения целесообразно выполнить повторную стернальную пункцию.
Полная ремиссия подразделяется на три основных типа: 1) цитогенетическая, 2) молекулярная, 3) с неполным восстановлением показателей периферической крови, когда число нейтрофилов менее 1×10 9 /л, а тромбоцитов менее 10×10 9 /л. Последняя категория оговаривается специально, поскольку, по ряду данных, прогноз у таких пациентов несколько хуже. При этом эксперты не рекомендуют констатировать у таких пациентов полную ремиссию. Тем не менее вне клинических исследований эту формулировку ответа применяют редко.
Частичная ремиссия (частичный ответ) – этот термин рекомендуют использовать только в клинических исследованиях I–II фазы, оценивающих противоопухолевую эффективность, токсичность, переносимость новых препаратов и определяющих оптимальные дозы этих препаратов.
Резистентная форма – эта форма заболевания, которая констатируется при отсутствии полной ремиссии после завершения двух фаз индукционной терапии.
Рецидив – это состояние констатируется при обнаружении в пунктате костного мозга более 5 % бластных клеток. Рецидив заболевания не констатируется при обнаружении в очередном контрольном пунктате костного мозга более 5 % бластных клеток, но менее 10 %, в тех случаях, когда пункция костного мозга производится в ранние сроки после курса химиотерапии или использовались ростовые гемопоэтические факторы с целью сокращения периода нейтропении, при этом анализ периферической крови нормальный и отсутствуют экстрамедуллярные поражения. Вторая диагностическая пункция осуществляется через 7–10 дней после первой. Если сохраняется процент бластных клеток выше 5 или отмечается их увеличение (например, с 7 до 13 %), то констатируется рецидив.
Ранний рецидив – эта форма рецидива называется в том случае, если он регистрируется раньше, чем через полгода от момента окончания поддерживающей терапии или на терапии после достижения ремиссии. Поздним считается тот рецидив, который возникает через полгода и более от окончания поддерживающей терапии. Рецидивом также является и внекостномозговое поражение (нейролейкемия, поражение яичек, увеличение селезенки и т. д.) даже при отсутствии изменений в крови и костном мозге. Внекостномозговые рецидивы (особенно поражение центральной нервной системы) при использовании современных протоколов лечения встречаются приблизительно в 4–8 % случаев. Если констатирован изолированный внекостномозговой рецидив, то, кроме локальной терапии (лечение нейролейкемии, облучение/удаление яичка, удаление лейкемического очага в яичнике и т. д.), обязательно проведение и системной индукционной терапии по протоколам, предусмотренным для таких рецидивов.
Минимальная остаточная болезнь, или минимальная резидуальная болезнь – это небольшая популяция опухолевых клеток, которая не может быть зафиксирована с помощью светового микроскопа, но обнаруживается более тонкими методами исследования, выявляющими 1 лейкемическую клетку на 10 4–6 исследуемых. Основными методами детекции минимальной остаточной болезни являются проточная цитометрия и полимеразная цепная реакция. Методы стандартного цитогенетического исследования и метод FISH не используются в целях оценки минимальной остаточной болезни.
Цитогенетическая ремиссия – это полная клинико-гематологическая ремиссия, при этом методами стандартной цитогенетики не выявляются исходные аномалии кариотипа; кариотип должен быть нормальным, а число проанализированных метафаз должно составлять не менее 20. Цитогенетическая ремиссия – новое понятие, появившееся при регулярном использовании методов цитогенетики для исследований пунктатов костного мозга в период полной ремиссии.
Цитогенетический рецидив – это рецидив, который констатируется при наличии в пунктате костного мозга митозов с хромосомными аберрациями, которые обнаружены в дебюте заболевания на фоне сохраняющейся клинико-гематологической ремиссии.
Молекулярная ремиссия – это полная клинико-гематологическая ремиссия при отсутствии в костном мозге исходно определявшихся методом полимеразной цепной реакции молекулярных маркеров острого лейкоза с чувствительностью метода 10 –4 . Это также новое понятие, ставшее в настоящее время ключевым. Следует отметить, что может быть достигнута цитогенетическая ремиссия, но при этом молекулярные маркеры могут еще определяться.
Молекулярный рецидив – это появление исходно определявшихся молекулярных маркеров острых лейкозов в двух повторных анализах (проведенных с коротким интервалом времени) на фоне сохраняющейся клинико-гематологической ремиссии.
Важным и одним из самых точных способов оценки эффективности терапии острых лейкозов являются применение статистических методов и построение кривых выживаемости пациентов, которым проводили то или иное лечение. Чаще всего оценивают общую, безрецидивную, бессобытийную выживаемость и вероятность сохранения полной ремиссии (или обратное понятие – вероятность развития рецидива).
Общая выживаемость. Для оценки общей выживаемости анализируют временные параметры всех пациентов, включенных в исследование. Точкой отсчета является день начала терапии. Событием считается только смерть пациента от любой причины (ранняя летальность, смерть в период ремиссии от любой причины, смерть в период рецидива). Событие на кривой выживаемости графически отображается ступенькой, идущей вниз. Пациентов, живых во время проведения анализа, расценивают как случай и отмечают на кривой черточкой, т. е. цензурируют. Пациентов, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы. Больных, отказавшихся от лечения, цензурируют в день отказа от терапии.
Безрецидивная выживаемость. При оценке безрецидивной выживаемости учитывают данные только тех пациентов, у которых была достигнута полная ремиссия. Точкой отсчета считается дата достижения полной ремиссии. Событиями считаются рецидив или смерть от любой причины (в период консолидации или поддерживающего лечения, от рецидива, в период ремиссии от другой причины, например, суицида). Цензурируют только тех пациентов, которые были живы и находились в полной ремиссии в момент проведения анализа. Больных, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия, но они отказались от лечения в ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии (обратное от вероятности развития рецидива). При оценке вероятности сохранения полной ремиссии учитываются данные только тех пациентов, у которых достигнута полная ремиссия. При этом точкой отсчета служит дата достижения полной ремиссии. Событием считается только рецидив заболевания. Цензурируют всех больных, кто жив в полной ремиссии в момент проведения анализа. Пациенты, умершие в период полной ремиссии от осложнений, связанных с лечением, или от других причин, цензурируют в день смерти, как больных, находившихся в полной ремиссии. Пациентов, судьба которых неизвестна, цензурируют на тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия и которые отказались от лечения в период ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии является тем показателем, который позволяет оценивать истинную противоопухолевую эффективность какой-либо терапии без учета таких субъективных моментов, как выхаживание пациентов от осложнений, связанных с самим лечением.
Бессобытийная выживаемость. Этот показатель оценивает выживаемость всех больных, включенных в анализ, с момента начала терапии. Событием считается ранняя летальность, факт недостижения полной ремиссии через два месяца от начала лечения, смерть в период ремиссии от осложнений химиотерапии или других причин, а также рецидив заболевания. Цензурируют только пациентов, у которых была достигнута полная ремиссия в течение первых двух курсов химиотерапии, и они остаются живыми, сохраняя полную ремиссию, на момент проведения анализа.
Индукция – это период начального лечения, целью которого является максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии, называется периодом индукции (обычно 1–2 курса). Именно в этот период на фоне применения цитостатических средств количество лейкемических клеток в костном мозге уменьшается примерно в 100 раз, т. е. в момент констатации полной ремиссии в костном мозге морфологически определяется менее 5 % опухолевых клеток.
Консолидация. Второй этап терапии острых лейкозов – закрепление достигнутого противоопухолевого эффекта (разное количество, в зависимости от протокола). Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
Поддерживающее лечение – это продолжение цитостатического воздействия в меньших дозах, чем в период индукции ремиссии, на возможно остающийся опухолевый клон.
Лейкоз/лимфома Беркитта – это высокоагрессивное лимфопролиферативное заболевание из иммунологически зрелых В-клеток с преимущественно экстранодальной локализацией. Клинически выделяют 3 варианта лимфомы Беркитта: эндемический, спорадический и ВИЧ-ассоциированный.
Эндемический вариант лимфомы Беркитта – это вариант лимфомы Беркитта характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант лимфомы Беркитта – это типичная лимфома Беркитта по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант лимфомы Беркитта – это лимфома Беркитта, возникающая на фоне иммунодефицитных состояний (у пациентов с ВИЧ-инфекцией, после трансплантации органов, у пациентов с первичными иммунодефицитами). Чаще всего встречается у ВИЧ- инфицированных пациентов, причем на ранних этапах развития (до снижения CD 4+ -клеток).
Читайте также:

