Что в таблице менделеева перед хлором
Основное минеральное вещество, содержащееся в мясе
17-е место в химическом сообществе (хлор)
17-й "подопечный" Менделеева (хлор)
17-й в таблице химическ. элементов (хлор)
17-й в химической таблице (хлор)
17-й в череде химических элементов (хлор)
17-й обитатель периодическ. таблицы (хлор)
17-й по счёту химический элемент (хлор)
17-й среди химических элементов (хлор)
17-й химический элемент (хлор)
17-я графа химических элементов (хлор)
Бассейновый галоген (хлор)
В химич. таблице он стоит 17-м (хлор)
Враг микробов (хлор)
Газ Карла Шееле (хлор)
Газ отбеливателей (хлор)
Газ, чье присутствие в воздухе не только отбивает аппетит, но и поражает бронхи (хлор)
Галоген из таблицы (хлор)
Галоген уборщицы (хлор)
Галоген, Cl (хлор)
Галогеновый газ (хлор)
Добавка в бассейн (хлор)
Его главные минералы: галит, сильвин и бишофит (хлор)
Его масса равна 35, 5, а название его означает "желто-зеленый" (хлор)
Запах боёв у Ипра (хлор)
Им пахнет больничная сантехника (хлор)
Между серой и аргоном (хлор)
Очищает воду (хлор)
Перед аргоном в таблице (хлор)
Санитарный элемент (хлор)
Семнадцатый элемент (хлор)
Следом за серой в таблице (хлор)
Соль это натрий и . (хлор)
Химическ. элемент по "фамилии" Cl (хлор)
Химическ. элемент с кодовым именем Cl (хлор)
Химический элемент по "фамилии" Cl (хлор)
Химический элемент с кодовым именем Cl (хлор)
Химический элемент, Cl (хлор)
Что за химический элемент Cl ? (хлор)
Этот элемент занимает по распространенности третье место в морской воде - после кислорода и водорода (хлор)
санитарный галоген (хлор)
"Зеленый" среди галогенов (хлор)
17 в таблице Менделеева (хлор)
враг бактерий (хлор)
газ с удушливым запахом (хлор)
газ, открытый шведским аптекарем Карлом Шееле (хлор)
галоген в воде (хлор)
галоген с символом Cl (хлор)
галоген, чтобы чистить бассейн (хлор)
добавка к извести для дезинфекции (хлор)
каким газом, кроме фосгена, российский химик Николай Зеленский наполнил комнату, чтобы испытать противогаз собственной конструкции (хлор)
м. греч. одно из химических начал, основ, в поваренной соли. Хлоральгидрат, получается при действии хлора на безводный спирт, кристаллизованное вешество; употр. как усыпляющее средство (Наумов). Хлоровый газ. Хлорные соли. кислота, высшая, четвертая степень окисленья. Хлористая кислота, вторая степень; хлорноватая, первая. Хлороводородный и хлористоводородный, состоящий из хлора и водорода. Хлорит, зеленоватое ископаемое, частью похожее на слюду. Хлоритовый сланец. Хлорофан м. ископаемое, видоизмененье плавика. Хлороформ, жидкость, добываемая действием хлориновой извести на спирту (Наумов) (хлор)
один из химических элементов, делающих наш суп соленым (хлор)
открыли вместо мурия (хлор)
первый боевой отравляющий газ (хлор)
санитарный элемент (хим.) (хлор)
семнадцатый газ (хлор)
химический элемент (хлор)
химический элемент с позывным Cl (хлор)
химический элемент, в изобилии присутствующий в общественных туалетах (хлор)
химический элемент, газ желто-зеленого цвета с резким запахом (хлор)
химический элемент, удушливый газ (хлор)
элемент №1 для санитарии (хлор)
ядовитый газ желто-зеленого цвета, галоген (хлор)
ядовитый галоген (хлор)
Какой химический элемент (атомный номер 17) обозначается символом Cl (хлор)
Трактат о сжигание этого газа опубликовал в 1821 году великий физик Майкл Фарадей (хлор)
Хим. элемент, галоген (хлор)
Химический элемент с атомной массой 35 (хлор)
Химический элемент, удушливый газ, употребляющийся в технике, санитарии и т. п. как отравляющее или обеззараживающее средство (хлор)
Элемент главной подгруппы седьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 17. Обозначается символом Cl . Химически активный неметалл. Входит в группу галогенов (хлор)
Химический элемент VII группы периодической системы Менделеева, галоген (хлор)
(c) База Бушмена: ответы на сканворды и кроссворды 2020
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.

Периодическая система химических элементов Д. И. Менделеева
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.

Элементы таблицы Менделеева
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
![]()
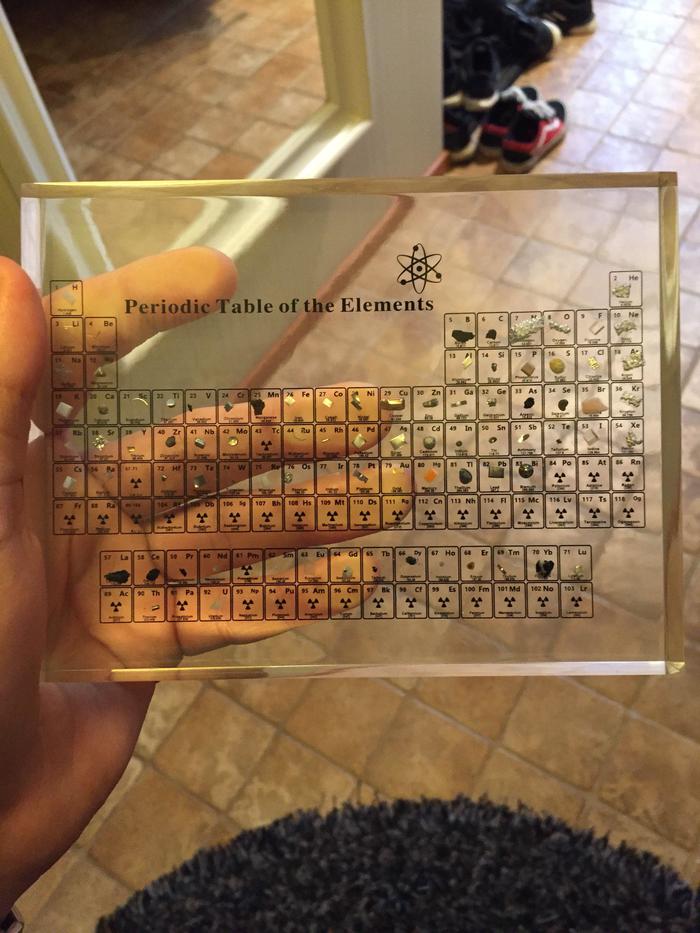
че у них газы твердые?
В смысле "газы". Любое вещество имеет агрегатное состояние "газ". Их четыре какбэ - твердое, жидкое, газообразное, плазма.
Газы у них твердые. *facepalm*
Боюсь представить, что будет когда пойдет плазма.
А она пойдёт. После ведра крылышек из KFC
Ну, к примеру, неон (Ne) замерзает примерно при -248 градусах. Здесь приведено твердое вещество. Не хранят же эту таблицу при такой температуре?
Так что суть вопроса предыдущего оратора состояла в том, что не понятно, почему вещества, которые в нормальных условиях являются газами, здесь представлены в твердом состоянии
У кислорода, водорода, азота, гелия, неона. - я вижу "пузырьки" внутри "стекла" на фото, а не твердое состояние.
А вообще я думаю здесь нет самих элементов, как это преподносится постом, а только их изображение.
Почему тогда радиоактивных элементов нет
Потому что это прототип/макет как вариант, для краундфандинга. Хз.
Да хер с ним гадать
Она уже давно в продаже и элементы там объемные

Ссылку то можно, если давно в продаже.
Я сомневаюсь что там вообще те элементы внутри, что должны быть, начнем с этого.
Мы говорим не о качестве подделки, а то, что вы высмеяли человека, который задал вполне правильный вопрос, почему у них в таблице газы в твердом состоянии.
Потому что "газ" - это не "тип" элемента. Я написал лишь об этом, что такое "газы". "Твердые газы" - это оксюморон.
Я кроме этого ничего и не написал.
"че у них газы твердые?" - это бред, а не вопрос.
Да не бред, всё же вполне понятно в контексте обсуждения: а почему вещества, которые в н.у. находятся в виде газов, в таблице представлены в твердом агрегатном состоянии?
Потому что они там представлены в виде пузырьков внутри стекла, а не в твердом агрегатном состоянии.



Я уже писал, что это либо макет, либо тупо фотошоп, в любом случае никаких элементов там нет. Но стилизовано имхо именно под "пузырьки".
Что такое газ? Как может быть "твердый газ" если это два разных агрегатных состояния? Дальше разжевывать или и так поймете о чем я написал до этого?
Каждому что-ли отвечать. "газы твердые". Как блеать газы могут быть твердые? Что это за вопрос? Хлор - это газ? НЕТ. Газ это НЕ ТИП ВЕЩЕСТВА, а его агрегатное состояние. Что значит "твердые газы".
Я написал лишь о том, что подобное выражение - оксюморон, оно не имеет смысла. То, что в "нормальных условиях" хлор является газом - не делает его "газом", это значит лишь то, что он в "нормальных условиях" - представлен в газообразном состоянии. И если соблюсти условия при которых хлор станет твердым, он не станет "твердым газом", он станет "хлором в твердом агрегатном состоянии".
Я не про то, что он на фото может быть в твердом состоянии - нет конечно. Я про саму постановку вопроса.
А про фото я вообще думаю, что это либо макет, либо вообще фотошоп. И никаких элементов реальных там нет, как это преподносится постом.
Да он не про это. Он про то, что газ - это газ. Он может быть только газообразным. Если вещество "аргон" находится в газообразном состоянии, то это газ, а если в твердом то это уже не газ.
Ну это то же самое, что красная синька
Он про херню! В статье про любой элемент будет сразу сказано о фазовом состоянии в НОРМАЛЬНЫХ УСЛОВИЯХ.
Подскажите, что такое "твердый газ"? Газ блеать по определению не может быть твердым, потому что это другое агрегатное состояние вещества. Я написал об этом.
Это газ в процессе сублимации. Он отчасти твёрдый, а отчасти газ
И каковы условия превращения допустим гелия в твердое состояние?
Если вы про то, что здесь не соблюдены условия - да, естественно.
Так я вообще считаю что на фото либо макет без реальных элементов, либо вообще нарисовано тупо.
Главное, чтобы газы были не с подливой.
Сколько таблиц химических элементов существует на самом деле?
В 1869 году Дмитрий Менделеев представил коллегам из Русского химического общества совершенно новую версию периодической таблицы элементов. С того самого момента прошло 150 лет. Но Дмитрий Иванович не единственный, кто сумел организовать элементы таким образом, чтобы они показали всю сложность устройства мироздания и материи. Большое количество исследователей со всего мира пробовали свои силы в классификации и организации 63 элементов, известных на тот момент. Напомним, что на сегодняшний день обнаружено по крайней мере 118 элементов, включая попытки переставить их в самые странные и необычные таблицы. Из этой статьи вы узнаете, насколько необычной может предстать перед нами всем знакомая и привычная таблица.

Перед вами классификация химических элементов, устанавливающая зависимость различных свойств элементов от их заряда атомного ядра.
Напомним, что таблица химических элементов Дмитрия Ивановича Менделеева представлена в виде периодического закона. Его современная формулировка звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер. На момент написания статьи опубликовано свыше 500 вариантов периодической системы классификации химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. По решению ООН 2019 год был провозглашен Международным годом Периодической таблицы химических элементов.
Периодическая таблица Д.И. Менделеева
Вне зависимости от того, любите вы или ненавидите ее, перед вами оригинальная периодическая таблица Менделеева и, скорее всего, вы всегда ее узнаете. Эта система классификации химических элементов знакома нам с детства и упорядочена по атомному номеру, электронной конфигурации. Необхдимо отметить, что она слабо зависит от химических свойств элементов как таковых. В этой версии таблицы меньше элементов, но зато в ней оставлено место для большего количества еще не открытых элементов, что – как показали годы исследований – оказалось разумным предположением русского ученого.
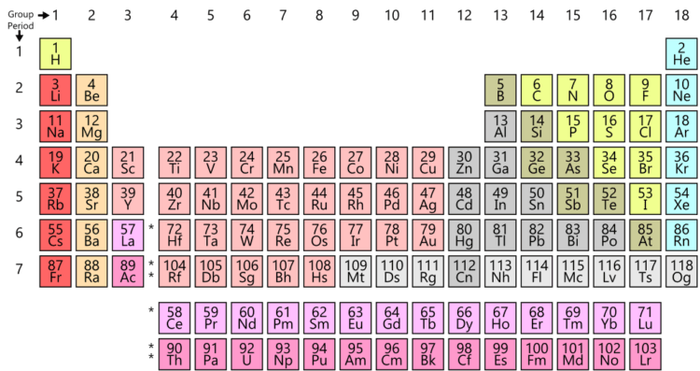
Всем знакомая периодическая таблица химических элементов Д.И. Менделеева
Периодическая таблица ADOMAH разработанная в 2006 году Валерием Циммерманом. Вместо того, чтобы основываться на атомных числах, систематизирована вокруг четырех квантовых чисел электронной конфигурации, эти четыре числа используются для описания расположения и движения электронов внутри атома. Идея берет свое начало из более старой таблицы инженера и биолога Чарльза Джанета, согласно статье, опубликованной на портале Science Alert. Его работа перестраивала элементы в соответствии с орбитальным заполнением – основной вероятностью нахождения электрона на определенном расстоянии от ядра атома.
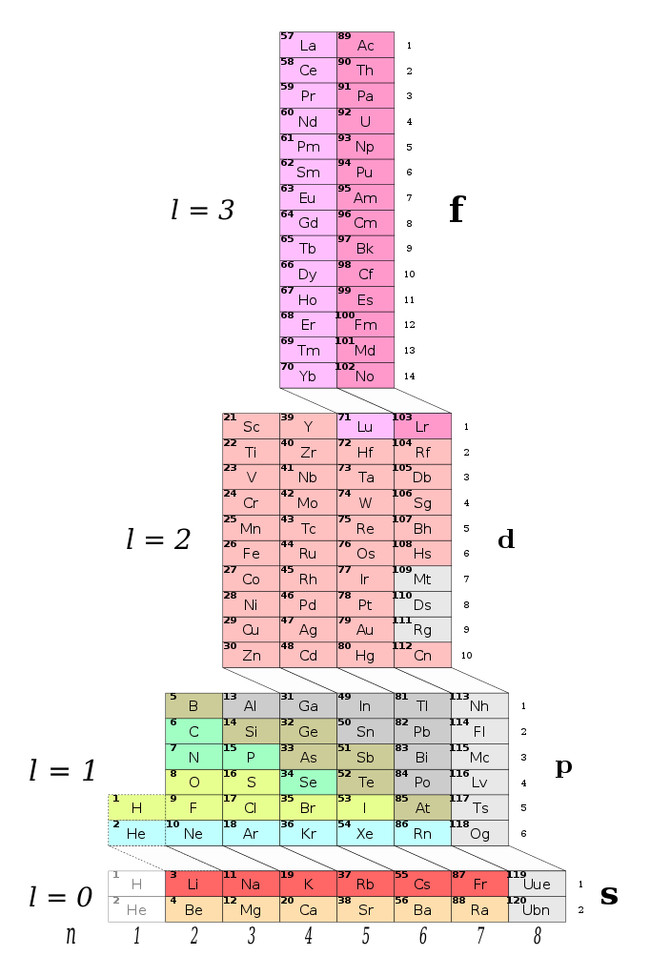
Так выглядит периодическая система ADOMAH
Спираль из химических элементов
Спиральная таблица химических элементов, созданная в 1964 году химиком Теодором Бенфеем, выглядит очень красиво. Начиная с середины спирали с водородом, она закручивается наружу в порядке атомных номеров, прежде чем разветвляется на переходные металлы, лантаноиды, актиниды и до сих пор не открытые суперактиниды.
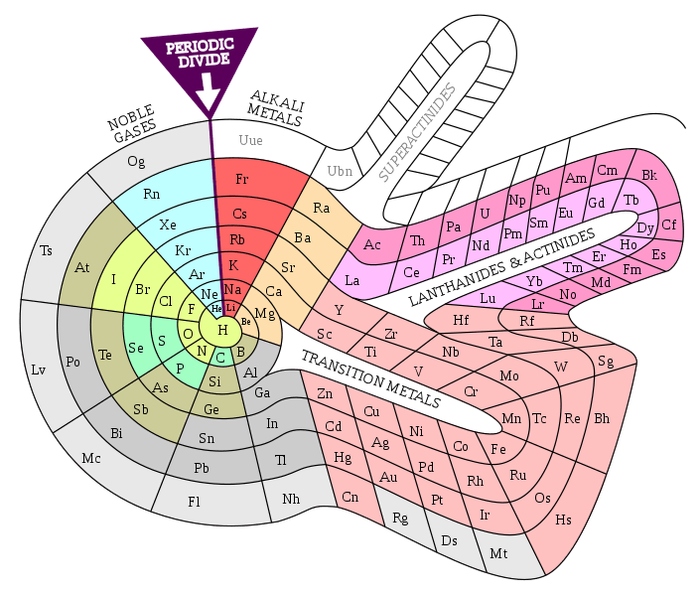
Цветок Менделеева

Сочетание химических эелемнтов может поражать воображение, особенно если взглянуть на него под другим углом
Примечательно, что в этой периодической таблице нет ни водорода, ни гелия. Первая, окрашенная в бирюзовый цвет секция (или лепесток) содержит щелочные металлы спереди и щелочноземельные металлы позади. Другие лепестки, в свою очередь, содержат остальные элементы, сгруппированные по присущим им качествам.
Лента периодических химических элементов
Ниже вы можете увидеть движущуюся вариацию: Названная периодической таблицей скрученная лента, таблица создана Джеймсом Франклином Хайдом в 1975 году. Хайд был химиком, изучающим кремниевую органику, а потому уделил кремнию центральное место в таблице (в бежевой секции в середине двух кругов), подчеркнув, крепкую связь этого элемента с многими другими в таблице.
В периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.

Перед вами таблица химических элементов и их взаимодействий
Однако, таблица все еще начинается в центре правого круга с водородом, прежде чем спирально выйти в различные группы. Множество цветов подчеркивают периодические отношения элементов. Красивые изгибы делают это одним из наших любимых вариантов, но это также довольно интенсивно. Для практического рассмотрения вещей ознакомьтесь с этой периодической таблицей, которая рассказывает вам, как использовать эти элементы.
![]()
В посте "Человек по ГОСТу", был опубликован упрощенный вариант популярного давно принта Human Being. К сожалению магазин оригинальных авторов давно канул в лету. Но кому интересно выкладываю векторный исходник - для желающих подкорректировать вес, ингредиенты и прочие мелочи.


Свой вариант я перерисовывал для девушки, поэтому некоторые вещи отличаются от оригинальной работы. Весь текст кернился вручную, и переведен в кривые, исходника без кривых найти не смог.
Для тех, кому текущего макета будет достаточно - просто поменяйте вес в нижнем левом углу.
Для тех, кто захочет поменять данные в других блоках - Шрифт Helvetica 65 и 75. В печать можно отдать PDF как есть, или импортировать его в Фотошоп в любом размере и уже после этого отправить в печать в необходимом размере и формате.
Человек по ГОСТу

Ингредиенты:
Кислород 65%, Углерод 18%, Водород 10%
Азот 3%, Кальций 1.5%, Фосфор 1%
Пригоден к употреблению до: Сентября 2058 г.
Состав может варьироваться.
![]()
Менделеев
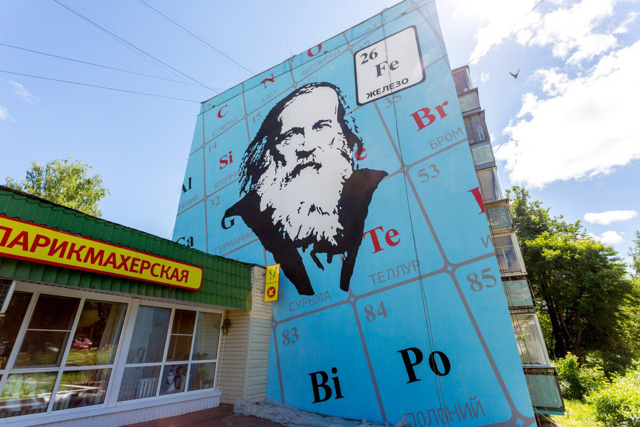
В городе Кирове местные художники расскрасили унылую стену дома по ул. Менделеева 26.
Желтый хлор светится синим?!



Люминесцентная лампа в кармане!
Газовый разряд в парах ртути! В ампулку введена металлическая ртуть, которая в холодной ампулке имеет вид компактного шарика, или оседает в виде налёта на стенках ампулки. Светящимся телом ампулки является столб дугового электрического разряда. Электрический разряд в парах ртути создаёт видимое излучение голубого или фиолетового цвета, а также, мощное ультрафиолетовое излучение. Для создания газового разряда мы использовали мощную катушку Теслы.

Дейтерий - это тяжелый изотоп водорода, который соответственно имеет более сложно устроенное ядро по сравнению с водородом (протием), состоящее из протона и нейтрона. Соответственно атомная масса дейтерия вдвое больше – 2,0141. Принятое обозначение – 2H1 или D. Эта изотопная форма также стабильна, так как в процессах сильного взаимодействия в ядре протон и нейтрон постоянно превращаются друг в друга, и последний не успевает претерпеть распад.
Также как и протий, дейтерий это газ, который состоит из миллиардов и миллиардов атомов. Каждый атом дейтерия имеет на орбите вокруг ядра электрон. Когда мы включаем катушку Теслы в сеть, ампулка оказывается в электромагнитном поле катушки, электроны начинают перескакивать с атома на атом, как им и положено при прохождении тока. Атомы дейтерия возбуждаются при столкновении с электронами так же, как человек, которого грубо толкнули в толпе. Электроны в атоме дейтерия не склонны к бродяжничеству, поэтому после возбуждения атом успокаивается и электрон возвращается на свое место. В результате атом испускает фотон света. Энергия этих фотонов лежит в розовато-красной части спектра видимого света, поэтому мы и наблюдаем такой цвет свечения дейтерия!
Кстати, во время свечения это уже не газ, а так называемая холодная плазма, четвёртое агрегатное состояние. Плазма характеризуется частичным или полным срывом электронов с их атомных орбит, при этом сами свободные электроны остаются внутри вещества. Таким образом, плазма, будучи ионизированной, в целом остаётся электрически нейтральной, поскольку число положительных и отрицательных зарядов в ней остаётся равным. Для ионизации дейтерия нам приходится использовать довольно мощную катушку Теслы, так как дейтерий довольно слабо ионизируется, например, по сравнению с неоном и даже протием.
На Земле водород содержит от 0,011% до 0,016% дейтерия. Концентрация его различна в зависимости от среды: в морской воде этого изотопа больше, а в составе, например, природного газа – существенно меньше.
Вода, в молекулах которой, дейтерий полностью заменяет лёгкий водород, называется тяжелой водой D2O. Такая вода характеризуется замедленным течением химических реакций, вследствие чего в больших концентрациях она вредна для живых организмов, особенно высших, таких как млекопитающие и в том числе человек. Если в составе воды четверть водорода замещена дейтерием, длительное употребление ее чревато развитием бесплодия, анемии и других заболеваний. При замещении 50% водорода млекопитающие погибают через неделю употребления такой воды. Что касается кратковременных повышений концентрации тяжелого водорода в воде, она практически безвредна.
Читайте также:

