Что такое сосудистая инвазия при раке яичек
Диагностика
На ранних стадиях рак яичка протекает бессимптомно, однако у 20% больных первым симптомом может быть боль в мошонке.
Наличие опухоли в яичке часто больной выявляет самостоятельно.
Иногда выявлению опухоли способствует травма мошонки.
Могут развиться также гинекомастия (7%) и боль в спине (11%). У 10% больных опухоль может протекать под маской эпидидимита, что затрудняет своевременное установление диагноза. Физикальное обследование с пальпацией опухоли должно всегда сопровождаться общим осмотром, при котором можно выявить метастазы в надключичные лимфатические узлы, пальпируемое образование брюшной полости, гинекомастию.
Ультразвуковое исследование (УЗИ) применяют для подтверждения наличия образования яичка, исследования контралатерального яичка, оценки состояния забрюшинных лимфатических узлов, органов брюшной полости. Чувствительность метода при выявлении опухолей яичка составляет 100%. УЗИ также следует выполнять у молодых мужчин без пальпируемого образования в мошонке, но имеющих забрюшинные и висцеральные образования или повышенные концентрацию в-субъединицы хорионического гонадотропина (в-ХГ) или а-фетопротеина (АФП) в сыворотке крови.
Компьютерную томографию (КТ) выполняют для оценки состояния забрюшинных лимфатических узлов, органов брюшной полости, легких.
Магнитно-резонансная томография (МРТ) обладает большей чувствительностью и специфичностью, чем УЗИ, и способностью дифференцировать семиномные и несеминомные опухоли.
Стадирование
Необходимо оценить концентрацию опухолевых маркеров после орхифуникулэктомии, состояние надключичных и абдоминальных лимфатических узлов и печени, наличие или отсутствие вовлечения лимфатических узлов средостения и метастазов в легкие, состояние головного мозга и костей, если подозревается их метастатическое поражение.
Диагностические тесты в настоящее время включают повторное исследование крови на опухолевые маркеры, рентгенографию органов грудной клетки, КТ брюшной полости и органов грудной клетки, УЗИ, МРТ, позитронно-эмиссионную томографию (ПЭТ) и другие методы диагностики по необходимости.
Рекомендации по использованию диагностических тестов с учетом уровня достоверности представлены в табл. 4.1.
Таблица 4.1. Диагностические тесты, применяемые для стадирования опухолей яичка (EAU, 2004)

Классификация опухолей яичка по TNM приведена в табл. 4.2.
Таблица 4.2. TNM-классификация опухолей яичка (UICC, 2002)

В 1997 г. Международная группа по изучению герминогенных опухолей яичка (International Germ Cell Cancer Collaborative Group — IGCCCG) предложила систему стадирования с разделением на прогностические группы (табл. 4.3).
Таблица 4.3. Система стадирования опухолей яичка (IGCCCG. 1997)

Рекомендации по диагностике и стадированию опухолей яичка с учетом их достоверности:
• Физикалъное обследование может быть достаточным для диагностики рака яичка.
• УЗИ яичек следует проводить в обязательном порядке, если есть подозрение на опухоль яичка, а пальпация мошонки не выявляет отклонений от нормы или если есть сомнения после физикального обследования.
• Орхифуникулэктомия и гистологическое исследование яичек необходимы для подтверждения диагноза и определения стадии первичной опухоли (рТ).
• Концентрацию опухолевых маркеров (АФП, в-ХГ, ЛДГ) следует определять до и после орхифуникулэктомии для установления стадии и оценки прогноза.
• Состояние забрюшинных, медиастинальных и надключичных лимфатических узлов и внутренних органов обязательно следует оценивать у больных раком яичка.
Лечение
Первый этап лечения всех опухолей яичка — орхифуникулэктомия.
Орхифуникулэктомия — удаление яичка с семенным канатиком. Операцию выполняют через паховый доступ. Семенной канатик необходимо выделять и отсекать у внутреннего пахового кольца.
Цели орхифуникулэктомии:
• удаление первичного очага;
• морфологическая верификация опухоли;
• стадирование процесса по символу рТ;
• определение тактики лечения в зависимости от гистологической структуры опухоли.
Через 5-7 дней после орхифуникулэктомии определяют концентрацию опухолевых маркеров. Сохранение повышенного уровня маркеров после орхифуникулэктомии может быть единственным признаком наличия субклинических метастазов.
На первом этапе выполняют орхифуникулэктомию. Учитывая наличие у 15-20% больных субклинических микрометастазов в регионарных лимфатических узлах, с профилактической целью проводят дистанционную лучевую терапию на парааортальные и ипсилатеральные тазовые лимфатические узлы.
Суммарная очаговая доза составляет 20-24 Гр. Были проведены рандомизированные исследования, в которых у больных облучали только парааортальные зоны, в результате значительно снизилось число побочных эффектов, а число рецидивов выросло всего на 2%.
Осложнения профилактической лучевой терапии:
• анорексия;
• тошнота, рвота:
• диарея:
• повышение риска возникновения вторичных опухолей желудочно-кишечного тракта, лейкозов.
В ряде работ отмечают высокую эффективность профилактической химиотерапии (цисплатин 50 мг/м2, 2 курса), которую рекомендуют как альтернативу адъювантной лучевой терапии. По данным исследований EORTC 30942 и MRC ТЕ19, не было выявлено достоверной разницы в частоте возникновения рецидивов после 1-го курса адъювантной химиотерапии карбоплатином, адъювантной дистанционной лучевой терапии (ДЛТ) или тщательного наблюдения.
Таким образом, проведение 1-го курса химиотерапии карбоплатином может являться альтернативой ДЛТ или тщательному наблюдению у больных семиномой 1-й стадии. Ожидается, что два курса химиотерапии карбоплатином позволят снизить частоту рецидивирования до 1-3%, но для подтверждения этого требуется дальнейшее наблюдение и накопление опыта.
Безрецидивная 5-летняя выживаемость составляет 82,3%. Пятилетняя выживаемость — 97-100%, смертность — 0,6%. По размерам опухоли >4 см и наличию инвазии в сеть яичка можно подразделить больных семиномой 1-й стадии на группы низкого и высокого риска развития метастазов.
Этот вывод был сделан на основании метаанализа ретроспективных исследований. У больных при отсутствии или наличии обоих факторов риска вероятность прогрессирования составляет 12 и 32% соответственно. Большинство рецидивов возникало в забрюшинных лимфатических узлах.
Для развития рецидива неблагоприятными считают следующие прогностические факторы:
• размер первичной опухоли >4 см;
• наличие сосудистой инвазии;
• возраст пациентов старше 34 лет.
Лечение распространенной семиномы
У больных семиномой IIА и IIВ стадии стандартным методом лечения является лучевая терапия 30 и 36 Гр соответственно. Поле облучения захватывает ипсилатеральные подвздошные лимфоузлы, образуя поле в виде хоккейной клюшки.
Латеральные границы поля облучения должны отступать не менее чем на 1,0-1,5 см от края метастатических лимфоузлов при IIВ стадии. При этом 6-летня я безрецидивная выживаемость составляет 95 и 89% при IIА и IIB стадии соответственно. Общая выживаемость составляет около 100%.
Лучевая терапия позволяет добиваться положительных результатов у больных с конгломератом забрюшинных лимфатических узлов размером менее 10 см: безрецидивная 2-летняя выживаемость составляет до 91%, а общая выживаемость — 95%. При размере забрюшинной опухоли более 10 см в 38-50% случаев развивается рецидив заболевания
У больных IIВ стадии возможно проведение трех курсов адъювантной химиотерапии по схеме ВЕР (блеомицин 30 мг на 2, 9 и 16-й день, этопозид 120 мг/м2 в 1, 3, 5-й дни или 100 мг/м2 в 1-5-й дни, цисплатин 20 мг/м2 в 1-5-й дни) или четыре курса по схеме ЕР (этопозид, цисплатин) в группе хорошего прогноза в качестве альтернативы лучевой терапии или при наличии противопоказаний к применению блеомицина.
Безрецидивная выживаемость у больных, перенесших химиотерапию, достигает 90%.
При прогрессировании заболевания проводят четыре курса химиотерапии II линии PEI (цисплатин, этопозид, ифосфамид) или высокодозную химиотерапию.
Неблагоприятными прогностическими факторами у больных, получающих химиотерапию, являются:
• большие размеры забрюшинных метастазов;
• наличие отдаленных метастазов;
• повышение содержания ЛДГ в сыворотке крови.
Остаточная опухоль после химиотерапии, постепенно уменьшаясь в размерах, исчезает, хирургически ее не удаляют. При отрицательной динамике (увеличение резидуальной опухоли) выполняют биопсию для исключения несеминомного компонента.
Лечение несеминомных герминогенных опухолей яичка
У больных несеминомными опухолями яичка 1-й стадии бея повышения уровня маркеров уже у 30% из них имеются субклинические метастазы.
Больных несеминомными опухолями можно разделить на группы риска в зависимости от результатов патоморфологического исследования. Главным патоморфологическим критерием является инвазия опухоли в микрососудистое русло.
Отсутствие сосудистой инвазии позволяет отнести пациентов к группе низкого риска и оставить под тщательное наблюдение при желании больного. Наличие сосудистой инвазии имеет 53% предсказательное значение в развитии метастазов. Этих пациентов относят к группе высокого риска.
Забрюшинную лимфаденэктомию выполняют у больных с высоким риском забрюшинных метастазов. Забрюшинная лимфаденэктомия с последующим морфологическим исследованием удаленного материала остается наиболее точным методом стадирования опухолевого процесса у больных раком яичка.
У 30% больных выявляются метастазы в забрюшинные лимфоузлы при клинической 2-й стадии. У 10% больных без метастазов в забрюшинные лимфоузлы (1-я клиническая стадия) возникают отдаленные рецидивы.
Показания к забрюшинной лимфаденэктомии:
• сосудистая и лимфатическая инвазия в опухоли яичка;
• стойкое повышение концентрации опухолевых маркеров после орхифуникулэктомии;
• элементы эмбрионального рака в опухоли яичка;
• отсутствие элементов опухоли желточного мешка в первичной опухоли.
Границы лимфаденэктомии:
• нижняя — глубокое паховое кольцо;
• верхняя — почечные сосуды;
• латеральная — мочеточник;
• медиальная, при операции;
• слева — передняя полуокружность нижней полой вены;
• справа — передняя полуокружность аорты.
Осложнения забрюшинной лимфаденэктомии:
• интраоперационные: ранение магистральных сосудов, кровотечение, ранение мочеточника;
• послеоперационные: кишечная непроходимость, перитонит, образование лимфоцеле, ретроградная эякуляция, бесплодие.
В связи с пересечением во время операции постганглионарных эфферентных симпатических волокон, располагающихся в межаортокавальном пространстве ниже уровня отхождения нижней брыжеечной артерии, у больных развиваются ретроградная эякуляция и бесплодие. Для их устранения разработана и выполняется нервосберегающая техника операции.
Возможно выполнение лапароскопической забрюшинной лимфаденэктомии, преимущества ее следующие:
• лучшая визуализация операционного поля;
• малая травматичность;
• меньшее количество послеоперационных осложнений;
• снижение сроков послеоперационной реабилитации.
Выживаемость в группе больных после хирургического лечения:
• у больных, не имевших метастазов в забрюшинных лимфатических узлах, до 95%;
• при наличии микрометастазов — от 50 до 75%.
У 87% пациентов с повышенным уровнем маркеров АФП и в-ХГЧ при выполнении забрюшинной лимфаденэктомии (ЗЛАЭ) имелись метастазы в забрюшинных лимфоузлах. При имеющемся повышенном уровне серологических маркеров следует также выполнить УЗИ контралатерального яичка, если это не было выполнено ранее.
Под динамическим наблюдением могут находиться больные с низким риском развития рецидива. Учитывая, что до 80% рецидивов возникает в 1-й год наблюдения, 12% — на 2-й и 6% — в течение 3-го года, больные в 1-й и во 2-й годы наблюдения должны быть под постоянным тщательным контролем.
Динамическое наблюдение включает:
• УЗИ брюшной полости, забрюшинного пространства;
• рентгенографию легких;
• определение концентрации опухолевых маркеров;
• при необходимости КТ брюшной и грудной полостей.
Следует иметь в виду, что у 35% больных с рецидивом опухолевого процесса может не происходить повышения концентрации опухолевых маркеров.
В настоящий момент большинство исследователей полагают, что лечение несеминомных опухолей IIА и IIВ стадий должно начинаться со стартовой химиотерапии 3-4 курсами ВЕР и ЕР в группах хорошего и умеренного прогноза с последующим удалением резидуальных масс, за исключением случаев без повышения уровня маркеров, когда можно выполнить ЗЛАЭ или оставить пациента под тщательное наблюдение. Забрюшинные образования без повышения уровня маркеров представляют собой метастатически дифференцированную тератому.
Общеприняты следующие схемы I линии химиотерапии:
• ВЕР (блеомицин 30 мг на 2, 9 и 16-й дни, этопозид 120 мг/м2 в 1, 3 и 5-й дни или 100 мг/м2 в 1-5-й дни, цисплатин 20 мг/м2 в 1-5-й дни);
• ЕР (этопозид 100 мг/м2 в 1 -5-й дни, цисплатин 20 мг/м2 в 1-5-й дни).
При сравнении 4 курсов ЕР и 3 курсов ВЕР доказана их одинаковая эффективность.
При неэффективности химиотерапии I линии проводят химиотерапию в следующих режимах:
• монохимиотерапия препаратами этопозид. ифосфамид;
• полихимиотерапия по схемам ЕР (этозид, цисплатин), PEI (ифосфамид, цисплатин. этопозид), VelP (цисплатин, винбластин, ифосфамид).
Неблагоприятный прогностический признак у больных после индукционной химиотерапии — сохранение положительных результатов при определении опухолевых маркеров.
Забрюшинную лимфаденэктомию выполняют у больных, у которых не достигнут полный эффект после индукционной химиотерапии (остаточная опухоль размером более 1 см). При гистологическом исследовании удаленного препарата фиброзно-некротические массы выявляют в 40%, жизнеспособные раковые клетки — в 10%, зрелую тератому — в 50% случаев.
Индукционная химиотерапия позволяет достичь ремиссии и избежать хирургического вмешательства при IIА стадии у 87%, при IIВ стадии у 67% больных.
Больным проводят индукционную химиотерапию по схемам ВЕР (блеомицин 30 мг во 2, 9. 16-й дни, этопозид 120 мг/м2 в 1, 3, 5-й дни или 100 мг/м2 в 1-5-й дни, цисплатин 20 мг/м2 в 1-5-й дни), всего 3 курса, или ЕР (этопозид 100 мг/м2 в 1-5-й дни, цисплатин 20 мг/м2 в 1-5-й дни), всего 4 курса.
В дальнейшем оправдан агрессивный хирургический подход с выполнением забрюшинной и/или медиастинальной лимфаденэктомии, удалением солитарных метастазов, попыткой удаления всех опухолевых очагов. После хирургического этапа проводят еще 4 курса полихимиотерапии. При неэффективности схемы ВЕР проводят химиотерапию второй линии.
Больным из группы умеренного прогноза проводят 4 курса по схеме ВЕР; 5-летняя выживаемость составляет 80%.
Стандартная терапия пациентов из группы неблагоприятного прогноза состоит из 4 курсов по схеме ВЕР. Проведение химиотерапии по схеме PEI имеет такую же эффективность, но является более токсичным; 5-летняя безрецидивная выживаемость составляет 45-50%. В настоящий момент проводятся исследования улучшения.
Лечение негерминогенных опухолей
Негерминогснные опухоли составляют до 3% всех опухолей яичка, из них до 90% являются доброкачественными опухолями:
• опухоли стромы полового тяжа;
• гонадобластомы;
• мезенхимальные опухоли;
• смешанные негерминогенные опухоли.
В основном лечение негерминогенных опухолей заключается в выполнении орхифуникулэктомии и динамическом наблюдении. При развитии забрюшинных метастазов производят забрюшинную лимфаденэктомию. В редких случаях возможно органосохраняющее лечение.
Динамическое наблюдение (табл. 4.4-4.10).
Таблица 4.4. Наблюдение за больными семиномными опухолями яичка 1-й стадии

Таблица 4.5. Наблюдение за больными семиномными опухолями яичка 1-й стадии после адъювантной химиотерапии или ДЛТ

Таблица 4.6. Наблюдение за больными семиномными опухолями яичка IIA-IIB стадии после ДЛТ

Таблица 4.7. Наблюдение за больными несеминомными опухолями яичка 1-й стадии

Таблица 4.8. Наблюдение за больными несеминомными опухолями яичка 1-й стадии после адъювантной химиотерапии или ЗЛАЭ

Таблица 4.9. Наблюдение за больными несеминомными опухолями яичка IIА-IIВ стадии после ЗЛАЭ и адъювантной химиотерапии или основной химиотерапии

Таблица 4.10. Наблюдение за больными распространенными семиномными и несеминомными опухолями яичка

Прогноз
Прогноз зависит от гистологической структуры опухоли, стадии заболевания, возраста больного, концентрации опухолевых маркеров. Наиболее благоприятный прогноз у семиномы, менее благоприятный — у эмбрионального рака и тератобластомы. наихудший — у хориоэпителиомы и смешанных опухолей с элементами хориоэпителиомы.
Саркомы яичка протекают очень агрессивно. Плохой прогностический признак — стойкое повышение концентрации опухолевых маркеров, отсутствие изменения в процессе лечения. Прогноз у людей молодого возраста хуже, чем у лип старшего возраста.
В.И. Чиссов, Б.Я. Алексеев, И.Г. Русаков
Каждый пациент на приёме у врача больше всего боится, что у него заподозрят или, что хуже, найдут новообразование. Однако мало кто знает о механизме развития опухоли и за счет чего конкретно данный диагноз является настолько страшным. В этой статье мы разберёмся, что именно делает онкологические заболевания такими опасными для жизни.
- Строение тканей с точки зрения формирования опухолевого процесса
- Доброкачественные и злокачественные опухоли: в чем разница?
- Что такое инвазия опухоли?
- Факторы, определяющие степень инвазивности опухоли
- Инвазия раковых клеток в сосуды
- Циркуляция раковых клеток в системе кровотока и экстравазация
- Резюме
Строение тканей с точки зрения формирования опухолевого процесса
Чтобы разобраться в механизме образования и развития опухоли, необходимо иметь представление о принципе строения тканей в организме. Большинство тканей, независимо от места их расположения, имеют сходный план строения:
- Базальная мембрана — это неклеточная структура, отграничивающая ткани друг от друга;
- Ростковый слой — группа активно делящихся клеток, расположенных на базальной мембране, которые обеспечивают обновление ткани. Именно изменение генетического материала клеток росткового слоя влечёт за собой развития опухоли;
- Слой созревающих клеток — клетки ростового слоя, которые постепенно продвигаются в верхние слои в процессе дифференцировки (приобретения формы и свойств, характерных для данной ткани);
- Поверхностный слой — группа клеток, которая и обеспечивает выполнение тканью определённой функции.
Между ростковым и поверхностным могут располагаться дополнительные слои в зависимости от конкретного вида ткани. Но принцип строения всегда один и тот же: клетки, способные делиться, находятся на базальной мембране. В процессе созревания они перемещаются в верхние слои, утрачивая способность к делению и приобретая специфические свойства.
Доброкачественные и злокачественные опухоли: в чем разница?
Исходя из того, клетки какого слоя подверглись мутации, выделяют два типа неоплазий — доброкачественные и злокачественные. Их отличия заключаются в том, что первый тип формируется из высоко дифференцированных клеток созревающего слоя. При доброкачественных опухолях клетки не будут сильно отличаться от здоровых клеток данной ткани. Такая неоплазия считается неагрессивной и растет медленно, а также не даёт метастазы. Патогенное действие доброкачественного новообразования заключается главным образом в сдавлении окружающих её тканей. Иногда такие опухоли полностью или частично закрывают просвет какого-либо полого органа.
В процессе развития рака выделяют 4 стадии:

Что такое инвазия опухоли?
Инвазия обуславливает способность опухолей давать метастазы — вторичные очаги онкологического процесса вдали от материнской опухоли, возникшие из-за миграции раковых клеток. Обязательное условие метастазирования — наличие у опухоли собственной капиллярной сети. Она формируется, когда количество неопластических клеток достигает 103 (1-2 мм).
- Разрыв межклеточных связей, соединяющих раковые клетки между собой;
- Прикрепление клеток опухоли к базальной мембране;
- Разрушение базальной мембраны лизирующими (расщепляющими) ферментами;
- Миграция клеток в соседние ткани и органы.
Раковые клетки, находящиеся в процессе инвазии, более устойчивы к облучению и химеотерапии, чем стационарные. Во многом это связано с временной утратой мигрирующими клетками способности к делению. Также движущиеся опухолевые клетки проявляют повышенную активность антиапоптотических генов (гены, препятствующие запрограммированной смерти клетки — апоптозу). И, поскольку химиотерапевтические препараты направлены на стимуляцию апопоза, их устойчивость к лечению возрастает.
Факторы, определяющие степень инвазивности опухоли
Чтобы злокачественная опухоль проросла сквозь базальную мембрану, необходимо наличие следующих факторов:
- Быстрое деление и давление. Механическое воздействие опухолевой массы на базальную мембрану способствует её разрушению и, как следствие, инвазии раковых клеток;
- Подвижность клеток. Клетки новообразования способны к миграции, причем их движение не является хаотичным. Они движутся в направлении большей концентрации кислорода, питательных веществ, а также в сторону более нейтрального показателя кислотности (рН);
- Межклеточные связи. Чем прочнее эти контакты, тем меньше шансов, что опухоль начнет инвазивный рост. У злокачественных клеток связи слабые, поэтому клетки легко отрываются от новообразования и попадают в кровоток или в лимфатическую систему;
- Действие лизосомальных ферментов. Злокачественная опухоль вырабатывает вещества, способные разрушать здоровые клетки и межклеточное вещество, что будет способствовать инвазии;
- Иммунная система человека. В организме существует собственная противоопухолевая защита, которую обеспечивает наш иммунитет. Её активность у каждого человека индивидуальна. Она зависит от генетической предрасположенности и состояния всего организма в конкретный момент. Так, при заболеваниях, сопровождающихся угнетением иммунной системы (например, при ВИЧ), пациенты могут погибать от онкологических заболеваний, возникших из-за отсутствия противоопухолевой активности.
Инвазия раковых клеток в сосуды
Вслед за прорастанием в базальную мембрану наступает интравазальная (внутрисосудистая) инвазия опухоли. Чаще раковые клетки мигрируют в артерии. Это связано с тем, что стенки артерий более упругие и эластичные, в то время как у вен они тонкие и легко спадаются в опухолях. Однако раковые клетки могут быть занесены в вены из лимфатических сосудов.
Циркуляция раковых клеток в системе кровотока и экстравазация
Экстарвазация представляет собой выход опухолевых клеток из сосудов для формирования метастатического очага. В этом процессе задействованы те же ферменты, что и в инвазии через базальную мембрану.
Резюме
Вот что следует знать об инвазии опухолей:
- Инвазия — это проникновение раковых клеток через базальную мембрану ткани, из которой развилась опухоль;
- Инвазия свойственна только злокачественным новообразованиям;
- В инвазии участвуют лизирующие ферменты, которые способны разрушать как неклеточные структуры, так и связи между здоровыми клетками (например, выстилка сосудов);
- Явление инвазии лежит в основе метастазирования;
- Инвазия бывает индивидуальной и групповой, и последняя чаще обуславливает появление метастазов,
- Самые распространенные виды инвазивных опухолей — рак шейки матки и рак молочной железы.
В настоящее время используется несколько систем классификации опухолей яичка. В Великобритании больше распространена система, разработанная British Testicular Tumour Panel, а в США классификация Диксона и Мура. Обе системы предусматривают микроскопическое исследование образцов опухоли и индентификацию преобладающего типа клеток. Основная проблема заключается в гетерогенности клеток опухолей.
Полиморфизм особенно характерен для тератом, которые состоят из различных типов клеток. Новые системы классификации все в большей степени смогут опираться на данные, полученные гистохимическими методами, особенно в тех случаях, когда опухоли продуцируют онкомаркеры.

Большая часть опухолей яичка имеет герминогенную природу. Обычно они представлены семиномами (40%), тератомами (32%) и смешанными опухолями, содержащими клетки обоих типов (14%). За последние десять лет сформировалось представление о том, что карцинома in situ (также известная как герминативная интратубулярная неоплазия) имеет тестикулярное происхождение и после примерно 5-летнего периода покоя может превратиться в инвазивную опухоль.
Такие специфически измененные клетки обнаруживаются почти всегда, и они являются предшественниками инвазивных герминогенных опухолей. Подобное превращение карциномы in situ часто происходит по всему объему органа и особенно характерно для больных с пороком опускания яичка.
Определение гистологического типа герминогенных опухолей раньше имело большое прогностическое значение, главным образом, для случаев семином и тератом (несименомные опухоли). Однако успехи, достигнутые в лечении опухолей, и особенно в лечении тератом, понизили значимость гистологических показателей.
Наряду с типом клеток, наиболее важным прогностическим признаком является присутствие опухолевых клеток на срезе семенного канатика или внутри близлежащих сосудов (внутрисосудистая инвазия). Это можно обнаружить при исследовании образца, взятого при орхфуникулэктомии, и такие опухоли характеризуются неблагоприятным прогнозом. Начальный уровень онкомаркера также имеет прогностическое значение.
В настоящее время твердо установлена взаимосвязь между карциномой in situ и инвазивным раком, хотя биопсия яичка не всегда оказывается возможной. Тем не менее по наличию изменений in situ можно выделить группу высокого риска, что представляется крайне важным, поскольку облучение в небольших дозах предупреждает развитие инвазивного процесса, не сказывается на уровне тестостерона и не вызывает нарушений в половой сфере.
Показано, что по хромосомному набору клетки семиномы занимают промежуточное положение между клетками-предшественниками in situ и более злокачественными клеточными формами.
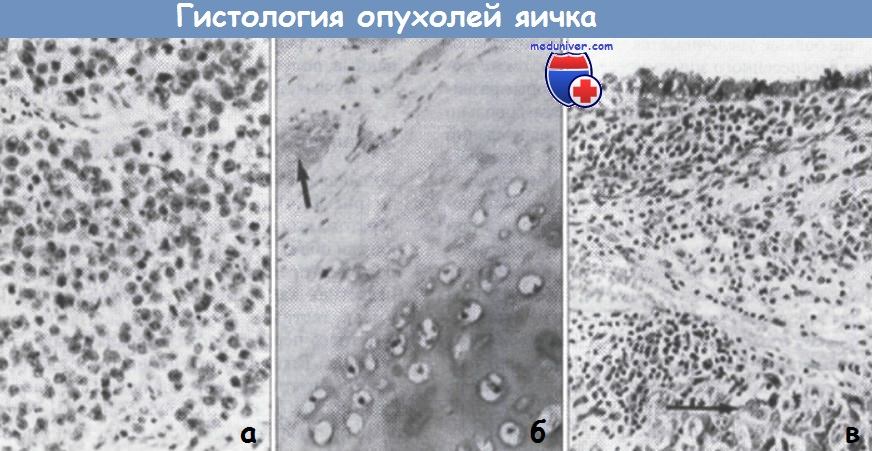
Гистологическая характеристика герминогенных опухолей яичка (х200):
(а) чистая семинома;
(б) дифференцированная злокачественная тератома; хрящевые и гладко-мышечные структуры в составе опухоли показаны стрелкой;
(в) злокачественная тератома промежуточного типа; видны дифференцированные клетки эпителия; клетки эмбрионального рака показаны стрелкой.
Семиномы имеют склонность к инкапсуляции и представляют собой плотные сероватые опухоли, обладающие четкими формами и обычно без каких-либо характерных особенностей. Они содержат небольшое количество геморрагических участков и некротических зон.
Микроскопическое исследование показывает, что опухоль состоит из больших клеток округлой формы с четко выраженными границами. Цитоплазма прозрачна, в ней присутствуют крупные ядра и часто видны ядрышки. Нередко опухоль инфильтрирована лимфоцитами.
Распространение опухоли за пределы яичка почти всегда затрагивает тазовые и парааортальные лимфатические узлы. В дальнейшем, опухоль распространяется на медиастинальные и надключичные лимфатические узлы. Хотя семиномы в основном локализуются в тканях яичка, иногда встречаются первичные опухоли внегонадного происхождения.
Они образуются в забрюшинной и средостенной области, над турецким седлом или в области шишковидного тела головного мозга.
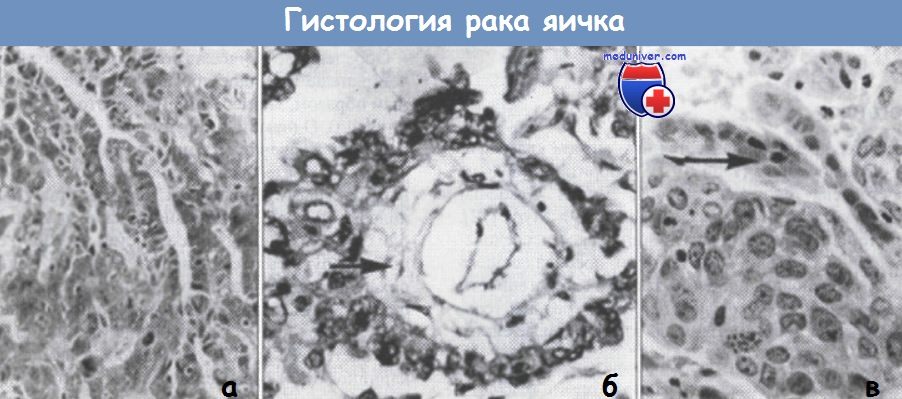
Гистологическая характеристика герминогенных опухолей яичка (х200):
(а) недифференцированная злокачественная тератома; видны клетки эмбрионального рака;
(б) опухоль желточного мешка; стрелкой показано тельце Шиллера-Дюваля;
(в) хориокарцинома: видны синцитиотрофобласт (показан стрелкой) и цитотрофобласт
Недифференцированная злокачественная тератома (эмбриональный рак). Недифференцированная злокачественная тератома (НЗТ) — наиболее распространенная несименомная опухоль герминогенного происхождения. Она представляет собой плотные узловатые образования, содержащие геморрагические участки и некротические зоны. Микроскопически опухоль состоит из крупных анапластических клеток с размытыми границами. Эозинофильная цитоплазма содержит различной величины ядра. Встречаются более дифференцированные, чаще гландулярные, формы.
Злокачественная тератома промежуточного типа (тератокарцинома). Обычно злокачественная тератома промежуточного типа (ЗТП) внешне сильно отличается от НЗТ. Это узелковая опухоль, и нередко ее срезы выглядят как бы набитыми песком из-за присутствия мельчайших участков хрящевой и/или костной ткани. В опухоли часто присутствуют различные типы половых клеток, а также клетки из всех трех первичных эмбриональных слоев: предшественники костной, хрящевой, соединительной и гладкомышечной тканей.
Кроме того, обнаруживаются клетки дыхательного или желудочно-кишечного эпителия.
Злокачественная трофобластоидная тератома (хориокарцинома). Злокачественная трофобластная тератома (ЗТТ) встречается не часто. Для этой опухоли характерна специфическая гистология: она содержит типичные цитотрофобластные элементы и/или синцитиотрофобласты. Опухоли относятся к числу высокозлокачественных и дают ранние и обширные метастазы. Истинные трофобластные опухоли яичка, локализация которых ограничивается органом, встречаются крайне редко.
Обычно опухоль выглядит как массивное новообразование. Она чаще других типов тератом метастазирует в головной мозг. Нередко у этих опухолей проявляется ранняя устойчивость к лекарственным препаратам. Между ЗТТ и обычными типами тератом (ЗТП и НЗТ) существуют различия, имеющие прогностическое значение. Так, по сравнению с ЗТП, клетки НЗТ характеризуются более коротким временем удвоения.
Недифференцированная злокачественная тератома в большей степени склонна к метастазированию в легкие, более чувствительна к химиопрепаратам, и для нее характерен несколько более благоприятный прогноз, чем для ЗТП.
Оценка клинической стадии развития опухолей яичка основана на особенности их метастазирования, которая имеет относительно предсказуемый характер. Вначале опухоли обычно распространяются по лимфатическим путям, затем по семенному канатику на парааортальные лимфатические узлы, оттуда на забрюшинные и ретрокруральные лимфатические узлы, грудной проток, заднюю часть средостения и на надключичные лимфатичекие узлы.
Обычно поражаются лимфатические узлы, расположенные слева, хотя у небольшой части больных может наблюдаться правое или билатеральное метастазирование. Часто, особенно при ЗТТ и НЗТ, наблюдаются метастазы гематогенной природы. Более чем в 90% случаев это связано с распространением опухоли по лимфатическим узлам; в остальных случаях метастазы развиваются в легких при отсутствии признаков поражения лимфатических узлов брюшной полости.
Метастазирование печени происходит крайне редко и необычно для больных без признаков легочных метастазов. Иногда обнаруживаются метастазы в головном мозге и в костях. Образование локальных инвазивных первичных опухолей и гематогенный характер их распространения, являются признаками более характерными для НЗТ, чем для ЗТП.
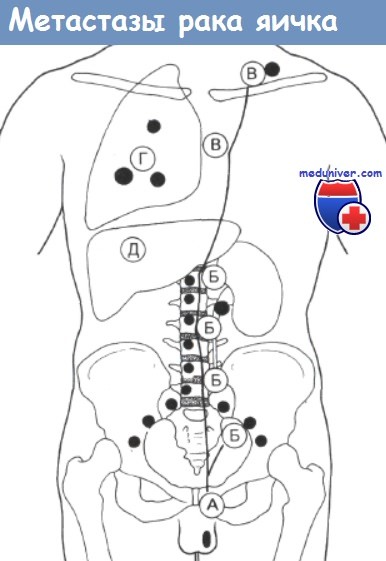
Пути распространения герминогенных опухолей яичка. Распространение:
А — По лимфатическим путям вдоль позвоночного столба;
Б — Подвздошные и забрюшинные (парааортальные) лимфатические узлы, включая почечные лимфатические узлы;
В — Лимфатические узлы средостения и надключичные лимфоузлы;
Г — Легкие;
Д — Печень, головной мозг и другие места Обычно опухоль распространяется от А к Д
Читайте также:

