Что такое реканализация опухоли

Цель исследования - установить значение полной или частичной лазерной эндоскопической реканализации стенозирующих опухолей толстой кишки для предоперационной декомпрессии и выполнения отсроченного оперативного вмешательства, оценить возможности применения высокоэнергетического лазерного излучения 1,06 мкм для реканализации стенозирующего колоректального рака при опухолевой толстокишечной непроходимости,
Материалы и методы исследования
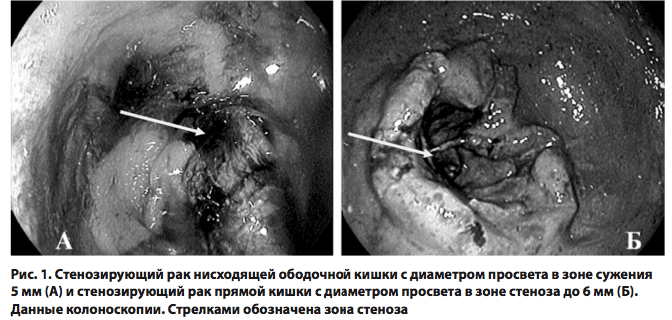
Учитывая многообразие форм нарушений толстокишечного пассажа, нами была изучена эффективность метода лазерной эндоскопической реканализации толстой кишки при опухолевой непроходимости. Среди пациентов этой группы было 10 мужчин и 16 женщин, что составило 38,5 и 61,5 %, соответственно. Размеры колоректальной опухоли варьировали от 5,0 до 10 см. У 8 (30,7 %) больных опухоль располагалась в поперечно-ободочной кишке или ее селезеночном изгибе, у 10 (38,4 %) - в нисходящей ободочной кишке, у 6 (23,0 %) - в сигмовидной кишке и у 2 (7,9 %) - в прямой кишке.
Морфологическое исследование операционного материала выявило в 9 случаях (34,6 %) эндофитную форму роста злокачественного образования, в 5 (19,2 %) - экзофитную и в 12 (46,2 %) случаях определялась смешанная форма роста опухоли. При гистологическом исследовании в 93,3 % случаях был установлен диагноз аденокарциномы, в 4,4 % - слизистого рака и в 2,3 % - плоскоклеточного рака.
Регионарное метастазирование было выявлено в 7 случаях (26,9 %). Вторичное поражение органов и отдаленных лимфатических узлов выявлено у 5 (19,2 %) пациентов. Среди фоновых заболеваний полипы толстой кишки были выявлены в 9 случаях, дивертикулы - в 4 случаях.
Результаты исследования и их обсуждение
Эндоскопическая реканализация во всех случаях была выполнена в течение 8-10 часов после поступления. Эндоскопическая картина полной непроходимости была выявлена в 10 случаях (38,5 %), при этом устье опухолевого канала не визуализировалось, кал и газы не поступали. У 16 (61,5 %) больных при эндоскопии определялось устье канала в опухоли.
Полная реканализация толстой кишки была достигнута нами у 32,6 % пациентов, частичная реканализация - у 39,4 %. В 28,0 % случаях реканализация оказалась неэффективной.
Полная и частичная эндоскопическая реканализация стенозирующей колоректальной опухоли, осложненной острой толстокишечной непроходимостью, была проведена у 18 (69,8 %) из 26 больных. Выполнение эндоскопической реканализации у этих пациентов позволило отказаться от экстренной операции и провести полноценную предоперационную подготовку.
При полной реканализации опухоли оперативное лечение проводилось через 3-4 суток после восстановления водно-электролитных нарушений, детоксикационной терапии. При частичной реканализации положительный эффект носил временный характер, и оперативное лечение в большинстве случаев было выполнено через 16-20 часов. Временная отсрочка операции после полной или частичной реканализации давала возможность провести полноценную предоперационную подготовку. При неэффективной реканализации или возникновении осложнений в ходе выполнения эндоскопической реканализации, оперативное лечение выполняли сразу после эндоскопического исследования.
Лазерная реканализация стенозирующей экзофитной раковой опухоли ректосигмоидного отдела толстой кишки, обусловливающей выраженное нарушение кишечной проходимости, проведена женщине 80 лет в стационарных условиях. Данной пациентке с опухолевой непроходимостью в течение 6 часов после поступления было проведено эндоскопическое исследование и ирригоскопия, при выполнении которых определялась причина непроходимости, оценивалась степень сужения и при возможности выполнялась биопсия опухолевидного образования. Эндоскопическая реканализация была выполнена в течение 9 часов после поступления.
Данное эндохирургическое пособие выполнено с целью улучшения проходимости и обеспечения возможности проведения адекватной подготовки толстой кишки для радикальной плановой операции. Протяжённость выраженного стеноза, по данным ирригоскопии, составила 4,0 см, а диаметр просвета в зоне максимального сужения был 0,4-0,6 см. Процедура лазерной реканализации продолжалась 50 минут. На продолжительность процедуры отрицательно повлияло дымообразование. В результате в опухолевой ткани был сформирован канал диаметром до 1,2 см. Максимальный эффект реканализации (успешная постановка очистительных клизм и эффективное применение слабительных) проявился спустя неделю после лазерной процедуры, что было обусловлено, скорее всего, постепенным отторжением некротических тканей со стенок канала. Проведённая эндоскопическая лазерная реканализация позволила провести адекватную подготовку толстой кишки и выполнить плановую радикальную резекцию сигмовидной кишки без осложнений.
Выводы
1. Лазерная реканализация стенозирующей колоректальной опухоли и последующая декомпрессия толстой кишки в большинстве случаев являются высокоэффективными лечебными мероприятиями, дающими возможность отсрочить основное оперативное вмешательство и провести полноценную дооперационную подготовку больного.
2. Срочность выполнения операции зависит от степени реканализации: при полной реканализации оперативное лечение может выполнено через 2-3 суток, при частичной реканализации - через 12-24 часа, при неэффективной реканализации показано экстренное оперативное вмешательство.
3. Применение эндоскопической реканализации опухоли у больных колоректальным раком, осложненным непроходимостью, позволило более чем у половины больных с опухолевой непроходимостью левой половины толстой кишки выполнить резекцию, наложить первичный анастомоз и снизить послеоперационную летальность до 12,4 %.
4. Высокоэнергетическое лазерное излучение 1,06 мкм обладает выраженной коагулирующей способностью при контактной вапоризации ткани опухоли.
Рецензент -


Чаще всего встречается в азиатском "поясе рака пищевода" — от севера Ирана через Среднюю Азию до центральных районов Китая и Японии, захватывая Сибирь. Это во многом обусловлено особенностями питания в данных регионах.
Злокачественное новообразование пищевода занимает шестое место по распространенности среди онкологических заболеваний. Развивается наиболее часто из эпителиальных клеток его слизистой оболочки (карцинома), реже наблюдается плоскоклеточный рак, редко – аденокарцинома, крайне редко – другие виды злокачественных новообразований.
Причины
Причины развития рака пищевода, как и других злокачественных опухолей, в настоящее время полностью не изучены. Большое значение имеет действие химических, механических или термических раздражающих факторов на слизистую пищевода, приводящее к возникновению хронического воспаления пищевода – эзофагиту, с последующим изменением его клеток (дисплазией). Клеточные изменения вследствие действия повреждающих факторов нарастают на фоне повышенной митотической активности (более интенсивного деления клеток) и приводят к злокачественному перерождению тканей пищевода и возникновению рака. Рак чаще возникает в верхней части пищевода, чем в нижней.
Поскольку рак возникает, как правило, на фоне хронического эзофагита, то заболевания, при которых наблюдается длительный воспалительный процесс в пищеводе, современная медицинская наука рассматривает как предрасполагающие к онкологическому заболеванию, или предраковые состояния. К таким состояниям относят пищевод Баррета (осложнение диафрагмальную грыжу).
Рак пищевода может быть обусловлен мутациями в гене р53, которые так же, как при поджелудочной железы, приводят к увеличению выработки аномального белка р53, не выполняющего свои функции защиты тканей от злокачественного перерождения. Причиной возникновения рака пищевода может быть вирус папилломы человека. Этот микроорганизм, в частности, был обнаружен в большом проценте случаев у больных раком пищевода жителей Китая (в ходе проводимых в этой стране исследований).
Способствуют развитию заболевания особенности питания, в частности, употребление горячей и грубой пищи, маринадов, алкоголя; дефицит витаминов, особенно В2 и А, а также железа, меди и цинка; вредные привычки (курение, алкоголь, жевание табака). Большой риск связан с сочетанием табака и алкоголя.
Симптомы
Начальные стадии рака пищевода протекают без симптомов. Проявляется заболевание только тогда, когда происходит нарушение процесса проглатывания и продвижения пищи по пищеводу. Это нарушение возникает при частичном перекрытии просвета пищевода растущей внутрь опухолью. Наличие небольшой опухоли может вызывать спазм стенки и, как следствие, поперхивание едой. При дальнейшем росте новообразования и перекрытии им большей части просвета пищевода больной может потерять способность к нормальному питанию, которое без специальных мероприятий приводит к истощению организма. Задержка пищи выше места сужения приводит к возникновению пищеводной рвоты, срыгиванию слюной и слизью.
Боль невысокой интенсивности за грудиной с иррадиацией в межлопаточную область при прохождении пищи и/или слюнотечение являются поздними симптомами и часто связаны с сопутствующим эзофагитом или прорастанием опухоли в соседние органы. При локализации рака в зоне кардии (перехода пищевода в желудок) первым признаком может быть не нарушение проглатывания и продвижения пищи, а постоянное срыгивание воздуха.
При росте опухоли за пределы пищевода она может сдавливать дыхательные пути с нарушением дыхания. Она также может сдавливать или прорастать в нервные стволы, располагающиеся рядом со стенкой пищевода, приводя к осиплости голоса, кашлю, развитию синдрома Горнера (опущение верхнего века, сужение зрачка, ослабление реакции зрачка на свет, расширение сосудов конъюнктивы глаза, западение глазного яблока, нарушение потоотделения на лице и покраснение кожи лица).
При глотания (дисфагия), но эти нарушения имеют тенденцию к прогрессированию, хотя и очень медленному. Данное состояние также сопровождают ночной кашель, регургитация (движение в обратном направлении) или аспирация (вдыхание) пищевых масс, иногда повышенное выделение слизи при срыгивании, что связано с застоем в пищеводе. Периодическое возникновение нарушений глотания во время болевого приступа за грудиной свидетельствует в пользу спазма пищевода. Дисфагия сопровождает и раннюю стадию поражения пищевода при склеродермии, но при этом развивается рефлюкс (забрасывание) содержимого желудка в пищевод. Кроме того, дополнительными признаками склеродермии могут быть истончение кожи с просвечиванием подкожных сосудов, уменьшение амплитуды дыхательных движений.
Диагностические обследования
При развитии дисфагии (нарушений проглатывания и продвижения пищи) диагностическое значение имеет оценка ее выраженности и локализации. Наличие дисфагии дает основание заподозрить рак пищевода. Основными методами диагностики являются рентгенологический и эндоскопический с обязательным морфологическим исследованием образцов тканей из измененных участков слизистой оболочки пищевода.
При рентгенографии пищевода, прежде всего, проводят исследование функции глотания с использованием рентегноконстрастных веществ (сульфата бария) различной консистенции, за исключением выраженного сужения просвета пищевода, когда необходимо использовать водорастворимый контрастный препарат.. Это позволяет выявить, где наблюдаются нарушения: в глотке или в пищеводе. Если причина дисфагии в нарушении функции пищевода, то следующим этапом обследования должна быть оценка того, какая пища ее вызывает: только твердая или твердая и жидкая. Нарушение глотания твердой пищи предполагает наличие механической непроходимости пищевода и может быть обусловлено ранними проявлениями целого ряда заболеваний. Пожилой возраст, отсутствие изжоги, снижение массы тела – это факторы, помогающие диагностировать опухоль.
Рентгенография позволяет получить информацию не только о локализации, протяженности поражения, но и о состоянии органа в целом. Так как в вертикальном положении контрастное вещество быстро эвакуируется из пищевода, рентгенологическое исследование выполняют в положении пациента стоя и лежа.
На ранних этапах заболевания, когда оно протекает бессимптомно, обнаружить его можно только при эндоскопическом обследовании. Эта диагностическая процедура является методом, позволяющим помимо визуального осмотра слизистой пищевода взять для исследования ее часть для морфологического и гистологического исследования. В последние годы широко используется эндоскопическая ультрасонография, которая дает возможность оценить распространение опухоли в стенке пищевода и состояние прилежащих тканей, а также регионарных лимфатических узлов. Применение этого метода диагностики значительно повысило частоту выявления ранних форм рака пищевода, в том числе локализующихся только в пределах слизистой оболочки (рак in situ).
Отдаленные метастазы рака пищевода определяются при ультразвуковом исследовании и рентгеновской компьютерной томографии. При подозрении на прорастание опухоли в соседние структуры, прежде всего в бронхиальное дерево, необходимо провести исследование верхних дыхательных путей, в том числе бронхоскопию с морфологичеким изучением промывных вод бронхов и биопсийного материала.
Лечение. Профилактика
Основными методами лечения рака пищевода являются хирургические и все более широко применяемые эндоскопические.
В лечении рака пищевода основное значение придается хирургическим методам, а также комбинации лучевой терапии и оперативного вмешательства. Очередность сочетания, объем лучевой нагрузки и комбинация ее с оперативным вмешательством зависят от стадии заболевания и локализации опухоли.
Основные виды хирургических операций:
• Экстирпация пищевода – радикальная операция, предусматривающая удаление пораженного пищевода вместе с регионарными лимфатическими узлами и окружающей жировой клетчаткой. Выполнение такой операции возможно не более чем у 5% больных вследствие поздней диагностики рака, пожилого возраста пациентов и наличия у них тяжелых сопутствующих заболеваний. Она очень травматична, в последующем пациенты нуждаются в проведении реконструктивной пластики пищевода.
• Операция Гарлока (резекция нижней трети пищевода, части желудка с малым сальником и формирование пищеводно-желудочного анастомоза) выполняется при опухолях в нижней трети пищевода и в области его перехода в желудок (кардии). Результаты этого вида хирургического лечения лучше, чем при экстирпации пищевода.
• Операция Льюиса – одномоментная субтотальная резекция пищевода и пластика его желудком. Выполняется при раке среднегрудной части пищевода.
• Фотодинамическая нетермическая деструкция проводится с использованием лазера, спектр излучения которого находится в зоне наибольшей чувствительности используемого фотосенсибилизирующего препарата. Фотосенсибилизатор вводится за 2–3 суток перед манипуляцией, за это время он накапливается в клетках пораженной области слизистой и под влиянием излучения активируется, разрушая опухолевые клетки.
• Лазерная деструкция выполняется световодом, вводимым через эндоскоп. Из-за невозможности гистологического исследования тканей подобный вид лечения используется у пациентов, которым невозможно радикальное хирургическое лечение и для прогноза заболевания которых оценка глубины прорастания опухоли не имеет определяющего значения.
• Дилатация (расширение) суженной области пищевода выполняется специальными типами бужей (медицинские инструменты цилиндрической формы для введения в трубчатые внутренние органы) или баллонных катетеров (катетеры с надувающимися воздухом и увеличивающимися в объеме баллонами). Данные манипуляции используются при наличии опухолей, суживающих просвет пищевода. Подобное лечение имеет непродолжительный эффект и часто используется как первый этап перед применением других эндоскопических методов лечения.
• Реканализация просвета пищевода применяется при полностью или частично перекрытом просвете пищевода, чаще в верхней его трети. Для этих целей можно проводить курсовое лазерное лечение для деструкции (выжигания) опухоли. Повторные процедуры обычно проводятся через 1–2 недели (после отторжения некротичесих масс), курс состоит из 2–4 сеансов лазерного воздействия. Также опухоль можно разрушить термическим воздействием полипэктомической петлей или электрокоагуляцией, выполняемой моно- или биполярным электродом. Для разрушения опухоли применяется также 96° этиловый спирт, вводимый инъекционной иглой через канал эндоскопа 2–3 раза с интервалом 5–7 дней. Хорошие функциональные результаты при использовании различных методов реканализации (возможность питаться через рот плотной и кашицеобразной пищей) достигаются в среднем у 75% пациентов.
• Эндопротезирование выполняется для закрепления эффекта реканализации, восстановлении нормального способа питания через рот, а также для устранения сообщения пищевода и дыхательных путей при наличии пищеводно-трахеальных или пищеводно-бронхиальных свищей. В качестве протезов применяются трубчатые пластиковые протезы и металлические саморасправляющиеся стенты.
Лучевая терапия при операбельном раке пищевода проводитсякурсами до и после операции. До операции лучевая терапия выполняется при недифференцированных и инфильтративной формах рака, а также при локализации опухоли в средней трети пищевода, то есть в анатомической области, где сложно выполнить радикальное удаление опухолевых тканей. После операции она проводится, если при хирургическом вмешательстве не удалось радикально убрать опухоль или если существует риск обсеменения окружающих тканей раковыми клетками. При неоперабельных опухолях лучеваятерапия используется в составе комплексных схем лечения с различными химиотерапевтическими препаратами. Например, применение комбинации цисплатины и 5-фторурацила в сочетании с лучевой терапией в дозе 50 Гр на область опухоли почти в 20% случаев приводит к полной регрессии опухоли.
Рак пищевода – опухоль, чувствительная к химиотерапии. Эффективность монотерапии при лечении такими препаратами, как фарморубицин, виндезин, блеомицин, митомицин, 5-фторурацил составляет от 15 до 20%. Использование схем комбинированной терапии с включением в их состав цисплатнины, позволяет достигнуть 40% эффективности при диссеминированном и до 70% при местнораспространенном опухолевом процессе.
Основным методом профилактики рака пищевода является выделение групп риска и обязательная диспансеризация пациентов, входящих в них. Для этого необходимо, чтобы врачи поликлиник проявляли онконастороженность при наблюдении пациентов с хроническим эзофагитом, пищеводом Баррета, стриктурами пищевода, ахалазией кардии и грыжей пищеводного отверстия диафрагмы, а сами пациенты не пренебрегали регулярными диагностическими обследованиями. Приранней диагностике рака пищевода возможности современной медицины позволяют эффективно лечить это заболевание.
Лазерная реканализация опухоли толстой кишки
Колоректальный рак занимает третье место в структуре онкологической патологии в большинстве развитых стран мира, а количество пациентов с запущенными формами заболевания достигает 70% [2]. Наибольшая смертность при этом регистрируется в странах Западной Европы (34,3 человека на 100 000 населения), а наименьшая – в США (15,2 человек на 100 000 населения) [1, 6, 9, 21, 24]. В Республике Беларусь также отмечается рост заболеваемости колоректальным раком. За последние 11 лет (с 1990 по 2011 гг.) число пациентов с впервые установленным диагнозом рака данной локализации увеличилось с 12,9 до 19,5 человек на 100 тысяч населения [4].
До 70% пациентов доставляется в стационар в экстренном порядке (при этом в абсолютном большинстве случаев развившиеся осложнения стали первым проявлением болезни). Самое частое осложнение колоректального рака – обтурационная кишечная непроходимость. Она развивается у 26,4–69% больных [7, 17]. Наиболее характерно это осложнение для опухолей левых отделов толстой кишки (67–72%), что связано с особенностями местного роста (эндофитный, циркулярный), спецификой интрамурального лимфооттока, а также большей плотностью опухоли этой локализации и меньшим диаметром кишки [16, 18, 19, 20, 23]. От колоректального рака ежегодно в мире погибает более ста тысяч человек [22]. По официальным данным, в Республике Беларусь в 2009 г. всего от рака толстой кишки умерло 2173 человека, или 22,9 на 100 тысяч населения (городских жителей – 1628, или 23,1 на 100 тысяч населения, сельских жителей – 545 или 22,2 на 100 тысяч населения); в 2011 г. от этой локализации рака умерло 2278 человек или 24,0 на 100 тысяч населения (городских жителей – 1750 или 24,5 на 100 тысяч населения, сельских жителей – 528 или 22,7 на 100 тысяч населения) [13, 14]. При этом в большинстве экономически развитых стран мира на сто вновь выявленных больных раком ободочной и прямой кишки приходится более 70 умерших, из которых на первом году с момента установления диагноза погибает около 40% пациентов. Эта закономерность обусловлена тем, что при первичном обращении пациентов к врачу запущенные формы рака (III–IV стадия) диагностируются у 71,4% пациентов с раком ободочной кишки и у 62,4% – в случаях заболевания раком прямой кишки [15].
Развитые страны мира несут огромные экономические потери в связи с поражением населения колоректальным раком. Например, в США стоимость комплексного лечения больных с этой локализацией рака занимает второе место по затратам на лечение онкобольных, составляя 6,5 миллиарда долларов в год [6].
До настоящего времени хирургическая тактика при обтурационной толстокишечной непроходимости на фоне колоректального рака продолжает оставаться предметом оживленной дискуссии. Нет общепринятых подходов к выбору методов хирургического пособия и завершения операции, что требует дальнейшего научного поиска и изучения возможности реализации новых направлений решения проблемы.
Одним из способов реканализации зоны стеноза является лазерная вапоризация центральной части раковой опухоли. Для эффективного испарения и коагуляции ткани опухолей желудочно-кишечного тракта используют различные модели высокоэнергетических лазеров, совместимые с эндоскопическим комплексом. При этом наибольшую популярность приобрели аргоновый лазер (длина волны 514 нм), полупроводниковый лазерный скальпель (970 нм) и неодимовый лазер на алюмоиттриевом гранате (Nd:YAG-лазер,1064 нм) [3, 8, 10, 11, 23]. Достаточно быстрое достижение порога вапоризации при контактном методе применения лазерного излучения способствует быстрому испарению патологической ткани, которое, в свою очередь, обеспечивает эффективное охлаждение и предупреждение глубокого ожога тканей кишки [3].
В настоящее время методической информации по применению лазерного излучения в хирургической эндоскопии явно недостаточно. Хирургами используются различные по своей технике и режимам инсталляции лазерного излучения приемы фотодеструкции патоло- гических тканей. Это отрицательно сказывается на частоте, эффективности и безопасности применения лазерного излучения в практике внутрипросветной гастроинтестинальной эндоскопии, вызывает обоснованную неуверенность у большинства практических эндоскопистов, не имеющих надлежащих условий для отработки оптимальных методик в эксперименте и на практике [3, 10, 12].
Повысить эффективность комплексного лечения стенозирующего колоректального рака путем разработки и внедрения технологии лазерной реканализации опухоли и ускоренной подготовки пищеварительного тракта к радикальному хирургическому лечению с первичным восстановлением непрерывности пищеварительного тракта.
Проведено проспективное клиническое исследование с оценкой результатов лечения 24 пациентов со стенозирующим колоректальным раком, обусловившим развитие непроходимости кишечника. Возраст пациентов варьировал от 54 до 81 года (в среднем 62,4 ± 7,32 года). Женщин было 13 (54,2%), мужчин – 11 (45,8%). У всех пациентов имели место признаки толстокишечной непроходимости: неотхождение стула и газов в течение последних 2–4 суток, вздутие живота, пневматоз толстой кишки (выявляемый перкуторно и рентгенологически) с дилятацией ее просвета в 2–2,5 раза, пневматоз тонкой кишки. Пациенты разделены на 2 группы (таблица).
| Локализация стенозирующей опухоли | Основная группа (n=10) | Контрольная группа (n=14) |
|---|---|---|
| Рак прямой кишки | 3 | 4 |
| Рак ректосигмоидного отдела толстой кишки | 3 | 5 |
| Рак сигмовидной кишки | 2 | 3 |
| Рак нисходящего отдела | 2 | 3 |
В первой (основной) группе при поступлении пациентов в стационар (до 24 часов) всем им выполняли лечебно-диагностическую ректо- или колоноскопию, во время которой (после установления диагноза стенозирующей опухоли толстой кишки и биопсии) производили лазерную вапоризацию внутренней части опухоли с восстановлением просвета пищеварительной трубки в зоне опухоли не менее чем на 0,8–1 см. После лазерной реканализации пациентам выполняли сифонную клизму, которая в 100% случаев приводила к эффективному антеградному опорожнению толстой кишки. Пациентам назначали слабительные и вазелиновое масло. В комплекс лечения включали ежедневную инфузионную терапию (кристаллоидные и коллоидные растворы, калий-поляризующую смесь, по показаниям – препараты парентерального питания), внутривенно вводили диаветол 15–20 мг/кг (по сухому веществу), эмоксипин 1,5–2,5 мг/кг, пентоксифиллин 0,2%-ный раствор 200–400 мл/сутки и реамберин 400–800 мл/сутки (или цитофлавин 10 мл раствора в 100 мл 0,9%-ного раствора хлорида натрия). Через 4–6 суток, не выписывая пациента из стационара, в состоянии клинико-метаболической компенсации выполняли радикальную операцию с первичным восстановлением непрерывности пищеварительного тракта (только у 1 пациента реканализация опухоли стала окончательной симптоматической операцией ввиду тяжести фоновой патологии с декомпенсацией функции сердечно-сосудистой системы). В качестве радикальных вмешательств выполнены резекция сигмовидной кишки (2), передняя низкая резекция прямой кишки (6), левосторонняя гемиколэктомия (1) с первичным восстановлением непрерывности пищеварительного тракта с помощью циркулярного механического шва.
Во второй (контрольной) группе при безуспешности консервативных мероприятий после предоперационной подготовки (от 6 до 25 ча- сов) выполнены неотложные вмешательства: левосторонняя гемиколэктомия с концевой трансверзостомией (2), операция типа Гартмана – обструктивная резекция сигмовидной кишки с концевой сигмостомией (6), петлевая сигмостомия (4), трансверзостомия (2).
Отрабатывая режим вапоризации, было установлено, что наиболее эффективное расстояние от торца кварцевого световода до облучаемой ткани составляет 3–5 мм. При этом обработку выступающей части опухоли производили в сканирующем режиме по периметру стенозирующей опухолевой ткани. Контакт торца световода с тканью приводил к обгоранию световода с последующим снижением эффективности вапоризации.
Процедура лазерной реканализации продолжалась от 25 до 65 ми- нут (в среднем 40,0 ± 11,4 минуты). Лазерную вапоризацию внутренней части опухоли проводили до восстановления просвета пищеварительной трубки в зоне опухоли не менее чем до 0,8–1 см. В 5 случаях (50%) потребовалась повторная лазерная вапоризация опухолевой ткани для достижения целевых размеров реканализации. Даже при неполном восстановлении просвета толстой кишки в зоне опухоли уже в первые сутки после манипуляции у пациентов обильно отходили газы, у 40% был самостоятельный стул. Через сутки у всех пациентов отсутствовали клинико-рентгенологические признаки непроходимости толстой кишки. Максимальный эффект реканализации отмечен спустя 3–4 дня после лазерной процедуры (рис. 2), что было обусловлено постепенным отторжением некротических тканей в просвет кишки. Кровотечений, связанных с отторжением девитализированных опухолевых тканей, отмечено не было.
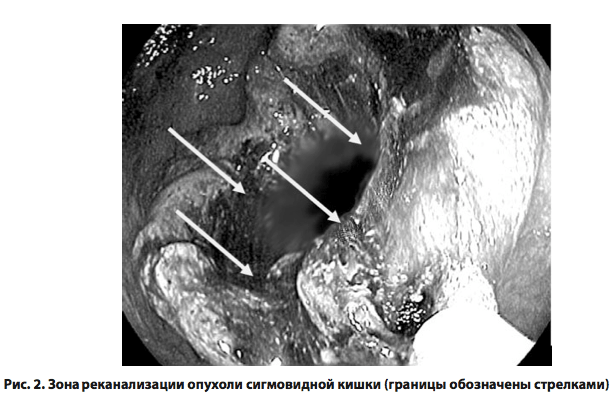
Проведенная лазерная реканализация позволила провести адекватную подготовку толстой кишки и выполнить плановую радикальную резекцию сигмовидной кишки без осложнений. После лазерной деструкции и восстановления просвета толстой кишки в зоне опухоли ставили сифонную клизму, проведение которой приводило к обильному отхождению стула и газов. Пациентам назначали слабительные и вазелиновое масло. В комплекс лечения включали ежедневную инфузионную терапию (кристаллоидные и коллоидные растворы, калий- поляризующую смесь, по показаниям – препараты парентерального питания), внутривенно вводили диаветол 15–20 мг/кг (по сухому веществу), эмоксипин 1,5–2,5 мг/кг, пентоксифиллин 0,2%-ный раствор 200–400 мл/сутки и реамберин 400–800 мл/сутки (или цитофлавин 10 мл раствора в 100 мл 0,9%-ного раствора хлорида натрия). Последние позволили в 90% случаев в течение 2–3 суток добиться клинико- метаболической компенсации и восстановления моторно-эвакуаторной функции пищеварительного тракта.
Через 4–6 суток, не выписывая пациента из стационара, в состоянии клинико-метаболической компенсации выполняли радикальную операцию с первичным восстановлением непрерывности пищеварительного тракта (только у 1 пациента 83 лет реканализация опухоли стала окончательной симптоматической операцией ввиду тяжести фоновой патологии с декомпенсацией функции сердечно-сосудистой системы на фоне ИБС, постинфарктного крупноочагового кардиосклероза с недостаточностью кровообращения 2А, аневризмой восходящего отдела аорты, артериальной гипертензией III, риск 4). В качестве радикальных вмешательств в этой группе пациентов выполнены резекция сигмовидной кишки (2), передняя низкая резекция прямой кишки (6), левосторонняя гемиколэктомия (1) с первичным восстановлением непрерывности пищеварительного тракта с помощью циркулярного механического шва. Осложнений в послеоперационном периоде зарегистрировано не было. Все пациенты были выписаны из стационара в удовлетворительном состоянии для реабилитации в амбулаторных условиях. Средний койко-день (с учетом первого этапа лечения) составил 17,3 ± 6,72.
В группе сравнения при безуспешности консервативных мероприятий после предоперационной подготовки (от 6 до 25 часов) выполнены неотложные вмешательства: левосторонняя гемиколэктомия с концевой трансверзостомией (2), операция типа Гартмана – обструктивная резекция сигмовидной кишки с концевой сигмостомией (6), петлевая сигмостомия (4), трансверзостомия (2). Выраженные признаки непроходимости кишечника потребовали интраоперационного использования различных методик зондовой декомпрессии кишечника в 71,4% случаев. Послеоперационный период у всех пациентов протекал тяжело. Во всех наблюдениях он требовал применения дополнительных способов восстановления моторно-эвакуаторной функции пищеварительного тракта (интестинального диализа, фармакологической стимуляции кишечника), проведения вспомогательных методик афферентной терапии и системного антибактериального лечения. Несмотря на интенсивное лечение, у ряда пациентов этой группы зарегистрированы послеоперационные осложнения: пневмония (14,3%), инфекция области послеоперационного вмешательства (35,7%), тромбофлебит глубоких вен (7,1%). Средний койко-день у пациентов этойгруппы составил 28,7 ± 9,28 дней.
1. Лазерная реканализация опухоли толстой кишки позволяет в условиях непроходимости кишечника выполнить раннюю антеградную декомпрессию пищеварительного тракта с быстрым восстановлением его моторно-эвакуаторной функции и раннейклинико-метаболической компенсацией (без лапаротомии и формирования кишечного свища). Предлагаемый подход позволяет в ограниченные сроки осуществить подготовку пациента к радикальному вмешательству, не выписывая его из стационара, способствует повышению надежности хирургического лечения и эффективности одномоментного восстановления непрерывности пищеварительного тракта.
4. В условиях запущенности онкологического процесса или наличия абсолютных противопоказаний к хирургическому лечению лазерная реканализация (изолированная или в сочетании со стентированием просвета толстой кишки) может стать окончательным вариантом лечебного пособия в условиях прогрессирования признаков кишечной непроходимости.
Читайте также:

