Что такое монотерапия при раке поджелудочной железы
Клетки рака поджелудочной железы переваривают собственные белки, которые могут выдать их иммунной системе.
Иммунитет должен уничтожать не только вирусы с бактериями, но и злокачественные клетки. Но у злокачественных клеток есть разные уловки, которые позволяют им оставаться незаметными для иммунитета. Однако если иммунной системе, так сказать, открыть глаза, то она увидит опухоль и начнёт её истреблять. Суть иммунотерапии в том и заключается, чтобы активировать противораковые свойства иммунитета. Здесь используют разные подходы, и два иммунотерапевтических открытия даже удостоились недавно Нобелевской премии.
Но разные виды рака по-разному реагируют на иммунотерапию, и рак поджелудочной железы в этом смысле один из самых стойких. Он не реагирует как раз на «нобелевские « методы терапии, основанные на том, что у иммунитета в прямом смысле отключают тормоза.
У иммунной системы есть предохранители, клетки и молекулы, которые следят, чтобы защитная реакция была по делу и адекватна угрозе – чтобы иммунитет не впадал в агрессию без повода и чтобы иммунная активность утихала по мере исчезновения опасности. В число таких предохранителей входят белки PD-1 и CTLA-4, сидящие на поверхности Т-лимфоцитов, которые обычно уничтожают больные клетки, в том числе и раковые.
PD-1 и CTLA-4 успокаивают Т-лимфоциты, то есть если PD-1 и CTLA-4 активны, Т-лимфоциты никого не убивают. Раковые клетки как раз поддерживают PD-1 и CTLA-4 во включённом состоянии, так что иммунитет опухоль игнорирует. Но если отключить PD-1 и CTLA-4 – иными словами, сорвать лимфоцитам тормоза – то иммунная система начнёт охотиться на раковые клетки.
Но и Т-лимфоциты с сорванными тормозами всё равно почему-то не трогают клетки рака поджелудочной железы. Тут может быть несколько причин. Во-первых, активность иммунных клеток зависит не только от этих двух белков. И в самой раковой опухоли могут быть какие-то другие клетки, которые усыпляют бдительность Т-лимфоцитов, используя какие-то другие клеточно-молекулярные механизмы. Во-вторых, собственно у раковых клеток могут быть особенности, из-за которых лимфоциты просто не могут их обнаружить.
Почему иммунные клетки начинают атаковать раковые? Потому что иммунные клетки чувствуют на поверхности раковых клеток особые молекулы, которые выдают раковые клетки с головой. Но особые раковые молекулы не появляются на поверхности клеток просто так. На днях мы писали о белках главного комплекса гистосовместимости (MHC), или человеческих лейкоцитарных антигенах (HLA), которые служат чем-то вроде клеточного паспорта: они сидят на клеточной мембране и держат на себе обломки разных клеточных белков.
Иммунные клетки проверяют, что держат на себе белки MHC: если они держат обломки обычных клеточных белков, то клетка здорова и трогать её не надо; если же они держат обломки вирусных или бактериальных молекул, то клетка инфицирована и её нужно уничтожить. И если белки MHC держат обломки других белков, которые присущи раковым клеткам, то такую клетку тоже нужно уничтожить.
Говорят, что белки MHC занимаются презентацией антигенов – молекул, на которые иммунная система может отреагировать. И если в генах MHC случается мутация, то они уже не могут показывать иммунным клеткам разные антигены, или показывают их плохо. Некоторые раковые клетки спасаются от иммунитета как раз благодаря тому, что в генах MHC у них мутированы.
Но рак поджелудочной железы в этом смысле особенный: мутации в генах MHC у него встречаются не более чем в 1% случаев, и одновременно в клетках рака поджелудочной в более чем 60% случаев уровень MHC ниже должного, или же MHC вовсе отсутствуют (что особенно заметно у метастазных клеток).
Исследователи из Нью-Йоркского университета пишут в Nature, что клетки рака поджелудочной избавляются от белков MHC с помощью важного клеточного процесса под названием аутофагия. С помощью аутофагии клетка переваривает ставшие ненужными белки и целые органеллы, чтобы из их запчастей снова сделать что-нибудь полезное (кстати, за расшифровку механизма аутофагии тоже дали Нобелевскую премию несколько лет назад). То, что нужно переварить, расщепить, разобрать на части, метится специальной меткой, после чего помеченный мусор упаковывается в мембранный пузырёк – аутофагосому; потом аутофагосома сливается с другим мембранным пузырьком – лизосомой, которой содержатся расщепляющие ферменты.
Если у подопытных мышей с раком поджелудочной аутофагию каким-то образом подавляли, то у мышей активировались Т-лимфоциты, задача которых была в истреблении раковых клеток – эти Т-лимфоциты массово приходили в опухоль, а если мышам ещё и давали иммунотерапевтические препараты, то болезнь у животных заметно отступала.
На самом деле, как пишет портал Nature, специалисты давно знали о том, что для рака поджелудочной железы аутофагия очень и очень важна; неясно было только, чем именно аутофагия так полезна именно раковым клеткам. Также сравнительно давно блокируют одну из стадий аутофагии; оба вещества, которые уже не одно десятилетие используют как средство от малярии, испытывали против злокачественных опухолей, но результаты тогда получались не слишком выдающиеся.
Возможно, что после новых данных интерес к противораковым свойствам хлорохина снова воскреснет, и рак поджелудочной железы можно будет успешно лечить иммунотерапевтическими методами, усиленными этим противомалярийным средством или же его аналогом.
Рак поджелудочной железы (РПЖЖ) — это одно из самых смертельных заболеваний среди солидных опухолей. Ежегодно регистрируется более 250000 смертей от рака поджелудочной железы. Он является восьмой по частоте причиной смерти от злокачественных новообразований у мужчин и женщин во всем мире, а заболеваемость РПЖЖ варьируется от 1 до 10 случаев на 100000 человек. Проблема рака поджелудочной железы актуальна в современной медицине, так как большинство пациентов с локальным или метастатическим РПЖЖ не являются кандидатами на лечебную резекцию из-за чрезвычайно неблагоприятного прогноза.
Несмотря на огромный прогресс в лечении других злокачественных опухолей благодаря прорыву в иммунотерапии рака, лечение рака поджелудочной железы развивалось медленно в течение последних двух десятилетий. Неэффективность иммунотерапии РПЖЖ объясняется несколькими факторами, в том числе слабой иммуногенностью опухоли (мутантные белки, экспрессируемые на поверхности опухолевых клеток РПЖЖ, обладают слабыми антигенными свойствами, по сравнению, к примеру, с антигенами меланомы или рака легкого), а также наличием иммуносупрессивных свойств как у самой опухоли, так и у ее микроокружения. Не последнюю роль в резистентности к терапии играет десмопластическая строма опухоли, состоящая из фибробластов, клеток поджелудочной железы, иммунных клеток, кровеносных сосудов и белков внеклеточного матрикса. Помимо уже упомянутых иммуносупрессивных свойств, она играет роль физического барьера, препятствующего доставке терапевтических агентов к опухолевым клеткам. Взаимодействие опухолевых клеток с микроокружением может приводить как к усилению роста опухоли и подавлению иммунного ответа на нее, так и к нарушению ее развития, что делает опухолевое микроокружение хорошей целью для терапевтического воздействия. Совокупностью этих факторов обосновывается неэффективность традиционной иммунотерапии. Это поднимает необходимость разработки и внедрения новых, улучшенных способов лечения РПЖЖ с помощью различных иммунологических методик, а также подготовки комбинированных схем терапии с применением различных препаратов или иных методов (например, лучевая терапия).
Устранение иммуносупрессивных свойств опухолей — это один из зарекомендовавших себя подходов в иммунотерапии рака. Ингибирование иммуносупрессивных молекул CTLA-4 и PD-1 — неплохой метод, который проявил себя в лечении таких видов рака как меланома, уротелиальная карцинома, рак почки, гепатоцеллюлярный рак и др. CTLA-4 (цитотоксический лимфоцитарный антиген 4) представляет собой ингибирующий рецептор, локализующийся на CD4+ и CD8+ лимфоцитах. Его экспрессия повышена в опухолях, и было показано, что блокада CTLA-4 вызывает противоопухолевый иммунный ответ. Препарат ипилимумаб — это человеческое моноклональное антитело, нацеленное на CTLA-4. Однако несмотря на его эффективность в терапии других опухолей, клинические испытания ипилимумаба в терапии РПЖЖ не показали эффективных результатов. Другой супрессивной молекулой является programming death 1 (PD-1, рецептор запрограммированной смерти 1). Он экспрессируется на эффекторных Т-лимфоцитах, B-лимфоцитах, NK-клетках и Treg. При связывании со своим лигандом PD-1L этот рецептор активирует ингибирование активации и пролиферации лимфоцитов. Терапия моноклональными антителами против PD-1 (препараты пембролизумаб и ниволумаб) также была эффективна при лечении солидных опухолей, таких как меланома, рак почки и урогенитальная карцинома. Также применяются моноклональные антитела против PD-1L (атезолизумаб). Однако клинические испытания на РПЖЖ не показали эффективности данных методов.
Другим подходом к лечению злокачественных новообразований является стимуляция собственного иммунитета организма пациента с помощью противоопухолевых вакцин. Такие вакцины предназначены для увеличения представления опухолевых антигенов и активации антигенспецифичных эффекторных Т-лимфоцитов и Т-клеток памяти. Выявлено несколько антигенов, которые экспрессируются в большинстве опухолей поджелудочной железы, как например карциноэмбриональный антиген (СЕА), муцин-1 (MUC-1) и белок, кодируемый мутированным геном KRAS. В настоящее время несколько вакцин были испытаны для терапии РПЖЖ. GVAX — это клеточная вакцина, в которой модифицированные клетки рака поджелудочной железы экспрессируют гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). Фаза I клинических испытаний показала безопасность данной вакцины, однако эффект от терапии был неоднозначный. Несмотря на то, что не было выявлено улучшения однолетней и общей выживаемости в группах пациентов, получавших данную вакцину в сочетании с химиолучевой терапией, и пациентов, получавших только адъювантную лучевую терапию, подгруппа пациентов с длительной безрецидивной выживаемостью показала увеличение опухолеспецифичных CD8+ Т-лимфоцитов после вакцинации. Это демонстрирует, что данная методика может использоваться в отношении некоторой группы пациентов. Другой тип вакцин, на основе опухолевых пептидов, также был исследован. Вакцина на основе мутантного белка KRAS, который мутирует больше чем в 90 % случаев РПЖЖ, давала появление иммунного ответа у 58 % пациентов, причем медиана выживаемости среди таких пациентов была в два раза выше, чем у группы, не развивших иммунный ответ. Другая мультипептидная вакцина OCV-C01, содержащая фрагменты рецептора фактора роста эндотелия сосудов 1 и 2 (VEGFR1 и VEGFR2 соответственно), а также белка семейства кинезина (KIF20A), была исследована на пациентах с РПЖЖ. 58,6 % испытуемых показали развитие иммунного ответа на KIF20A, что сопровождалось значительным улучшением безрецидивной выживаемости. Данные результаты свидетельствуют о перспективности использования противоопухолевых вакцин и необходимости установления новых антигенных детерминант, более специфичных для РПЖЖ.
Хорошие результаты вакцин и важность иммуносупрессивных свойств микроокружения опухоли для успешной терапии дают обоснования для комбинирования данных методик в терапии РПЖЖ. Клиническое исследование комбинированной терапии ипилимумабом и вакциной GVAX показало эффективность данного подхода, по сравнению с монотерапией ипилимумабом, а также безопасность данного сочетания препаратов. Эффективной оказалась и комбинация GVAX с ингибиторами PD-1, которая демонстрировала значительное увеличение средней общей выживаемости по сравнению с монотерапией. В группе пациентов, получавших оба препарата, обнаруживалось увеличение CD8+ T-лимфоцитов, продуцирующих IFN-gamma. Было показано, что пациенты, получавшие GVAX за 2 недели до резекции опухоли, демонстрировали увеличение уровня PD-L1, что указывает на один из механизмов иммунорезистентности. Таким образом, комбинация вакцин и ингибиторов иммуносупрессивных молекул является обоснованной и перспективной схемой терапии, требующей дальнейших исследований.
Новым подходом к лечению РПЖЖ являются методики, воздействующие на определенный компоненты стромы рака поджелудочной железы, о роли которой в резистентности к терапии было упомянуто ранее. Мезенхимальная строма РПЖЖ содержит большое количество фибробластов, продуцирующих белок-α активирующий фибробласты (FAP-α). Высокая экспрессия этого белка коррелирует с худшим прогнозом заболевания. В эксперименте на мышах ликвидация клеток, экспрессирующих FAP-α, повышала эффективность противоопухолевых вакцин. Эффективными оказались и комбинации данной методики с анти-CTLA-4 и анти-PD-L1 препаратами. Другое исследование было направлено на блокаду рецептора колониестимулирующего фактора 1 (CSF1R), который экспрессируется на ассоциированных с опухолью М2-макрофагах и супрессорных миелоидных клетках (MDSC). Данные клетки обладают способностью блокировать цитотоксический иммунный ответ. Ингибирование CSF1R в сочетании с химиотерапией улучшает противоопухолевый иммунитет. В мышиной модели трансплантации РПЖЖ лечение ингибиторами CSF1R приводило к усилению инфильтрации опухоли Т-клетками, однако эти клетки демонстрировали повышенные уровни CTLA-4, а также наблюдалось усиление экспрессии PD-L1 в опухоле. Этот факт делает обоснованным сочетание ингибиторов CSF1R и анти-CTLA-4, анти-PD-L1 препаратов. IMC-CS4 является CSF1R-антителом, которое в настоящее время проходит клинические испытания в сочетании с GVAX и анти-PD1 терапией. Еще одна важная молекула, а точнее пара молекул, была исследована в качестве мишени для терапии РПЖЖ. Хемокин CXCL12 широко представлен в микроокружении опухоли, а его рецептор CXCR4 экспрессирован на опухолевых клетках. Показано, что CXCL12 способствует хемотаксису опухолевых клеток, что указывает на перекрестное клеточное взаимодействие между опухолевыми клетками и стромой. Это взаимодействие оказалось значимым для иммунорезистентности РПЖЖ, так как при обработке опухоли AMD3100 моноклональным антителом к CXCR4, регистрировалось снижение роста опухоли, зависимое от Т-лимфоцитов. Комбинация AMD3100 с анти-PD-L1 препаратом также оказалась эффективной. На данный момент AMD3100 находится в I фазе клинических испытаний в качестве терапии РПЖЖ под торговым названием Мозобил (Mozobil). Помимо ингибирующих агентов моноклональные антитела могут использоваться и как агонисты различных рецепторов. CD40 является молекулой, располагающейся на поверхности иммунных клеток. При связывании со своим лигандом CD40L (который экспрессирован на CD4+ Т-хелперных клетках) активирует антигенпредставляющие клетки. Было продемонстрировано, что усиление действия CD40 повышает эффективность противоопухолевых вакцин. Моноклональные антитела, активирующие CD40, приводили к регрессии опухоли в сочетании с химиотерапией в доклинических исследованиях. В клинических испытаниях I фазы терапия агонистом CD40 в сочетании с химиотерапией привела к иммунному противоопухолевому ответу в 19 % случаев у пациентов с неоперабельной формой РПЖЖ. В мышиных моделях, сочетание анти-PD-1 или анти-CTLA-4 препаратов с агонистами CD40 усиливало противоопухолевый иммунитет. 39 % мышей, получавших подобную схему терапии, демонстрировали длительную полную ремиссию и продолжительную выживаемость. Также терапия привела к уменьшению Treg и увеличению CD8+ Т-лимфоцитов в микроокружении опухоли. Важно, что в экспериментах на мышах сочетание CD40 агонистов с анти-PD-1 или анти-CTLA-4 препаратами показало улучшенную среднюю выживаемость по сравнению с комбинацией химиотерапии и CD40 агониста. На данный момент моноклональное антитело-агонист CD40 R07009789 проходит клинические испытания в комбинации с химиотерапией и ингибиторами супрессорных молекул.
Таким образом, рак поджелудочной железы является важной проблемой в современной медицине. Традиционные подходы иммунотерапии, такие как ингибиторы иммуносупрессивных молекул и противоопухолевые вакцины, малоэффективны в качестве монотерапии при РПЖЖ. В то же время, комбинации специальных препаратов, воздействующих на компоненты микроокружения опухоли с традиционной иммунотерапией и химиотерапией показали многообещающие результаты. Требуется дальнейшее всестороннее изучение данного злокачественного новообразования для разработки эффективных методов лечения, в том числе и иммунотерапии.
Источники:
- Torphy R. J., Zhu Y., Schulick R. D. Immunotherapy for pancreatic cancer: Barriers and breakthroughs //Annals of Gastroenterological Surgery. — 2018.
- Bhosale R. R. et al. Current Perspectives on Novel Drug Carrier Systems and Therapies for Management of Pancreatic Cancer: An Updated Inclusive Review // Critical Reviews™ in Therapeutic Drug Carrier Systems. — 2018. — Т. 35. — №. 3.
Купирование боли
Боли низкой интенсивности можно купировать с помощью ацетилсалициловой кислоты (аспирина) или парацетамола, при болях средней интенсивности назначают опиаты внутрь (сульфат морфина по 20 мг 2 раза в сут), к которым можно добавить блокаторы Н1-рецепторов гистамина. При более интенсивных болях наркотические анальгетики вводят подкожно, внутривенно, эпидурально или интратекально. Бензодиазепины (диазепам по 2 мг 3 раза в сут) или хлорпромазин (по 25мг 3 раза в сут) усиливают эффект морфина у тревожных больных.
Наиболее эффективно купируют боли наркотические анальгетики, однако их применение ограничено развитием широкого спектра побочных реакций, включающих сухость во рту, запоры, тошноту, рвоту, сонливость, возможность развития галлюцинаций и бреда, что в целом может значительно уменьшать качество жизни. Кроме того, длительное применение наркотических анальгетиков закономерно вызывает развитие физической и психической зависимости.
Непереносимые боли можно уменьшить с помощью лучевой терапии. Для симптоматического лечения используют антацидные препараты, блокаторы Н2-рецепторов гистамина, препараты ферментов ПЖ, иногда — небольшие дозы глюкокортикоидов. Для купирования зуда, связанного с желтухой, назначают колестирамин (холестирамин) или фенобарбитал.
Закономерно к купированию болевого абдоминального синдрома приводит химиотерапия.
Химиотерапия
Оценка эффективности консервативных методов лечения рака ПЖ затруднительна. Это обусловлено тем, что растущая протоковая опухоль ПЖ вызывает десмопластические реакции окружающих тканей, опухоль состоит не только из злокачественных клеток, но и из воспалительных элементов и фиброзной ткани. Кроме того, забрюшинное расположение ПЖ и отсутствие реакции фиброзной ткани на успешную химиотерапию не позволяет уточнить расположение очагов и динамику заболевания при использовании современных диагностических методов, таких, как КТ, МРТ и УЗИ. Таким образом, традиционные современные методы оценки эффективности консервативной противоопухолевой терапии при раке ПЖ не всегда объективно отражают степень регрессии первичной опухоли и метастазов в отдалённых органах и тканях.
До сих пор рак ПЖ считают резистентной к химиолучевой терапии опухолью, поэтому основное внимание исследователи уделяют не столько получению объективного эффекта в виде регрессии опухоли, сколько достижению улучшения качества жизни и продления её.
Поскольку возможности инструментальной регистрации уменьшения опухоли ограничены, были предложены дополнительные показатели оценки эффективности противоопухолевого лечения, основные из которых — качество жизни и её продолжительность. Большое внимание уделяют купированию болевого синдрома и снижению суточной потребности в обезболивающих средствах. Клинические наблюдения показывают, что даже незначительное уменьшение размеров опухоли ПЖ, которое соответствует стабилизации болезни, может сопровождаться исчезновением болевого синдрома и улучшением общего физического статуса пациента.
Таким образом, лучевая терапия, химиотерапия и иммунотерапия — только паллиативное и, в целом, малоэффективное лечение.
В течение многих десятилетий в качестве стандартного препарата для паллиативного лечения рака ПЖ применяли фторурацилиею комбинации с другими цитостатиками. Фторурацил — синтетический аналог естественного пиримидинового основания урацила. В процессе распада фторурацила несколько его метаболитов оказывают повреждающее воздействие на синтез и функционирование ДИК и рибонуклеиновых кислот опухолевых клеток.
Основная мишень — фермент тимидилат синтетаза, контролирующий синтез нормальных тимидиновых нуклеотидов — угнетается метаболитом фторурацила 5-фтордезокси-уридин монофосфатом. Другой фармакологически активный метаболит 5-фтордезоксиуридин трифосфат встраивается в ДНК опухолевых клеток вместо трифосфата тимидина, что ведёт к её разрывам. Ещё один метаболит — 5-фторуридинтрифосфат встраивается в рибонуклеиновую кислоту и серьёзно повреждает её стабильность.
Эффективность монотерапии фторурацилом и различных комбинаций с ним при раке ПЖ крайне низка (0-20%), а средняя выживаемость составляет всего 5—6 мес. Из других цитостатиков, которые проявили противоопухолевую активность при клинических испытаниях, следует отметить цисплатин, эпирубицин, митомицин, стрептозоцин, тегафур (фторафур), эффект которых колеблется в пределах 0-10%.
У ряда врачей сложилось мнение, что химиотерапевтическое лечение существенно не повышает качество жизни у больных с перезектабельным раком ПЖ. Однако, клинические исследования по изучению различных схем химиотерапии при раке ПЖ показали, что химиотерапия — лучше, чем любая симптоматическая терапия, и уж тем более её отсутствие.
Рандомизированные исследования по применению фторурацила в комбинации с доксорубицином (адриамицином), митомицином и этопозидом по сравнению с симптоматической терапией показали достоверное увеличение выживаемости в группе больных, которым проводили химиотерапию.
Внедрение в клиническую онкологию новых оригинальных противоопухолевых препаратов с различным механизмом действия на опухолевую клетку привело к увеличению эффектавности химиотерапии. При изучении препаратов из группытаксановбыли изучены паклитакселидоцетаксел, эффективность которых оказалась 20%. Ралтитрексид (томудекс) оказался активным в 12%, а иринотекан (кампто) — в 11,4% случаев. Наибольшую противоопухолевую активность при раке ПЖ проявил гемцитабин — фторзамещённый аналог дезоксицитидина, близкий по структуре к цитарабину (цитозару). Однако, в отличие от последнего, гемцитабин более липофильный, вследствие чего он быстрее проходит через мембраны опухолевых клеток. У гемцитабина больший аффинитет к мишени — дезоксицидин киназе, его активный метаболит гемцитабин трифосфат дольше, чем цитозар, находится в опухолевой клетке.
При монотерапии гемцитабином частичное уменьшение опухоли происходит в 10,6—12,8%, а симптоматический эффект — в 23,8—43% случаев. Гемцитабин эффективен у больных, рефрактерных к фторурацилу. Таким образом, гемцитабин — наиболее перспективное средство для лечения генерализованного рака ПЖ и, несомненно, препарат первой линии. В последние годы предприняты попытки разработать новые, более эффективные комбинации противоопухолевых препаратов, каждый из которых в той или иной степени эффективен при раке ПЖ. Следует отметить, что большинство применённых схем включали гемцитабин (табл. 5-8).
Учитывая синергизм действия гемцитабина и препаратов платины, были проведены клинические исследования по изучению данной комбинации. Результаты таковы: общий лечебный эффект составляет 50—57%, частичное уменьшение опухоли отмечено в 17% случаев.
При применении цисплатина, эпирубицина, фторурацила и гемцитабина у больных диссеминированным раком ПЖ объективный эффект значительно выше — 58% случаев. Средняя длительность эффекта составляет 8,5 мес, а средняя выживаемость — 11 мес. Симптоматический эффект отмечен у 78% больных.
Предприняты попытки улучшить результаты лечения путём использования комбинации таксанов и гемцитабина — клиническое улучшение происходит у 23—44,4% больных.
Комбинация митомицина и гемцитабина показывает лечебный эффект у 28,5% больных, стабилизацию — у 50%, а симптоматический эффект — у 46,6% больных.
Учитывая экспериментальные данные о радиосенсибилизирующем эффекте гемдитабина, проводят химиолучевое лечение. Средняя выживаемость при этом составляет 17.3 мес.
Таким образом, несмотря на кажущиеся скромные результаты применения гемцитабина при распространённом раке ПЖ, исследования показывают, что средняя продолжительность жизни увеличивается с 4 до 8 мес, а клиническое улучшение общего состояния наступает более чем у половины больных.
Адъювантное и неоадъювантное лечение
Одно из направлений улучшения результатов при неоперабельном раке ПЖ — сочетание лучевой терапии и перспективных противоопухолевых лекарств — позволяет достичь объективного улучшения у 27% больных и средней выживаемости 8—15 мес при хорошей переносимости режима комбинированной терапии. Низкая эффективность методов хирургического и лучевого лечения рака ПЖ создала предпосылки для активного изучения адъювантного и неоадьювантного подхода к лечению рака ПЖ (табл. 5-9). Сводные данные по результатам адъювантного химиолучевого лечения представлены в табл. 5-10.
Попытка адъювантного лечения с помощью химиотерапии без сопутствующею облучения ложа удалённой опухоли не даёт хороших результатов.
Таким образом, адъювантная терапия стала значительной ступенькой в лечении рака ПЖ. Однако полноценное её использование ограничено, потому что только 20% больных операбельны на момент первичной диагностики. Максимальный эффект адъювантного лечения можно получить лишь у 4% всех больных.
Интерес к неоадьювантной терапии рака ПЖ основан на том, что лишь небольшой процент больных обращается в клинику на ранней стадии болезни. Значительно чаще на момент первичной диагностики опухоль распространяется на окружающие ПЖ ткани, вовлекая пара-панкреатическую клетчатку и соседние органы. Другое теоретическое обоснование применения предоперационного лечения — возможность предотвращения имплантационного метастазирования во время хирургического вмешательства. Глобальной задачей неоадъювантного подхода служит попытка увеличить возможность удаления опухоли до 40% (20% за счёт потенциально излечимых больных и 20% за счёт неизлечимых пациентов на момент первичной диагностики путём рестадирования).
Средняя выживаемость при неоадъювантной терапии составляет 12—14 мес. Использование в качестве неоадъювантного лечения только химиотерапии не приводит к достоверному увеличению выживаемости. Необходимо дальнейшее развитие этого метода для лечения рака ПЖ, что позволит увеличить процент резектабельности опухоли и увеличить сроки жизни больных.
Гормонотерапия и перспективы лечения
Считают, что рак ПЖ — опухоль гормонозависимая, в пользу чего свидетельствуют указанные нами ранее половые различия в частоте рака ПЖ (у мужчин чаще), а также обнаружение рецепторов стероидных гормонов. Однако была отмечена низкая способность связывания рецепторов гормонами в культуре клеток рака ПЖ у человека. В эксперименте было показано, что тестостерон может стимулировать рост опухолевых ктеток, а эстрогены — замедлять. Возникла идея применения антагонистов андрогенов и аналогов релизипг-гормонов, но эти попытки не увенчались успехом. У пожилых женщин в ряде исследований выявлено положительное влияние тамоксифена, однако механизм полученного эффекта не совсем ясен. Весьма интересны результаты исследований с применением октреотида (300—600 мг/сут), способствующего стабилизации опухолевого процесса в 27% случаев.
Разработан препарат маримастат — ингибитор опухолевых металлопротсиназ, принимающих участие в росте и метастазировании карциномы. Идут клинические испытания ингибитора фермента фарнезил трансферазы, необходимого для встраивания в клеточную мембрану белка K-ras. На этот протеин, уже встроенный в мембрану, способны действовать монотерпены. Реальные перспективы открылись с развитием генетических аспектов лечения рака ПЖ:
• клонирование участков ДНК, комплементарных мутантным;
• создание на их основе системы переносчиков, эффекторных векторов — рекомбннантного аденовирусного вектора, аденоассоциированных вирусных векторов (из ларвовирусов), катионного липидного комплекса (излилосом) и др.;
• комплементарное внедрение этой системы в культуру поражённых клеток, устранение дефекта.
Одно из перспективных направлений в лечении рака ПЖ — вакцинация. Она основана на развитии цитолитического Т-клеточного ответа при сенсибилизации Т-лимфоцитов опухолевыми антигенами. Сенсибилизацию проводят in vitiv, а затем сенсибилизированные лимфоциты вводят больному.
Ретинодды способны тормозить рост и метастазирование опухоли, повышать дифференцированность её клеток. Это действие усиливается при сочетании ретиноидов с интерфероном-а. Последний и сам обладает антипролиферативным эффектом.
В целом молекулярно-биологические разработки генной терапии, несомненно, радикальным образом изменят лечение рака ПЖ, но это пока ешё впереди. Изменить сложившуюся ситуацию способны только профилактические диагностические подходы, особенно у лиц с отягощенным анамнезом и наличием факторов риска.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
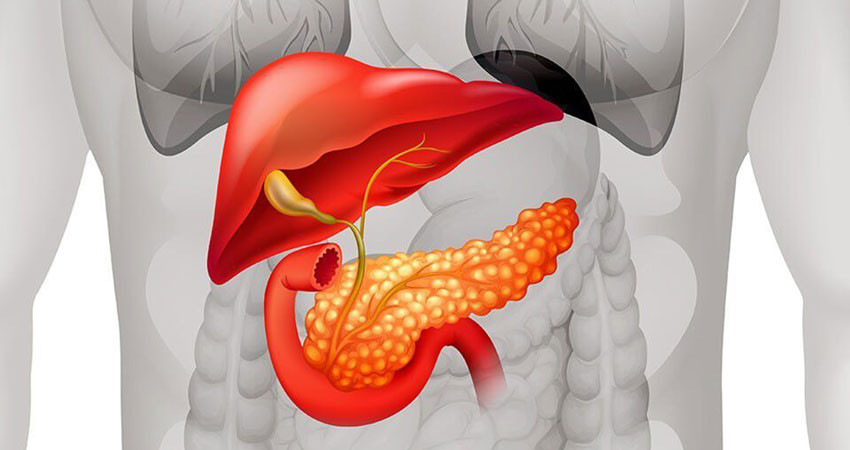
Рак поджелудочной железы относится к онкологическим заболеваниям, с которыми сложно бороться, и которые характеризуются относительно низкой выживаемостью. В течение 5 лет с момента установления диагноза в живых остаются лишь 9% больных. Рак поджелудочной железы нередко диагностируют в запущенной стадии, потому что не существует эффективного рекомендованного скрининга, злокачественная опухоль может долго не вызывать симптомов.
Тем не менее, пациенту можно помочь, даже если заболевание диагностировано на поздней стадии. В случаях, когда невозможно добиться ремиссии, врачи могут продлить жизнь пациента и избавить его от мучительных симптомов. Эффективное лечение можно получить в клинике Медицина 24/7.
Хирургическое лечение
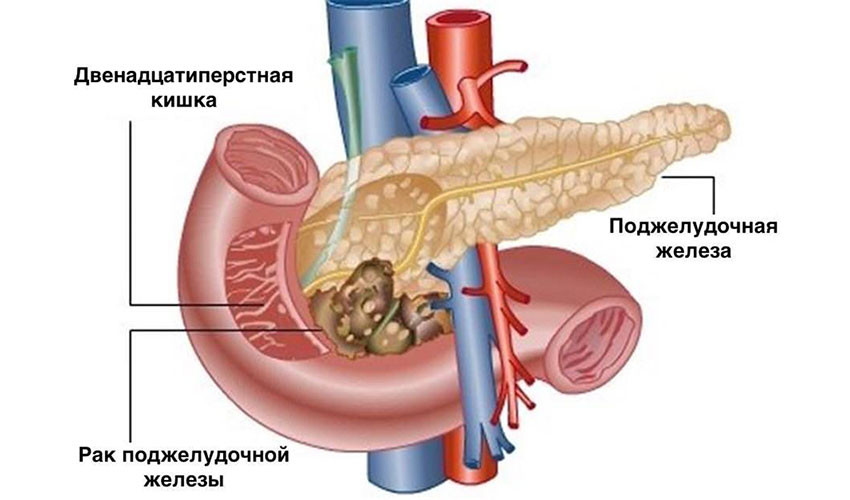
Хирургическое удаление опухоли — самый эффективный метод лечения рака поджелудочной железы. Это единственная реальная возможность достичь ремиссии. К сожалению, на момент постановки диагноза только у одного из пяти пациентов опухоль не успела распространиться за пределы поджелудочной железы, и лишь у некоторых из них рак можно полностью удалить. Обычно это узлы в головке органа: через неё проходит желчный проток, при его сдавлении развивается механическая желтуха, и эта симптоматика помогает рано диагностировать опухоль.
Операцию проводят, если хирург уверен, что он сможет удалить рак полностью. Циторедуктивные вмешательства, направленные на частичное удаление как можно большего количества опухолевой ткани, не проводятся, так как нет доказательств того, что они помогают продлевать жизнь пациентов.
При раке головки поджелудочной железы чаще всего выполняют операцию Уиппла. Во время нее удаляют головку органа, иногда вместе с телом, и часть окружающих органов: тонкой кишки, желчного протока, ближайшие лимфатические узлы, желчный пузырь, иногда часть желудка.
При резектабельном раке хвоста поджелудочной железы проводят дистальную панкреатэктомию: удаляют хвост поджелудочной железы, иногда вместе с телом, и селезенку.
В редких случаях встречаются ситуации, когда злокачественная опухоль распространилась по всей поджелудочной железе, но все еще является операбельной. При этом может быть выполнена тотальная панкреатэктомия: поджелудочную железу удаляют полностью, вместе с ней — желчный пузырь, часть желудка и тонкой кишки.

Паллиативные операции
Во время паллиативных операций не удаляют рак, их цель — избавить больного от симптомов, вызванных злокачественной опухолью. При раке головки поджелудочной железы нередко развивается механическая желтуха — состояние, вызванное сдавлением желчного протока и нарушением оттока желчи. У больного окрашиваются в желтый цвет кожа, слизистые оболочки и белки глаз, беспокоит кожный зуд, ухудшается общее состояние, прогноз.
С этим осложнением можно справиться тремя способами:
- Дренирование. Во время эндоскопической ретроградной холангиопанкреатографии (РХПГ) или чрескожной чреспеченочной холангиографии в желчные протоки устанавливают дренажную трубку. По ней желчь может оттекать наружу, в просвет двенадцатиперстной кишки или сразу в обоих направлениях. Это достаточно эффективно, но не очень удобно: дренажная трубка постоянно мешается, может случайно сместиться, выпасть.
- Стентирование — более современное решение. Эндоскопически, с помощью катетера, заведенного в желчные протоки из двенадцатиперстной кишки, в заблокированном участке устанавливают стент — трубку с сетчатой стенкой из полимера или металла. Он расширяет просвет протока и обеспечивает свободный отток желчи. Стентирование — быстрая и относительно безопасная процедура, ее выполняют без разрезов.
- Шунтирование — операция, во время которой хирург создает обходной путь для оттока желчи. По сравнению со стентированием, хирургическое вмешательство несет более высокий риск осложнений, его могут перенести не все больные. Но иногда оно позволяет более эффективно, надолго восстановить отток желчи. Во время операции можно перерезать нервы, которых беспокоят мучительные боли.
Насколько эффективна химиотерапия при раке поджелудочной железы?
Химиопрепараты довольно часто применяют при злокачественных опухолях поджелудочной железы. Они могут быть назначены с разными целями:
- Адъювантная химиотерапия проводится до операции, чтобы уменьшить объем опухоли.
- Неоадъювантная химиотерапия проводится после операции, чтобы снизить риск рецидива.
- Химиотерапия как основной метод лечения применяется при неоперабельных опухолях. Цель лечения в таком случае — не достичь ремиссии, а как можно дольше держать болезнь под контролем.
Чаще всего применяют такие химиопрепараты, как гемцитабин (Гемзар), оксалиплатин (Элоксатин), иринотекан (Камптозар), , цисплатин, капецитабин (Кселода). Обычно назначают комбинации из двух препаратов с разными механизмами действия, это помогает повысить эффективность лечения. Ослабленным пациентам назначают только один препарат риска серьезных побочных эффектов.
Эффективность лучевой терапии
Лучевую терапию при раке поджелудочной железы зачастую применяют вместе с химиопрепаратами. Такое лечение называется химиолучевой терапией. Ее назначают после операции, при неоперабельном раке.
Если опухоль находится в пограничном состоянии между резектабельной и нерезектабельной, после курса неоадъювантной лучевой терапии ее размеры могут уменьшиться так, что ее получится удалить хирургическим путем.
Также лучевую терапию при раке поджелудочной железы применяют в качестве симптоматического лечения, например, если беспокоят мучительные боли, и пациенту противопоказано хирургическое вмешательство.
Таргетная терапия
На поверхности раковых клеток в поджелудочной железе нередко увеличено количество молекул EGFR. Активируясь, он заставляет клетки быстро размножаться. Его можно заблокировать с помощью таргетного препарата эрлотиниб (Тарцева). Его часто назначают в сочетании с химиопрепаратом гемцитабином. Эффективность этой комбинации различается у разных онкологических больных.
Помогает ли иммунотерапия при раке поджелудочной железы?
Иммунная система человека должна не только атаковать чужеродные агенты, но и знать, когда пора остановиться, чтобы не навредить собственным тканям организма. Для этого в ней есть специальные сигнальные молекулы, подавляющие активность иммунных клеток. При раке эти молекулы начинают мешать. Они не дают иммунитету эффективно распознавать и уничтожать опухолевые клетки. Существуют препараты, которые могут заблокировать эти молекулы, они называются ингибиторами контрольных точек.
При раке поджелудочной железы ингибиторы контрольных точек могут быть полезны для пациентов, у которых выявлены определенные генетические отклонения: высокий уровень микросателлитной нестабильности, мутации в генах восстановления несоответствия (MMR).
В клинике Медицина 24/7 при многих типах рака можно пройти исследование, которое помогает выявить мишени для лекарственных препаратов, имеющиеся в раковых клетках пациента, и назначить оптимальную, персонализированную терапию.
Читайте также:





