Что такое матрикс опухоли
ГИСТОГЕНЕЗ И ЦИТОГЕНЕЗ ОПУХОЛЕЙ
МОРФОЛОГИЯ ОПУХОЛЕВОГО РОСТА
● Трансформации подвержены только пролиферирующие соматические клетки (поли- или унипотентные клетки-предшественники).
● Опухолевая клетка способна повторять в извращённой форме признаки дифференцировки (фенотип), заложенные в её клетке-предшественнице.
● В опухолевых клетках извращение дифференцировки вызвано её блоком. При блоке дифференцировки на уровне унипотентных клеток опухолевые клетки обладают минимальной фенотипической гетерогенностью. При блоке на уровне полипотентных клеток выражена фенотипическая гетерогенность опухолевых клеток, возникают клетки-химеры с множественной дифференцировкой.
● Дифференцировка опухолевых клеток зависит от уровня малигнизации клетки-предшественницы и уровня блока дифференцировки. Доброкачественные опухоли развиваются при трансформации унипотентных клеток с низким блоком дифференцировки, поэтому они построены из зрелых клеточных элементов. Для злокачественных опухолей характерен меньший уровень дифференцировки клеток по сравнению с доброкачественными, что связано с их развитием из полипотентных клеток, наличием высокого блока дифференцировки. Чем выше уровень малигнизации и блока дифференцировки, тем менее дифференцированная злокачественная опухоль возникает.
Опухоли состоят из паренхимы и стромы. Паренхима опухоли — собственно опухолевые клетки, возникшие в результате злокачественной трансформации исходной клетки и её клональной пролиферации. Строма в опухоли, как и в нормальной ткани, в основном, выполняет трофическую, модулирующую и опорную функции. Стромальные элементы опухоли представлены клетками и межклеточным матриксом соединительной ткани, сосудами, нервными окончаниями.
Межклеточный матрикс состоит из базальных мембран и собственно соединительнотканного матрикса.
● Базальные мембраны содержат коллагены типов IV, VI и VII, гликопротеины (ламинин, фибронектин, витронектин), протеогликаны (гепарансульфат и др.).
● Собственно соединительнотканный матрикс содержит коллагены типов I и III, фибронектин, протеогликаны и гликозаминогликаны.
В зависимости от развитости стромы различают опухоли органоидные и гистиоидные.
● Органоидные опухоли имеют паренхиму и развитую строму. Пример органоидных опухолей — опухоли из эпителия. При этом степень развитости стромы может быть различной: от узких редких фиброзных прослоек и сосудов капиллярного типа (медуллярный рак) до мощных полей фиброзной ткани с едва различимыми эпителиальными опухолевыми цепочками (фиброзный рак, или скирр).
● Гистиоидные опухоли. Преобладает паренхима, строма практически отсутствует, так как представлена лишь тонкостенными капиллярами, необходимыми для питания. По гистиоидному типу построены опухоли из соединительной ткани.
Роль стромы для опухоли не ограничена только трофическими и опорными функциями. Строма влияет на пролиферацию и дифференцировку опухолевых клеток, возможности инвазивного роста и метастазирования. Модифицирующее воздействие стромы на опухоль возможно благодаря наличию на клеточных мембранах опухолевых клеток интегринов, участвующих в передаче сигналов на элементы цитоскелета и далее — в ядро опухолевой клетки. Интегрины обеспечивают межклеточные взаимодействия между опухолевыми клетками, с клетками и межклеточным матриксом стромы, определяя способность опухоли к инвазивному росту и метастазированию.
Молекулы адгезии — важный компонент клеточных мембран опухолевых клеток, обеспечивающий их взаимодействие между собой и с компонентами стромы. При опухолевой трансформации происходит изменение структуры и экспрессии молекул адгезии, входящих в состав клеточных мембран. Это приводит к нарушению взаимосвязи между опухолевыми клетками, следовательно, к инвазивному росту и метастазированию.
Происхождение стромы опухоли. Получены убедительные данные о возникновении клеточных элементов стромы опухолей из нормальных соединительнотканных предшественников окружающих тканей. В 1971 г было показано, что клетки злокачественных опухолей синтезируют фактор, стимулирующий пролиферацию элементов сосудистой стенки и рост сосудов (фактор Фолькмана). Это вещество белковой природы — группа факторов роста фибробластов. Фолькман первым показал, что образование стромы опухоли — результат сложных взаимодействий между опухолевой клеткой и клетками соединительной ткани.
Важную роль в образовании стромы опухоли выполняют соединительнотканные клетки местного (гистиогенного) и гематогенного происхождения. Стромальные клетки синтезируют факторы роста, стимулирующие пролиферацию клеток мезенхимального происхождения (фактор роста фибробластов, ФНО-α, фибронектин, инсулиноподобные факторы роста — соматомедины и др.), онкобелки (c-sis, c-myc). Одновременно клетки стромы экспрессируют рецепторы, связывающие факторы роста и онкобелки. Это стимулирует пролиферацию клеток как по аутокринному, так и по паракринному пути. Кроме того, сами клетки стромы способны выделять разнообразные протеолитические ферменты, приводящие к деградации межклеточного матрикса.
Опухолевые клетки активно участвуют в образовании стромы. Трансформированные клетки стимулируют пролиферацию соединительнотканных клеток по паракринному регуляторному механизму, синтезируют факторы роста и онкопротеины. Клетки опухоли синтезируют сами и стимулируют клетки соединительной ткани к синтезу компонентов межклеточного матрикса. Компоненты матрикса имеют характерный состав, что можно использовать при дифференциальной диагностике опухолей. Кроме того, опухолевые клетки синтезируют ферменты (коллагеназы и др.), их ингибиторы и активаторы, способствующие или препятствующие инфильтрирующему и инвазивному росту злокачественных опухолей. Динамическое равновесие между коллагеназами, их активаторами и ингибиторами обеспечивает стабильное состояние опухоли и препятствует её прорастанию в прилежащие ткани. В момент роста опухолевые клетки активно синтезируют коллагеназы, эластазы и их ингибиторы.
Злокачественные опухоли часто образуют строму, где преобладает эмбриональный тип коллагена стромы соответствующего органа. Например, в строме рака лёгкого преобладает коллаген типа III, характерный для эмбрионального лёгкого. Разные опухоли имеют разный состав коллагенов стромы. В карциномах, как правило, преобладают коллагены типа III (рак лёгкого), IV (почечно-клеточный рак, нефробластомы), в саркомах — интерстициальные коллагены. Однако в хондросаркоме много коллагена II, а в синовиальной саркоме — коллагена IV. Описанные различия состава стромы важно учитывать при дифференциальной диагностике сарком.
Образование стромы в опухоли — сложный процесс, включающий следующие стадии.
● Секреция опухолевыми клетками митогенных цитокинов — факторов роста и онкопротеинов, стимулирующих пролиферацию соединительнотканных клеток, прежде всего, эндотелия, фибробластов, миофибробластов, гладкомышечных клеток.
● Синтез опухолевыми клетками компонентов межклеточного матрикса: коллагенов, ламинина, фибронектина и др.
● Пролиферация и дифференцировка клеток-предшественниц соединительнотканного происхождения, секреция ими компонентов межклеточного матрикса, формирование тонкостенных сосудов капиллярного типа, в совокупности составляющих строму опухоли.
● Миграция в строму опухоли клеток гематогенного происхождения: моноцитов, плазмоцитов, лимфоцитов, тучных клеток и др.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Невус сальных желез (син. невус Ядассона) — редкий врожденный порок развития. Обычно обнаруживается на волосистой части головы, изредка на лице в виде тонкой, мягкой, оранжевой бляшки диаметром 1—2 см. Примерно у 10 % больных на месте невуса сальных желез развивается базально-клеточный рак. Под микроскопом этот порок характеризуется наличием большого количества зрелых сальных желез, а также эпидермальных кист, расширенных потовых желез и недоразвитых волосяных фолликулов.
Рак сальных желез (син. светлоклеточный рак кожи) — крайняя редкость. Болеют люди пожилого возраста. Локализация любая, преобладают язвенно-инфильтративные формы роста. Под микроскопом паренхима опухоли обычно представлена как солидными комплексами, осуществляющими инвазию и сформированными из крупных полиморфных себоцитов с пенистой цитоплазмой, так и мелких клеток с единичными точечными включениями жира. Встречаются фигуры митоза. Местами опухоль напоминает липосаркому, от которой ее в первую очередь и следует дифференцировать.
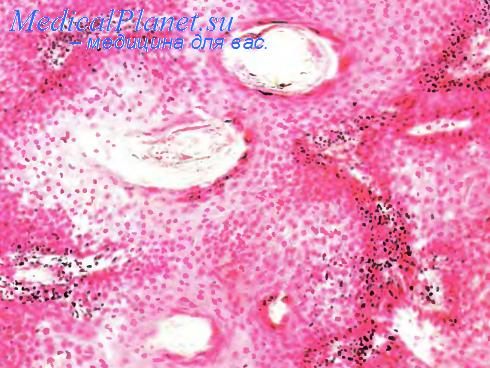
Трихоэпителиома
Трихоэпителиома (син. трихоэпителиоматозный невус) — доброкачественная опухоль, встречается у лиц обоего пола, обычно в период полового созревания. Локализация повсеместная. Макроскопически опухоль представляет собой несколько папул, иногда одиночную бляшку. Под микросколом видно, что паренхима трихоэпителиомы состоит из порочно развитых волосяных фолликулов, эпидермальных кист и солидных пластов, построенных из светлых клеток, аналогичных наружным элементам корневого влагалища волосяного фолликула. Внутри кист встречаются массы кератина или извести.
Родственные формы трихоэпителиомы: трихобазалиома, отличающаяся от трихоэпителиомы наличием базалиомных структур с пилоидной дифференцировкой; трихо фолликул ома развивается в глубине дермы и содержит особенно много уродливо развитых волосяных фолликулов с разрастаниями светлых клеток, подобных элементам наружного волосяного влагалища, и с гиалиновыми мембранами вокруг этих разрастаний; аденоидкистозная эпителиома Брука (син.: железисто-кистозная эпителиома Брука, трихоэпителиоматозный аденоид-кистозный невус). Последняя форма часто появляется на липе, шее или голове в период полового созревания. У нее нет эпидермальных кист, но имеется сочетание порочно развитых волосяных фолликулов и потовых желез, часть которых кистозно-расширены и могут содержать роговые массы. Все эти формы следует дифференцировать от разновидностей базально-клеточного рака.
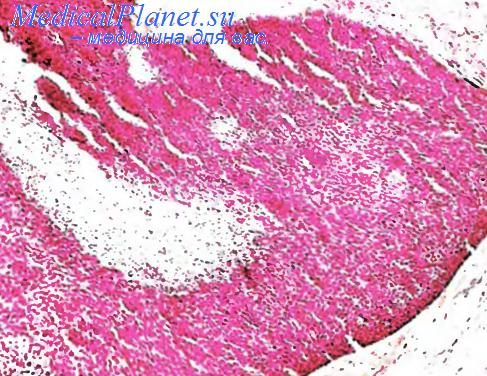
Опухоль волосяного матрикса
Инвертированный фолликулярный кератоз (син. фолликулярная кератома) — редкая одиночная интрадермальная опухоль, растущая обычно на лице у пожилых мужчин. Под микроскопом видны обширные акантотические тяжи с «жемчужинами и/или очагами пилоидной дифференцировки. Следует дифференцировать от бородавок и эккринной поромы.
Рак из элементов волосяного фолликула (син.: пилокарцинома, рак с пилоидной дифференцировкой) — настолько редкое новообразование, что определить закономерности его распределения по разным признакам не удается. От эпидермоидного рака отличается наличием в пластах опухолевой паренхимы очагов пилоидной дифференцировки, крупных светлых клеток типа элементов наружного корневого влагалища волосяного фолликула и гиалиновых мембран, окружающих пласты.
- Вернуться в оглавление раздела "Онкология."
Второй важный структурный компонент опухоли — ее строма. Строма в опухоли, так же как и строма в нормальной ткани, в основном выполняет трофическую, модулирующую и опорную функции. Стромальные элементы опухоли представлены клетками и экстрацеллюлярным матриксом соединительной ткани, сосудами и нервными окончаниями. Экстрацеллюлярный матрикс опухолей представлен двумя структурными компонентами: ба-зальными мембранами и интерстициальной соединительной тканью. В состав базальных мембран входят коллагены IV, VI и VII типов, гликопротеиды (ламинин, фибронектин, витронектин), протеогликаны (гепаран-сульфат и др.). Интерстициальная соединительная ткань опухоли содержит коллагены I и III типов, фибронектин, протеогликаны и гликозаминогликаны.
Происхождение стромы опухоли.В настоящее время получены убедительные экспериментальные данные о возникновении клеточных элементов стромы опухолей из предсуществующих Нормальных соединительнотканных предшественников окружающей опухоль ткани. J.Folkman (1971) показал, что клетки злокачественных опухолей продуцируют некий фактор, стимулирую-^й пролиферацию элементов соосудистой стенки и рост сосудов. Это сложное вещество белковой природы впоследствии было названо фактором Фолькмана. Как затем было установлено, фактор Фолькмана представляет собой группу факторов роста фибробластов, которых уже известно более 7. Фолькман первым доказал, что стромообразование в опухоли является результатом сложных взаимодействий опухолевой клетки и клеток соединительной ткани.
Важную роль в стромообразовании в неоплазме выполняют соединительнотканные клетки как местного, гистиогенного, так и гематогенного происхождения. Стромальные клетки продуцируют разнообразные факторы роста, стимулирующие пролиферацию клеток мезенхимного происхождения (факторы роста фибробластов, фактор роста тромбоцитов, ФНО-а, фибронектин инсулиноподобные факторы роста и др.), некоторые онкобелки (c-sic, c-myc), одновременно экспрессируют рецепторы, связывающие факторы роста и онкобелки, что позволяет стимулировать их пролиферацию как по аутокринному, так и по паракринному пути. Кроме того, сами клетки стромы способны выделять разнообразные протеолитические ферменты, приводящие к деградации экстрацеллюлярный матрикс.
Опухолевые клетки активно участвуют в образовании стромы. Во-первых, трансформированные клетки стимулируют пролиферацию соединительнотканных клеток по паракринному регуляторному механизму, продуцируют факторы роста и онкобелки. Во-вторых, они способны стимулировать синтез и секрецию соединительнотканными клетками компонентов экстрацеллюлярного матрикса. В-третьих, сами опухолевые клетки способны секретировать определенные компоненты экстрацеллюлярного матрикса. Причем определенный тип таких компонентов имеет характерный состав в некоторых опухолях, что можно использовать при их дифференциальной диагностике. В-четвертых, опухолевые клетки продуцируют ферменты (коллагеназы и др.), их ингибиторы и активаторы, способствующие или, напротив, препятствующие инфильтрирующему и инвазивному росту злокачественных опухолей. Динамическое равновесие между коллагеназами, их активаторами и ингибиторами обеспечивает стабильное состояние опухоли и препятствует прорастанию ее в прилежащие ткани. В момент роста опухолевые клетки активно синтезируют коллагеназы, эластазы и их ингибиторы.
Таким образом, образование стромы в опухоли является сложным многостадийным процессом, основными ступенями которого можно считать следующие:
▲ секреция опухолевыми клетками митогенных цитокинов -— различных факторов роста и онкобелков, стимулирующих пролиферацию соединительнотканных клеток, прежде всего эндотелия, фибробластов, миофибробластов и гладких мышечных клеток;
▲ синтез опухолевыми клетками некоторых компонентов экстрацеллюлярного матрикса — коллагенов, ламинина фибронектина и др.;
▲ пролиферация и дифференцировка клеток-предшественниц Соединительнотканного происхождения, секреция ими компонентов экстрацеллюлярного матрикса и формирование тонкостенных сосудов капиллярного типа, что в совокупности и составляет строму опухоли;
▲ миграция в строму опухоли клеток гематогенного происхождения — моноцитов, плазмоцитов, лимфоидных элементов, тучных клеток и др.
Злокачественные опухоли часто формируют строму, в которой доминирует тип коллагена стромы соответствующего органа на стадии эмбрионального развития. Так, в строме рака легкого преобладающим типом коллагена является коллаген III, характерный для эмбрионального легкого. Разные опухоли могут отличаться по составу коллагенов стромы. В карциномах, как правило, доминируют коллагены IIIтипа (рак легкого), IV типа (почечноклеточный рак и нефробластомы). В саркомах — интерстициальные коллагены, но в хондросаркоме — коллаген IIтипа, в синовиальной саркоме — достаточно много коллагена IV типа. Описанные различия в композиции стромы особенно важно учитывать при дифференциальной диагностике сарком.
Ангиогенез в опухоли.Рост опухолей зависит от степени развитости в них сосудистой сети. В новообразованиях диаметром менее 1—2 мм питательные вещества и кислород поступают из тканевой жидкости окружающих тканей путем диффузии. Для питания же более крупных новообразований необходима васкуляризация их ткани.
Ангиогенез в опухоли обеспечивается группой ангиогенных факторов роста, некоторые из которых могут генерироваться также активированными эпителиальными клетками в очагах хронического воспаления и регенерации. Группа ангиогенных факторов опухоли включает в себя факторы роста фибробластов, эндотелия, ангиогенин, фактор роста кератиноцитов, эпидермоидный фактор роста, фактор роста сосудов глиомы, некоторые колониестимулирующие костномозговые факторы и др.
Наряду с факторами роста в ангиогенезе имеет большое значение состав экстрацеллюлярного матрикса стромы опухоли. Благоприятным является содержание в нем компонентов базальных мембран — ламинина, фибронектина и коллагена IV типа. Формирование сосудов в опухолях происходит на фоне извращенной митогенетической стимуляции в измененном экстрацел-люлярном матриксе. Это приводит к развитию неполноценных сосудов преимущественно капиллярного типа, имеющих нередко прерывистую базальную мембрану и нарушенную эндотелиальную выстилку. Эндотелий может замещаться опухолевыми клетями, а иногда и вовсе отсутствовать.
Роль стромы.Для опухоли роль стромы не ограничивается только трофическими и опорными функциями. Строма оказывает модифицирующее влияние на поведение опухолевых клеток т.е. регулирует пролиферацию, дифференцировку опухолевых клеток, возможность инвазивного роста и метастазирования. Модифицирующее воздействие стромы на опухоль осуществляется благодаря наличию на клеточных мембранах опухолевых клеток интегриновых рецепторов и адгезивных молекул, способных передавать сигналы на элементы цитоскелета и дальше в ядро опухолевой клетки.
Интегриновые рецепторы — класс гликопротеидов, расположенных трансмембранно, внутренние концы которых связаны с элементами цитоскелета, а наружный, внеклеточный, способен взаимодействовать с трипептидом субстрата Arg — Gly — Asp. Каждый рецептор состоит из двух субъединиц — альфа и бета, имеющих множество разновидностей. Разнообразие сочетаний субъединиц обеспечивает разнообразие и специфичность интегриновых рецепторов. Интегриновые рецепторы в опухолях подразделяются на межклеточные и интегриновые рецепторы между опухолевыми клетками и компонентами экстрацеллюлярного матрикса — ламининовые, фибронектиновые, витронектиновые, к различным типам коллагенов, гиалуронатовые (к адгезивным молекулам семейства CD44). Интегриновые рецепторы обеспечивают межклеточные взаимодействия между опухолевыми клетками, а также с клетками и экстра-целлюлярным матриксом стромы. В конечном итоге интегриновые рецепторы определяют способность опухоли к инвазивному росту и метастазированию.
Адгезивные молекулы САМ (от англ. cell adhesiv molecules) — другой важный компонент клеточных мембран опухолевых клеток, обеспечивающий их взаимодействие между собой и со стромальными компонентами. Они представлены семействами NCAM, LCAM, N-кадгерином, CD44. При опухолевой трансформации происходит изменение структуры и экспрессии адгезивных молекул, входящих в состав клеточных мембран, что приводит к нарушению взаимосвязи опухолевых клеток, а следовательно, инвазивному росту и метастазированию.
В зависимости от развитости стромы опухоли подразделяют на органоидные и гистиоидные.
В органоидных опухолях имеются паренхима и развитая строма. Примером органоидных опухолей могут служить различные опухоли из эпителия. При этом степень развитости стромы может также варьировать от узких редких фиброзных прослоек и сосудов капиллярного типа в медуллярном раке до мощных полей фиброзной ткани, в которой эпителиальные опухолевые цепочки едва бывают различимыми, в фиброзном раке, или скирре.
В гистиоидных опухолях доминирует паренхима, строма практически отсутствует, так как представлена лишь тонкостенными сосудами капиллярного типа, необходимыми для питания. По гистиоидному типу построены опухоли из собственной соединительной ткани и некоторые другие неоплазмы.
Характер роста опухолей по отношению к окружающим тканям бывает экспансивным с формированием соединительнотканной капсулы и оттеснением прилежащих сохранных тканей, а также инфильтрирующим и инвазивным с прорастанием прилежащих тканей.
В полых органах выделяют также два типа роста в зависимости от отношения опухоли к их просвету: экзофитный при росте опухоли в просвет, и эндофитный — при росте опухоли в стенку органа.
В зависимости от количества узлов первичной опухоли неоплазмы могут обладать уницентрическим или мулътицентрическим характером роста.
В последнее время существенно возрос интерес к изучению роли стромы в опухолевом процессе.
Исследования в этом направлении позволяют изучать взаимоотношения опухолевых клеток и стромы на основе новых методических возможностей.
Возвращаясь к истории вопроса, необходимо еще раз отметить, что его постановкой мы во многом обязаны А.А. Богомольцу и созданному им учению о физиологической системе соединительной ткани.
Согласно этому учению, именно от состояния указанной системы, представленной различными клетками (фибробласты, эндотелиальные клетки, макрофаги, гистиоциты, перициты и др.), а также ее компонентами (фибронектин, коллагены различных типов, эластин) зависит, какие условия сложатся как для возникновения опухолевого процесса, так и для особенностей его дальнейшего развития.
Система стромальных элементов
Именно система стромальных элементов определяет особенности микроокружения — одного из главных критериев как регрессии, так и прогрессии опухолевого процесса.
Нет необходимости говорить о том, сколь сложны и многоплановы взаимоотношения опухоль — строма, а соответственно и сложен анализ этих взаимоотношений.
Одной из важных стратегий опухолевой клетки против системы иммунитета является способность влиять на строму (ее клетки и компоненты), так как иммунологический ответ во многом зависит от состояния стромы.
Состояние стромы определяется многими факторами, среди которых одно из центральных мест принадлежит различным протеолитическим системам, поскольку известно, что солидные опухоли располагают мощным протеолитическим механизмом для их инвазии и метастазирования.
Существуют различные протеолитические системы, но наиболее изученными являются система активации плазминогена и матричных металлопротеиназ (ММП). Тем не менее многое в вопросе о роли отдельных клеток стромы остается неясным.
Перспективы изучения этого вопроса во многом связаны с разработкой моделей взаимодействия раковых клеток и клеток стромы, которые так же, как и опухолевые клетки, нуждаются в протеолитических компонентах, необходимых и для инвазии опухоли. В этом направлении исследований значительно больше известно о клетках эндотелия сосудов, в то время как другие клетки стромы изучены недостаточно.
Известно, что злокачественные клетки, в первую очередь эпителиального происхождения, нуждаются в компонентах протеолитических систем и увеличивают их экспрессию, однако их потребность в этом значительно меньше, чем клеток стромы.
В последние годы появляется все больше публикаций, которые с позиций новых методических возможностей освещают роль клеток стромы и ее элементов. Особое внимание привлекают металлопротеиназы, а также их тканевые ингибиторы, в изучении которых важное место принадлежит работам U. Hofmann и соавт., выполненным, в большинстве случаев, на клетках меланомы кожи (эта опухоль, как известно, относится к ранометастазирующим).
Процессы инвазии, а также метастазирования этой опухоли определяются координированной экспрессией и/или активацией протеолитических ферментов.
Как свидетельствует значительное число данных, активность отдельных ММП и их ингибиторов преимущественно коррелирует с прогрессией процесса. Наиболее информативной в этом плане оказалась ММП-2, которая четко коррелирует с прогрессией меланомы in vitro.
Такое заключение сделано на основании исследования образцов меланомы и клеток многих линий с различной метастатической активностью. Показано также, что мРНК ММП-2 экспрессируется клетками всех линий меланомы, но присутствие функционально активной ММП-2 характерно для клеток наиболее агрессивных линий меланомы (МV3 и BLM).
В клетках как отдельных образцов, так и отдельных линий параллельно с активностью ММП-2 присутствовали ММ1-ММП, ТИМ-2 (тканевой ингибитор металлопротеиназы) и его мРНК.
Как известно, в процессе инвазии и метастазирования важную роль играют различные адгезивные молекулы. Например, экспрессия ММП-2 при меланоме коррелирует с экспрессией интегрина-aVвЗ как в клетках меланомы человека различных линий, так и в свежевыделенных клетках из участков поражения.
Такая закономерность наблюдалась в различных системах, она свидетельствует о том, что процесс инвазии и метастазирования меланомы требует ко-экспрессии ММП-2 и указанного интегрина.
В процесс метастазирования включаются аспартил- и цистеинпротеиназы, компоненты системы активации плазминогена. Однако активации ММП-2 и включения указанных факторов недостаточно для инвазии и метастазирования, поскольку клетки меланомы для взаимодействия с другими клетками и компонентами экстрацеллюлярного матрикса требуют экспрессии адгезивных молекул, к которым относятся не только интегрины, но и другие молекулы, в частности CD44.
Еще одним примером значения адгезивных молекул является экспрессия Е-катхерина клетками аденокарциномы поджелудочной железы: применение олигонуклеотидного антисенса Е-катхерина значительно снижает инвазию, уменьшая активность межклеточных взаимодействий.
Для процесса инвазии и метастазирования клеток меланомы такое же значение имеет экспрессия металлопротеиназы не только этими клетками, но и клетками стромы, окружающими опухоль.
В исследованиях, проведенных на модели спонтанных и экспериментальных метастазов, выявлены различия в экспрессии металлопротеиназы и тканевых ингибиторов в зависимости от микроокружения и путей метастазирования (исследовались ММП-2, ММП-9 и различные тканевые ингибиторы). ММП-2, ММП-9 и МТ1-ММП обнаруживались преимущественно в клетках стромы.
В спонтанных метастазах в лимфатические узлы или метастазах в легкое экспрессия ММП-9 наблюдалась как по периферии, так и в центре опухоли, в то время как эти участки были негативны по ММП-2 и МТ1-ММП. Опухолевые клетки экспериментальных метастазов в легкое не экспрессировали ММП-9.
Полученные данные представляются крайне важными, поскольку экспрессия металлопротеиназы в метастазах меланомы связана не только с их локализацией, но и с природой индукции опухоли (спонтанные или экспериментальные), и это предполагает различную роль ММП в развитии отдельных стадий формирования метастазов.
Имеется и ряд других доказательств важности значения экспрессии металлопротеиназы клетками стромы. Так, при исследовании карцином эндометрия показано, что ММП-2 и ММП-9 выявляются не только в клетках карцином, но и стромы, включая эндотелиальные, фибробласты, макрофаги.
Получены данные, из которых следует, что ангиогенез и деградация экстрацеллюлярного матрикса происходит одновременно с усилением роста карцином эндометрия и их инвазии, а процесс опухолевой прогрессии характеризуется кооперацией клеток карцином и стромы.
В результате изучения взаимодействия экстрацеллюлярного матрикса с опухолевыми клетками получены новые данные о регуляции этого взаимодействия клеточным гликопротеином, который стал известен как SPARC.
В опытах на модели рака поджелудочной железы мышей, дефицитных по этому гликопротеину, показано, что его отсутствие сопровождается уменьшением отложения коллагена, образованием волокон, изменениями перераспределения макрофагов, инфильтрирующих опухоль, и снижением интенсивности апоптоза опухолевых клеток. Авторы пришли к заключению, что SPARC является центральным фактором в регуляции тканевого ответа на онкогенез.
Имеются данные и о том, что межклеточный контакт опухолевых и стромальных клеток усиливает продукцию металлопротеиназы, что может сопровождаться развитием дисбаланса между ММП и их различными тканевыми ингибиторами, приводя к прогрессии и инвазии.
Установлено, что изменения в уровнях металлопротеиназы, а также сериновых протеаз связаны с нарушениями в генах, ответственных за состояние тканевого гомеостаза.
Исследования на молекулярном уровне подтвердили, что экспрессия стромальными клетками МПП, в частности МПП-1, зависит от активности фактора транскрипции — Ets-2, который регулируется фосфорилированием митогенактивирующей киназы. Такие данные получены на примере развития опухоли рака молочной железы мышей. Отмечено также, что активация Ets-2 при определенных условиях предопределяет прогрессию опухолей молочной железы, индуцированных HER-2/neu или вирусом папилломы.
Многие злокачественно трансформированные эпителиальные клетки экспрессируют ММП-12, что показано при плоскоклеточной карциноме кожи; параллельно с этим происходит инфильтрация CD68-положительными макрофагами.
Получены доказательства, что экспрессия ММП-12 связана с индукцией продукции TGFP и TNFa. Клетки указанных опухолей экспрессируют также ММП-7 (матрилизин) и ММП-9 (желатин), способные участвовать в разрушении экстрацеллюлярного матрикса.
Экспрессия упомянутых металлопротеиназ ассоциируется с особенно низким уровнем дифференцировки опухолевых клеток, а экспрессия ММП-9 — с плохим прогнозом.
При исследовании таких экстрацеллюлярных компонентов, как фибронектин, коллаген I и IV типов, показано, что эти компоненты могут нарушать продукцию IL-10 и TNFa моноцитами после их стимуляции раковыми клетками. При этом отмечен дифференцированный характер влияния указанных компонентов: выделение TNFa ингибируется фибронектином и коллагенами I и IV типов, а IL-10 — только фибронектином и коллагеном IV типа.
Продукция опухолевыми клетками
Продукция опухолевыми клетками, в частности клетками рабдомиосаркомы, коллагена XIX типа способствует дифференцировке клеток (скелетных мышц), что в условиях данной модели особенно отчетливо проявлялось на ранних этапах онкогенеза.
В процессе протеолиза экстрацеллюлярного матрикса очень важно взаимодействие между стромальными клетками и клетками, участвующими в воспалении, а также факторами, которые ими выделяются.
В связи с этим представляют интерес данные о культивировании фибробластов кишечника, молочной железы и соответствующих опухолевых клеток в различных условиях.
Установлено, что при совместном культивировании процесс деградации экстрацеллюлярного матрикса многократно усиливается, что проявлялось разрушением DQ-коллагена IV типа, а применение ингибиторов металлопротеиназ, плазмина, катепсина-В, цистеиновой протеазы снижало уровень деградации.
В общем понимании сложных процессов взаимодействия опухоли и стромы интересной является точка зрения, согласно которой именно стромальные иммунокомпетентные клетки служат резервуаром Т-киллеров, которые мигрируют в паренхиму, где взаимодействуют с Т-хелперами и В-лимфоцитами при формировании противоопухолевой защиты. На поздних стадиях рака такая возможность исчерпывается, что проявляется в снижении активности лимфоидных клеток.
Интерес к изучению роли микроокружения с каждым годом возрастает и все больше концентрируется на выяснении особенностей взаимодействия опухолевых клеток с клетками стромы. С этой целью разрабатываются различные модели, которые позволяют получать адекватную информацию.
В последние годы большое внимание уделяется указанному взаимодействию при метастазировании, в частности в костный мозг. Естественно, что в центре внимания — остеобласты и остеокласты, взаимодействие которых с опухолевыми клетками изучено при различных опухолях (миелома, рак простаты и др.).
Эти исследования показали значительные изменения в остеобластах и появление ряда факторов, которые могут способствовать дифференцировке опухоли и ее прогрессии.
Во взаимодействии опухолевых клеток и стромы, что неизменно проявляется и на особенностях микроокружения, в высшей степени важным является участие цитокинов, которые могут выделяться как опухолевыми клетками, так и клетками стромы.
Анализ соответствующих данных по этому вопросу показывает, что ведущая роль принадлежит таким цитокинам, как VEGF, TNFa, TGFp, IL-1в, IL-8, основному фактору роста фибробластов, PDGF. В значительно меньшем числе случаев возможно и участие некоторых других цитокинов.
Значение указанных цитокинов прослеживается при различных опухолях. Так, при исследовании клеток колоректальной карциномы установлено, что они секретируют VEGF, TNFa и PDGF, действие которых направлено преимущественно на строму. В связи с этим они рассматриваются как факторы регуляции стромы и могут играть ключевую роль в ангиогенезе и инвазии опухоли.
Параллельное исследование клеток рака молочной железы и фибробластов эмбрионов мышей в различных модельных системах показало, что после обработки некоторыми цитокинами (IL-1в, TGFв, IL-8 и др.) отмечена экспрессия ММП-11 (известна также как стромелизин-3) фибробластами и опухолевыми клетками.
Представляются важными результаты изучения метастазирующего и первичного рака яичника. Интерес к ним обусловлен тем, что параллельно с опухолевыми клетками исследовались и стромальные, а также гены, контролирующие метастазирование (Ets-1 и РЕА3).
Выявлено, что все клетки экспрессировали ММП-2, ММП-9, что сочеталось с секрецией VEGF, основного фактора фибробластов и IL-8. Авторы полагают, что последовательная активация указанных генов, экспрессия ММП, IL-8, VEGF при раке яичника — факторы, которым принадлежит важное место в индукции метастазирования.
Пути повреждения экстрацеллюлярного матрикса в условиях роста опухоли представлены на рис. 78.

Рис. 78. Повреждение экстрацеллюлярного матрикса в условиях роста опухоли
В связи с большим значением особенностей микроокружения, одним из основных компонентов которого является строма, формируется выраженный интерес к изучению протеомного профиля клеток микроокружения.
Так, параллельное исследование различных структур на клетках плоскоклеточной карциномы полости рта и клетках стромы показало, во-первых, различия в экспрессии белков опухолями и стромальными клетками, во-вторых, что большинство белков экспрессируется на всех исследованных клетках, в-третьих, протеомный анализ может служить маркером прогрессии плоскоклеточного рака ротовой полости.
Поэтому вполне правомочна постановка вопроса о необходимости изучения взаимодействия между эпителиальными и стромальными клетками на молекулярном уровне с учетом экспрессии различных белковых структур и определением их значения для опухолевой прогрессии.
Возможности иммуносупрессирующего влияния опухоли на клетки системы иммунитета
Приведенный материал иллюстрирует, насколько велики возможности иммуносупрессирующего влияния опухоли на клетки системы иммунитета. Несомненно, дальнейшая идентификация иммуносупрессирующих факторов опухоли существенно пополнит уже имеющийся их перечень.
Нельзя не подчеркнуть, что в подавляющем большинстве случаев имеет место как непосредственное иммуносупрессирующее действие на функции клеток системы иммунитета, так и влияние различных факторов на ангиогенез, микроокружение, формирование резистентности опухолевых клеток к апоптозу и др.
Это позволяет говорить о многоплановости влияния различных иммуносупрессирующих факторов и свидетельствует о чрезвычайной сложности проблемы взаимодействия клеток системы иммунитета и опухоли.
Несмотря на весьма значительное число работ по обсуждаемому вопросу становится очевидным, что иммуносупрессирующее влияние опухоли на клетки системы иммунитета подлежит более глубокому изучению.
Это прежде всего касается:
1) дальнейшей идентификации факторов супрессии, выделяемых различными опухолями;
2) дифференцированной оценки их влияния на функции различных клеток системы иммунитета;
3) роли супрессорных факторов во взаимоотношении опухолевых и иммунокомпетентных клеток.
Примером необходимости дальнейшего изучения супрессорных факторов является неоднозначность данных о роли NО — бесспорно, что он может быть участником противоопухолевой защиты, но не вызывает сомнений и то, что при определенных условиях он является мощным иммуносупрессирующим фактором.
Представленный далеко не исчерпывающий материал, касающийся иммуносупрессирующих факторов опухоли, позволяет сделать следующие заключения:
Функциональная активность клеток системы иммунитета во многих случаях восстанавливается после хирургического удаления опухоли.
Бережная Н.М., Чехун В.Ф.
Как известно, учение о цитокинах (монокинах, лимфокинах, интерлейкинах, хемокинах, различных ростовых факторах) начало формироваться к концу 60-х годов прошлого столетия, непрерывно и очень активно развивалось на протяжении всех последующих десятилетий и в настоящее время представляет собой .
Еще P. Erlich отметил, что, во-первых, многие опухоли могут быть инфильтрированы эозинофилами, а во-вторых, в некоторых случаях такая инфильтрация сочетается с благоприятным прогнозом. В последующем было получено много примеров инфильтрации эозинофилами различных опухолей — ходжкинские и неходжкинск.
Исследования последних лет показывают, что наиболее активными антигенпрезентирующими клетками являются дендритные клетки, впервые выявленные в 1973 г. R. Steinman и Z. Colin. В дальнейшем было установлено и дендритное происхождение клеток Лангерганса, которые как "нервные" клетки были опис.
СD8+Т-лимфоциты — клетки, экспрессирующие антиген CD8, представлены основными двумя субпопуляциями — цитотоксическими Т-клетками и Т-лимфоцитами с супрессорной активностью. Со временем стало известно, что CD8 экспрессируют не только эти субпопуляции лимфоцитов, но и отдельные клоны других клеток.
Согласно условиям формирования иммунологического ответа на антигены различной природы его развитие, как отмечено выше, сопровождается обязательной экспрессией молекул ГКГ. Система ГКГ обеспечивает регуляцию всех форм иммунологического ответа, начиная от распознавания, и в конечном итоге — общий конт.
Основными антигенпрезентирующими клетками являются: В-лимфоциты, макрофаги и дендритные клетки. Особенности развития, дифференцировки, фенотипа, функций, участия в различных формах иммунологического ответа антигенпрезентирующих клеток — базисная область фундаментальной иммунологии, которая уже в теч.
Как отмечалось выше, CD40 и CD40L впервые были описаны соответственно как рецептор В-лимфоцитов и его лиганд на Т-лимфоцитах и с полным основанием определены как один из центральных механизмов взаимодействия указанных популяций лимфоцитов.
Читайте также:





