Что такое иммунотерапия при опухоли головного мозга




- Лечение рака головного мозга: иммунотерапия с облучением
- Лечится ли рак мозга? Борьба за жизнь!
- Как перенести лучевую терапию
Лечение рака головного мозга по новому протоколу, когда облучение проводится вместе иммунотерапией показало успешный синергетический эффект. Врачи, специализирующиеся на лечении рака головного мозга за рубежом, активно обсуждает последние достижения в области нейроонкологии и комбинации облучения с иммунотерапией. Онкорадиологи в неоперабельных случаях предлагают лечить опухоли головного мозга различными комбинациями лучевой и иммунотерапии.
Тема радиации и иммунотерапии уже получила широкое внимание на международном уровне. Опыт показал что можно успешно лечить как первичные опухоли, так и метастазы в головной мозг, распространившиеся туда из других частей тела. По статистике метастазов в головной мозг примерно в десять раз больше, чем первичных очагов. Для некоторых видов рака, таких как меланома, немелкоклеточный рак легкого и даже рак молочной железы, частота метастазов в головном мозге у больных с IV стадией заболевания достаточно высока в диапазоне от 30 до 40%.

Стереотаксическая радиотерапия VMAT уничтожает опухоли очень точно. Например, после того, как препарат Ipilimumab был одобрен для лечения меланомы, его начали использовать в сочетании с VMAT облучением для пациентов с метастазами меланомы в головном мозге. После чего из 11 пациентов, у семи из них не нашли каких-либо раковых клеток вообще.
Комбинация иммунотерапии с радиохирургией является очень актуальной для пациентов с раком немелкоклеточного легкого, который распространился в головной мозг. Примерно у 30 40% больных с IV стадией рака немелкоклеточного рака легкого наблюдаются метастазы в головной мозг. Сочетанием иммунотерапии с радиохирургией можно достаточно успешно лечить глиомы или глиобластомы.
Стереотаксичекое облучение VMAT имеет иммуногенный характер. Это означает, что оно раздражает опухолевые антигены, что улучщает иммунный ответ, увеличивая количества иммунных Т-клеток в зоне опухоли после высокой дозы радиации. Иммунотерапия препаратом Pembrolizumab является эффективной, имеет меньше побочных эффектов и показала значительные улучшения в показателях выживаемости. Сочетание облучения с иммунотерапией изменили клиническую практику при лечении метастазов головного мозга.
Исторически сложилось так, что если у больного обнаруживали метастазы в головном мозге, медиана выживаемости было четыре месяца. Теперь после комбинированной онкотерапии за рубежом большинство людей живы через много лет и есть надежда на выздоровление.
Хирургическая резекция с последующей лучевой терапией давно является стандартом лечения для пациентов с метастазами в головном мозге. Однако, облучение всего головного мозга в России часто связано с когнитивными нарушениями и ухудшением качества жизни. Стереотаксическая радиотерапия VMAT в сочетании с иммунотерапией уничтожает опухоль, сохраняя окружающую мозговую ткань.
В тех случаях, когда опухоль удаляется хирургически, послеоперационная стереотаксическая радиотерапия ведет к улучшению местного контроля после полной резекции. Чтобы определить и выбрать наиболее лучший способ лечения рака головного мозга пациенту делается специальная навигационная МРТ, а анализ биопсии позволяет точно подобрать иммунопрепараты.
Биологическая иммунотерапия опухолей мозга – это новейший метод борьбы с раковыми поражениями. Ключевой особенностью этой методики является то, что она применима при лечении всех форм рака на любом этапе прогрессирования.
Варианты иммунотерапии опухолей мозга
Определенные варианты биоиммунотерапии мозговых опухолей показали хорошую действенность, поэтому им уделяется много времени при научных опытах. К числу медикаментов, применяемых при иммунотерапии опухолей мозга, относятся следующие лекарства.
• DCVax-L (дендритная клеточная вакцина) – медикамент, создающийся из онкоклеток самого больного. Эта вакцина проходит 3-й этап исследований для последующего использования при лечении вторичных глиом.
• Rindopepimut – это специфический мутационный пептид, который продемонстрировал действенность в трети случаев устранения глиобластом. Сегодня медикамент проходит 3-ю стадию исследований при лечении первичной глиобластомы и 2-ю стадию при лечении рецидивирующей формы данного заболевания.
• HSPPC-96 – новый медикамент, проходящий через 2-й этап исследований при лечении людей с рецидивирующей неоперабельной глиомой.
• ICT-107 (дендритная клеточная вакцина) – подразумевает задействование синтетических компонентов. Она направлена на истребление раковых антигенов при лечении глиобластомы. 2-я стадия исследований прошла успешно, дав оптимистичные результаты. Сейчас планируется осуществление 3-го (международного) этапа.
• Indoximod (или просто IDO ингибитор) – задействуется для лечения вторичной глиомы. Сейчас продолжаются начальные стадии опытов.
• Nivolumab и Ipilimumab – эффективно применяемые медикаменты, помогающие устранять глиобластому. Проходят через 2-й этап опытов при лечении рецидивирующей формы данного онкопоражения.
• Анти-EGFRvIII – методика, основанная на возможности уничтожения аномальных компонентов Т-клетками (LAK терапия). Этот способ был выработан несколько десятков лет назад, однако, по сей день нет универсальной методики, способной помочь абсолютно всем онкобольным. Рассматриваемый метод пока проходит начальные стадии исследований при уничтожении глиомы.
• ADU-623 – это экспрессирующий антиген, который проходит через 1-й этап опытов среди пациентов с первичной и рецидивирующей астроцитомой.
• AMG 595 – медикамент точечной терапии, который основан на воздействии антител. Задействуется в комбинации с химиотерапевтическими процедурами. Проходит через 1-ю стадию испытаний.
Учеными проделана огромная работа по созданию уникальных вакцин, способных эффективно устранять разные типы мозговых онкопоражений. Большинство медицинских разработок, основанных на иммунной терапии мозгового рака, демонстрируют хорошую результативность. В частности, они помогают замедлить разрастание очага или полностью блокировать его рост.
Иммунная терапия онкоочагов: специфика методики
Суть иммунотерапии опухолей мозга заключается во введении внутрь пораженного организма биологически активных компонентов, имеющих повышенную противораковую активность. К таким веществам относятся цитокины, а также моноклональные антитела.
Эти элементы блокируют механизмы опухолевого питания, прекращая разрастание болезнетворного формирования. У рассматриваемой методики нет побочных явлений, что объясняется отсутствием повреждений здоровых тканей.
Как правило, противораковые медикаменты изготавливаются из биоматериала, содержащего клеточные компоненты онкоочага пациента либо же иного человека. Извлекаемый материал проходит через спец. обработку, а потом, посредством инъекции, вводится онкобольному.
Иммунотерапия опухолей мозга – это продолжительный процесс. Во время лечебного курса пациент пребывает под врачебным наблюдением. Прогноз полного излечения составляет около 80%. Из-за сложности выработки биовеществ и наличия инновационных генно-инженерных разработок биологичекая иммунотерапия пока не получила должного распространения.
Для подбора эффективного метода лечения вы можете обратиться за
- методы инновационной терапии;
- возможности участия в экспериментальной терапии;
- как получить квоту на бесплатное лечение в онкоцентр;
- организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
Глиальные опухоли являются наиболее распространенной первичной опухолью головного мозга у взрослого населения, о чем свидетельствуют официальные зарубежные реестры по эпидемиологии опухолей центральной нервной системы и литературные данные 1. Данная группа характеризуется общим происхождением, агрессивным течением, выраженным инвазивным ростом, быстрым прогрессированием заболевания, а также высоким процентом рецидивирования и склонностью к малигнизации [1; 4; 5]. Согласно классификации Всемирной организации здравоохранения (WHO), среди глиальных опухолей выделяют четыре степени злокачественности, от I степени (наименее злокачественные) до IV (наиболее злокачественные), степени III и IV относятся к высокозлокачественным глиальным опухолям [3]. Глиома IV степени злокачественности также известна как глиобластома, являющаяся наиболее распространенной и малигнизированной среди других глиом [1; 6]. Как правило, по статистике, такие пациенты из-за грубого неврологического дефицита и низкого качества жизни оказываются инвалидами и нуждающимися в посторонней помощи. Медиана продолжительности жизни больных с анапластической астроцитомой (III степень злокачественности) на фоне проводимого стандартного комплексного лечения составляет порядка 30 месяцев, тогда как данный показатель у пациентов с глиобластомой (IV степень злокачественности) варьирует от 12 до 14 месяцев 9. Представленная распространенность глиальных опухолей и продолжительность жизни больных с данной патологией, достигнутая стандартным комбинированным лечением, включающим резекцию опухоли, лучевую терапию и химиотерапию темозоломидом, диктует необходимость поиска дополнительных методов комплексного лечения больных с указанной нозологией.
Возможность только хирургического лечения в виде радикального удаления глиальной опухоли, несмотря на применение соответствующей микрохирургической техники, имеет ряд ограничений: отсутствие четких границ со здоровой тканью мозга, физиологическая значимость пораженных зон и инфильтрация опухолевыми клетками перифокальной зоны прилежащего головного мозга. При назначении адъювантного лечения, такого как химио- и лучевая терапия, следует принимать во внимание низкую чувствительность глиом к данным методам [4; 10; 11].
Согласно данным литературы, на сегодняшний день одним из наиболее успешных направлений в лечении высокозлокачественных глиом является применение иммунотерапии в дополнение к стандартным методам лечения 12. Существует несколько иммунотерапевтических подходов, включающих как неспецифический, так и антигенспецифический вариант иммунотерапии. Примерами неспецифического варианта иммунотерапии могут служить применение цитокинов (IL-2, IFN-a), лимфокин-активированных киллерных (ЛАК) клеток и полиадъювантов, тогда как примерами антигенспецифического варианта является использование антигенспецифических цитотоксических Т-клеток, полученных при активации лимфоцитов ex vivo в присутствии опухолевых антигенов, а также различные протоколы иммунизации опухолевыми антигенами, на основе пептидов, дендритных и опухолевых клеток. Предполагается, что сочетание представленных вариантов между собой повышает эффективность иммунотерапии. Результаты одного из исследований, основанного на применении антигенспецифических цитотоксических Т-лимфоцитов совместно с курсом интерлейкина-2, показали увеличение продолжительности жизни у больных с высокозлокачественными глиальными опухолями [5]. Однако в дальнейшем у пациентов наблюдалось рецидивирование опухоли, что говорит об уместном поддержании противоопухолевого иммунитета по завершении курса комбинированной иммунотерапии. В дополнение к вышеприведенному выводу наличие рецидива указывает на присутствие оставшихся опухолевых клеток после окончания курса комбинированной иммунотерапии. Представленные заключения подталкивают к поиску более эффективных методов генерации цитотоксических лимфоцитов.
В результате этого большой интерес представляет применение дендритных клеток как основного источника клеток, презентирующих опухолевый антиген. Данное свойство обусловлено наличием большого количества факторов, определяющих их эффективность: сочетание макропиноцитоза и особенности продукции антигена (АГ), направленная миграция в лимфоидные органы, увеличение поверхности ДК за счет образования цитоплазматических отростков в процессе созревания, высокое содержание комплексов гистосовместимости (МНС-АГ), экспрессия более широкого набора молекул адгезии и костимуляции, секреция различных цитокинов [7; 13; 14]. Как следствие, все эти факторы позволяют ДК быть более активными в индукции иммунного ответа на чужеродные АГ. Помимо основного качества, демонстрируется способность ДК к подавлению опухолевого роста в результате рестимулирования лимфоцитов и повышения их противоопухолевой активности. В свою очередь, немаловажным фактом является описание безопасности и хорошей переносимости вакцинотерапии, что подтверждается в исследованиях различных авторов [5; 8]. В данных источниках зарегистрированы только два клинических случая с проявлением воспалительной реакции как побочного эффекта: у пациента с большой остаточной опухолью после хирургического лечения и при выполнении кожной аллергической пробы для диагностики гиперчувствительности замедленного типа. На основании вышеперечисленного вакцинотерапия с использованием дендритных клеток представляет собой многообещающий метод иммунотерапии, позволяющий увеличить длительность безрецидивного периода и общей продолжительности жизни.
Исходя из этого целью нашего исследования являлась оценка безопасности и эффективности комбинированной иммунотерапии (КИТ) по новому протоколу лечения, с применением аутологичных дендритных клеток.
Материал и методы. Наше исследование было выполнено на базе клиники нейрохирургии Новосибирского НИИТО в период с 2006 по 2013 год, которое заключалось в применении методов комбинированной иммунотерапии, состоящей из двух этапов: локорегиональное введение цитотоксических лимфоцитов (ЦТЛ) в ложе удалённой опухоли и последующая 5-6-кратная инъекция противоопухолевой вакциной на основе ИФН-альфа индуцированных дендритных клеток, которые использовались не только как антигенпрезентирующие клетки, но и как клетки, потенциально обладающие прямой цитотоксической активностью на опухолевые клетки. Пациенты были разделены на опытную и контрольную группы, состоящие из 49 и 51 пациента соответственно. Группа исследования, помимо стандартного комплексного лечения, включающего резекцию опухоли, химио- и лучевую терапию, получала комбинированную иммунотерапию состоящую из вышеперечисленных этапов. Предоперационная подготовка включала в себя ряд параклинических и инструментальных методов исследований с обязательным выполнением МРТ головного мозга с контрастным усилением и с последующим послеоперационным МРТ-контролем. В течение данного этапа у пациентов основной группы осуществлялся забор крови в объеме 300 мл для получения мононуклеарных клеток. В это же время, с целью снятия перифокального отёка и нивелирования неврологического дефицита, назначались синтетические глюкокортикостероиды (ГКС) в дозе от 16 до 32 мг/сут., с непосредственным продолжением гормональной терапии после оперативного вмешательства. Следующим этапом после проведенного регламентированного дообследования было хирургическое лечение, целью которого являлось максимально возможное удаление опухоли. Во время последнего хирургического лечения выполнялся забор опухолевой ткани для определения морфологической составляющей новообразования и получении суспензии опухолевых клеток для проведения КИТ. Сроки операции варьировали от 1 до 3 дней с момента поступления. Далее выполнялся первый этап комбинированной иммунотерапии, который заключался во введении цитотоксических лимфоцитов (ЦТЛ) в ложе удаленной опухоли через установленный во время операции катетер, генерированных путем культивирования мононуклеарных клеток крови больного с дендритными клетками, нагруженными опухолевым антигеном, в присутствии рекомбинантного ИЛ-2, в виде двух процедур с интервалом 48 ч. Последующий этап комбинированной иммунотерапии выполнялся в условиях Научно-исследовательского института фундаментальной и клинической иммунологии в виде 5-6-кратной инъекции противоопухолевой вакцины на основе ИФН-альфа индуцированных дендритных клеток.
Результаты и обсуждение. В результате сравнения кривых выживаемости больных контрольной и опытной группы были получены статистически достоверные отличия медиан выживаемости: 12 и 26 месяцев соответственно (p=0,013). При разделении общей массы пациентов на подгруппы, соответствующие гистологической принадлежности оперированных образований, достоверные различия получены для больных глиобластомами (ГБ): медиана выживаемости в группе без иммунотерапии (ИТ) составляла 11 месяцев против 15 месяцев у пациентов, получивших КИТ (p=0,03) (рис. 1). Тем временем у больных анапластической астроцитомой кривые выживаемости различались недостоверно p=0,263 [15].
Обоснованием срока проведенного исследования является длительный подбор пациентов с учетом схожести нижеперечисленных параметров. Исходя из этого, были проанализированы группы больных ГБ по возрасту, полу, объёму выполненного стандартного комплексного лечения, включающего хирургическую резекцию, химио- и лучевую терапии, дозам полученной противоотёчной гормональной терапии и индексу качества жизни по шкале Карновского, где достоверных различий получено не было. Достоверные различия (p=0,007) получены по критерию наличия продолженного роста опухолей: в группе КИТ 18 из 27 больных оперированы по поводу рецидива опухоли, в то время как в группе без ИТ аналогичный показатель составлял 9 из 30 (рис. 2) [15].
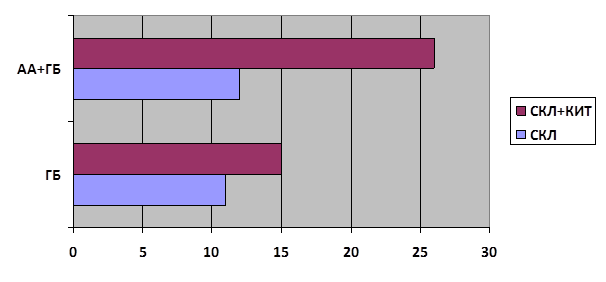
Рис. 1. Общая продолжительность жизни пациентов
*СКЛ – стандартное комплексное лечение; КИТ – комбинированная иммунотерапия;
АА – анапластическая астроцитома; ГБ – глиобластома
В дальнейшем было решено определить, оказывает ли влияние данный фактор на кривые выживаемости. Для этого были оценены показатели продолжительности жизни относительно времени последней проведённой операции, были получены различия в медианах в 5 и 7 месяцев, носившие характер отчётливого тренда p=0,066 [15].
Дискуссия. Иммунная система является основным барьером на пути возникновения злокачественных опухолей, а активация специфического и неспецифического иммунного ответа предполагает возможность воздействия на опухолевый процесс, тем самым демонстрируя вероятность эффективного пути борьбы с онкологическими заболеваниями. Основываясь на фактах, указывающих, что иммунодефицитные состояния приводят к повышению частоты появления онкологического процесса, поскольку опухоли часто вырабатывают иммуносупрессирующие факторы для преодоления ограничений, накладываемых на их рост иммунной системой, и основываясь также на положительных результатах иммунотерапии злокачественных опухолей, полученных на экспериментальных моделях и в клинических исследованиях как с опухолями ЦНС, так и другой локализации, есть надежда на благоприятный исход в развитии иммунного ответа против опухоли. Таким образом, на сегодняшний день проблема лечения глиальных опухолей остаётся по-прежнему актуальной в нейрохирургии.
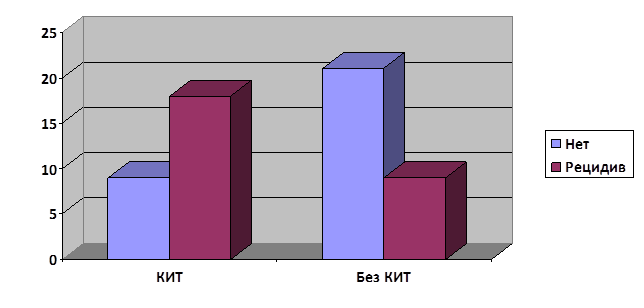
Рис. 2. Показатель продолженного роста в подгруппах пациентов
В период с 1999 по 2006 год в клинике нейрохирургии Новосибирского НИИТО уже была показана эффективность и безопасность КИТ с использованием лимфакин-активированных клеток (ЛАК). Однако невысокая эффективность при клиническом исследовании ЛАК-терапии, серотерапии глиальных опухолей, а также современные знания в иммунологии повлияли на возникновение новой методики, основанной на применении основных антиген-представляющих клеток, из которых высокоэффективными являются дендритные клетки. Последние способны экспрессировать в необходимом количестве костимулирующие молекулы, требующиеся для активации противоопухолевого иммунного ответа. Существуют литературные данные, что Т-клетки могут активироваться только, когда антиген представлен ДК [6; 7]. Данные клетки способны приблизиться к опухолевым клеткам, изолировать антигены опухоли и активировать Т-киллеры (CD8), минуя поддержку Т-хелперов (CD4). В связи с этим в новом исследовании мы решили модифицировать протокол ИТ, добавив ИФН-альфа индуцированные дендритные клетки, обладающие цитотоксической активностью.
Выводы. Результаты проведенного исследования показали, что данная методика является безопасным методом лечения, обладая определённой эффективностью, которая проявляется в увеличении сроков выживаемости у больных злокачественными глиомами, что позволяет заключить, что КИТ является оправданным методом адъювантной терапии указанной патологии.
13 марта 2020 г. 9:07
Пациенты с раком имеют подавленную иммунную систему и более восприимчивы к инфекциям.
12 марта 2020 г. 8:26
Исследователи представили структуру и механизм белков, которые экспрессируются при различных формах рака и связаны с плохим прогнозом пациента.
9 марта 2020 г. 12:07
В низких дозах тетродотоксин заменяет опиоиды для облегчения боли, связанной с раком.
5 марта 2020 г. 14:24
Новый метод картирования сил, которые кластеры клеток оказывают на микроокружение, может помочь в изучении развития тканей и метастазирования рака.
Иммунотерапия доказала свою эффективность в лечении ряда раковых заболеваний, но опухоли головного мозга остаются устойчивыми. Теперь новое исследование предполагает, что медленно растущая опухоль головного мозга, возникающая у пациентов, страдающих нейрофиброматозом типа 1 (NF1), может быть уязвимой для иммунотерапии, которая дает иммунной системе стимул в борьбе с раком.
Результаты, сделанные международным консорциумом во главе с исследователями из Колледжа врачей и хирургов Колумбийского университета, были опубликованы сегодня в журнале Nature Medicine.
Приблизительно 100 000 человек в Соединенных Штатах имеют NF1, наследственное заболевание, которое может привести к развитию опухолей по всей нервной системе, включая тип опухоли головного мозга, называемой глиомой. Дети обычно имеют медленно растущий тип глиомы, тогда как взрослые часто имеют более агрессивный тип.
Но ли медленно растущие или нет, глиомы трудно поддаются лечению. Большинство из них обладают высокой устойчивостью к химиотерапии, и лучевая терапия может усугублять, а не ослаблять симптомы, такие как головные боли и судороги. Поскольку опухоли обычно охватывают деликатные области головного мозга, операция редко возможна.
Иммунотерапия была успешной для некоторых пациентов с меланомой, лимфомой и несколькими другими видами рака. Но клинические испытания показали, что пока он неэффективен для рака мозга в целом.
Удивительно мало было известно о молекулярных изменениях, которые происходят в опухолях головного мозга NF1, что затрудняет разработку таргетной терапии. В этом исследовании исследователи из 25 учреждений по всему миру, возглавляемые Колумбийским врачом Антонио Иавароне и Анной Ласореллой, выполнили углубленный анализ образцов опухоли от 56 пациентов, чтобы создать первый полный перечень генетических, эпигенетических и иммунных изменения в глиомах NF1.
Иммунотерапия неэффективна для большинства опухолей головного мозга, потому что опухоли инфильтрированы большим количеством клеток, называемых макрофагами, которые препятствуют атаке иммунной системы.
Новое исследование показало, что многие медленно растущие глиомы NF1 содержат мало макрофагов и продуцируют белки, называемые неоантигенами, которые могут вызвать атаку иммунной системы.
Это исследование также обнаружило, что подгруппа опухолей головного мозга у пациентов без NF1 имеет тот же молекулярный профиль, что и медленно растущие глиомы NF1. Будущие исследования должны будут установить, имеют ли эти "NF1-подобные глиоме" опухоли головного мозга те же иммунные свойства и потенциально уязвимы для иммунотерапии.
Агрессивные глиомы NF1 можно ослабить с помощью препаратов, повреждающих ДНК.
Несмотря на то, что агрессивные опухоли NF1 были заполнены макрофагами и, вероятно, противостоят иммунотерапии, исследователи также обнаружили, что у многих был генетический дефект, который может сделать их более чувствительными к терапии, повреждающей ДНК.
Лучевая терапия и некоторые современные лекарства от рака повреждают ДНК, но также разрабатываются лекарства, которые могут быть более эффективными в раковых клетках с этим специфическим генетическим дефектом.
Лечение астроцитомы в Израиле
Лечение астроцитомы головного мозга: характеристика видов и их градация, признаки опухолей, основные диагностические процедуры, методы лечения (операция, лучевая терапия, химиотерапия), варианты терапия различных видов астроцитом.

Лечение глиобластомы в Израиле
Лечение глиобластомы - у лучших нейрохирургов Ассуты. Тщательная диагностика и персональная программа терапии гарантируют отличный результат

Лучевая терапия опухолей мозга в Ассуте – высокие технологии
Лучевая терапия опухолей мозга: показания к проведению, основные методики облучения, процесс подготовки и планирования лечения, потенциальные побочные эффекты и меры по их снижению.

Операции при опухолях головного мозга в клинике Ассута
Операции при опухолях головного мозга: показания и противопоказания, подготовка и симптоматическое лечение, виды операций (биопсия, краниотомия, шунтирование), процесс восстановления после после удаления опухоли головного мозга.
ЗАЯВКА НА ЛЕЧЕНИЕ
Отправляя форму Вы соглашаетесь с политикой конфиденциальности
За последние десятилетия наука серьезно продвинулась вперед в лечении рака. И хотя полная победа над этим заболеванием еще довольно далека, у врачей с каждым годом становится все больше эффективных инструментов для борьбы с опухолями.
Один из них – активизация собственного иммунитета человека против раковых клеток. Именно в иммуноонкологии сегодня проводится максимальное количество исследований и разрабатывается наибольшее число противоопухолевых препаратов.
В чем плюсы и методы механизма, за открытие которого была присвоена Нобелевская премия, беседуем с заведующей дневным стационаром №3 Алтайского краевого онкологического диспансера, кандидатом медицинских наук Еленой Россохой.

Заведующая дневным стационаром №3 Алтайского краевого онкологического диспансера, кандидат медицинских наук Елена Россоха. Фото: Юлия КОРЧАГИНА
- Елена Ивановна, расскажите, как в норме действует иммунный ответ на возникновение злокачественных клеток?
- Иммунитет – это уникальная способность организма защищать себя от губительного воздействия внешних и внутренних потенциально опасных факторов, каковыми являются, в том числе, и раковые клетки.
Давайте разберемся, что такое рак? В норме все клетки организма проходят строго определенные стадии развития, выполняют заданные функции, размножаются по установленным правилам, а со временем стареют и умирают. Эта запрограммированная обязательная смерть нормальных клеток называется апоптоз. Но иногда у обычной клетки в силу ряда причин происходит сбой в программе деления – она приобретает способность делиться очень быстро и бесконечное количество раз, становится потенциально бессмертной - злокачественной.
Опухолевые клетки ежедневно появляются в организме любого человека и отличаются от здоровых наличием аномального белка - ракового антигена. Но в норме иммунитет вовремя распознает угрозу и уничтожает чужеродные элементы с помощью Т-лимфоцитов и других компонентов.
Кстати
Доказано, что если иммунитет подавлен ( ВИЧ , терапия иммуносупрессорами после пересадки органов), то риск развития онкологических заболеваний высок. И наоборот, раковые опухоли могут проходить сами собой без какого-либо специального лечения. Это явление получило название синдрома Перегрина по имени молодого священника, жившего в Италии в конце XIII века. У него была саркома (костная опухоль), требующая ампутации ноги. Хирургия тех времен не могла ему помочь, и юноше оставалось только уповать на Бога. Спустя некоторое время опухоль чудесным образом исчезла, а Святой Перегрин прожил долгую жизнь и умер в возрасте 80 лет без признаков рецидива.
- Почему же в какой-то момент иммунитет ослабляет свою защиту?
-В настоящее время механизмы взаимодействия опухолей и иммунной системы активно изучаются.

В иммуноонкологии сегодня проводится максимальное количество исследований и разрабатывается наибольшее число противоопухолевых препаратов. Фото: Юлия КОРЧАГИНА
Кстати
За открытие иммунных контрольных точек PD-1 и CTLA-4, американцу Джеймсу Эллисону и японцу Тасуко Хондзё в 2018 году была вручена Нобелевская премия. Это открытие позволило совершить прорыв в лечении некоторых ранее смертельных опухолей.
- В чем отличие иммунотерапии от других видов лекарственного противоопухолевого лечения?
- Можно сказать, что открытие принципов иммунотерапии изменило саму парадигму противоопухолевой терапии. Раньше в ее основе лежало воздействие на опухолевую клетку. Сейчас в центре внимания онкологов находится иммунная система человека, возможности ее перепрограммирования и восстановления способности самостоятельно противостоять злокачественным опухолям.
- Какие виды опухолей можно лечить с помощью иммунотерапии, и какова эффективность такого лечения?
- В первую очередь, это распространенные метастатические процессы, 3 и 4 стадии рака, когда удалить злокачественное новообразование с помощью операции невозможно. Что касается видов опухолей, то иммунотерапию можно применить практически ко всем из них. Рак легкого, мочеполовой системы у мужчин и женщин, молочной железы, различные виды лимфом, опухоли головы и шеи, меланома.
Кстати, впервые подобные препараты начали использовать именно при меланоме. Это очень агрессивные опухоли, характеризующиеся быстрым ростом и метастазированием. Еще несколько лет назад такие пациенты, даже получая специальное противоопухолевое лечение, жили максимум шесть месяцев. Сейчас благодаря иммунотерапии, медиана выживаемости для них выросла до нескольких лет.
В лечении злокачественной меланомы достигнут самый высокий прогресс. Пожалуй, самый известный онкобольной, излечившийся благодаря иммунотерапии, бывший презедент США Джимми Картер. В возрасте 90 лет он сообщил об успешно перенесенной операции по удалению опухоли печени. Однако вскоре стало известно, что это - метастаз меланомы, тогда же были выявлены и метастазы в головной мозг. Немедленно начатая иммунотерапия дала результаты - уже через год лечения сообщалось, что у экс- президента не обнаружено никаких следов онкологических образований.
Вообще, в последние годы темпы появления новых лекарств для борьбы с опухолями, ускорились в геометрической прогрессии. Сейчас любая уважающая себя фармацевтическая компания одновременно разрабатывает десятки молекул. Не факт, что из каждой из них на выходе появится новый противоопухолевый препарат, но, тем не менее, благодаря такой высокой заинтересованности производителей, в мире регулярно появляются новые эффективные лекарства.
- Если механизм иммунотерапии так эффективен, прост и органичен замыслу самой природы, почему одним пациентам назначают такие препараты, а другим, с таким же диагнозом, - нет?
- Рак настолько сложное заболевание, что вряд ли когда-нибудь будет придумано универсальное лекарство от этой болезни. Поэтому и иммунотерапия – это не панацея, а всего лишь еще одна очень хорошая лекарственная опция.
Почему мы не назначаем одинаковые препараты пациентам с одинаковыми диагнозами - а что вы считаете одинаковым диагнозом? Это раньше мы лечили рак легкого, рак груди, рак почки и так далее. Сейчас пациента с таким определением статуса болезни ни один врач не сможет лечить эффективно.

Иногда у обычной клетки в силу ряда причин происходит сбой в программе деления – она приобретает способность делиться очень быстро и бесконечное количество раз, становится потенциально бессмертной - злокачественной. Фото: Юлия КОРЧАГИНА
Ученые давно доказали, что не существует абсолютно одинаковых раков. Поэтому мы сейчас лечим не опухоли, а их особенности - наличие определенных биомаркеров. В иммунотерапии это уровень экспрессии рецептора PD-L1 на опухолевых клетках. И чем этот уровень этот выше, тем более результативным будет лечение. Вот почему персонализация - тренд современной онкологии.
Онкологи уже научились применять иммунопрепараты не только в монорежиме, но и эффективно использовать их в сочетании с химиопрепаратами, таргетными и даже другими иммунными препаратами. Причем, комбинация двух или нескольких средств, как правило, имеет синергетический эффект, они многократно усиливают действие друг друга.
Полностью излечить метастатический процесс, к сожалению, нельзя. Наша задача, чтобы пациент жил долго и в хорошем качестве. И сегодня мы научились переводить рак в длительное хроническое течение, назначая последовательную терапию при прогрессировании заболевания.
- Может ли человек сам, не дожидаясь лечения в стационаре, купить иммунологический препарат и начать его использовать самостоятельно? Ведь многие из них выпускаются в форме таблеток – ничего сложного.
- Ни в коем случае! Любой иммунологический препарат должен приниматься под контролем врача, имеющего опыт работы с подобными средствами.
Иммунологические препараты при неграмотном применении могут вызывать тяжелые побочные явления. Например, у пациента появилась высокая температура, кашель одышка. Что это – аутоиммунная или обычная пневмония? Знать это крайне важно, ведь при схожем названии тактика лечения будет принципиально различной.
Токсичная реакция на иммунологический препарат может развиться как через несколько дней, так и через несколько лет после его применения, может пройти почти сразу, а может сохраняться годами. Понимание первопричин каждого из явлений крайне важно для его успешного лечения.
Конечно, такие тяжелые побочные эффекты развиваются редко, поэтому мы успешно лечим наших пациентов в условиях дневного стационара, однако быть готовыми к ним просто необходимо. Тем более не понятно, зачем так рисковать собственным здоровьем, ведь все препараты есть в наличии в диспансере, и пациенты получают их абсолютно бесплатно. А это отнюдь немалые деньги – одно введение такого препарата может стоить 500 тысяч рублей, а общий курс составляет до 18 процедур.
- Почему так дорого?
- Разработка нового иммунологического препарата стоит порядка миллиарда долларов. Это многоуровневый процесс, в ходе которого сначала изучаются общие и специфические свойства препарата, потом его тестируют на животных, затем на добровольцах, следующим этапом изучают степень его токсичности, и так далее.
На входе может стартовать десять потенциальных лекарств, а лет эдак через двадцать к финишу придет лишь один препарат. И только семь лет после разработки формула защищается патентом, по истечении этого срока буквально на следующий день заранее скопированный препарат начинает продаваться гораздо дешевле. Вот производители и успевают отбить затраты и заработать на своем изобретении.
- Можно ли профилактически укрепить иммунитет конкретно против онкологии?
- К сожалению, это невозможно. Иммунитету все равно, против кого бороться, для него и раковая клетка и вирус гриппа – одинаково опасны. Он либо работает, либо нет. Чтобы увереннее противостоять, в том числе развитию злокачественных патологий, нужно укреплять свой иммунный ответ в целом. Рекомендации тут стандартные: здоровый образ жизни, отказ от вредных привычек, правильное питание, постоянный контроль за хроническими болезнями высокого онкориска. Кроме этого существуют и специфические меры профилактики, например, вакцинация против рака шейки матки.
Ну а если есть выраженные проблемы с иммунитетом – частые простуды, головные боли, усталость, упадок сил, сонливость, раздражительность – то лучше обратиться к врачу.
- Ваше мнение: действительно ли иммунотерапия – это прорыв в онкологии, как об этом сейчас говорят?
- Это несомненный прорыв. Появление современных иммунных препаратов коренным образом изменило подход к терапии злокачественных опухолей. У этой категории лекарств есть важная особенность: однажды получив полный ответ на иммунотерапию, мы сохраняем его на годы. У цитостатиков и таргетных препаратов такого нет, там этот эффект длится в среднем от полугода до года. То, что новые препараты дают возможность превратить ра нее считавшееся смертельным заболевание в контролируемую хроническую болезнь или полностью от нее излечиться, вселяет надежду в миллионы больных.
Да, мы пока не можем вылечить всех. Но можем выделить иммунозависимую популяцию и полечить ее. Например, для рака легкого это около 25% всех пациентов. Это уже немало!
Бывает, что опухоли уходят полностью, как в случае со Святым Перегрином, однако следует признать, что это случается крайне редко. Чаще – они значительно уменьшаются в размерах или полностью регрессируют и такое состояние при назначении иммунотерапии может длиться очень долго. Сейчас все эти эффекты изучаются более активно, и я уверена, что ученых ждет еще масса революционных открытий.
Читайте также:

