Что такое dc в онкологии
Онкологические заболевания в современном мире встречаются все чаще. Это связано с особенностями экологии, множеством новых вирусов, а также с большим количеством канцерогенов. Ежегодно ученые вводят новые методы борьбы с раком. Однако прежние способы лечения применяются до сих пор. Одним из них является ПХТ. Расшифровка этой аббревиатуры – полихимиотерапия. Системное введение цитостатических препаратов помогает устранить атипичные клетки, из которых состоит опухоль. Несмотря на то что данный вид лечения нелегко переносится пациентами, он является одним из самых эффективных методов.
ПХТ в онкологии: расшифровка аббревиатуры
В медицинской документации людей, страдающих от раковых заболеваний, часто встречается такое понятие, как химиотерапия. Сокращенно ее называют ПХТ. В онкологии расшифровка данной аббревиатуры - полихимиотерапия, что означает сочетанное воздействие сразу нескольких цитостатических средств. Данный вид лечения направлен на полное устранение опухоли или ее уменьшение.
В большинстве случаев ПХТ сочетают с другими методами лечения. Среди них – хирургическое удаление патологического образования и лучевая терапия. Иногда полихимиотерапия является самостоятельным методом лечения. Выбор ПХТ зависит от расположения и стадии рака, а также от состояния больного. Назначать цитостатические препараты может только врач-онколог.
Виды химиотерапии в онкологии

Противоположным понятием является адъювантная ПХТ в онкологии. Расшифровка аббревиатуры проста. АПХТ – это профилактическое лечение рака после операции. Имеется в виду, что саму опухоль полностью удалили, однако для предотвращения рецидива требуется цитостатическая терапия. Перечисленные виды ПХТ относятся к комбинированному или комплексному лечению злокачественных опухолей. То есть, помимо назначения препаратов, пациенту проводится операция, а иногда – и облучение.
Отдельным видом терапии является самостоятельный (лечебный) курс ПХТ в онкологии. Расшифровка подобного медицинского термина понятна не каждому врачу. Зачастую отличить лечебный курс от профилактической терапии может только онколог. Самостоятельная ПХТ проводится в тех случаях, когда другие методы оздоровления не показаны. Например, при мелкоклеточном раке легкого или наличии метастазов в отдаленные органы.
Показания к проведению терапии
Стоит отметить, что каждая злокачественная опухоль лечится по-разному. Иногда достаточно только оперативного лечения или облучения, в других случаях – требуется химиотерапия. ПХТ назначают лишь по специальным медицинским показаниям, когда это необходимо. Если подобное лечение не было предложено после операции врачом, значит злокачественный процесс был ограничен небольшим участком и не поразил глубокие слои органа. Кроме того, некоторые типы опухолей не поддаются химиотерапии. Выделяют следующие показания для ПХТ в онкологии:
- Злокачественные образования лимфоидной ткани.
- Рак крови.
- Опухоли пищеварительного тракта.
- Мелко- и крупноклеточный рак легкого.
- Новообразования головы и шеи.
Следует отметить, что эффективность химиотерапии зависит от гистологического типа опухоли. К примеру, железистый рак поддается цитостатическому лечению лучше, чем плоскоклеточная карцинома или саркома. Зачастую ПХТ не назначают на первых стадиях болезни, если опухоль можно удалить оперативным путем. Адъювантная терапия показана пациентам, у которых после хирургического лечения была обнаружена 2 или 3 стадия рака. Если опухоль имеет большой размер и проросла в соседние органы, назначают самостоятельный курс ПХТ. Иногда данный вид лечения применяется на поздней стадии рака, когда другие методы бессильны.
Что такое курс химиотерапии?
Большинство людей знает, что химиотерапию принято назначать курсами. Это означает, что цитостатические средства вводятся в организм неоднократно, а на протяжении длительного времени - с определенными промежутками. Подобная схема лечения необходима, потому что препараты разрушают не только саму опухоль, но и другие клетки организма. Введение большой дозы единовременно невозможно, так как цитостатики обладают кардио-, нефро- и гепатотоксичным действием. Чтобы организм восстановился после курса ПХТ, требуется время. В среднем это занимает 2-4 недели. За этот период клетки крови успевают обновиться, и общее самочувствие пациента приходит в норму.
Количество курсов ПХТ в онкологии может быть различным. Оно зависит от переносимости препаратов, состояния больного и эффективности лечения. После 3 курсов проводится обследование, благодаря которому врач делает соответствующее заключение. Если опухоль полностью исчезла или частично уменьшилась, химиотерапию продолжают. В случаях, когда имеется прогрессирование злокачественного процесса, схему ПХТ меняют. При этом отсчет курсов начинается заново.
Подготовка и сопроводительная терапия
Противопоказания к назначению химиотерапии
Несмотря на то что химиотерапия относится к одним из самых эффективных методов лечения рака, ее проведение не всегда необходимо. В некоторых случаях цитостатические средства приносят больше вреда, чем пользы. Проведение ПХТ противопоказано в следующих случаях:
- Старческий возраст (от 70 лет).
- Непереносимость цитостатических средств.
- Наличие тяжелых патологий со стороны сердца.
- Почечная и печеночная недостаточность.
- Прогрессирование заболевания, несмотря на проводимую терапию.
- Наличие множественных метастазов.
- Кахексия.
Перед тем как назначить ПХТ, проводится комплекс обследований. К ним относятся: общий и биохимический анализ крови, ЭКГ, ОАМ, коагулограмма, УЗИ сердца. При выявлении декомпенсированных заболеваний лечение цитостатиками нецелесообразно.
Возможные результаты химиотерапии
Для контроля эффективности ПХТ проводится повторное обследование. Благодаря этому оценивается результат терапии. К благоприятным исходам лечения относятся: полный и частичный регресс опухоли, а также стабилизация. В первом случае новообразование исчезает или уменьшается в размере в 2 раза и более. Стабилизация процесса означает, что опухоль осталась прежней. Однако это расценивается как положительный результат, ведь без лечения рак быстро прогрессирует.
Если при обследовании выявлено, что злокачественное образование растет, или появились метастазы, схему лечения меняют. При удовлетворительном состоянии пациента количество курсов химиотерапии неограниченно. Однако постоянное прогрессирование служит показателем того, что лечение не приносит результата, а только вредит организму. Это служит противопоказанием для назначения ПХТ.

Список лекарственных средств

Эмболизация — малоинвазивная процедура, которая может дополнять хирургическое лечение или использоваться самостоятельно. Хирург через прокол в бедренной артерии проводит специальный катетер в артерии, непосредственно питающие опухоль и через него закрывает их специальными частицами — эмболами, которые перекрывают кровоток. В ряде случаев используют эмболы, способные выделять химиопрепарат в ткань опухоли — такое вмешательство называется химиоэмболизация.
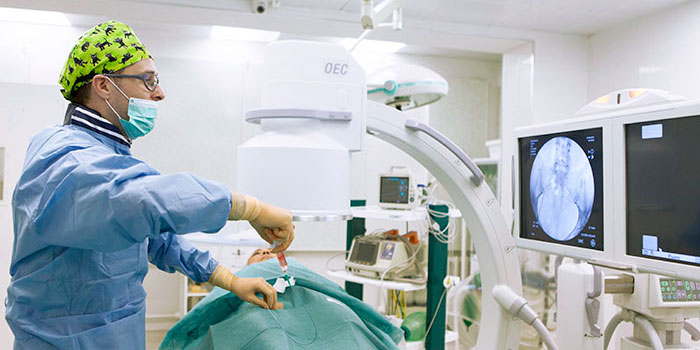
Эмболизация применяется для лечения многих заболеваний. С начала XXI века эта процедура получает все более широкое применение и в онкологии, в первую очередь из-за своей эффективности и малоинвазивности — эмболизации безболезненны, не требуют наркоза, инструмент вводится через пункцию артерии, т. е. нет никакой операционной раны.
Эмболизация у онкологических пациентов
Эмболизация артерий для лечения опухолей и их метастазов помогает решить следующие задачи:
- в качестве самостоятельного метода лечения — эмболизация (чаще всего в варианте химиоэмболизации) может приводить к ишемии ткани опухоли и ее гибели. Для некоторых заболеваний, например, ряд опухолей печени, этот лечения может приводить к полной ремиссии без хирургического лечения.
- в сочетании с хирургическим лечением эмболизация используется как вспомогательная технология — чаще всего для уменьшения кровотечения во время операции за счет деваскуляризации (обескровливания) новообразования;
- в ряде случаев эмболизация, выполненная перед операцией, дает возможность проведения более радикальной операции за счет предварительного уменьшения опухоли;
- эмболизация также может применяться для борьбы с симптомами и осложнениями онкологических заболеваний — это в первую очередь остановка опасных кровотечений, которые угрожают жизни пациента, кроме того — облегчение боли, вызванной злокачественным новообразованием; еще одним эффектом является уменьшение объема и замедление роста опухоли.
Виды эмболизации артерий у онкологических больных:
- предоперационная — выполняется в качестве первого этапа хирургического вмешательства;
- в качестве самостоятельного метода лечения — чаще всего при опухолях печени, почек и ряде других опухолей
- в качестве паллиативного метода лечения — для остановки кровотечений, уменьшения болевого синдрома, уменьшения объемов и темпа роста опухоли.
Как проводится эмболизация артерий?
Эмболизация выполняется врачами-рентгенохирургами в специально оборудованной ангиографической операционной. Перед эмболизацией всегда проводят ангиографию. В сосуды вводят рентгенконтрастное вещество, в ходе чего записывают рентгеновское изображение в цифровом видеоформате. Это помогает врачу оценить расположение и анатомию сосудов, определить, из каких артерий осуществляется кровоснабжение опухоли.
Чаще всего эмболизацию выполняют под местной анестезией. В редких случаях приходится использовать общую анестезию (наркоз). За 4–5 часов до процедуры пациента просят ограничить прием пищи, иногда дают успокоительные препараты.
В большинстве случаев доступ к нужному сосуду получают через бедренную артерию, это самый типичный доступ для всех ангиографических исследований и вмешательств, но могут использовать и другие артерии в других местах (лучевую на запястье, плечевую в области локтевого сгиба и т. п.). Врач обрабатывает кожу антисептиком и делает небольшой прокол, вводит в артерию специальный катетер размером не более 1,5 мм и продвигает его до тех пор, пока не достигнет нужного сосуда. Через катетер в сосуд вводят эмболы, которые перекрывают его просвет.
Существуют разные виды эмболов:
- Поливинилалкоголь (PVA) представляет собой частицы размером от 50 до 1000 мкм. Это относительно недорогой и простой в применении препарат, однако, в настоящее время он считается устаревшим. Сейчас чаще всего применяют сферические эмболы, например, Bead Block и Embozene.
- Спирали из платины и нержавеющей стали. После установки в просвете сосуда на них быстро образуется тромб, который перекрывает кровоток. Иногда такие спирали применяют вместе с желатиновыми губками: сначала устанавливают спираль, а затем через катетер вводят губку — ее частички оседают между витками. Их применяют только для остановки кровотечений, обусловленных опухолями.
- Химиоэмболизация — введение в просвет сосуда эмболов, содержащих химиопрепарат. Таким образом, с одной стороны происходит закупорка сосудов, кровоснабжающих опухоль, а с другой химиопрепарат поступает непосредственно в ткань опухоли и не оказывает побочные эффекты, которые возникают при его введении в вену. При этом в самой опухоли создаются очень высокие концентрации препарата, невозможные при обычном введении. Мы применяем самые современные препараты для химиоэмболизации: DC Beads (Terumo, Япония) и Hepaspheres (Merit Medical, США)., которые высвобождают химиопрепарат в течение длительного времени, в стабильной дозировке.
- Радиоэмболизация — введение эмболов, содержащих радиоактивные изотопы. Эта процедура еще называется внутренней лучевой терапией, так как в опухоль изнутри вводят дозу радиации, разрушающей ее клетки. Для этого обычно используют изотоп Иттрий-90.
К эмболизации артерий наиболее часто прибегают при следующих онкологических заболеваниях:
- В качестве самостоятельного метода лечения: Первичные и метастатические опухоли печени, почек, легких и других локализаций.
- В комбинации с хирургическими методами: Первичные и метастатические опухоли печени, почек, легких, костей, позвоночника, матки, простаты, мочевого пузыря и т. д.
- Для остановки кровотечений при опухолях: малого таза, легких, прямой кишки, толстой кишки, печени, матки, простаты, опухолях головы и шеи. Т. е. практически при любой локализации с целью прекращения кровотечения.
Эмболизация также широко применяется для лечения заболеваний, не связанных с онкологией:
- Миома матки. Эмболизация маточных артерий — наименее травматичный способ лечения миомы матки, обладающий высокой эффективностью — около 98,5% женщин, перенесших эту процедуру, не нуждаются в дополнительном лечении.
- Аденома простаты. Эмболизация - эффективный, малоинвазивный способ лечения аденомы предстательной железы, который сегодня становится все более распространен в развитых странах.
- Варикоцеле — наименее инвазивная альтернатива хирургическому лечению, выполняется амбулаторно за 20–30 минут.
- Сосудистые мальформации различной локализации.
- Аневризмы — в первую очередь аневризмы головного мозга, способные вызвать геморрагический инсульт.
Насколько безопасна эмболизация?
Цель эмболизации в онкологии — не только прекратить приток крови к патологическому очагу, но и сохранить при этом кровообращение в соседних здоровых тканях. Современная техника эмболизации с использованием микрокатетеров позволяет обеспечить необходимую точность эмболизации.
Для того чтобы обеспечить точность в ходе эмболизации всегда проводят ангиографию. Врач внимательно изучает сосудистую сеть, кровоснабжение опухоли и определяет, в какой сосуд должны быть введены эмболы. Эмболы вводятся только после детального изучения сосудистой анатомии опухоли в ходе вмешательства. Перед эмболизацией вам также могут назначить УЗИ, КТ, МРТ и другие исследования.
Существует ряд противопоказаний к проведению эмболизации, но все они являются относительными, то есть процедура, как правило, все же может быть проведена при соблюдении некоторых условий. Например, у пациента с нарушением функции почек должно быть нормализовано артериальное давление, водно-солевой баланс, а во время ангиографии нужно использовать минимальное количество контрастного вещества.
В Европейской клинике с каждым пациентом работают индивидуально. Врач оценивает общее состояние больного, учитывает сопутствующие заболевания, размеры и расположение опухоли, особенности ее кровоснабжения.
Врачи-специалисты Европейской клиники имеют огромный опыт проведения эмболизации артерий при различных видах опухолей. Мы используем значительный собственный и опыт коллег из ведущих зарубежных клиник. Некоторые процедуры, которые мы предлагаем пациентам в Европейской клинике (например, эмболизация при аденоме простаты), даже в Европе, США и Израиле являются прерогативой крупных университетских клиник из-за необходимости иметь хирургов самого высокого уровня.
Нашими врачами были выполнены первые в России эмболизации миомы матки, артерий простаты, мы первыми стали работать с самыми современными препаратами для эмболизации — Bead Block, Embozene, DC Bead и др.
Конкурирующие интересы: Проф. Штеммер — академический редактор в журнале PLoS One. Это не изменяет приверженность авторов PLOS ONE Редакционные политики и критерии.
Задуманные и разработанные эксперименты: RY SR. Выполняли эксперименты: RY AS IBA DH VN NBC LB LA AZ TG SR SMS. Проанализированы данные: RY AS SR SMS. Используемые реагенты / материалы / инструменты анализа: RY HG SR. Написал документ: RY AS SMS.
Четыре цикла доцетаксела / циклофосфамида (DC) приводили к превосходной выживаемости, чем доксорубицин / циклофосфамид при лечении раннего рака молочной железы. В оригинальном исследовании сообщалось о 5% случаев фебрильной нейтропении (FN), рекомендующей профилактические антибиотики без поддержки гранулоцитарного колониестимулирующего фактора (G-CSF). Во всем мире принятие этого протокола дало несколько отчетов по значительно более высоким темпам событий FN. Мы исследовали использование поддержки фактора роста (GF) в дни 8 и 12 цикла с исходным протоколом постоянного тока.
Наше исследование включало всех последовательных пациентов с раком молочной железы I-II стадии, которым с апреля 2007 года по март 2012 года лечили протокол DC в Институте онкологии, Центр Дэвидофф (Медицинский центр Рабина, Петах-Тиква, Израиль). Пациент, опухоль характеристики и токсичность. Результаты. В общей сложности 123 пациента получили режим DC. Средний возраст составлял 60 лет (диапазон — 25-81 лет). Тридцать три пациента (26,8%) были в возрасте 65 лет и старше. Большинство женщин (87%) придерживались запланированного протокола G-CSF (дни 8 и 12). 96% пациентов завершили 4 запланированных цикла химиотерапии. Шесть пациентов (5%) имели снижение дозы, 6 (5%) имели задержки в лечении по немедицинским причинам. Тринадцать пациентов (10,6%) имели по крайней мере одно событие FN (у 3 пациентов было 2 случая), все из которых требуют госпитализации. Восемь пациентов (6,5%) нуждались в дополнительной поддержке с G-CSF после первого цикла химиотерапии, 7 из-за FN и одного из-за нейтропении и диареи.
Первичная профилактическая поддержка G-CSF в дни 8 и 12 цикла обеспечивает приемлемый вариант для доставки протокола постоянного тока. Наши результаты соответствуют другим ретроспективным протоколам, использующим более длинные графики поддержки GF.
Показано, что адъювантная химиотерапия для пациентов с ранней стадией рака молочной железы улучшает как безрецидивенную выживаемость, так и общую выживаемость [1]. Однако выбор наиболее подходящего режима химиотерапии для каждого пациента остается проблемой. Многие используемые адъювантные протоколы основаны на антрациклинах и, следовательно, потенциальной кардиотоксичности в гавани. Джонс и его коллеги изучили факультативный неантрациклиновый адъювантный режим. Они обнаружили, что 4 цикла доцетаксела / циклофосфамида (DC) обеспечивают превосходную выживаемость по сравнению с доксорубицином / циклофосфамидом (AC) при лечении раннего рака молочной железы. Исследование показало, что у 5% пациентов развились лихорадка и нейтропения с использованием профилактических антибиотиков без поддержки гранулоцитарного колониестимулирующего фактора (G-CSF) [2]. Всемирное принятие этого протокола дало несколько сообщений о значительно более высоких показателях случаев фебрильной нейтропении (FN) (до 80% в подгруппе пациентов в этом отчете) [3], что побудило добавить G-CSF большинством медицинских центров [3 ] — [6].
График администрации G-CSF варьируется в зависимости от практики онкологов. Предыдущие исследования предположили, что переключение с pegfilgrastim на несколько доз филграстима может быть достаточным для адекватной поддержки адъювантной химиотерапии. По сравнению с ежедневным назначением филграстима в течение 7 дней (дни от 8 до 14) меньшее количество доз 2 (дней 8 и 12) и 4 (дней 8, 10, 12 и 14) дней показало меньшие побочные эффекты, такие как боль в костях и заболеваемость лихорадка [7], [8]. Мы исследовали использование только 2 доз филграстима (Neupogen) 5 мкг / кг на днях 8 и 12 с исходным протоколом постоянного тока. В этом отчете суммируется связанная с лечением заболеваемость протокола DC с поддержкой G-CSF, которая предоставляется на 8 и 12 днях в каждом цикле.
Исследование было одобрено институциональной комиссией по обзору Медицинского центра Рабина. Согласие не было получено (как было одобрено этическим комитетом). Информация пациента была анонимизирована и деидентифицирована до анализа.
Этот ретроспективный анализ включал всех последовательных пациентов с раком молочной железы I-II стадии, которые получали протокол DC (доцетаксел 75 мг / м2 и циклофосфамид 600 мг / м2 внутривенно в день 1 каждые 21 день в течение 4 циклов) и получали филграстим (Neupogen, Amgen Inc. Thousand Oaks, CA. США) 5 мкг / кг подкожно в дни 8 и 12 каждого цикла (по крайней мере в течение одного цикла) в Институте онкологии, Центр Дэвидофф, Медицинский центр Рабина, Петах-Тиква, Израиль с апреля 2007 г. до марта 2012 года. Никакого профилактического лечения антибиотиками не было.
Описательная статистика использовалась для суммирования характеристик пациентов и опухолей и полученных обработок. Чи-квадрат был использован для сравнения количества событий FN между возрастными группами (≤65,> 65 лет). P 65 лет (таблица 1).
* HER2 положительные случаи были определены как IHC + 3 или IHC + 2, FISH с коэффициентом усиления ≥2,0.
Сто восемнадцать пациентов (95,9%) завершили 4 запланированных цикла DC (из них 2 пациента получили 6 циклов в соответствии с планом лечения своего врача). Пять пациентов (4,1%) прекратили лечение после первого цикла постоянного тока из-за боли в груди, второй злокачественности, аллергии, диареи и боли в животе или перемещения (по одному пациенту). Из 496 запланированных циклов было упущено 15 (3,0%). Шесть пациентов (4,9%) нуждались в снижении дозы для ≥1 цикла (снижение плановой дозы на 9-25%), а 6 пациентов (4,9%) имели задержку лечения до 5 дней, ни одна из-за медицинских причин.
Большинство пациентов (107 пациентов, 87,0%) придерживались запланированного протокола филграстима (дни 8 и 12). Четырнадцать пациентов (11,4%) нуждались в дополнительной поддержке G-CSF после первого цикла DC, 13 из-за FN и 1 из-за нейтропении и диареи. Средний (диапазон) возраст пациентов, нуждающихся в дополнительной поддержке G-CSF, составил 58 (28-73) лет. У 5 пациентов (4,1%) доза филграстима снижалась после первого цикла DC до 1 инъекции в течение цикла постоянного тока из-за лейкоцитоза и сильной боли в костях (таблица 2).
G-CSF гранулоцитарный колониестимулирующий фактор.
Тринадцать пациентов (10,6%) имели по крайней мере одно заболевание FN (у 3 пациентов было 2 случая), все из которых требуют госпитализации. Восемь пациентов (6,5%) испытали событие FN в своем первом цикле DC. В целом, события FN произошли в 16 из 496 циклов (3,2%). Частота случаев FN была сходной у пациентов старше (> 65 лет) и молодых (≤65 лет) (4 из 33 пациентов [12,1%] и 9 из 90 пациентов [10,0%] соответственно, P = 0,74). В целом, средний (диапазон) возраст пациентов, нуждающихся в госпитализации из-за FN, составлял 60 (42-73) года. Средний возраст старшей больничной группы составлял 72 года по сравнению с 54 годами в младшей группе. В дополнение к 13 госпитализации, связанным с ФН, было зарегистрировано еще 14 госпитализаций по другим причинам, включая: диарею, боль в груди, лихорадку и целлюлит (по 2 пациента), а также хроническую обструктивную болезнь легких, тонзиллит, боль в костях, слух проблема, наблюдение после лечения и неизвестная причина (по одному пациенту). Следует отметить, что 4 дополнительных пациента имели диарею 2-3 степени, но не требовали госпитализации. Смертности, связанной с лечением, не было.
Адъювантная системная химиотерапия оказывает решающее влияние на выживаемость многих пациентов и их качество жизни [1]. Комбинация доцетаксела и циклофосфамида является разумным вариантом для пациентов с ранней стадией рака молочной железы, как положительного или отрицательного, так и отрицательного HER2-рецептора эстрогена. Для некоторых пациентов, таких как те, которые не являются кандидатами на стандартные схемы, содержащие антрациклин, режим DC может быть предпочтительным лечением [2]. Приверженность к первоначальной плотности дозы / интенсивности выбранного системного лечения очень важна. FN может поставить под угрозу дозировку и график лечения, а в крайних случаях может быть опасным для жизни событием. Поддержка G-CSF может снизить риск таких опасных для жизни событий [9]; поэтому Американское общество клинической онкологии (ASCO), Национальная комплексная онкологическая сеть (NCCN) и Европейская организация по исследованию и лечению рака (EORTC) одобряют использование G-CSF в определенных ситуациях [10] — [12 ]. В обновленном в 2006 году обновлении рекомендаций ASCO по использованию факторов роста белых клеток крови (WBC) и руководящих принципов NCCN 2011 говорится, что первичная профилактика с фактором роста белых клеток рекомендуется для профилактики FN у пациентов с высоким риском развития этого осложнения терапия. Высокий риск определяется как риск более 20%. Руководящие принципы EORTC 2011 рекомендуют использовать G-CSF, когда снижение интенсивности или плотности дозы химиотерапии может нанести ущерб результатам пациентов, как в настройке адъюванта.
В нескольких исследованиях оценивались показатели FN у пациентов с раком молочной железы, получавших курс DC (таблица 3). Самые высокие показатели событий FN были обнаружены у японцев (28,3%) и в канадских (33%) исследованиях [3], [4]. В обоих исследованиях не было обычного профилактического введения G-CSF. Старшая группа (возраст> 65 лет) страдает от чрезвычайно высокой частоты событий FN: восемьдесят процентов пожилых пациентов в японском исследовании, где первичная профилактика не была предложена, и 40% в канадском исследовании, где только 28% пациентов прошли профилактическое лечение. В других исследованиях общая частота событий FN составляла не более 12% даже в старшей подгруппе. В этих исследованиях значительная доля (49% -100%) пациентов получала первичную профилактику G-CSF, за исключением Jones et al. исследование, в котором профилактические антибиотики были рекомендованы всем пациентам (хотя авторы заявляют, что не знают точного числа пациентов, которые получали антибиотик профилактически) [2], [5], [6], [13]. Таким образом, наше исследование сопоставимо с предыдущими отчетами, подтверждающими использование профилактического G-CSF с протоколом постоянного тока, хотя оптимальный график G-CSF еще предстоит определить.
Показатель коморбидности CCI Charlson, сердечно-сосудистые заболевания, сердечно-сосудистые заболевания, доцетаксел DC / циклофосфамид, интенсивность дозы DI, гранулоцитарный колониестимулирующий фактор G-CSF, NA недоступны, пациенты с очками.
Хотя авторам неизвестно точное число пациентов, прошедших профилактическое лечение антибиотиками.
Все пациенты были> 70 лет.
В то время как некоторые онкологи рекомендуют 5-7 ежедневных инъекций филграстима, начиная с 48-72 часов после начала химиотерапии, другие рекомендуют pegfilgrastim для достижения поддержки длительного действия. Наши пациенты получали только 2 инъекции G-CSF в качестве первичной профилактики с сопоставимыми результатами с предыдущими исследованиями с разными графиками поддержки G-CSF. Следует отметить, что Chan et al. предоставили протокол, аналогичный нашему, короткий первичный профилактический протокол G-CSF. Там пациенты получали 3 инъекции через день и имели сопоставимые результаты для событий FN [6].
Преимущество поддержки G-CSF, по-видимому, является существенным. Недавний метаанализ, основанный на 61 рандомизированном клиническом исследовании с различными типами опухолей и включавшем 24 796 пациентов, которые сравнивали химиотерапию с G-CSF и без него, показал, что смертность от всех причин с медианным наблюдением за 3 года была значительно снижена при поддержке G-CSF [14], что еще более усиливает его использование в клинической практике. Однако инъекции G-CSF могут иметь значительные побочные эффекты, такие как сильная боль в костях (что стало причиной госпитализации для одного пациента в текущем исследовании), аллергическая реакция и лихорадка [15].
В последнее десятилетие в нескольких публикациях сообщалось об увеличении скорости использования G-CSF в адъювантной установке [16] — [19]. Как и ожидалось, принятие поддержки G-CSF в качестве стандарта в онкологической практике вызывает экономические проблемы [20] — [21]. Семь дней лечения филграстимом стоят $ 500-800, а одна инъекция pegfilgrastim стоит $ 1500-2000. Поскольку протокол DC основан на 4 циклах химиотерапии, финансовое бремя, связанное с поддержкой G-CSF, может достигать 8000 долларов США на пациента. В последнее время широко распространенное использование режима постоянного тока с поддержкой G-CSF добавило к бюджетным ограничениям при адъювантной терапии пациентов с раком молочной железы. Younis et al. отметил, что более высокая заболеваемость FN, связанная с режимом DC, привела, как и ожидалось, к менее благоприятным оценкам затрат-полезности. Добавление G-CSF ко всем пациентам удвоило оценочную стоимость на год жизни, скорректированный на качество (QALY), при сравнении 4 циклов DC до 4 циклов AC [22]. Следует отметить, что события FN обычно требуют госпитализации.
Наши пациенты получали только 2 инъекции G-CSF в качестве первичного профилактического лечения с более низкой частотой событий FN по сравнению с некоторыми предыдущими публикациями. Однако у 10,6% пациентов по-прежнему было по крайней мере одно событие FN. Это ставит вопрос о том, приведет ли более чем к двум инъекциям или предварительному управлению пегфилграстимом еще больше снизить риск таких событий.
Ограничениями этого исследования являются его ретроспективный дизайн и использование когорты пациентов из одного центра. Тем не менее, мы включили всех последовательных пациентов, которые получили протокол, и отсутствовали данные для любого из пациентов. Только 8 из 131 пациента (6%) были назначены на режим DC без протокола G-CSF, из которых 5 пациентов не получали никакой поддержки G-CSF. Это исключает потенциальный уклон, который пациенты, склонные к разработке FN, были предложены другим протоколом G-CSF.
Таким образом, поддержка первичного профилактического фактора роста на днях 8 и 12 обеспечивает приемлемый вариант для доставки протокола постоянного тока. Наши результаты соответствуют другим ретроспективным протоколам, использующим более длинные графики поддержки факторов роста. Дальнейшие исследования необходимы для определения наиболее подходящего режима G-CSF для протокола постоянного тока.
Читайте также:

