Что такое частичная резорбция опухоли
Распад опухоли — это закономерное следствие слишком активного роста ракового узла по периферии или осложнение избыточно высокой реакции распространённого злокачественного процесса на химиотерапию.
Не каждому пациенту доводится столкнуться с тяжелой проблемой распада ракового процесса, но при любой интенсивности клинических проявлений инициируемое распадом злокачественной опухоли состояние непосредственно угрожает жизни и радикально меняет терапевтическую стратегию.

Распад опухоли: что это такое?
Распад — это разрушение злокачественного новообразования, казалось бы, что именно к распаду необходимо стремиться в процессе противоопухолевой терапии. В действительности при химиотерапии происходит уничтожение раковых клеток, только убийство органичное и не массовое, а единичных клеток и небольших клеточных колоний — без гибели большого массива ткани с выбросами в кровь из распадающихся клеток токсичного содержимого.
Под действием химиотерапии клетки рака приходят не к распаду, а к процессу апоптоза — программной смерти. Останки раковых клеток активно утилизируются фагоцитами и уносятся прочь от материнского образования, а на месте погибших возникает нормальная рубцовая ткань, очень часто визуально не определяющаяся.
Регрессия злокачественного новообразования в форме апоптоза происходит медленно, если наблюдать за новообразованием с перерывами в несколько дней, то заметно, как по периферии раковый узел замещается совершенно нормальной тканью и сжимается в размере.
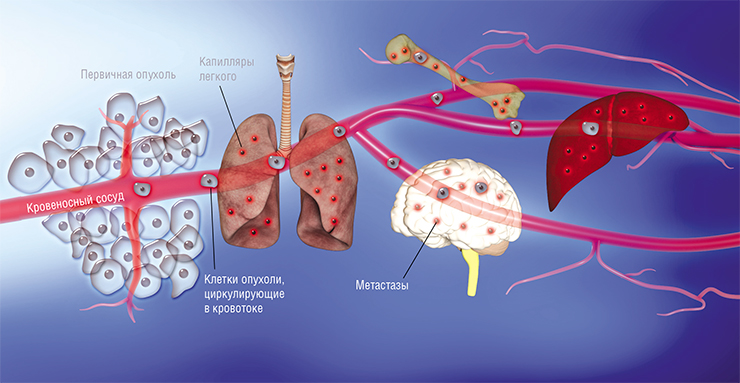
При распаде раковый конгломерат не замещается здоровыми клетками соединительной ткани, мертвые клеточные пласты формируются в очаг некроза, отграничивающийся от остальной раковой опухоли мощным воспалительным валом. Внутри злокачественного новообразования некроз не способен организоваться и заместиться рубцом, он только увеличивается, захватывая новые участки ракового узла, походя разрушая опухолевую сосудистую сеть. Из мертвого очага в кровь поступают продукты клеточного гниения, вызывая интоксикацию.
Массированный выброс клеточного субстрата становится причиной тяжелейшей интоксикации, способной привести к смерти.
Причины распада злокачественной опухоли
Инициируют распад ракового образования всего только две причины: сама жизнедеятельность клеток злокачественной опухоли и химиотерапия.
Первая причина спонтанного — самопроизвольного распада характерна для солидных новообразований, то есть рака, сарком, злокачественных опухолей головного мозга и меланомы. Вторая причина распада типична для онкогематологических заболеваний — лейкозов и лимфом, при онкологических процессах встречается чрезвычайно редко.

Второй вариант распада, типичный для онкогематологических заболеваний, можно констатировать по клиническим симптомам тяжелейшей интоксикации с осложнениями — тумор-лизис-синдрому (СОЛ) и биохимическим анализам крови, где резко повышена концентрация мочевой кислоты, калия и фосфора, но существенно снижен кальций. Конкретная побудительная причина для развития СОЛ — обширное злокачественное поражение с очень высокой чувствительностью к химиотерапии.
При онкологических процессах — раках, саркомах, меланоме реакция на цитостатики преимущественно умеренная и не столь стремительная, поэтому СОЛ принципиально возможен только в исключительных случаях мелкоклеточного, недифференцированного или анаплазированного злокачественного процесса.
Симптомы распада злокачественной опухоли
Клиническим итогом спонтанного распада раковой опухоли становится хроническая интоксикация, нередко сочетающаяся с симптомами генерализованного воспаления вследствие образования гнойного очага. Симптомы разнообразны, но у большинства отмечается прогрессивно нарастающая слабость, повышение температуры от субфебрильной до лихорадки, сердцебиение и даже аритмии, изменение сознания — оглушенность, нарушение аппетита и быстрая потеря веса.
Локальные проявления спонтанного разрушения раковой опухоли определяются её локализацией:
- рак молочной железы, меланома и карцинома кожи, опухоли ротовой полости — гнойная, обильно секретирующая открытая язва с грубыми подрытыми краями, часто источающая гнилостный запах;
- распадающаяся карцинома легкого — при прободении некротической полости в крупный бронх возникает приступообразный кашель с гнойной мокротой, нередко с прожилками крови, иногда случается обильное легочное кровотечение;
- разрушение новообразования органов желудочно-кишечного тракта — развитие локального перитонита при прободении ракового конгломерата в брюшную полость, кровотечение с чёрным стулом и рвотой кофейной гущей;
- распадающаяся карцинома матки — интенсивные боли внизу живота, нарушение мочеиспускания и дефекации при образование гнойных свищей.
Синдром опухолевого лизиса при лейкозах и лимфомах потенциально смертельное состояние, приводящее:
- в первую, очередь к осаждению кристаллов мочевой кислоты в почечных канальцах с выключением функции и острой почечной недостаточностью;
- дополнительно повреждает почки быстрое закисление крови — лактатацидоз;
- снижение уровня кальция и повышение фосфатов инициирует судорожный синдром, дополняемый неврологическими проявлениями вследствие выброса цитокинов;
- повышения калия негативно отражается на сердечной деятельности;
- выброс биологически-активных веществ из клеток приводит к повышению проницаемости мелких кровеносных сосудов, что снижает уровень белков и натрия крови, уменьшает объем циркулирующей плазмы, клинические проявляется падением давления и усугублением поражения почек;
- обширные и глубокие нарушения метаболизма во всех системах органов с исходом в полиорганную недостаточность.
Лечение распада опухоли
Формально при распадающейся опухоли невозможна радикальная операция, зачастую заболевание считается неоперабельным, но химиотерапия и облучение исключаются из программы, потому что способны усугубить некроз. Отчаянное положение пациента и вероятность массированного кровотечения из изъеденного раком крупного сосуда оправдывает выполнение паллиативной операции, основная цель которой — удаление очага хронического воспаления и интоксикации.
Синдром лизиса опухоли лечится многочасовыми капельными вливаниями при усиленном диурезе — выведении мочи, связыванием мочевой кислоты специальными лекарствами. Одновременно поддерживается работа сердечно-сосудистой системы, купируется интоксикация и воспаление. При развитии острой почечной недостаточности проводится гемодиализ.
Синдром лизиса опухоли сложно лечить, но можно предотвратить или хотя бы уменьшить его проявления. Профилактика начинается за несколько дней до курса химиотерапии и продолжается не менее трёх суток после завершения цикла. Кроме специальных препаратов, выводящих мочевую кислоту, назначаются продолжительные капельницы, вводятся недостающие микроэлементы, а избыточные выводятся или связываются другими лекарствами.
Профилактика лизиса опухоли стала стандартом лечения онкогематологических больных, чего нельзя сказать об онкологических пациентах с распадающимися злокачественными процессами, которым очень сложно найти хирурга, готового выполнить паллиативную операцию. Во вмешательстве по санитарным показаниям отказывают из-за сложности выхаживания тяжелого больного после обширного хирургического вмешательства. В нашей клинике никому не отказывают в помощи.
Похожие темы научных работ по клинической медицине , автор научной работы — Зиневич Б. М.
ЗАМЕТКИ ИЗ ПРАКТИКИ
ПОЛНАЯ РЕЗОРБЦИЯ РАКА ПРЯМОЙ КИШКИ НА ФОНЕ ЛУЧЕВОЙ ТЕРАПИИ
Смоленский областной онкологический диспансер
Хирургический метод лечения рака прямой кишки является основным [3]. Лучевой и лекарственный методы играют роль вспомогательных и не претендуют на радикальность [1, 2].
Мы располагаем благоприятным 15-летним наблюдением больного с полной резорбцией рака прямой кишки лучевым методом.
Больной М., 56 лет поступил во 2 хирургическое отделение 2 городской клинической больницы г. Смоленска 21,03.73 г. с жалобами на периодическое выделение крови при акте дефекации. Длительность анамнеза
Больной обследован, при пальцевом исследовании прямой кишки на расстоянии 3 см от ануса опухоль, верхний полюс которой не определяется. При ректороманос-копии обнаружена опухоль нижнеампу-лярного и среднеампулярного отделов прямой кишки, смешанная форма рака Т4Т\ПД0 стадия IV, клиническая группа IV. Гистологическое исследование №503 - аде-нокарцинома прямой кишки.
Рекомендован паллиативный курс лучевой терапии, переведен в радиологическое отделение областной больницы. В связи с отказом от лечения направлен в МНИОИ им. Герцена. С 10.04.73 г. проведено полное клиническое обследование: ректо-романоскопия, ирригоскопия, общеклинические и биохимические анализы. Гистологическое исследование №433/73/503
С 24.04.73 г. по 28.04.73 г. больному был проведен предоперациооный курс телегам-матерапии РОД 4 Гр, СОД- 30 Гр, отмечен выраженный положительный эффект.
03.05.73 г. - произведена лапаротомия, наложение противоестественного заднего прохода. С 28,05.73 г. по 08.06.73 г. проведен послеоперационный курс телегамматера-пии СОД - 28 Гр.
Находился на диспансерном наблюдении в онкологическом кабинете, регулярно осматривался, продолжал работать инженером.
Поступил в хирургическое отделение 2 городской клинической больницы г. Смоленска 06.07.76 г., обследован, при ректо-романоскопии данных за рак прямой кишки не выявлено. Больной настоятельно требовал восстановить естественную проходимость кишечника. 23.07.73 г. произведена операция - закрытие противоестественного заднего прохода с резекцией сигмы и грыжесечением.
Находился под наблюдением в онкологическом кабинете с 1973 по 1988 г., при ежегодной ректороманоскопии патологических изменений со стороны слизистой оболочки прямой кишки не обнаружено. Данных за метастазирование не получено.
Таким образом, при помощи телегамма-терапии и паллиативного хирургического лечения-двуствольный анус, констатирована полная резорбция распространенной опухоли прямой кишки, клиническое выздоровление.
Госпитализирован в урологическое отделение отделенческой больницы станции Смоленск 13.06.88 г. по поводу рака правой почки T4N0M0 стадия III, клиническая группа II, пальпируется увеличенная плотная, малоподвижная правая почка. 14.06.88 г. произведена операция - правосторонняя нефрэктомия. Макропрепарат; ампутиро-
УдовиковаО.И., Хибин Л.С-, Прудникова Н.В., Стешиц A.C.. Брук П.Г., Снапковский H.H.. Зернова Н.И.
ванная почка размером 20x10x9 см, на разрезе нормальной структуры. Почка увеличена в нижнем полюсе, остальная часть состоит из чередующихся между собой участков белого и тёмнокрасного цвета. Гистологическое заключение №2285-2289 почеч-ноклеточный рак, смешанный вариант. Опухоль состоит из комбинации различных структур, светлоклеточных, иногда зернис-токлеточных. Имеет место инвазивный рост и очаговая инфильтрация. 27.08.88 г. констатирована смерть от раковой интоксикации.
В нашем наблюдении имел место случай излечения рака прямой кишки глубокой лучевой терапией в сочетании с паллиативным хирургическим лечением -двуствольный анус, закрытие ануса через 3 года, восстановлением непрерывности кишки.
Отдаленный результат наблюдения в течение 15 лет был прерван первично-множественным метахронным раком правой почки, который, по-видимому, был индуцирован лучевой терапией.
1. Билынский Б.Т., Огорчак М.А. // Вопросы онкологии. 1987. №1. С. 100-101.
2. Горбатов И .Д., Деренко ЛИ., Романченко H.A. // Вопросы клинической онкологии и ней-роэндокринных нарушений при злокачественных опухолях. Вып. 3. Ростов-на-Дону 1974 С. 100-101.
3. Клиническая онкология / Под редакцией H.H. Блохина, Б.Е. Петерсона. Т.2. М.: Медицина 1979. 647 с.
Удовикова О.И.', Хибин Л.С.', Прудникова Н.В.г, Стешиц A.C.2, Брук Я.Г.г, Снапковский Н.И/, Зернова Н.И.2
ТОУ ВПО СГМА Кафедра пропедевтики внутреннги: болезней,
Хондроостеопластическая трахеоброн-хопатия (ХТ; синонимы: хронический ос-сифицирующий трахеит, множественный экхондроз) является редким заболеванием трахеи и бронхов, характеризирующимся образованием в слизистой оболочке хрящевой и костной ткани. Этиология этого заболевания неясна. Предполагают, что ХТ может быть следствием хронического воспалительного процесса в трахее и бронхах, амилоидоза дыхательных путей, большое значение придают генетическим факторам.
По данным L. Ragaini, P. Piccoli (1957), частота ХТ составляет 3 случая на 1000 патологоанатомических вскрытий. Первый случай данного заболевания, установленный при вскрытии, был описан в 1855 году
К. Rokitansky. Прижизненный диагноз впервые был выставлен значительно позже Н. J. Moersch с соавторами (1937). В зарубежной литературе до 1973 года было описано около 200 наблюдений. Отечественных же публикаций, посвященных ХТ, очень мало.
За последние 2 года (2005-2006) в пульмонологическом отделении СОКБ ХТ диагностирована у двух пациентов. Приводим одно из клинических наблюдений.
Больной Л. 1939 г. р. (история болезни № 20511) поступил в пульмонологическое отделение Смоленской областной клинической больницы 8.09.2006 г. с жалобами на кашель в течение дня, иногда с выделением небольшого количества мокроты серого цвета, неприятные ощущения в грудной
Лучевая терапия злокачественных новообразований основывается прежде всего на различной радиочувствительности опухолей и окружающих их здоровых тканей (терапевтический интервал радиочувствительности).
При относительно большей радиочувствительности опухоли возможно подавить опухолевый рост, сохранив или относительно мало повредив здоровые ткани.
Высокорадиочувствительны лимфосаркомы, лейкозные разрастания, семиномы, некоторые тимомы, многие опухоли носоглотки и глотки, возникающие в области кольца Вальдейера—Пирогова, некоторые ретикулярные опухоли, опухоли Юинга. В целом высокая радиочувствительность свойственна быстрорастущим опухолям с низкой дифференцировкой клеточных структур, опухолям, возникающим из лимфоидной, гемопоэтической ткани, герминативной ткани гонад.
Другие опухоли обладают умеренной радиочувствительностью, но встречаются они чаще. Это плоскоклеточные раки кожи, нижней губы, глотки, гортани, шейки матки и др., возникающие из покровных эпителиев. Известное различие радиочувствительности среди них связано со степенью дифференцировки клеточного строения, локализацией в различных частях органа, характером роста (более или менее инфильтративным), сопутствующей инфекцией, общим состоянием организма. Более дифференцированные, имеющие более выраженный инфильтративный характер роста инфицированные опухоли, особенно у ослабленных больных, менее чувствительны к лучевому воздействию. Это указывает на сложность проблемы лучевой терапии, на необходимость наряду с местным воздействием принимать меры, направленные на усиление общей резистентности организма, бороться с сопутствующей инфекцией. Как специфические задачи лучевого воздействия на опухоль, так и общие меры лечения опухолевого больного решаются в радиологической клинике.
К радиорезистентным опухолям относятся рак желудка, кишок, миогенные и остеогенные саркомы. В лечении этих опухолей лучевая терапия самостоятельного значения не имеет либо вовсе не применяется.
Облучение используют также перед хирургическим удалением опухоли с тем, чтобы, ослабив активность опухолевых клеток, ограничить их рассеивание и приживление в операционном поле. Облучение применяют и в послеоперационном периоде с целью воздействовать на рассеянные опухолевые клетки, вызвать склероз лимфатических и мелких кровеносных сосудов, снизить васкуляризацию и тем уменьшить возможное распространение опухолевых клеток. Этот механизм наряду с непосредственным влиянием на опухолевую ткань может иметь значение и в эффекте непосредственного лучевого воздействия на опухоли.
Под влиянием облучения часть опухолевых клеток гибнет в ходе последующих делений; деление других, оставшихся жизнеспособными, клеток тормозится; одновременно происходят изменения в сосудах и нервах опухоли, нарушаются ее связи с организмом. При условии, что реактивная способность нормальных тканей, окружающих опухоль, как и реактивность целого организма, сохраняется, происходит постепенная резорбция опухоли.
Различие в радиочувствительности опухоли и окружающих тканей чаще всего невелико. Поэтому успешность лучевой терапии связана с мерами ограничения действия радиации на здоровые ткани, а с другой стороны — с увеличением эффективности лучевого воздействия на опухолевую ткань. К сохранению здоровых тканей ведут методы облучения, сводящие к минимуму неизбежное побочное действие, т. е. ограничивающие дозу излучения, поглощенную в окружающих опухоль тканях. Известное значение имеет десенсибилизация здоровых тканей, попадающих в зону облучения. Так, охлаждение кожи или компрессия, ведя к анемизации, снижает чувствительность этой ткани, что имеет значение при облучении из наружных источников глубоко располагающихся опухолей. Средства для предупреждения и лечения лучевой болезни (см.) — радиопротекторы — используют для защиты. организма больных от общего действия радиации, неизбежного при облучении опухолей, однако они не должны одновременно защищать от лучевого воздействия опухолевую ткань. Уменьшение повреждающего действия облучения на нормальные ткани позволяет усилить его влияние на опухолевую ткань, применять необходимые, нередко большие, дозы.
Преимущественная защита нормальных тканей может быть связана со способностью радиопротекторов устранять или снижать кислородный эффект (см. Радиобиология), имеющий большое значение в реализации лучевого воздействия. Кислородное напряжение в опухолевой ткани меньше, чем в нормальных тканях. Это приводит к меньшей защите опухоли и, как следствие, к желательному в терапевтических целях увеличению различия радиочувствительности нормальных и патологической тканей. Кроме того, некоторые радиопротекторы, введенные в организм больного, могут накапливаться лишь в малых количествах в опухолях. Так, бета-аминоэтилизо-тиуроний (АЭТ) — эффективное средство противолучевой защиты организма — мало концентрируется в клетках опухоли.
Другой путь расширения терапевтического интервала радиочувствительности — радиосенсибилизация опухолей. Концентрация кислорода в опухолевой ткани мала, чувствительность к рентгено- и гамма-облучению в условиях высокого содержания клетками кислорода можно увеличить в 2—3 раза. Некоторый клинический успех получен при облучении опухолей у больных, вдыхавших кислород под давлением 2— 3 атм. Предпринимаются попытки радиосенсибилизации опухолей химическими соединениями — порфиринами, уретаном и его производными. Известные надежды возлагают на препараты типа синковита (четырехнатриевая соль 2-метил-1,4-нафто-гидрохинондифосфата). По-видимому, синковит обладает способностью преимущественно накапливаться в опухолевой ткани. В экспериментах изучается возможность радиосенсибилизации путем изменения строения ДНК клеток опухолей, например путем замены пиримидиновых оснований в ДНК их аналогами. Имеются основания рассчитывать на радиосенсибилизацию и путем замены пуриновых оснований в ДНК клеток.
В основе лучевой терапии лежит также различие способности к восстановлению нормальных и опухолевой тканей после лучевого воздействия, так или иначе распределенного во времени. Дробное (фракционированное) облучение оказывается более губительным для клеток опухолей, чем для нормальных клеточных элементов. Кроме того, такие повторные облучения создают более благоприятные условия для повреждения опухолевых клеток в фазы наибольшей радиочувствительности, соответствующие митотической активности. В связи с этим испытывают различные ритмы и различную длительность облучения, учитывающие колеблющуюся радиочувствительность опухолевой ткани и периоды радиорезистентности ее, возникающие под влиянием первых же, а в дальнейшем и последующих облучений.
Разрушение очага онкологии обозначает гибель опухолевых клеток, которые рушатся и выделяют токсины. Распад опухоли сам по себе – это частое явление, отмечающееся у многих больных, страдающих от поражения онкологией. Данный процесс в еще большей степени ухудшает состояние пациента, отравляет организм опасными продуктами метаболизма, приводя в конечном итоге к гибели человека.

Предпосылки
Вся сложность ситуации, когда происходит распад опухоли, прежде всего в том, что часто такой процесс вызывается проводимым лечением, которое как раз направлено на уничтожение опухолевых клеток. Именно поэтому этот процесс является естественным последствием лечения против рака. Он может происходить спонтанно из-за терапевтического воздействия.
Спонтанное разрушение, как правило, характерно для новообразований, которые имеют внушительные размеры, поскольку при больших габаритах некоторые клетки отмирают. Опухолевые образования злокачественного характера, локализованные в кишечнике или слизистой желудка, могут повреждаться механически. Их могут повредить ферменты и соляная кислота.
Синдром стремительного распада
Отмирание опухолевых клеток вызывает образование синдрома стремительного распада опухоли, который сопровождается серьезной интоксикацией. Из-за этого высвобождаются соли мочевой кислоты, и она сама непосредственно. Помимо этого, происходит высвобождение фосфатов и калия. Все эти составляющие проникают в кровоток, через который попадают в различные области организма, где повреждают органы и создают щелочной дисбаланс. В массе крови образуется закисленность, которая губительно действует на почечное функционирование.
Химиотерапия как источник разрушения
Когда в кровяной массе циркулирует слишком большое количество мочевой кислоты, это рано или поздно приведет к закупорке просветов канальцев почек. Следствием подобного процесса обычно становится развитие почечной недостаточности.
Такое осложнение преимущественно затрагивает пациентов, которые и до появления опухоли имели нарушения в деятельности органа. Из-за высвобождения фосфата из погибших онкоклеток снижается концентрация кальция в сыворотке крови. Подобное явление вызывает судороги и усиливает сонливость. Помимо прочего, из онкоочага все время поступают излишки калия, что приводит к возникновению аритмии, а она, в свою очередь, может привести к летальному исходу.

Помимо описанных метаболитов, опухолевые клетки могут продуцировать ферменты и прочие агрессивные продукты. Именно поэтому опухолевый распад зачастую осложняется инфекционным поражением, воспалениями, повреждением габаритного сосуда, по причине чего начинается обильное кровотечение. Такие осложнения затрудняют лечение. Кроме того, происходит ухудшение состояния пациента в целом. Если отсутствует своевременная медицинская помощь, перечисленные нарушения грозят сильными потерями крови.
Симптомы
Наблюдаются следующие симптомы распада опухоли:
- появляется лихорадка;
- рвота и тошнота;
- болевой дискомфорт, который локализуется в области живота;
- быстрая потеря изначальной массы тела, что может стать причиной онкологической кахексии;
- изменение цвета кожных покровов (они бледнеют, может появиться желтушный оттенок);
- отклонения деятельности печени.
Нужно помнить о том, что при различных заболеваниях могут присутствовать свои симптомы, которые будут зависеть от вида рака и локализации ракового образования.
Виды рака и характерные симптомы
Для разных видов рака, кроме описанных выше общих признаков, характерны и другие симптомы, которые наблюдаются при определенной локализации новообразования.
Например, при распаде опухоли молочной железы зачастую появляются основания для отнесения патологии к четвертой стадии. При массивном клеточном некрозе, вовлечении в процесс кожи и ее инфицировании, образуются крупные и долго незаживающие язвы, не дающие онкологу в большинстве случаев приступить к лечению опухоли как можно быстрее, так как последняя может еще сильнее усугубить распад. Наряду с проведением дезинтоксикационной и антибактериальной терапии у пациента опухоль продолжает прогрессировать и расти, часто не оставляя возможности для лечения ее хирургическим путем.
Вопрос терапии распадающихся опухолей молочных желез стоит очень остро, особенно с учетом большого количества поздних обращений пациентов и запущенных форм болезни. Кстати, многим интересно, каков прогноз при распаде опухоли. Об этом ниже.
Распад кишечных злокачественных опухолей грозит сосудистым повреждением стенки кишечника и кровотечением, в прямой кишке может не только появиться сильное инфицирование, нагноение и воспаление, но и образуются свищевые ходы в прочие органы малого таза (матку у пациенток, мочевой пузырь).
Распад опухоли легкого опасен проникновением в плевральную полость воздуха (пневмоторакс), сильным кровотечением, появляются привычные симптомы одышки, кашель и боли осложняются отхождением огромного количества гнилостной мокроты.
Маточные опухоли могут распадаться при больших размерах новообразования. Если разрушаются раковые клетки, то происходит инфильтрация и выраженное воспаление окружающих тканей, в прямой кишке и мочевом пузыре появляются свищи, через которые будет распространяться неопластический процесс на данные органы.
Раковый распад при такой локализации отличается лихорадкой, сильной интоксикацией, распространением воспалительного процесса в малом тазу.

Симптомы начала распада опухоли при онкологии – всегда тревожный сигнал, который нельзя оставлять без внимания, в связи с чем любое ухудшение самочувствия человека должно стать поводом для избавления от такого опасного состояния. Очень важно контролировать состояние пациентов, которые проходят противоопухолевую терапию.
Диагностика
Ставится диагноз на основании клинических признаков, результатов инструментальных исследований и лабораторных анализов. Первым настораживающим симптомом чаще всего становится снижение объема выделяемой мочи.
Чтобы диагностировать распад опухоли (на фото его сложно увидеть), нужно определить уровень мочевой кислоты, креатинина, кальция и фосфатов в кровяной сыворотке. Оценивается состояние печени на основании результатов проведенных печеночных проб. В случае необходимости пациенту назначаются УЗИ почек, КТ и ЭКГ.
Лечение
Терапия синдрома опухолевого распада должна проводиться лишь под контролем врача в стационарных условиях. Она включает в себя:
- Противорвотные средства, слабительные препараты, сорбенты. В случае их неэффективности ставят клизмы, не только выводящие каловые массы, но и уменьшающие интоксикацию обменными продуктами.
- Инфузионное лечение для коррекции равновесия кислот и щелочей – введение пациенту препаратов кальция, гидроксида алюминия, раствора глюкозы и инсулина, алюминия, если повышаются фосфаты в кровяной сыворотке, гидрокарбоната натрия.
- Ацидоз при опухолевом распаде, пожалуй, является только одним обоснованным случаем использования соды при раке, однако такое лечение может проводиться лишь врачом и под строгим наблюдением за кислотно-щелочным состоянием крови.
- При появлении симптомов острой недостаточности почек проводится гемодиализ.
- Антиаритмическое лечение при нарушении сердечного ритма.
- При анемии назначаются препараты железа.
- Противовоспалительные и обезболивающие препараты, которые, кроме купирования синдрома боли, уменьшают лихорадку.
- Адекватный режим питья и полноценный рацион.
- До проведения химиотерапии в профилактических целях от осложнений требуется обильное питье, регидратационное лечение на протяжении суток или двух.
А теперь выясним, при распаде опухоли сколько осталось жить больному?

Прогноз
Если лечение начинается своевременно, прогноз при синдроме опухолевого распада чаще всего благоприятный. Когда корректируются нарушения метаболизма, отмечается восстановление деятельности почек. Если терапия отсутствует или начинается поздно, то может быть летальный исход из-за острой недостаточности почек, осложнений, вызванных распадом опухоли (внутреннего кровотечения, серьезных инфекционных осложнений, перитонита из-за перфорации стенок полого органа) или остановки сердца.
Сколько жить при распаде опухоли в случае рака 4 степени? К сожалению, в лучшем случае получится прожить несколько месяцев при правильной терапии.
Профилактика
Для предотвращения появления распада опухолевого синдрома нужно обильное питье за 1-2 суток до начала употребления химиопрепаратов, регулярный контроль уровня мочевой кислоты, креатинина, кальция и фосфатов в кровяной сыворотке. В первую неделю терапии анализы делают ежедневно. Если появляются лабораторные или клинические симптомы синдрома распада новообразования, лабораторные тесты делают несколько раз в сутки.
- КЛЮЧЕВЫЕ СЛОВА: брахитерапия, метастазирование, гемофтальм, лейкопения, агранулоцитоз, пойкилоцитоз, анемия различного генеза, гемофилия
Увеальная меланома (УМ) является наиболее частой внутриглазной злокачественной опухолью у взрослых. Она составляет 12–15% меланом всех локализаций и 90% всех внутриглазных новообразований. Заболеваемость УМ в России составляет 5–8 случаев, в Москве достигает 13,3 случая на один миллион случаев в год. Пик заболеваемости приходится на возрастные группы 50–60 лет. В абсолютном большинстве случаев опухоль поражает один глаз и растет в виде единичного узла. У пациентов, не получающих лечения, опухоль приводит к летальному исходу. На протяжении многих лет основным способом лечения УМ была энуклеация. Однако она не считается радикальной операцией. Пятилетняя выживаемость больных после удаления пораженного глаза составляет 50–70%. В настоящее время золотым стандартом органосохранного лечения УМ признано контактное облучение опухоли (брахитерапия).
Единственная злокачественная опухоль сетчатки – ретинобластома встречается в детском возрасте в одном случае на 12 000–15 000 новорожденных. На выбор тактики лечения влияют размер, локализация, характер роста и распространенность процесса. При опухолях групп А, В и C (согласно Международной классификации ретинобластомы ICRB) в схеме комбинированного лечения предусмотрена брахитерапия.
Гемангиомы сетчатки и хориоидеи – редкие врожденные доброкачественные новообразования, относящиеся к классу гамартом. Встречаются изолированные узловые и диффузные формы гемангиом. У больных, не получающих лечения, опухоль может приводить к развитию тотальной отслойки сетчатки, вторичной глаукомы. Брахитерапия с успехом применяется для лечения отграниченных гемангиом, особенно при периферической локализации новообразования.
Основными преимуществами брахитерапии являются сохранение глаза и зрительных функций у половины леченых больных, лучший прогноз для жизни. Так, пятилетняя выживаемость после брахитерапии УМ при сопоставимых стадиях заболевания составляет 90–95% [1–3].
Выбор типа офтальмоаппликатора (ОА) определяется толщиной новообразования и проникающей способностью бета-излучения, которая зависит от энергии распада радионуклида. ОА с изотопом Sr 90 + Y 90 применяют в случаях, когда толщина опухоли не превышает 3,5 мм. При большей толщине применяют ОА с изотопом Ru 106 + Rh 106 . Главным условием успешного радикального лечения является набор необходимой дозы излучения на верхушке опухоли, то есть в точке, максимально удаленной от поверхности ОА. Оптимальные верхушечные дозы излучения при облучении ретинобластомы и УМ представлены в таблице. Целью облучения внутриглазной гемангиомы является облитерация патологических сосудов новообразования, большинство которых расположено у основания опухоли. Поэтому рассчитывается поверхностная доза излучения, то есть доза на склере глаза, которая должна составлять 600–700 Гр.
Эффективность лечения внутриглазных опухолей оценивается по следующим критериям: полная резорбция опухоли, частичная резорбция опухоли – уменьшение исходных размеров на 50% и более, отсутствие эффекта.
Показания и противопоказания
- УМ, ретинобластома с проминенцией до 6 мм и диаметром до 15 мм;
- отграниченная гемангиома с проминенцией до 6 мм и диаметром до 15 мм.
Противопоказания к использованию медицинской технологии:
- мультицентрический рост опухоли (при УМ);
- наличие отдаленных метастазов;
- врастание опухоли в диск зрительного нерва или прорастание за пределы склеры;
- заболевания крови (лейкопения, агранулоцитоз, пойкилоцитоз, анемия различного генеза, гемофилия и др.);
- острые воспалительные заболевания глаза и его придаточного аппарата;
- гемофтальм, отслойка сетчатки, глаукома;
- тяжелая сопутствующая соматическая патология;
- беременность.
Материально-техническое обеспечение
Описание медицинской технологии
Дозиметрические характеристики офтальмоаппликаторов. Основной дозиметрической характеристикой ОА является дозное поле, создаваемое им в патологическом очаге и прилежащих отделах глаза. Конфигурация дозного поля любого бета-источника зависит от конструкции излучателя, формы и размеров его активной зоны, вида радионуклида и характера его распределения по объему (или поверхности) активной части.
По результатам экспериментальных и расчетных методик были получены дозные поля офтальмоаппликаторов и градиент падения поверхностной дозы в биологической ткани. Значения глубинных мощностей доз приведены в относительных единицах, причем за 100% принята величина дозы на поверхности ОА (рисунок). Все дозиметрические характеристики, необходимые для расчета, представлены в индивидуальном паспорте на каждый ОА.
Активный диаметр офтальмоаппликатора должен превышать границы опухоли на 1,5–2 мм со всех сторон. При локализации новообразования рядом с диском зрительного нерва используются офтальмоаппликаторы с вырезом для зрительного нерва.
Расчет поглощенной дозы. Распределение дозы на поверхности ОА относительно равномерное (±10%). Резкий спад дозы наблюдается по глубине, поэтому новообразование облучается неравномерно: участки, расположенные ближе к источнику, облучаются значительно интенсивнее, чем участки, отдаленные от излучающей поверхности аппликатора. Дозу следует рассчитывать таким образом, чтобы рекомендованная доза поглощалась на верхушке опухоли – в наиболее удаленной от ОА точке. При планировании брахитерапии внутриглазной опухоли выбирают тип ОА: Р (с изотопом Ru 106 + Rh 106 ) или С (с изотопом Sr 90 + Y 90 ), что определяется ее максимальной толщиной. При толщине новообразования до 3,5 мм выбирают ОА типа С, при толщине 3,5 мм – тип Р. Оптимальная верхушечная доза представлена в таблице.
Для облучения внутриглазной гемангиомы предпочтение следует отдавать офтальмоаппликаторам с изотопом Sr 90 + Y 90 , поскольку они создают максимальную поверхностную дозу излучения.
Методика операции
Фиксацию ОА к глазу выполняют в операционной. Подготовку к операции проводят по общепринятым правилам, необходим максимальный мидриаз. Под общим наркозом выполняют разрез конъюнктивы в квадранте локализации опухоли в 6 мм от лимба, слизистую оболочку отсепаровывают кзади. На две соседние прямые мышцы накладывают лигатуры. Для проведения транспупиллярной диафаноскопии обычно достаточно тракции за лигатуры или отведения брюшка мышцы, но при необходимости возможно временное пересечение прямой мышцы. С помощью транспупиллярной диафаноскопии маркируют тень границы опухоли. Для более четкого обзора центрального края опухоли при ее локализации в постэкваториальной зоне полезной может оказаться наружная кантотомия. Заранее выбранный ОА фиксируют к склере двумя швами, проведенными через его кольца. Необходимо следить, чтобы край ОА перекрывал намеченные границы опухоли на 1,5–2 мм. При необходимости аппликатор можно подвести под любую прямую мышцу глаза. После фиксации ОА к склере на конъюнктиву накладывают непрерывный шов. Время контакта ОА со склерой зависит от толщины опухоли и мощности аппликатора. После операции на сутки накладывают бинокулярную повязку, что значительно ограничивает движения глаза и снижает вероятность смещения ОА. Через сутки проводят ультразвуковой контроль положения ОА по отношению к облучаемой мишени. При необходимости осуществляют соответствующую коррекцию экспозиции облучения с целью достижения расчетной дозы на верхушке опухоли. Удаляют ОА под местной анестезией в операционной по истечении времени экспозиции.
На вторые-третьи сутки после начала облучения на глазном дне в области расположения ОА появляется отек сетчатки и ткани опухоли, который, постепенно нарастая, стушевывает рисунок глазного дна. Наряду с увеличением отека тканей могут появиться гемодинамические расстройства: локальные и дистантные кровоизлияния (на 5–7-й день), фрагментация ретинальных сосудов в зоне облучения (на второй-третьей неделе). Больного выписывают из стационара на 2–4-й день после удаления ОА. Острая лучевая реакция стихает через 4–8 недель, и наступает процесс резорбции опухоли, который длится от восьми до 24 месяцев.
Контрольные осмотры больных после брахитерапии проводят каждые 3–6 месяцев.
Возможные осложнения и способы их устранения
Парез прямой мышцы глаза возможен в случае, если ОА располагался под ней. После удаления ОА отмечают ограничение движения глаза в сторону действия такой мышцы. Субъективно это выражается в диплопии. Симптомы пареза прямой мышцы наблюдаются в течение двух-трех недель, затем они полностью проходят без специального лечения.
Повышение внутриглазного давления может иметь место при использовании ОА большого диаметра (22 мм). Реактивная гипертензия (до 35 мм рт. ст.) возникает на второй-третий день облучения и связана с гиперсекрецией водянистой влаги. После удаления ОА внутриглазное давление быстро нормализуется. Назначают Азопт, Диакарб, Лазикс.
Иридоциклит развивается крайне редко, когда глаз облучался большими дозами и передний край ОА располагался над цилиарным телом. Лучевой иридоциклит протекает с гипертензией, выраженным болевым синдромом и требует интенсивного лечения (мидриатики, глюкокортикостероиды, гипотензивные препараты, неспецифические противовоспалительные препараты, ингибиторы карбоангидразы, диуретики).
Кровоизлияния в сетчатку и ткань опухоли можно считать скорее проявлением лучевой реакции, чем осложнением. Рассасываются эти кровоизлияния на фоне медикаментозного лечения (Вобэнзим, Аскорутин, Дицинон) длительно и на исход лечения не влияют.
Эффективность медицинской технологии
Брахитерапия как самостоятельный метод лечения УМ использована более чем у 1600 больных в возрасте от 18 до 82 лет, 65% из которых составили женщины. Сроки наблюдения – от трех месяцев до 16 лет, медиана – 71,1 месяца. Полная резорбция УМ достигнута у 67,8% больных, частичное уменьшение размеров опухоли (на 50% и больше) и стабилизация процесса – у 24% пациентов. Рецидив опухоли и продолженный рост зафиксированы в 6% случаев. Лечение оказалось неэффективным у 35 (2,2%) больных. Частота отдаленного метастазирования составила 5,3% (в сроки от шести месяцев до девяти с половиной лет).
С 2008 по 2013 г. в комплексном лечении ретинобластомы брахитерапия была использована у 137 детей. Срок наблюдения составил от девяти месяцев до шести с половиной лет. Полная резорбция опухоли зарегистрирована в 85% случаев.
У 167 пациентов для лечения внутриглазных гемангиом использовали брахитерапию. Срок наблюдения составил от трех месяцев до девяти лет. Полная облитерация новообразования зафиксирована в 69% случаев, формирование рубца вокруг новообразования – у 26% больных. Таким образом, эффективность локального контроля составила 95%.
Читайте также:

