Чему равна молярная масса эквивалентов металла в его соединениях с хлором
Методические указания
Закон эквивалентов открыт в конце 18 века: вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам. Для решения задач удобно пользоваться другой формулировкой: массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам)
Химическим эквивалентом элемента (молярной массой эквивалента) называется такое его количество (моль), которое соответствует 1 моль атомов водорода (соединятся с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях). Химический эквивалент не является постоянной величиной, он зависит от валентности (степени окисления) элемента.
Молярная масса эквивалента (м э ) – это масса одного эквивалента (грамм/моль*экв, килограмм/моль*экв). Молярная масса эквивалента равна частному от деления молярной массы его атомов (А) на валентность (степень окисления) элемента (В) в данном соединении:
Например, молярная масса эквивалента серы в SO2 и SO3 соответственно равны 32/4 = 8 г/моль и 32/6 = 5.33 г/моль.
Эквивалентным объемом (л/моль, м 3 /моль) называется объем, занимаемый при данных условиях (Р, Т) 1 эквивалентов вещества. Значения эквивалентного объема вещества, находящегося в газообразном состоянии, можно найти, зная, что в молярном объеме любого газа, состоящего из одноатомных молекул, содержится 2 моля атомов и т.д. Так в 22.4 л Н2 содержится при нормальных условиях (Р0=760 мм рт.ст.=101325 Па; Т0 = 273 К) 2 моля атомов водорода. Поскольку эквивалент водорода равен 1 моль, то в 22.4 л Н2 содержится 2 эквивалента водорода; значит, эквивалентный объем водорода равен
22.4/2 = 11.2 л/моль = 11.2 * 10 -3 м 3 /моль.
Пример № 1.Определить эквивалента и эквивалентные массы элементов в соединениях HF, H2O, NH3, CH4.
Решение. В указанных соединениях с 1 моль атомов водорода соединяется 1 моль атомов фтора, 1/2 моль атомов кислорода, 1/3 моль атомов азота, 1/4 моль атомов углерода.
Следовательно, фактор эквивалентности фтора, кислорода, азота и углерода соответственно равны 1 моль, 1/2 моль, 1/3 моль, 1/4 моль. Исходя из молярных масс атомов этих элементов, определяем, молярную масса эквивалента фтора равна 19 г/моль, кислорода – 16 * 1/2 = 8 г/моль, азота – 14 * 1/3=4.67 г/моль, углерода – 12 * 1/4=3 г/моль.
Для определения молярной массы эквивалента не обязательно исходить из его соединения с водородом. Молярную массу эквивалента можно вычислить по составу соединения данного элемента с любым другим, молярная масса эквивалента которого известна.
Пример № 2.Вычислить молярную массу эквивалента металла, зная, что его хлорид содержит 79.78% хлора. Молярная масса эквивалента хлора равна 35.45 г/моль•экв.
Решение. Содержание металла в этом соединении составляет: 100 – 79.78=20.22%. Согласно закону эквивалентов: количество эквивалентов металла равно количеству эквивалентов хлора mме/ М э ме = mСl/ М э Сl, т.е.
20.22/ М э ме = 79,78/35.45 => М э ме=20.22•35.45/79.78=8.98 г/моль. Молярная масса эквивалента металла равена 8.99 г/моль.
Молярные массы эквивалентов химических соединений так же как молярные массы эквивалентов элементов могут иметь переменные значения. Это определяется характером превращения веществ.
Молярные массы эквивалентов оксидов в реакциях обмена:
где Моксида – молярная масса оксида; n – число атомов элемента;
В – валентность (степень окисления) элемента.
Пример № 3.Определить эквивалентные массы оксидов железа.
Решение. Железо образует три оксида FeO, Fe2O3, FeO3.
Молярные массы эквивалентов кислот в реакциях обмена:
где Мкислоты – молярная масса кислоты; nн – число атомов водорода, содержащихся в молекуле кислоты, способных замещаться на металл.
Пример№4.Определить молярную массу эквивалента и фактор эквивалентности H3PO4 в следующих реакциях:
Решение. Молярная масса H3PO4 равна 98 г/моль.
В реакции (1) количество nн атомов водорода, заместившихся на металл, равно 3, следовательно эквивалент Н3Р04 равен 1/3 моль, а эквивалентная масса ЭН3Р04 = 98/3 = 32.7 (г/моль).
В реакции (2) пн-2, следовательно, эквивалент Н3Р04 равен 1/2 моль, а эквивалентная масса Э = 98/2 = 49 (г/моль).
В реакции (3) пн= 1, следовательно, эквивалент Н3Р04 равен 1 моль, а эквивалентная масса Э = 98/1 = 98 (г/моль).
Молярные массы эквивалентов оснований в реакциях обмена:
где Mоснования – молярная масса основания; nон – валентность металла ли число гидроксильных групп в молекуле основания, способных заместиться на кислотный остаток.
Пример № 5.Определить молярную массу эквивалента и фактор эквивалентности Сu(ОН)2 в следующих реакциях:
Решение. Молярная масса Сu(ОН)2 равна 97.5 г/моль. В реакции (1) количество гидроксильных групп nон, заместившихся на кислотный остаток, равно 2, следовательно фактор эквивалентности Сu(ОН)2 равен 1/2 моль, а молярная масса эквивалента М э Сu(ОН)2 = 97.5/2 = 48.75 (г/моль).
В реакции (2) количество гидроксильных групп nон, заместившихся на кислотный остаток, равно 1, следовательно эквивалент Сu(ОН)2 равен 1 моль, а эквивалентная масса ЭСu(ОН)2 = 97.5/1 = 97.5(г/моль).
Эквиваленты солей в реакциях обмена:
где Мсоли – молярная масса соли; –число атомов металла; –валентность (степень окисления) металла.
Пример № 6.Определить молярную массу эквивалента сульфата алюминия.
Решение. Молярная масса сульфата алюминия Al(SO4)3 равна 342 г/моль. Следовательно, М э Al2(SO4)3 = 342/(2•3) = 57 г/моль.
Окислительно-восстановительные эквиваленты определяются путём деления молярной массы на число электронов, идущих на восстановление или окисление
где Мо(в) – молярная масса окислителя (восстановителя); nе – число электронов, идущих на окисление (восстановление).
Пример № 7.Чему равна молярная масса эквивалентна перманганата калия как окислителя, если это вещество в процессе реакции восстанавливается: 1) до сульфата марганца; 2) до диоксида марганца; 3) манганата калия?
Решение. 1) При восстановлении KMnO4 до MnSO4 степень окисления марганца понизится с +7 до +2, т.е. число электронов, идущих на восстановление, равно 5. Следовательно,
2) При восстановлении KMnO4 до MnO2 степень окисления марганца понизится с +7 до +4, т.е. число электронов, идущих на восстановление, равно 3. Следовательно,
3) При восстановлении KMnO4 до K2MnO4 степень окисления марганца понизится с +7 до +6, т.е. число электронов, идущих на восстановление, равно 1. Следовательно,
Выполнение работы
Определение эквивалентной массы металла
Задание: Определить экспериментально эквивалентную массу металла (магния, цинка – по заданию преподавателя) по количеству выделившегося водорода в реакции взаимодействия металла с соляной кислотой
Вычислить ее теоретическое значение и относительную ошибку эксперимента.
Приборы и реактивы.Прибор для определения эквивалента металла (рис.1.1.). Аналитические весы. Термометр. Барометр. Мерный цилиндр на 25-50 мл. Стаканчик химический. Фильтровальная бумага. Навеска металла (химически чистого) около 0.04 – 0.05 г. Соляная кислота (10мас.% раствор).
Ход определения.
1. Налить через воронку в бюретку воду до нулевого деления. Плотно закрыть отверстие бюретки пробкой со стеклянной трубкой. В одну часть сосуда Ландольта поместить навеску цинка. Другую часть сосуда через воронку наполнить на две трети объема разбавленной (10мас.%) соляной кислотой. Присоединить сосуд к свободному концу трубки, соединенной с бюреткой.
2. Проверить герметичность прибора. Для этого опустить или поднять воронку вместе с кольцом на 10-15 см. Если уровень воды в бюретке не меняется, то прибор герметичен и можно приступать к опыту. Если уровень воды в бюретке меняется, то необходимо плотнее закрыть пробками бюретку и сосуд, снова проверить и т.д. Уровень воды V1 в бюретке до начала опыта записать с точностью до 0.1 мл.
3. Привести в контакт кислоту и металл, осторожно наклоняя сосуд Ландольта. После полного растворения металла выждать 5-7мин., чтобы содержимое сосуда охладилось. Затем установить на одной высоте уровень воды в бюретке и воронке. При этом внутри прибора создается давление, равное давлению наружного воздуха. Записать уровень воды V2 в бюретке после опыта.
4. Результаты эксперимента внести в журнал по форме:
Уровень воды в бюретке:
Объем водорода при нормальных условиях (н.у.) V0, мл………………
Температура опыта T = 273+t, K…………………………………………
Барометрическое давление P, мм рт.ст…………………………………..
Давление насыщенного водяного пара h, мм рт.ст. при температуре опыта……………………………………………………
Экспериментальная эквивалентная масса металла М э эксп, г/моль……….
Теоретическая эквивалентная масса металла М э теор, г/моль……………..
Относительная ошибка e, %.
Рис. 1.1.Прибор для определения эквивалента металла:
1) Бюретка для измерения объёма выделившегося водорода;
2) Сосуд Ландольта для проведения реакции;
3) Каучуковая трубка;
1. Подсчитать VН2, вытесненного водорода по разности уровней в бюретке:
2. Привести это объем к нормальным условиям:
Величину h посмотреть в справочнике. Поправку h вводят вследствие того, что общее давление на воду является суммой пропорциональных давлений водорода и воды.
3. Вычислить экспериментальную массу металла:
где - эквивалентный объем водорода, равный 11200 мл/моль.
4. Сравнить найденную экспериментальную эквивалентную массу металла с теоретически посчитанным Этеор = А/В, вычислив в процентах ошибку опыта:
3. Контрольные вопросы и задачи
1. Вычислить молярные массы эквивалентов следующих элементов:
а) магния, если известно, что при нагревании одного моль его в токе кислорода, масса увеличилась на 66.7%. Ответ: 11.9 г/моль;
б) олова, если при нагревании 0.9185 г его в токе кислорода образуется 1.166 г оксида олова. Ответ: 29.68 г/моль.
2. Определить молярную массу эквивалента элемента, если при восстановлении 1.3 г оксида этого элемента алюминием получилось 1.02г оксида алюминия, содержащего 47% кислорода. Ответ: 13.66г/моль.
3. Написать формулу соединения сурьмы с серой, если известно, что молярная масса атомов сурьмы равна 121.8 г/моль, эквивалентная масса ее - 40.6 г/моль, молярная масса атомов серы равна 32 г/моль, эквивалентная масса - 16 г/моль.
4. Определить молярные массы эквивалентов и факторы эквивалентности кислот и оснований в следующих реакциях:
5. Вычислить молярную массу эквивалента и фактор эквивалентности хромата калия К2СrO4 как окислителя, если К2СrO4 восстанавливается до КСrO2.
6. Определить молярную массу эквивалента металла, если 0.34*10 -3 кг его вытесняют из кислоты 56.94*10 -6 м 3 водорода при температуре 0°С и давлении 94643 Па. Ответ: 67.8 г/моль.
7. Определить молярную массу эквивалента металла в следующих соединениях:
8. Чему равен эквивалентный объем кислорода?
Теоретическая часть
Единицей измерения количества вещества является моль. Один моль - это такое количество вещества, которое содержит столько формульных единиц , сколько атомов содержится в 0,012кг изотопа углерода 12 С. Число атомов в 12 граммах углерода 12 С равно постоянной Авогадро, NА = 6.0221·10 23 моль -1 . Массу одного моль вещества называют молярной массой. Основной единицей измерения молярной массы является килограмм на моль (кг/моль) или грамм на моль (г/моль). Например, молярная масса серной кислоты равна М(H2SO4)= 98г/моль. Кроме формулярных единиц в химии применяют такое понятие как эквивалент. Понятие эквивалента появилось после работ Рихтера (1793), открывшего закон эквивалентов. В некоторых химических реакциях, принимает участие не целая формульная единица, а лишь её часть, называемая эквивалентом.
1.1 Эквивалент – это реальная или условная частица вещества соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Эквивалент - безразмерная величина. Эквивалент в ZB раз меньше, чем соответствующие ему реальные частицы и их формульные единицы. Число ZB называют эквивалентным числом или числом эквивалентности ZB ≥ 1. Обратную величину эквивалентного числа 1/ZB называют фактором эквивалентности ( f Э ) В общем случае для некоторого вещества ( B) 1/Z называют фактором эквивалентности, а Z числом эквивалентности. Число эквивалентности показывает сколько химических эквивалентов содержит одна формульная единица. Химический эквивалент не является постоянной величиной, он зависит от валентности (степени окисления) элемента в данном соединении. Например, в соединениях: НСl, Н2О, NН3 и СН4, эквивалент хлора будет соответствовать 1 атому, кислорода - 1/2 атома, азота - 1/3 атома и углерода соответственно - 1/4 атома. Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества nэ.
1.2 Молярная масса эквивалента вещества (М Э ) – это такое количество вещества, которое соединяется с одним моль атомов водорода (1г) или замещает такое же количество в реакциях, выражается в грамм/моль. Она определяется как произведение молярной массы вещества на фактор эквивалентности.
Э = 1/Zэкв М Э = М•f Э
1.3 Фактором эквивалентности для вещества называется число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода H + в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Эквивалент любого вещества можно рассчитать по формуле: Э = 1 ∙ f Э вещества.
Введение в химию понятия "эквивалент" позволило сформулировать закон эквивалентов. (Рихтер,1793г., Германия)
Закон эквивалентов: Массы реагирующих веществ пропорциональны молярным массам их эквивалентов.
Закон эквивалентов можно записать в следующем виде:

; 

=n э 
=n Э ;n э - количество эквивалентов,
М Э -молярная масса эквивалента вещества, V Э – Эквивалентный объём.
Для газообразных веществ удобно пользоваться эквивалентным объёмом.
1.5 Эквивалентный объём
Эквивалентным объемом(л/моль·экв, м 3 /моль·экв) называется объем, занимаемый при данных условиях (Р, Т) одним моль эквивалента вещества. Значения эквивалентного объема вещества, находящегося в газообразном состоянии, можно найти, зная, что один моль любого газа занимает при нормальных условиях (Р0=760 мм рт.ст.=101325 Па; Т0 = 273 К) 22.4 литра , а эквивалентный объём (V э ) будет занимать Vm•f э данного газообразного вещества. Например, определим эквивалентный объём водорода. Поскольку один моль водорода состоит из двух моль атомов водорода, следовательно, в одном моль водорода содержится два эквивалента водорода; таким образом эквивалентный объем водорода будет равен 22.4/2 = 11.2 л/моль или 11.2 * 10 -3 м 3 /моль.
x = 11,2 л, т. е. Vэкв (H) =11,2 л/моль
Аналогично можно рассчитать эквивалентный объём для кислорода, который будет равен:V экв (O2) = 5,6 л/моль.
1.6 Эквивалент и молярная масса эквивалента простых и сложных веществ.
Эквивалентом сложного вещества называется реальная или условная частица этого вещества, которая взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества
Для расчёта молярных масс эквивалентов простых и сложных веществ можно воспользоваться стационарными формулами:
Молярная масса эквивалента простого вещества(элемента)(м э ) определяется как частное от деления молярной массы его атомов (А) на валентность (степень окисления) элемента (В) в данном соединении и измеряется в грамм/моль или граммах.

; 
; Э = 1· 
; 
;
Например, молярная масса эквивалента серы в SO2 и SO3 соответственно равны 32/4 = 8 грамм/моль•экв и 32/6 = 5.33 грамм/моль. Можно M э выражать в граммах.
Пример № 1.Определить эквивалент и эквивалентные массы элементов в соединениях HF, H2O, NH3, CH4.
Решение. В указанных соединениях с 1 моль атомов водорода соединяется 1 моль атомов фтора, 1/2 моль атомов кислорода, 1/3 моль атомов азота, 1/4 моль атомов углерода.
Следовательно, фактор эквивалентности фтора, кислорода, азота и углерода соответственно равны 1 моль, 1/2 моль, 1/3 моль, 1/4 моль. Исходя из молярных масс атомов этих элементов, определяем, молярную масса эквивалента фтора равную 19 г., кислорода – 16 • 1/2 = 8 г., азота – 14 * 1/3=4.67 г., углерода – 12 • 1/4=3 г.
Для определения молярной массы эквивалента не обязательно исходить из его соединения с водородом. Молярную массу эквивалента можно вычислить по составу соединения данного элемента с любым другим, молярная масса эквивалента которого известна.
Пример № 2.Вычислить молярную массу эквивалента металла, зная, что его хлорид содержит 79.78% хлора. Молярная масса эквивалента хлора равна 35.45 г/моль.
Решение. Содержание металла в этом соединении составляет: 100 – 79.78=20.22%. Согласно закону эквивалентов: количество эквивалентов металла равно количеству эквивалентов хлора mме/ М э ме = mСl/ М э Сl, т.е.
20.22/ М э ме = 79,78/35.45 => М э ме=20.22•35.45/79.78=8.98 г. Молярная масса эквивалента металла равна 8.99 г.
Молярные массы эквивалентов химических соединений так же как молярные массы эквивалентов элементов могут иметь переменные значения. Это определяется характером превращения веществ.
Молярные массы эквивалентов оксидов в реакциях обмена:

; 
; 
где Моксида – молярная масса оксида; n – число атомов элемента;
В – валентность (степень окисления) элемента.
Пример № 3.Определить эквивалентные массы оксидов железа.
Решение. Железо образует три оксида FeO, Fe2O3, FeO3.
Молярные массы эквивалентов кислот в реакциях обмена:

; 
где Мкислоты – молярная масса кислоты; nн –(основность), число атомов водорода, содержащихся в молекуле кислоты, способных замещаться на металл.
Пример№4.Определить молярную массу эквивалента и фактор эквивалентности H3PO4 в следующих реакциях:
Решение. Молярная масса H3PO4 равна 98 г/моль. В реакции (1) количество nн атомов водорода, заместившихся на металл, равны 3(кислота проявляет основность равную трём), следовательно эквивалентом Н3Р04 будет являться условная частица 1/3 молекулы H3PO4, т.к. если одна молекула H3PO4 предоставляет три иона Н + , то один ион Н + дает 1/3 молекулы H3PO4., . С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает 3 иона ОН – , следовательно, один ион ОН – потребуется на взаимодействие с 1/3 молекулы кислоты. Эквивалентом кислоты является условная частица 1/3Н3РО4, а эквивалентом щелочи частица КОН, M э (H3PO4 )= 98/3 =32,7 г/моль•экв, f э (H3PO4) = 1
В реакции (2) пн-2, следовательно, эквивалент Н3Р04 равен 1/2 моль, а эквивалентная масса M э (H3PO4) = 98/2 = 49 г/моль, f э (H3PO4) = 1|2
В реакции (3) пн= 1, следовательно, эквивалент Н3Р04 равен 1 моль, а эквивалентная масса M Э = 98/1 = 98 (г/моль).
Молярные массы эквивалентов оснований в реакциях обмена:

; 
где Mоснования – молярная масса основания; nон – число гидроксильных групп в молекуле основания, способных заместиться на кислотный остаток (кислотность).
Пример № 5.Определить молярную массу эквивалента и фактор эквивалентности Сu(ОН)2 в следующих реакциях:
Решение. Молярная масса Сu(ОН)2 равна 97.5 г/моль. В реакции (1) количество гидроксильных групп nон, заместившихся на кислотный остаток, равно 2, следовательно фактор эквивалентности Сu(ОН)2 равен 1/2 моль, а молярная масса эквивалента М э Сu(ОН)2 = 97.5/2 = 48.75 (г/моль).
В реакции (2) количество гидроксильных групп nон, заместившихся на кислотный остаток, равно 1, следовательно эквивалент Сu(ОН)2 равен 1 моль, а эквивалентная масса ЭСu(ОН)2 = 97.5/1 = 97.5(г/моль).
Молярные массы эквивалентов оснований солей в реакциях обмена:

; 
где Мсоли – молярная масса соли; –число атомов металла; –валентность (степень окисления) металла.
Пример № 6.Определить молярную массу эквивалента сульфата алюминия.
Решение. Молярная масса сульфата алюминия Al(SO4)3 равна 342 г/моль. Следовательно, М э Al2(SO4)3 = 342/(2•3) = 57 г/моль.
Окислительно-восстановительные эквиваленты определяются путём деления молярной массы на число электронов, идущих на восстановление или окисление

; 
где МOx-Red – молярная масса окислителя (восстановителя); nе – число электронов, идущих на окисление (восстановление).
Пример № 7.Чему равна молярная масса эквивалентна и фактор эквивалентности перманганата калия как окислителя, если это вещество в процессе реакции восстанавливается:
1) до сульфата марганца; 2) до диоксида марганца; 3) манганата калия?
Решение. 1) При восстановлении KMnO4 до MnSO4 степень окисления марганца понизится с +7 до +2, т.е. число электронов, идущих на восстановление, равно 5. Следовательно,
2) При восстановлении KMnO4 до MnO2 степень окисления марганца понизится с +7 до +4, т.е. число электронов, идущих на восстановление, равно 3. Следовательно,
3) При восстановлении KMnO4 до K2MnO4 степень окисления марганца понизится с +7 до +6, т.е. число электронов, идущих на восстановление, равно 1. Следовательно,
Для решения задач удобно пользоваться аддитивными формулами, т.е. молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов его составных частей, например:
М Э (оксида) = М Э (элемента) + М Э (О) = М Э (элемента) + 8
М Э (кислоты) = М Э (Н + ) + М Э (кислотного остатка) = 1 + М Э кислотного остатка
М Э (основания) = М Э (Ме) + М Э (ОН - ) = М Э (Ме) + 17
М Э (соли) = М Э (Ме) + М Э кислотного остатка

; 
M э OH- = 17г.
Определение эквивалентной массы вещества
Задача №1
При сгорании 5,00г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
Решение:
Из условия задачи следует, что в оксиде металла на 5г металла приходится 4,44г кислорода (9,44 – 5 = 4,44). Согласно закону эквивалентов, массы (объёмы) взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
5г металла эквивалентны 4,44г кислорода
mЭ(Ме) г/моль металла эквивалентны 8г/моль кислорода
Откуда mЭ(Ме) = 8 . 5/4,44 = 9,01г/моль.
Ответ: mЭ(Ме) = 9,01г/моль.
Задача №2
Одно и то же количество металла соединяется с 0,200г кислорода и с 3,17г одного из галогенов. Определить эквивалентную массу галогена.
Решение:
I Вариант:
Из условия задачи следует, что 0,200г кислорода и 3,17г галогена эквивалентно соединяются с металлом. Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
0,200г кислорода эквивалентны 3,17г галогена
mЭ(О2) 8г/моль кислорода эквивалентны mЭ(Г) Х г/моль
Ответ: mЭ(Г) = 126,8г/моль.
II Вариант:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
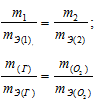
Таким образом, количество эквивалентов галогена и кислорода численно равны между собой, что составляет:
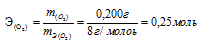
Зная количество эквивалентов и массу вещества можно определить эквивалентную массу этого вещества:
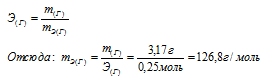
Ответ: 126,г/моль.
Задача №3
Масса 1л кислорода равна 1,4г. Сколько литров кислорода расходуется при сгорании 21г магния, эквивалент которого равен 1/2 моля?
Решение:
Находим эквивалентную массу магния: mЭ(Mg) = 1/2M(Mg) =24/2 = 12г/моль. Следовательно, 21г магния составляет 21/2 =1,75 эквивалентной массы Mg. Согласно закону эквивалентов масса израсходованного кислорода составляет 1,75 его эквивалентной массы. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, рассчитаем массу кислорода, расходуемую на сжигание магния: m(O2) = 1,75 . 8 = 14г. Зная, что 1л кислорода по массе составляет 1,4г, рассчитаем объём кислорода расходуемого при сгорании 21г магния, составив пропорцию:
1,4 : 1 = 14 : х;
х = 14 . 1/1,4 = 10л.
Ответ: V(O2) = 10л.
Задача№4
Определить эквивалентные массы металла и серы, если 3,24г металла образует 3,48г оксида и 3,72г сульфида.
Решение:
Из условия задачи следует, что в оксиде металла на 3,24г металла приходится 0,24г кислорода (3,48 – 3,24 = 0,24г). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам). Так как эквивалентная масса кислорода составляет 8г/моль, то эквивалентную массу металла находим из пропорции:
8 : 0,24 = х : 3,24;
х = 8 . 3,24/0,24 =108г/моль.
В сульфиде металла на 3,24г металла приходится 0,48г серы (3,72 – 3,24 = 0,48г). Эквивалентную массу серы находим из пропорции:
3,24 : 108 = 0,48 : х;
х = 108 . 3,24/0,48 = 16г/моль.
Ответ: mэ(Me) = 108г/моль; mэ(S) = 16г/моль.
Задача№5
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34г металла окисляются 0,680л кислорода (условия нормальные).
Решение:
Зная, что эквивалентный объём кислорода равен 5,6л/моль, рассчитаем эквивалентную массу металла, составив пропорцию:
8,345 : 0,680 = х : 5,6;
х = 8,34 . 5,6/0,680 = 68,68г/моль.
Атомную массу металла находим, учитывая, что металл двухвалентный, умножением его эквивалентной массы на 2:
М(Ме) = mэ(Ме) . В, где
В – валентность металла; М – молярная масса металла; mэ(Ме) – эквивалентная масса металла.
М(Ме) = 68,68 . 2 = 137,4г/моль.
Ответ: 137,4; Ba.
Задача№6
Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.
Решение:
а) Находим формулу оксида мышьяка, учитывая, что оксид содержит 65,2% As по массе. Тогда оксид содержит кислорода по массе 34,8% (100 – 65,2 = 34,8). Находим формулу оксид мышьяка:
AsхОу = х : у = 65,2/Ar(As) : 34,8/Ar(O2) = 65,2/74,92 : 34,8/16 = 1 : 2,5 = 2 : 5
Формула оксида будет иметь вид: As2O5.
Находим массу мышьяка и массу кислорода в оксиде:
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 5 = 80г.
Согласно закону эквивалентов массы элементов в оксиде пропорциональны их эквивалентным массам:
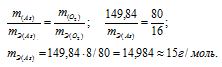
б) Подобные расчеты производим, учитывая, что оксид содержит 75,7% As и 24,3% О2 (100 – 75,7 = 24,3) по массе:
AsхОу = х : у = 75,7/74,92 : 24,3/16 = 1,01 : 1,51 = 1 : 1,5 2 : 3
Формула оксида будет иметь вид: As2O3.
M(As2O5) = 197,84г/моль.
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 3 = 48г.
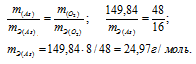
Ответ: а) 15г/моль; 24,97г/моль.
Задача№7
,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их а (объёмам):
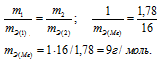
Находим эквивалентную массу брома, учитывая, что эквивалентная масса металла равна 9г/моль:
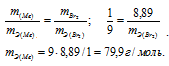
Ответ: 9г/моль; 79,9г/моль.
Задача№8
Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Решение:
Согласно закону эквивалентов:
Зная эквивалентные массы хлора и меди можно определить количество их атомов в молекуле соли: mэ(А) = М(А)/mэ(А).
Тогда: CuxCly = x : y = 63,5/63,546 : 35,45/35,5 = 0,992 : 0,999 = 1 : 1
Ответ: CuCl.
Задача№9.
Для растворения 16,8г металла потребовалось 14,7г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение:
M(H2SO4) =98г/моль.
Находим массу водорода в 14,7г серной кислоты, составив пропорцию: 98 : 2 14,7 : х;
х = 2 . 14,7/98 = 0,3г.
Согласно закону эквивалентов массы взаимодействующих веществ пропорциональны их эквивалентным массам:
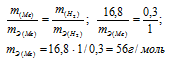
Учитывая, что эквивалентный объём водорода равен 11,2л/моль, рассчитаем объём который занимает 0,3г водорода: из пропорции:
1 : 11,2 = 0,3 : х;
х = 11,2 . 0,3/ 1 = 3,36л.
Ответ: mэ(Ме) = 56г/моль; V(H2) = 3,36л.
Задача№10
На восстановление 1,80г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
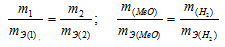
Так как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м 3 ). Мольный объём любого газа при н.у. равен 4л. Отсюда эквивалентный объём водорода равен, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000мл/моль.
Отношение 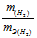
заменим равным ему отношением 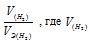
- объём водорода;
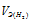
- эквивалентный объём водорода.
Тогда получим отношение 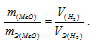
Находим эквивалентную массу оксида металла:
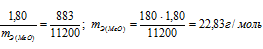
Согласно закону эквивалентов
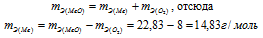
Ответ: 22,83г/моль; 14,83г/моль.
Читайте также:

