Частота объективного ответа в онкологии
Влияет ли частота объективных ответов на продолжительность жизни больных метастатическим почечно-клеточным раком, получающих таргетную терапию?
С 2006 года таргетная терапия широко используется для лечения метастатического почечно-клеточного рака (мПКР). За 5 лет накоплен большой опыт применения таргетных препаратов, стало возможным оценивать отдаленные результаты терапии, а именно влияние на продолжительность жизни больных.
Важным является поиск факторов, определяющих выбор препарата. Есть факторы, которые одинаково влияют на эффективность того или иного агента. К ним можно отнести статус по шкале ECOG, изменение уровня ЛДГ, гиперкальциемию, снижение гемоглобина, количество метастатически измененных органов, число нейтрофилов и тромбоцитов, а также насколько вовремя было начато лечение по поводу метастатической болезни и проводилась ли нефрэктомия – то есть факторы, определяющие течение самой болезни. Как известно, в различных модификациях данные факторы складываются в прогностические модели (модели Motzer, 2000; Hudes, 2007; Heng, 2009) и делят пациентов на группы гипотетически благоприятного, промежуточного или плохого прогноза, что сказывается на результатах выживаемости. Эффективность любого таргетного препарата вне зависимости от его механизма действия равнозначно снижается от благоприятного к промежуточному прогнозу.
Между тем, есть факторы, непосредственно связанные с лечением, являющиеся его результатом, которые могут влиять на продолжительность жизни. Речь идет о частоте ответов на фоне анти-VEGF(R) терапии.
Долгое время данному критерию эффективности таргетной терапии отводилась второстепенная роль. Основной задачей было увеличение выживаемости без прогрессирования как показателя времени контроля над болезнью. Однако в последний год значение развития ответа у пациента, получающего таргетный препарат, изменилось. Теперь это один из предикторов продолжительности жизни.
Частота ответов и ее влияние на продолжительность жизни
Частота ответов при лечении ингибиторами тирозинкиназы и моноклональными антителами, воздействующими на путь VEGF/VEGFR, колеблется от 5% (для сорафениба в первой линии) до 47% (для сунитиниба в первой линии) (табл. 1).
Таблица 1. Частота ответов и ее влияние на продолжительность жизни.
| Препарат | Исследование | Частота ответов |
|---|---|---|
| Сунитиниб [1] | III фаза (Motzer et al) Пациенты, не получавшие лечение | 47% |
| Сунитиниб [2] | II фаза (Motzer et al) После прогрессирования на цитокинах | 42% |
| Пазопаниб [3] | III фаза (Sternberg et al.) Пациенты, не получавшие лечение | 32% |
| Пазопаниб [3] | III фаза (Sternberg et al.) После прогрессирования на цитокинах (подгруппа) | 29% |
| Бевацизумаб+ИФН [4] | AVOREN (Escudier et al.) Пациенты, не получавшие лечение | 31% |
| Бевацизумаб+ИФН [5] | CALGB (Rini et al.) Пациенты, не получавшие лечение | 25,5% |
| Сорафениб [6] | TARGET (Escudier et al.) После прогрессирования на цитокинах | 10% |
| Сорафениб [7] | II фаза (Escudier et al.) Пациенты, не получавшие лечение | 5% |
В этом году на конгрессе ASCO несколькими авторами были представлены результаты влияния частоты ответов на выживаемость больных мПКР.
Wanling Xie с соавт. (abstract 4538) [8] проанализировали 2161 больных с мПКР, которые получали таргетную терапию. Из общей группы были выделены пациенты (N=152), живущие долго (медиана 69,3 мес.), и пациенты (N=218) с короткой продолжительностью жизни (медиана 3,1 мес.). Обе группы были сравнены по основным прогностическим факторам, относящимся к модели Heng. Неудивительно, что в группе с короткой продолжительностью жизни было достоверно больше пациентов с промежуточным и плохим прогнозом (P Поделиться |
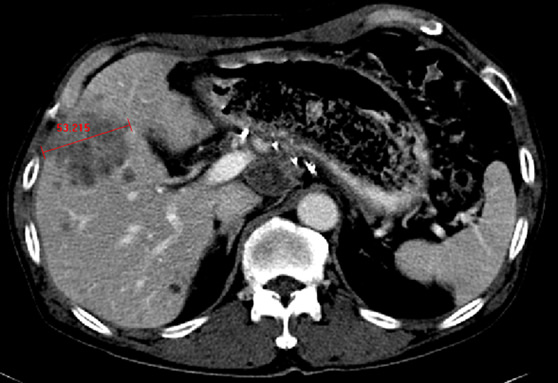
Современными критериями ответа опухоли на терапию являются критерии RECIST 1.1 от 2009 года. Критерии RECIST - это набор критериев, которые используют для оценки ответа опухоли на проводимую терапию. Основу оценки составляет определение размера опухоли с помощью методов лучевой диагностики (рентгенографии, компьютерной томографии, магнитно-резонансной томографии, ультразвукового исследования) и эндоскопических методов.
Опухолевые очаги
В соответствии с критериями RECIST опухолевые очаги подразделяются на два типа:
- измеряемые очаги — очаги, выявляемые и составляющие по наибольшему диаметру:
- ≥10 мм при спиральной КТ при реконструкции срезов толщиной в 5 мм
- ≥20 мм при шаговой КТ с толщиной среза 10 мм
- ≥20 мм при рентгенографии грудной клетки
неизмеряемые очаги — очаги, выявляемые и составляющие по наибольшему диаметру при шаговом КТ величение размеров органов (гепатоспленомегалия), п еритонеальные импланты.
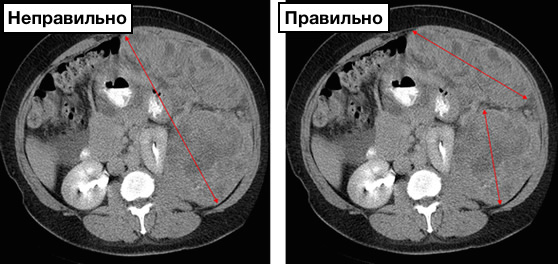
- В первую очередь измеряемые очаги оцениваются количественно.
- Следующим шагом нужно выбрать таргетные очаги, которые в процессе терапии будут использоваться для контроля. Таргетный очаг сохраняется на протяжении всех повторных исследований таргетным, если даже размеры очаги уменьшатся до пределы погрешности метода исследования.
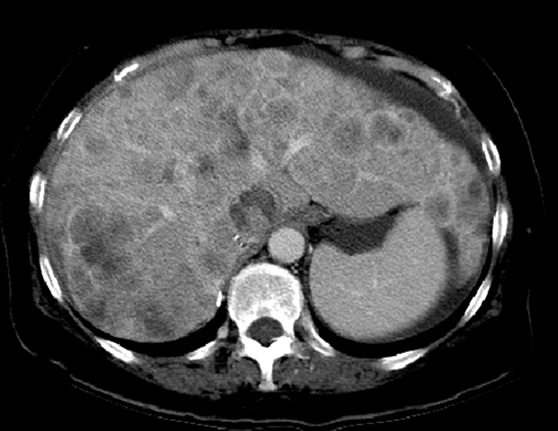
Выбирайте не наибольший очаг в качестве таргетного, а наиболее четкий, оптимальный для измерения.
Таргетные очаги:
- измеряемые очаги, максимально до 5 очагов на орган, в сумме до 10 очагов, очаги, отражающие пораженный орган должны соответствовать критериям таргетного очага
- выбираются исходя их размеров (с наибольшим диаметром) и пригодности для точного повторного измерения
- очаги в подвижных органах (напр. жкт, яичниках) могут быть неподходящими для оценки
- указываются только аксиальные размеры
Не-таргетные очаги:
- могут включать как измеряемые, так и неизмеряемые очаги
- к измеряемым очагам относят все очаги, которые превышают максимально допустимое количество таргетных очагов (до 5 очагов на орган, не более 10 очагов на весь организм), попадая таким образом в группу не-таргетных очагов
- не-таргетные очаги не обязаны быть измеряемыми
- в идеале должны включать все очаги не отнесенные к таргетным очагам
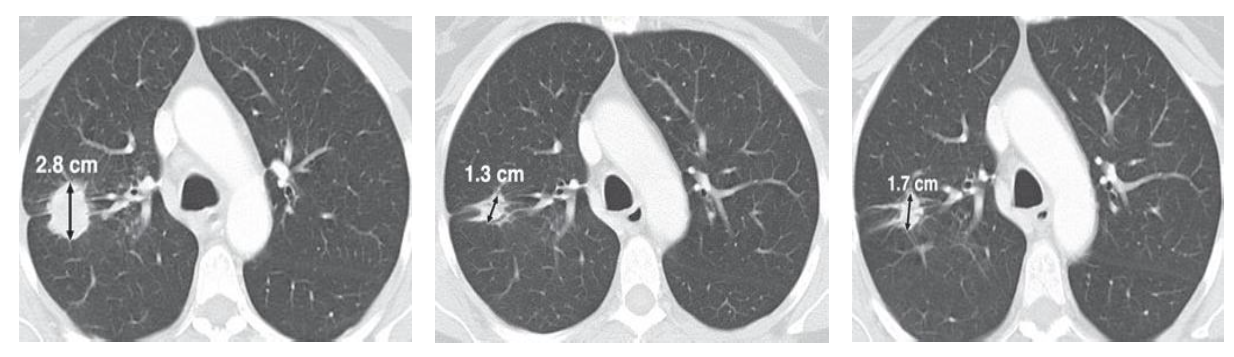
A. Образование наибольшим диаметром 2.8 см (единственный выявленный очаг).
B. КТ после 1 курса химиотерапии, наибольший диаметр образования 1.3 см – уменьшение размеров на 54% - PR.
C. до 1.7 см - увеличение на 30%, однако менее, чем на 5мм - SD по RECIST 1.1
В настоящее время объективная оценка по единым критериям лечебных и побочных эффектов лекарственной терапии у больных злокачественными опухолями является обязательным условием лечения, проведения клинических испытаний новых препаратов или их комбинаций, а также сравнения результатов лечения в различных медицинских учреждениях.
Необходимо отметить, что с точки зрения оценки эффективности лечения в цепом предпочтение отдается не критериям непосредственной эффективности, а показателям выживаемости и качества жизни.
Тем не менее, на начальных этапах исследования противоопухолевой активности непосредственный эффект играет очень важную роль.
Принципы и методология оценки эффективности лекарственной терапии у больных солидными опухолями отражены в рекомендациях ВОЗ и в опубликованных в 2000 г. новых единых подходах — RECIST [Response Evaluation Criteria In Solid Tumors]. В настоящее время при проведении международных, кооперированных, рандомизированных исследований по оценке эффективности новых лекарственных средств используются критерии RECIST, в клинической практике — критерии ВОЗ.
В цепом для обеих схем характерны общие методологические подходы. Оценка эффективности лечения предусматривает изучение динамики размеров опухолевых очагов, частоты и продолжительности общего объективного терапевтического ответа, изучение динамики лабораторных показателей и биологических маркеров как критериев прогрессирования заболевания и выживаемость больных.
Кроме того, дополнительно оцениваются частота и степень выраженности побочных эффектов, а также качество жизни больных. Оптимальным сроком после окончания курса лечения цитостатиками, необходимым для определения вышеперечисленных критериев, считают 4 недели.
Очевидно, что своевременная объективная оценка противоопухолевого действия химиопрепаратов дает основание либо изменить программу лечения, либо прекратить химиотерапию при ее неэффективности.
Оценка опухолевых очагов
Оценка опухолевых очагов осуществляется перед началом терапии на основании данных осмотра и результатов проведенных исследований. В связи с этим, все опухолевые очаги делятся на измеримые (величина может быть определена хотя бы в одном измерении) и неизмеримые, но оцениваемые: метастазы в кости и лимфоузлы, асцит, плевральный выпот, диффузная форма рака молочной железе и т д.
Оценка в динамике измеримых и неизмеримых опухолей проводится по данным тех же исследований, что и перед началом терапии. Все измерения выполняются при помощи линейки или циркуля.
Размеры опухоли определяются как произведение длины максимального диаметра и диаметра ему перпендикулярного и обозначаются в см2 (мм2) или могут определяться измерением только одного, наибольшего диаметра.
Неизмеримые оцениваются по количеству выпота, метастатических очагов и т.д. Непосредственный (объективный) эффект оценивается на основании изменений размеров и в зависимости от степени регресса опухолевых очагов может соответствовать следующим категориям: полная регрессия, частичная регрессия, стабилизация и прогрессирование заболевания (табл. 9.9).
Таблица 9.9. Критерии оценки результатов лекарственного лечения новообразований. 
Оценка эффективности лечения
Оценка эффективности лечения производится на основании оценки изменений опухолевых очагов после проведенного лечения. Основным критерием оценки противоопухолевой терапии, при которой лечение считается эффективным, является общий объективный ответ.
Он включает все случаи полной и частичной регрессии опухолей (ПР+ЧР), подтвержденные при двух последовательных осмотрах, выполненных с интервалом не менее четырех недель. Дополнительно учитывается лечебный эффект, включающий, кроме полной и частичной регрессии, стабилизацию процесса (ПР+ЧР+Ст).
Пациент отвечает на вопросы, после чего полученные данные анализируются в динамике по специально разработанным методикам. Стандартными опросниками в онкологической практике являются: FAGT — для функциональной оценки противоопухолевой терапии; EORTC QLQ — С3О — опросник Европейской организации исследований и лечения рака (содержит 30 вопросов, 5 параметров и параметры общего качества жизни); CARES-SF — система оценки реабилитации онкологических больных (59 вопросов, 5 параметров и параметры общего качества жизни).
Оценка побочных эффектов
Об эффективности лекарственной терапии позволяют судить также степень и частота побочных эффектов. Безопасность лекарственной терапии оценивается на основании регистрации побочных реакций, изменений лабораторных тестов и жизненно важных показателей.
Выявление и оценка побочных эффектов осуществляется в сравнении с исходными данными при каждом осмотре пациента, как во время, так и после завершения терапии и прослеживаются до их разрешения, либо возвращения к исходному уровню.
К побочным реакциям относят любое изменение (по отношению к исходным данным) в самочувствии или состоянии пациента, включая клинически значимые отклонения от нормы лабораторных и функциональных показателей, массы тела, которые могут и не иметь причинно-следственной связи с проводимым лечением.
В группу побочных эффектов относят также обострение существующего хронического заболевания или рецидив отмечавшегося ранее заболевания: значительное или неожиданное ухудшение течения основного заболевания; подозрение на взаимодействие с другими препаратами; интеркуррентные заболевания; клинически значимые отклонения лабораторных показателей.
Оценка побочных эффектов включает также выявление характера взаимосвязи вышеперечисленных факторов с лекарственной терапией (связь отсутствует, маловероятна, возможна, вероятна, высоко вероятна) и определение степени их выраженности (табл 9.10). Частота возникновения побочных эффектов является основным критерием безопасности лечения.
Таблица 9.10. Степень выраженности побочных эффектов [NCI Common Toxicity Criteria v. 2]. 
Угляница К.Н., Луд Н.Г., Угляница Н.К.

Онкологические заболевания — это вид очень серьёзных болезней, тяжесть которых варьирует от одного вида к другому.
Прогноз болезни зависит в большой степени от локализации и стадии её эволюции.
Разнообразие видов рака требует их дифференциации в зависимости от точной системы классификации.
Классификация видов рака
Онкологические заболевания могут классифицироваться в зависимости от органа или части тела локализации болезни (пищеварительная система, почки, печень, грудь) или в зависимости от клеток которые дали начало расстройству.
Например, лейкоз (лейкемия) является раком крови, который появляется в результате раковой пролиферации лейкоцитов.
Другая классификация имеет ввиду анатомические характеристики рака: локализованный или диффузный с инвазией лимфатических узлов или без неё.
Эти клетки могут выглядеть нормально, как и другие клетки данной ткани в которой локализуется рак, даже если формируют хаотические образования из-за быстрого размножения. В таком случае речь идёт о дифференцированном раке.
Недифференцированный рак относится к анормальным клеткам, которые очень похожи с примитивными эмбриональными клетками.
Такие виды рака развиваются весьма бурно и являются очень тяжелыми.
Если вид клеток, в какой-то мере похож с клетками ткани, тогда речь идёт об умеренном дифференцированном раке.
Элементы, которые характеризуют опухоль (локализация, размеры, наличие инвазии лимфатических узлов, наличие метастаз), обозначаются кодифицировано.

Данный универсальный код позволяет упростить диагноз и требуемое лечение.
Самая старая кодификация рака относится к стадиям рака:
- 0 — относится к полному исцелению в 100 % случаев;
- IV — относится к летальному исходу пациента в почти 100 % случаев.
Эта классификация базируется на данные клинических и радиологических обследований.
Классификация опухолей в зависимости от стадии объясняется таким образом:
- Стадия 0 — местный (локализованный) рак;
- Стадия I — опухоль маленьких размеров без инвазии лимфатических узлов;
- Стадия II — опухоль более выраженных размеров с минимальной инвазией лимфатических узлов;
- Стадия III — выраженная опухоль, которая выходит за рамки пораженного органа, со значительной инвазией лимфатических узлов;
- Стадия IV — диффузная опухоль с метастазами.
Другой вид кодировки относится к 3 элементам:
- расширение примитивной опухоли (обозначается латинской буквой T);
- состояние лимфатических узлов (обозначается латинской буквой N);
- наличие или отсутствие удалённых метастазов (обозначается латинской буквой M).
Каждый элемент T, N, M сопровождается цифрой, начиная от 0 в порядке возрастания, которая обозначается тяжесть рака.
Классификация TNM (ТНМ) состояния рака состоит из таких обозначений:
- T (Т) — примитивная опухоль (tumor)
- Tis — местный (локализованный);
- T1 — незначительный размер;
- T2 — размер опухоли больше по сравнению с T1;
- Т3 — размер опухоли больше по сравнению с T2;
- T4 — вторжение в соседние ткани.
- N (Н) — поражение лимфатических узлов (lymph node)
- N0 — лимфатические узлы не затронуты;
- N1 — увеличение числа пораженных лимфатических узлов или поражение лимфатических узлов на больших расстояниях;
- N2 — увеличение числа пораженных лимфатических узлов больше по сравнению с N1 и поражение лимфатических узлов на ещё больше расстоянии по сравнению с N1;
- N3 — увеличение числа пораженных лимфатических узлов больше по сравнению с N2 и поражение лимфатических узлов на ещё больше расстоянии по сравнению с N2.
- М (M) — удаленные метастазы (metastasis)
- M0 — без удаленных метастазов;
- M1 — наличие удаленных метастазов.

Кодификация TNM (ТНМ) происходит из английского языка Tumor — lymph Node — Metastasis.
Частота случаев рака в различных регионах мира
Рак как болезнь — известен ещё со времен Античности. В развитых странах, он является второй причиной смертности после сердечно-сосудистых заболеваний.
В Европе и в Северной Америке замечается преобладание рака легкого (который ассоциируется в 90 % случаев с курением), рака толстой кишки или прямой кишки (который связан в основном с питанием) и рака молочной железы (причины которого остаются неизвестными).
В Африке увеличена частота рака печени в областях, где распространен гепатит В. Другим распространенным онкологическим заболеванием в бедных странах мира с высокой рождаемостью является рак шейки матки. Частота этого вида рака объясняется плохими гигиеническими условиями, которые вызывают повышенный уровень венерических заболеваний (вирус папилломы или вирус герпеса). По причине этих венерических расстройств повышается вероятность этого вида рака.
Прогноз и тяжесть онкологических расстройств
Рак по своим характеристикам является тяжелым расстройством, но уровень тяжести различается от одного вида рака к другому.
Многие виды рака являются доброкачественными. Таким образом, некоторые опухоли кожи или пищеварительной системы, в случае лечения, считаются полностью устраненными.
Если учитывать полную статистику заболеваемости онкологическими заболеваниями, то можно считать что 50 % всех пациентов полностью исцелились.
Тяжесть рака часто зависит от его локализации.
Например, рак легкого и рак головного мозга являются тяжелыми расстройствами.
Прогноз рака кожи может составляться на базе классификации TNM (ТНМ). Микроскопическое обследование может выявить, если речь идёт об опасном раке с риском метастазов или об опухоли, которая может развиваться только локально.
Тяжесть рака пищеварительной системы часто зависит от стадии его эволюции.
Если его обнаружить поздно, то шансы на успешное излечение являются минимальными.
Такая же ситуация наблюдается и в случае рака шейки матки, при котором если использовать своевременно методы обнаружения, то можно выявить болезнь в начальной стадии, что повышает шансы на выздоровление.
Влияние возраста и пола
Люди не являются равными перед риском заболеть раком. Основным фактором риска является возраст. Даже если онкологические заболевания могут замечаться абсолютно при любом возрасте, частота опухолей повышается с возрастом.
1 % всех случаев рака наблюдаются при возрасте моложе 15 лет, в то время как 55 % случаев онкологии замечается у людей старше 65 лет.
Пол также играет важную роль, что касается частота заболеваемости в зависимости от пораженных органов.
Рак как заболевание чаще наблюдается у мужчин по сравнению с женщинами.
57 % случаев рака замечаются у мужчин, а также 60 % летальных случаев наблюдается у мужчин.
Сегодня отмечается увеличение заболеваемости раком во всем мире. Наряду с этим, развитие радиологических методов диагностики и их широкое применение, способствуют диагностике онкологических заболеваний на ранних стадиях…

Сегодня отмечается увеличение заболеваемости раком во всем мире. Наряду с этим, развитие радиологических методов диагностики и их широкое применение, способствуют диагностике онкологических заболеваний на ранних стадиях. Процент выживаемости при онкологических заболеваниях напрямую зависит от степени тяжести рака.
В онкологии применяются следующие основные методы лучевой диагностики:
- УЗИ — (визуальная методика, основанная на использовании ультразвуковых волн для получения изображения)
- Рентгенодиагностика (рентгенологический метод) — принцип получения изображения построен на особенностях поглощения рентгеновских лучей различными тканями организма
- Компьютерная томография (КТ) — метод рентгеновского исследования, основанный на получении послойных изображений в поперечной плоскости и их компьютерной реконструкции
- Магнитно-резонансная томография (МРТ) — метод, основанный на получении послойных изображений органов и тканей с помощью явления магнитного резонанса
- Радионуклидная диагностика или ядерная медицина — метод лучевой диагностики, основанный на регистрации излучения от введенных в организм искусственных радиофарм препаратов
- Соответствующие дополнительные исследования и биопсия должны быть выполнены в отношении любых локализаций, подозрительных на злокачественный процесс, так как точное установление стадии болезни определяет лечение и исход основного заболевания
Применение лучевой диагностики в онкологии направлено на решение основных задач:
- Ранняя (доклиническая) диагностика новообразований. В последнее время лучевые методы диагностики эффективно используются в качестве скрининга, что позволяет обнаружить новообразования размером менее 1 см
- Стадирование, оценка локализации, распространенности, метастазирования, дифференциальная диагностика. На данном этапе лучевые и радионуклидные методы являются наиболее информативными, на их основании принимается решение о тактике лечения
- Оценка результатов лечения и динамики болезни. Противоопухолевое лечение включает в себя лучевую терапию, химиотерапию, оперативное вмешательство как самостоятельные методы, так и их комбинации в различной последовательности. Для оценки эффективности проводимой терапии, а также объективного сравнения полученных результатов в различных клиниках во всем мире используется система критериев, известных как RECIST (Response Evaluation Criteria in Solid Tumors). C помощью этих критериев определяются параметры полного, частичного ответов, стабилизации и прогрессирования болезни. Основу классификации составляет определение размера опухоли с помощью методов лучевой диагностики и эндоскопических методов. Таким образом, повторная диагностика с использованием лучевых методов активно используется в послеоперационном периоде и по прошествии лечения, т.к. дает четкое понимание эффективности терапии и позволяет спланировать дальнейшую тактику ведения пациента
- Динамическое наблюдение. Современные алгоритмы лечения онкологических заболеваний предусматривают наблюдение и проведение периодических исследований с использованием радиологических методов для выявления рецидивов
Виды рака и методы его диагностики
Методы визуализации, такие как магнитно-резонансная томография (МРТ), которая может дать дополнительную информацию, но не являются необходимыми исследованиями при проведении предоперационной оценки в рутинной практике. При сомнительных результатах по данным УЗИ, использование МРТ усиливает специфичность метода визуализации, тем самым снижая риск неверного диагноза
КТ не является методом выбора при раке яичников, а используется при невозможности выполнения МРТ, также для оценки поражения лимфоузлов.
- Магнитно-резонансная томография (МРТ) рассматривается как дополнительный метод обследования, превосходящий КТ-исследование в оценке распространенности опухоли, но в оценке поражения лимфатических узлов оба метода равнозначны. Для поиска метастазов также проводится Магнитно-резонансная томография малого таза и брюшной полости
- Компьютерная томография может быть использована для выявления метастатического поражения органов грудной клетки
- При вовлечении в процесс шейки матки, рекомендовано выполнение магнитно-резонансная томография (МРТ) с контрастным усилением
- КТ грудной клетки и брюшной полости используется для определения метастазов
Для определения распространенности процесса, поиска метастазов, как дополнительный метод используется КТ грудной клетки и брюшной полости с контрастированием
Методы лучевой диагностики (МРТ, КТ) используются для поиска метастазов в брюшной полости и забрюшинном пространстве, в малом тазу, легких и головном мозге. Для этого предпочтительней делать МРТ органов брюшной полости, малого таза, головного мозга и КТ легких
КТ и МРТ с контрастом считаются оптимальными методами диагностики.
МРТ даст более точную информацию по выявлению опухоли, а КТ более точно определит инвазивный рост, что важно для оперативного хирургического объема.
Все органы брюшной полости и забрюшинного пространства имеют склонность к метастазированию в легкие, головной мозг, малый таз.
- Оптимальным методом диагностики образований в печени считается МРТ с контрастным усилением, а использование гепатоспецифических контрастных препаратов имееют дополнительное преимущество для данной патологии
- Для адекватного стадирования опухоли используется КТ органов грудной клетки и КТ органов брюшной полости
Диагноз должен быть основан на данных радиологического исследования МРТ и патоморфологическом подтверждении диагноза.
Виртуальная колоноскопия (неинвазивный метод, основанный на лучевой диагностике) способна точно визуализировать локализацию опухоли, что особенно полезно в сочетании с эндоскопическим методом в планировании объема хирургической операции
- Магнитно резонансная томография прямой кишки может дать исчерпывающую информацию хирургу в отношении стадии процесса, определит особенности кровоснабжения, поможет сформировать понимание объема операции и хирургического доступа
- Компьютерная томография, в данном случае, проводится с целью обнаружения метастазов (брюшная полость, легкие, головной мозг)
- В качестве скринингового метода диагностики применяется виртуальная колоноскопия (неинвазивный метод, основанный на лучевой диагностике)
- КТ используется для поиска метастазов
- Основным методом диагностики считается КТ грудной клетки
- Так как рак легких часто метастазирует в брюшную полость и головной мозг, то целесообразно проведение КТ / МРТ брюшной полости и МРТ головного мозга
- Данное заболевание диагностируется на КТ, определяются связи с почечными артериями, степень прорастания в чашечно-лоханочную систему и экстраорганное распространение и воздействие
- Магнитно-резонансная томография также широко используется в этой области. И КТ и МРТ исследования проводятся с применением контраста
- Выполняется МРТ малого таза с контрастом
- Наличие метастазов смотрят на КТ в легких и брюшной полости
- Магнитно-резонансная томография малого таза, позволяет детально оценить структуру предстательной железы, распространенность патологического процесса, вовлечение в процесс окружающих тканей, лимфатических узлов
- Т.к. рак простаты часто метастазирует в кости, то на поздних стадиях заболевания проводится остеосцинтиграфия
Лучевая диагностика (компьютерная, магнитно-резонансная томография с контрастом) позволяет выявить наличие опухолевых образований в различных анатомических областях, которые не доступны врачу при внешнем осмотре
- Основной метод диагностики — МРТ. Данный вид исследования необходим для уточнения локализации опухоли, определения степени распространенности
- МР — трактография сможет обозначить степень вовлечения проводящих путей головного мозга (трактов)
- Компьютерная томография используется как дополнительный метод в случае если в процесс вовлечены костные структуры. Также КТ выполняют при наличии абсолютных противопоказаний к МРТ исследованию
Магнитно-резонансная томография используется для определения локализации опухоли, ее уровня и положения (интрамедуллярные или экстрамедуллярные опухоли, т.е. находящиеся в структуре спинного мозга или вне его). В случае противопоказаний к МРТ проводят КТ
Лучевая диагностика не используется для выявления меланомы как таковой, но ввиду активного метастазирования, проводится КТ и МРТ.
Читайте также:

