Brca1 ассоциированный рак молочной железы
Маркер связан с особенностями восстановления ДНК при повреждениях, участвует в поддержании стабильности генома. Исследуется для выявления наследственной предрасположенности к раку молочной железы и яичников.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Локализация гена на хромосоме – 17q21.31
Ген BRCA1 кодирует белок BRCA1 (breast cancer 1), участвующий в репарации (восстановлении) ДНК, регуляции клеточного цикла и поддержании генетической стабильности.
Мутация гена BRCA1
Мутация заключается в делеции (утрате) одного нуклеотида - А (аденин) в позиции 4153 последовательности ДНК гена BRCA1 и обозначается как 4153delA.
Возможные генотипы
- N/N
- N/del
Ассоциация маркера с заболеваниями
- Рак молочной железы
- Рак яичников
Общая информация об исследовании
BRCA1 играет важную роль в репарации (восстановлении) ДНК, регуляции клеточного цикла и поддержании стабильности генома. Ген BRCA1, кодирующий белок BRCA1, является геном-супрессором опухоли, в норме защищающим клетку от злокачественного перерождения. При возникновении мутации в этом гене значительно повышается вероятность развития рака молочной железы (РМЖ) и яичников (РЯ).
BRCA1 имеет множество мутантных аллелей. Мутация, заключающаяся в делеции (утрате) нуклеотида аденина в позиции 4153, обозначается как 4153delA. Делеция инактивирует работу гена, что в итоге может увеличивать вероятность развития РЯ и РМЖ. Данная мутация и мутация 5382insC являются причиной почти 86 % семейного рака яичников в России.
Рак молочной железы и яичников – одни из самых распространенных онкологических заболеваний. Присутствие мутаций в гене BRCA1 может увеличить вероятность рака молочной железы более чем в 5 раз, а рака яичников – в 10-28 раз. Средний возраст развития заболевания при этом снижается до 25-30 лет. Чем старше человек, тем выше у него вероятность рака.
Выявленные семейные случаи заболевания в первую очередь свидетельствуют о наследственной природе рака и требуют генетического анализа. Ген BRCA1 участвует в защите организма от спонтанных повреждений ДНК, поэтому нарушение его работы позволяет накапливаться мутациям и приводит к онкологическим заболеваниям, и в первую очередь – к раку молочной железы и яичников. Известно, что рак, ассоциированный с генетическими маркерами BRCA, характеризуется высокой степенью злокачественности и выраженной лимфоидной инфильтрацией.
Анализ можно проводить в любом возрасте, и при раннем выявлении нарушений по указанному маркеру лечение будет начато своевременно.
Для успешного лечения онкологических заболеваний очень важно обнаружить опухоль на ранней стадии, еще до появления симптомов. Поэтому генетическая предрасположенность к раку молочной железы и яичников – серьезное показание к регулярному обследованию в целях выявления заболевания на ранней стадии.
- N/N – популяционный риск развития рака молочной железы и яичников
- N/del – высокий риск развития рака молочной железы и яичников
Интерпретация результатов исследования должна проводиться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Поскольку данный ген может иметь несколько мутантных вариантов, необходимо оценивать его работу одновременно по нескольким маркерам.
Изолированное исследование мутации 4153delA рекомендуется только при выявлении данного маркера у родственников первой степени родства.
Генетический маркер входит в исследование:
С предрасположенностью к возникновению синдрома РМЖ/РЯ связано присутствие у таких пациентов мутаций в генах BRCA1 или BRCA2. Мутации являются наследственными – то есть, буквально в каждой клетке организма такого человека есть повреждение, которое передалось ему по наследству. Вероятность возникновения злокачественного новообразования у пациентов с мутациями BRCA1 или BRCA2 к 70 годам достигает 80%.
Однако, в каждой клетке присутствует две копии каждого гена — от мамы и от папы, поэтому вторая копия может компенсировать нарушение работы клеточных систем. Но вероятность выхода ее из строя также очень высока. При нарушении процессов восстановления ДНК в клетках начинают накапливаться и другие изменения, которые, в свою очередь, могут привести к злокачественной трансформации и росту опухоли.
Определение генетической предрасположенности к онкологическим заболеваниям:
На базе лаборатории молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова применяется проведение поэтапного анализа для пациентов:
- сначала исследуется присутствие самых частых мутаций (4 мутации)
- при отсутствии таковых и клинической необходимости возможно проведение расширенного анализа (8 мутаций) и/или анализа полной последовательности генов BRCA1 и BRCA2.
 |  |
На данный момент известно более 2 000 вариантов патогенных мутаций в генах BRCA1 и BRCA2. Кроме того, данные гены являются довольно большими – 24 и 27 экзонов соответственно. Поэтому полный анализ последовательностей генов BRCA1 и BRCA2 является трудоемким, дорогостоящим и длительным по времени процессом.
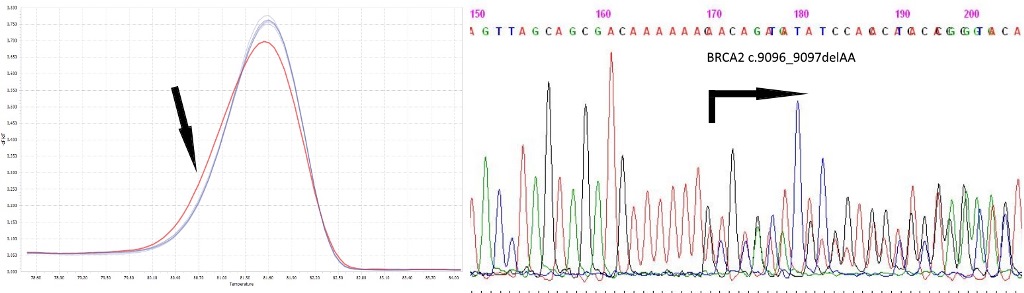
Анализ последовательности гена BRCA2, выявление мутации c.9096_9097delAA
В каких случаях нужно сдать анализ на мутации BRCA1 и BRCA2?
Национальная онкологическая сеть – National Comprehensive Cancer Network (NCCN) рекомендует направлять на генетическое исследование следующих пациентов:
- Пациенты до 45 лет с диагнозом рак молочной железы
- Пациенты в возрасте до 50 лет с РМЖ, если в семье есть хотя бы один близкий кровный родственник с таким диагнозом
- Также в том случае, если у пациента до 50 лет с РМЖ семейная онкологическая история неизвестна
- Если в возрасте до 50 лет диагностировано множественное поражение молочных желез
- Пациенты с РМЖ в возрасте до 60 лет — если по результатам гистологического исследования опухоль является трижды-негативной (отсутствует экспрессия маркеров ER, PR, HER2).
- При наличии диагноза рак молочной железы в любом возрасте — если присутствует хотя бы один из следующих признаков:
- не менее 1 близкой родственницы с РМЖ в возрасте менее 50 лет;
- не менее 2 близких родственниц с РМЖ в любом возрасте;
- не менее 1 близкой родственницы с РЯ;
- наличие не менее 2 близких родственников с раком поджелудочной железы и/или раком предстательной железы;
- наличие родственника-мужчины с раком грудной железы;
- принадлежность к популяции с высокой частотой наследственных мутаций (например, евреи Ашкенази);
- Все пациенты с диагностированным раком яичников.
- Если диагностирован рак молочной железы у мужчины.
- Если диагностирован рак простаты (с индексом по шкале Глисона >7) при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если диагностирован рак поджелудочной железы при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если рак поджелудочной железы диагностирован у уиндивидуума, принадлежащего к этносу евреев Ашкенази.
- Если у родственника обнаружена мутация BRCA1 или BRCA2
Выполнение молекулярно-генетического анализа должно сопровождаться генетическим консультированием, в ходе которого обсуждаются содержание, смысл и последствия тестирования; значение позитивного, негативного и неинформативного результатов; технические ограничения предлагаемого теста; необходимость информировать родственников в случае обнаружения наследственной мутации; особенности скрининга и профилактики опухолей у носителей мутаций и др.
Как сдать анализ на мутации BRCA1 и BRCA2?
Материалом для анализа является кровь. Для генетических исследований используют пробирки с ЭДТА (фиолетовая крышка). Сдать кровь можно в лаборатории НМИЦ или привезти из любой другой лаборатории. Кровь хранится при комнатной температуре до 7 дней.
 |  |
Особая подготовка к исследованию не нужна, на результаты исследования не влияют приемы пищи, прием лекарств, введение контрастных веществ и пр.
Пересдавать анализ через некоторое время или после лечения не потребуется. Наследственная мутация не может исчезнуть или появиться в течение жизни или после полученного лечения.
Что делать, если у женщины обнаружена мутация BRCA1 или BRCA2?
Для носителей патогенных мутаций разработан комплекс мероприятий по ранней диагностике, профилактике и терапии новообразований молочной железы и рака яичников. Если среди здоровых женщин своевременно выявить тех, у кого имеется генный дефект, есть возможность диагностировать развитие заболевания на ранних стадиях.
Исследователями были выявлены особенности лекарственной чувствительности BRCA-ассоциированных опухолей. Они хорошо реагируют на некоторые цитостатические препараты, и лечение может быть весьма успешным.
Для здоровых носителей BRCA-мутаций рекомендовано:
- Ежемесячное самообследование с 18 лет
- Клиническое обследование молочных желез (маммография или магнитно-резонансная томография) с 25 лет.
- Мужчинам-носителям мутации в генах BRCA1/2 рекомендовано проведение ежегодного клинического обследования грудных желез начиная с 35-летнего возраста. С 40 лет целесообразно выполнение скринингового обследования предстательной железы.
- Проведение дерматологического и офтальмологического осмотров c целью ранней диагностики меланомы.
Как предрасположенность к РМЖ и РЯ передается по наследству.
Часто у носителей мутаций BRCA1/BRCA2 возникает вопрос – всем ли детям она передалась и какие генетические причины появления наследственной формы РМЖ? Шансы передать повреждённый ген потомству составляют 50%.
Заболевание одинаково наследуется, как мальчиками, так и девочками. Ген, связанный с развитием рака молочной железы и рака яичников, расположен не на половых хромосомах, поэтому вероятность носительства мутации не зависит от пола ребенка.
Если мутация в нескольких поколениях передавалась через мужчин, очень сложно проводить анализ родословных, так как мужчины довольно редко болеют РМЖ даже при наличии генного дефекта.
Например: носителями были дедушка и отец пациентки, и у них заболевание не проявилось. На вопрос, были ли случаи онкологических заболеваний в семье, такая пациентка ответит отрицательно. При отсутствии других клинических признаков наследственных опухолей (ранний возраст/множественность опухолей), наследственная составляющая заболевания может быть не учтена.
При обнаружении мутации BRCA1 или BRCA2 всем кровным родственникам рекомендуется также пройти тестирование.
Почему при генетическом исследовании важно учитывать этнические корни?
Для многих этнических групп характерен свой набор частых мутаций. Национальные корни обследуемого необходимо учитывать при выборе глубины исследования.



А.Н. Грицай, О.А. Анурова, А.Л. Арзуманян, Э.Х. Кучмезов, А.И. Василенко,
РОНЦ им. Н.Н Блохина РАМН, Москва
Цели работы – анализ особенностей тактики лечения рака молочной железы и профилактики РМЖ и рака яичников (РЯ) у женщин-носителей мутаций генов BRCA1 и BRCA2.
Частота наследственного РМЖ составляет по различным оценкам от 5 до 15%. Вклад мутаций генов BRCA1 и BRCA2 в общую заболеваемость РМЖ ? менее 2% [1].
Риск развития РМЖ и РЯ по данным Breast Cancer Linkage Consortium

Мутации этих генов обуславливают чрезвычайно высокий риск развития РМЖ и РЯ, нарастающий с возрастом (смотри табл.
Вероятность развития РМЖ и РЯ у носителей мутации BRCA1
Вероятность развития РМЖ и РЯ у носителей мутации BRCA2
Морфологические особенности. Значительно чаще, чем при спорадическом раке, у носителей мутаций BRCA1/2 наблюдаются III степень злокачественности и РЭ– опухоли [4]. Данные, представленные E.Honrado и соавт. [5], являются обобщением результатов исследований, полученных в 9 работах (см. табл. 2–3). Можно отметить, что у носителей мутаций BRCA1 большинство опухолей имеют высокую степень злокачественности, высокую пролиферативную активность клеток, спонтанные некрозы, отсутствие РЭ и РП, отсутствие HER2neu. Опухоли носителей мутаций BRCA2 в основном имеют такие же характеристики, как носителей спорадических опухолей за исключением меньшей частоты гиперэкспрессии HER2neu.
Частота (%) морфологических форм РМЖ у носителей мутаций BRCA1 и BRCA2

Частота (%) экспрессии молекулярных маркёров у носителей мутаций BRCA1 и BRCA2

Клинические особенности. Результаты органосохраняющих операций у носителей мутаций BRCA1/2 являются подтверждением первичной множественности опухолей у этих больных. По данным Haffty B.G. с соавт. при средней длительности прослеженности 12 лет частота вторых РМЖ составила: ипсилатеральных – 49%, контралатеральных – 42% (6).
По данным Л.Н.Любченко и соавт. [4] предоперационная химиотерапия (ХТ) у носителей мутаций BRCA 1/2 значительно эффективнее (у 75 –100% больных получена III–IV степень патоморфоза), чем при спорадическом раке (только в 8% случаев наблюдалась III – IV степень патоморфоза). Эти данные подтверждают P.O.Chappuis и соавт. [9]: после 3-4 курсов антрациклин-содержащей ХТ клинический полный эффект наблюдали у 93% больных РМЖ I-III стадий с мутациями BRCA 1/2 и у 30 % больных без мутаций (р=0,0009); полный морфологический эффект был получен в 44 и в 4% соответственно, р=0,009. При лечении пациентов только III стадии также антрациклин-содержащими режимами не было получено столь выраженного эффекта: полный морфологический регресс получен в 13% при мутациях BRCA1 и ни у одной больной с мутацией BRCA2 [10]. Совершенно исключительную чувствительность опухоли к препаратам платины у носителей мутаций BRCA1 описывают Byrski T. с соавт. [11; 12]. Из 102 больных, получавших предоперационную ХТ, полный морфологический регресс был получен в 24% случаев, в том числе – при лечении по схеме CMF – в 7%, АТ – в 8%, AC или FAC – в 22%, цисплатином – в 83% (у 10 из 12 больных). При ХТ диссеминированного РМЖ антрациклин-содержащими режимами (n = 147) и по схеме CMF (n = 68) по сравнению с больными спорадическим РМЖ, у больных BRCA2-ассоциированным раком чаще наблюдался клинический эффект (89% против 50%; р=0,001), больше были время до прогрессирования и общая выживаемость. У больных BRCA1-ассоциированным раком наблюдалась тенденция к более частому эффекту (66% против 50%; 13) BRCA1-ассоциированный РМЖ и спорадический РМЖ имеют аналогичные показатели безрецидивной и общей выживаемости [14].
По данным Л.Н. Любченко (см. рис. 3), BRCA2-ассоциированный РМЖ имеет статистически значимо более высокие показатели выживаемости по сравнению с BRCA1-ассоциированным РМЖ и спорадическим РМЖ [15].
Выживаемость больных BRCA-ассоциированным и спорадическим РМЖ
Снижение риска развития РМЖ при различных мерах профилактики

Для оценки сальпинго-оофорэктомии как средства профилактики РМЖ и РЯ сошлёмся на результаты мета-анализа, проведённого недавно Rebbeck TR и соавт. [22]. Исследование оперирует данными о тысячах включённых в него женщин с мутациями генов BRCA1 и BRCA2, части из них производилось удаление придатков матки, а части – нет, что позволило оценить значение операции. Итак, сальпинго-оофорэктомия снижает риск развития РМЖ на 53% у носителей мутаций гена BRCA1, такой же эффект, ? 53% получен и у носителей мутаций гена BRCA2.
Эффективность двусторонней профилактической мастэктомии изучалась в двух группах: в группе с высоким риском и в группе с умеренным риском развития РМЖ. Итак, в группе с умеренным риском: ожидалось 37,4 случая РМЖ (расчёт с использованием модели Гейла), наблюдалось 4, снижение риска развития болезни – 89,5%. В группе с высоким риском развития РМЖ 3 случая рака развились у 214 оперированных женщин; из 403 сестёр, не подвергшихся профилактической мастэктомии, рак развился у 156, снижение риска развития болезни – 96%. Кроме того профилактическая мастэктомия сопровождалась снижением смертности от РМЖ не менее чем на 90% [23].
У больных односторонним РМЖ анализирована эффективность контралатеральной профилактической мастэктомии у больных из семей, в которых наблюдался РМЖ и/или РЯ [24]. У 388 больных репродуктивного периода ( 50 лет) ожидалось 50,3 случая РМЖ, наблюдалось 2; снижение риска развития болезни – 96,0%.
Позже у женщин, вошедших в первое сравнение (двусторонняя профилактическая мастэктомия), дополнительно было оценено влияние операции на риск развития РМЖ у носителей мутаций генов BRCA1 и BRCA2. Снижение риска составило 89.5%-100% [25]. Об эффективности двусторонней профилактической мастэктомии, равной 90-100%, сообщают также T.R. Rebbeck с соавт. [26] и S.M.Domchek с соавт. [27].
В наших наблюдениях профилактическая аднексэктомия выполнена 8 женщинам с мутациями BRCA1, в том числе 7 больным РМЖ. При длительности прослеженности 1-8 лет ни в одном случае не наблюдалось развития РЯ. 1 больная умерла от диссеминации РМЖ, остальные живы без рецидива болезни.
Заключение. Выявление мутаций генов BRCA1 и BRCA2 позволяет проводить целенаправленные варианты лечения и профилактики РМЖ в зависимости от индивидуального генотипа. Хирургическое лечение РМЖ может быть направлено на решение одной или двух целей.
Цель № 1 – лечение имеющейся болезни.
Цель № 2 – профилактика развития следующих опухолей.
В зависимости от физической и психологической готовности больной объём операций может колебаться от радикальной резекции до одномоментного выполнения: модифицированной радикальной мастэктомии (на стороне болезни), профилактической мастэктомии (контралатеральной), профилактического удаления придатков матки, двусторонней реконструкции молочных желёз.
Больным РМЖ с мутацией BRCA1 показано проведение химиотерапии, включающей лечение в полных дозах, наиболее эффективный режим пока не определён. Как здоровым женщинам-носителям мутаций генов BRCA1 и BRCA2, так и больным РМЖ оправдано предложение профилактического удаления придатков матки и профилактической мастэктомии. Профилактические операции эффективно защищают женщин от развития РМЖ и РЯ.
Аннотация научной статьи по клинической медицине, автор научной работы — Ходорович Ольга Сергеевна, Снигирева Галина Петровна, Чхиквадзе Владимир Давидович, Оксанчук Елена Александровна, Меских Елена Валерьевна
В статье представлен клинический случай наследственного BRCA-ассоциированного рака молочной железы . Проанализированы трудности постановки диагноза данной формы рака. Представлены этапы диагностики, лечения и профилактики.
Похожие темы научных работ по клинической медицине , автор научной работы — Ходорович Ольга Сергеевна, Снигирева Галина Петровна, Чхиквадзе Владимир Давидович, Оксанчук Елена Александровна, Меских Елена Валерьевна
BRCA-Associated Breast Cancer.Case Report
The article discusses a clinical case of hereditary BRCA-associated breast cancer . The difficulties of diagnosis of this form of cancer have been analyzed. The methods of diagnosis, treatment and prevention were presented.
Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
BRCA-ассоциированный рак молочной железы. Случай из практики
О.С.Ходорович, Г.П.Снигирева, В.Д.Чхиквадзе, Е.А.Оксанчук, Е.В.Меских,
Е.И.Новикова Российский научный центр рентгенорадиологии Минздрава РФ, Москва
В статье представлен клинический случай наследственного ВИСА-ассоциированного рака молочной железы. Проанализированы трудности постановки диагноза данной формы рака. Представлены этапы диагностики, лечения и профилактики.
Ключевые слова: мутации генов ВИСА1/2, наследственный рак молочной железы, ВИСА-ассо-циированный рак молочной железы, наследственная предрасположенность, профилактическая ма-стэктомия.
BRCA-Associated Breast Cancer.
O.S.Khodorovich, G.P.Snigireva , V.D.Chkhikvadze, E.A.Oksanchuk, E.V.Meskhikh,
E.I.Novikova Russian Scientific Center of Roentgenoradiology Ministry of Health of the Russian Federation, Moscow
The article discusses a clinical case of hereditary BRCA-associated breast cancer. The difficulties of diagnosis of this form of cancer have been analyzed. The methods of diagnosis, treatment and prevention were presented.
Keywords: gene mutations BRCA1/2, hereditary breast cancer, BRCA-associated breast cancer, genetic predisposition, prophylactic mastectomy.
Рак молочной железы (РМЖ) - самое распространенное онкологическое заболевание у женщин; в РФ на его долю приходится 20,9% от общего числа впервые выявленных случаев злокачественных опухолей и 17% смертей от них [1]. В общей популяции доля наследственного рака молочной железы составляет 5-10%, из них на ВИСА-ассоциированный РМЖ приходится до 80% [2, 3].
Вероятность развития рака молочной железы у женщин с патологическим генотипом в течение жизни очень высока. У женщин - носителей мутации одного из аллелей гена ВИСА1 риск развития рака молочной железы составляет около 75%, повышаясь с возрастом до 85-90%. При терминальных мутациях гена ВИСА2 риск развития опухолей молочной железы составляет 55-87,5% [2, 5].
Риск развития рака в контралатеральной молочной железе у носителей мутаций гена ВИСА1 к
70 годам достигает 83%, у женщин с мутациями гена BRCA2 этот показатель ниже и равен 62%. Вероятность развития рака в контралатеральной молочной железе возрастает при снижении возраста женщины на момент манифестации первой опухоли. Кроме того, женщины-носители BRCAl/2-мутации имеют повышенный риск развития рака яичников (РЯ) [5]. Наследственная форма РМЖ имеет следующие особенности, отличающие ее от спорадической формы: более молодой возраст манифестации заболевания (41-44 года), высокий риск развития рака контралатеральной молочной железы (до 47,4%), особая гистологическая картина - до 80% случаев эта форма рака представлена трижды (ER-, PR, HER2/neu) негативным раком с высоким про-лиферативным индексом и III степенью злокачественности.
На сегодняшний день наиболее значимыми методами профилактики развития наследственных форм РМЖ и РЯ являются динамическое наблюдение и хирургическая профилактика. Динамическое наблюдение, в сравнении со стандартным скринингом спорадического РМЖ, имеет более жесткие временные интервалы: начинается с 25-летнего возраста и включает: клинический осмотр, ультразвуковое исследование молочных желез и органов малого таза каждые 6 мес, а начиная с 30-летнего возраста -чередование маммографии и магнитно-резонансной томографии (МРТ) 1 раз в год [9].
Наиболее эффективной стратегией по сокращению риска развития BRCAl/2-ассоциированного РМЖ является двусторонняя профилактическая мастэктомия (ПМЭ), которая включена во многие зарубежные клинические рекомендации. Для больных с BRCA-ассоциированным РМЖ, рекомендовано выполнение профилактической контрлатеральной мастэктомии (кПМЭ) 6. Данный вид хирургического вмешательства разрешен на территории РФ.
В нашем центре накоплен большой опыт в диагностике, лечению и профилактике данной формы рака молочной железы. Приводим собственное наблюдение.
Пациентка А, 1986 года рождения, обратилась в ФГБУ РНЦРР для профилактического обследования в связи с отягощенной наследственностью. Из анамнеза установлено, что у матери и шести родных сестер матери - РМЖ.
При клиническом осмотре: молочные железы обычной формы, кожа над ними не изменена, сос-ково-ареолярные комплексы без особенностей. При пальпации на границе верхних квадрантов правой молочной железы нечетко определяется уплотнение до 1,5 см. Других узловых образований в молочных железах не определяется. Подмышечные и надключичные лимфатические узлы не увеличены.
При обследовании на маммограммах обеих молочных желез выявлена картина диффузной фиб-розно-кистозной мастопатии с развитым железистым компонентом. На этом фоне узловых образований не выявлено, справа на границе верхних квадратов определяется участок скопления микрокаль-цинатов размерами 6,3x5,4 мм (рис. 1, 2).
При ультразвуковом исследовании молочных желез справа на границе верхних квадрантов определяется участок сниженной эхогенности, с нечеткими контурами размерами 9,9 7,3 мм с включениями кальция. Была выполнена биопсия системой пистолет игла под УЗ контролем. Гистологическое заключение: инфильтративный протоковый рак молочной железы 2 степени злокачественности.
Рис. 1. Маммограммы правой молочной железы. Прямая (А) и боковая проекции (Б). Стрелками указан участок скопления микрокальцинатов
Рис. 3. Вид операционного поля. Установка тканевого расширителя, укрытого порцией большой грудной мышцей и латеральным краем зубчатой мышцей
При иммуногистохимическом исследовании: реакция с антителами к рецепторам эстрогена - отрицательная - 0% ядер опухолевых клеток (0 баллов (TS) Allred score), реакция с антителами к рецепторам прогестерона - отрицательная - 0% ядер опухолевых клеток (0 баллов (TS) Allred score), реакция с антителами к онкобелку cerb-B2 - 0, реакция с антителами к Ki-67 положительна в 40% ядер опухолевых клеток.
Пациентке было проведено молекулярно-генети-ческое исследование, включающее определение наиболее часто встречающихся мутаций в генах BRCA1/2 (BRCA1 - 5382insC, 185delAG, 4153decJA, 300T>G, 2080delA, 3819del5, 3875 del 4; BRCA2 -617delT), и СНЕК2 (1100delC, IVS2+1G>A, 470T>C(ile157Thr) методом ПЦР в реальном времени после выделения ДНК из периферической крови.
В результате обследования у пациентки не было выявлено данных генетических вариантов. Однако клинические признаки наследственного заболевания у пациентки (отягощенный семейный анамнез, биологический тип опухоли и ранний возраст манифестации заболевания) дали основание для проведения более расширенного анализа для поиска гер-минальных мутаций. С согласия пациентки было выполнено молекулярно-генетическое исследование методом массового параллельного секвенирова-ния (NGS) с использованием панели TruSight Cancer (Illumina), позволяющее оценить генетические варианты в 94 генах, ассоциированных с развитием наследственных форм онкологического заболевания.
В результате обследования были обнаружены редкие клинически значимые мутации в кодирующей части генов BRCA1 (делеция со сдвигом рамки считывания c.4165_4166delAG (HGVSc)) и ERCC3 (нонсенс-мутация c.1100C>G (HGVSc)), которые ассоциированы с высоким риском развития рака молочной железы, и позволили подтвердить наследственный характер заболевания.
С учетом полученных данных была проведена консультация врачом-генетиком, который дал рекомендации по обследованию пациентки (УЗИ и МРТ молочных желез, УЗИ органов малого таза не реже 1-2 раза в год, противопоказания к проведению маммографии, вследствие повышенной чувствительности к ионизирующей радиации), а также проведению генетического анализа (поиск аналогичных мутаций) здоровым родственникам 1-2 степени родства. Вопрос о профилактической аднек-сэктомии и ПМЭ рекомендовано обсуждать с врачом-онкологом.
В Центре проведено комплексное обследование по органам (УЗИ брюшной полости, почек, над-, подключичных, подмышечных и парастернальных л/узлов; R-графия органов грудной клетки; гинекологическое обследование, включая УЗИ органов малого таза; остеосцинтиграфии). Признаков регионарного и отдаленного метастазирования не выявлено.
История болезни пациентки обсуждена на общеклинической конференции Центра. Учитывая раннюю стадию заболевания, молодой возраст пациент-
Заболеваемость
Частота наследственной предрасположенности к раку молочной железы составляет около 25% всех случаев рака молочной железы. Приблизительно 5-10% случаев рака молочной железы и яичников вызваны мутациями генов BRCA1, BRCA2, CHEK2, TP53 и PTEN. Гены BRCA1 и BRCA2 высоко чувствительны при раке молочной железы, в то время как мутации в CHEK2, ATM, BRIP1 и PALB2 характерны для промежуточного риска возникновения рака молочной железы. Объединенные исследования идентифицировали другие общие варианты, связанные с низким риском возникновения рака молочной железы. Тем не менее, более 70% генетической предрасположенности к раку молочной железы остаются необъяснимыми.
Распространенность носителей мутации гена BRCA, в общем, по популяции составляет от 1/800 до 1/1000. Это обуславливает повышение риска развития рака молочной железы на 15%-20%. Распространенность мутаций генов BRCA1 или BRCA2 значительно различается у этнических групп в географических регионах. Специфические мутации и рецидивы мутаций в зависимости от популяции были описаны в Исландии, Нидерландах, Швеции, Норвегии, Германии, Франции, Испании, Канаде, странах Центральной и Восточной Европы и среди потомков евреев, выходцев из Германии.
Частота мутаций BRCA1 и BRCA2 у больных раком молочной железы и яичников, изначально не дифференцированных по признаку наследственности либо возраста, в общей массе мала: 25 лет, после получения генетической консультации и информированного согласия. Пациентов с выявленными генетическими мутациями следует поддерживать в вопросах получения генетической консультации для близких членов семьи.
Снижение рисков: нехирургические превентивные меры
Наблюдение
Наблюдение с точки зрения возникновения рака груди у носителей BRCA включает ежемесячные самопроверки, клиническое обследование груди раз или два в год, а также раз в год маммографию и магнитно-резонансную томографию (МРТ) молочной железы, начиная с 25-30 лет [IIa, B]. Пока еще нет доступных данных, чтобы определить, что более эффективно в молодом возрасте – поочередно маммография и МРТ каждые 6 месяцев либо оба обследования раз в год, учитывая высокую степень появления рака в промежутках между обследованиями.
Профилактическая химиотерапия
Адъювантный тамоксифен сокращает риск контралатерального рака груди у носителей мутаций гена BRCA [III, B], тогда как преимущества тамоксифена для предотвращения первичного рака молочной железы не были доказаны [Ib, A].
Снижение рисков: профилактические хирургические методы
Профилактическая двусторонняя мастэктомия — наиболее эффективная из известных на сегодня стратегий по сокращению риска развития рака груди у носителей мутации гена [III, B], хотя не отмечены преимущества в выживании, и многие женщины не считают эту стратегию приемлемой по косметическим соображениям. Контралатеральная профилактическая мастэктомия — вариант к рассмотрению для носителей мутации BRCA с раком груди в раннем возрасте и односторонней мастэктомией [IV, C].
Типы профилактической мастэктомии могут быть от тотальной мастэктомии до кожесохраняющей и сосковосохраняющей мастэктомии. Различные варианты реконструкции молочной железы должны быть обсуждены с пациентом и включая преимущество и риски для каждого.
На сегодняшний день недостаточно доказательств для рутинного выполнения биопсии сторожевого лимфатического узла у пациентов, подвергшихся профилактической мастэктомии.
Профилактическая двусторонняя сальпингоовариэктомия
Операция связана со снижением риска рака молочной железы у носителей мутации гена BRCA в пременопаузе, риска снижения рецидива ипсилатерального рака молочной железы после органосохранной операции и лучевой терапии, риска снижения рака яичников и гинекологических опухолей, а также имеются доказательства снижения общей смертности.[III, B]. Двусторонняя сальпингоовариэктомия рекомендована после 35 лет и в тех случаях, когда беременность больше не планируется [IV, C].
Кратковременная гормонозаместительная терапия после двусторонней сальпингоовариэктомии, по-видимому, не снижает общих преимуществ данной стратегии для уменьшения риска заболевания раком молочной железы [III, B].
Модификаторы риска
Риск BRCA-ассоциированного рака молочной железы может быть изменен внешними факторами. Гормональные и репродуктивные факторы, такие как беременность (количество беременностей и возраст в первую беременность), грудное вскармливание и оральные противозачаточные средства связаны с риском модификации у носителей мутации BRCA. Количество родов в анамнезе, кажется, снижает риск развития рака молочной железы у женщин с мутациями BRCA в общей популяции. [III, B].
Органосохранная операция и лучевая терапия у носителей BRCA мутаций, которые подверглись профилактической овариэктомии, ассоциирована с подобной формой развития рецидивного рака молочной железы по сравнению с контролем в течение 10 лет. Риск развития контралатерального рака молочной железы у носителей BRCA выше по сравнению со спорадическим контролем, независимо от гормонального вмешательства.
Решение о хирургическом лечении рака молочной железы у носителей мутации BRCA должно основываться на тех же параметрах, как и при спорадических случаях диагностики рака, при этом принимая во внимание более высокую степень риска двустороннего рака молочной железы, и ипсилатерального рецидива если за органосохранным оперативным лечением следует лучевая терапия без выполнения овариэктомии [III, B].
Системное лечение
Согласно последним данным, общий прогноз рака молочной железы у носителей BRCA мутаций такой же, как и при спорадическом раке молочной железы, а отсутствие мутации BRCA1/2, считается прогнозирующим фактором химиочувствительности опухоли [III, B].
Продолжается II фаза рандомизированного клинического исследования по изучению чувствительности к платино-содержащей химиотерапии при BRCA ассоциированных метастатических опухолях по сравнению с таксан-содержащими режимами.
Ингибиторы PARP используются как единственные терапевтические агенты для пациентов с BRCA ассоциированным раком молочной железы и яичников. Эти препараты ингибируют путь репарации однонитевого разрыва ДНК и приводят к апоптозу в BRCA дефицитных опухолевых клетках, которые уже имеют дефицит в гомологичной рекомбинантной репарации. Некоторые клинические исследования II фазы изучают недостаток специфической репарации ДНК в BRCA ассоциированных опухолях с использованием ингибиторов PARP при метастатическом процессе.
Два клинических исследования II фазы с применением орального ингибитора PARP — олапариба при местно распространенном раке молочной железы и раке яичников с BRCA мутацией недавно показали поддерживающий клинический эффект при применении 400мг препарата непрерывно (процент ответивших: 41% и 33%, и безрецидивная выживаемость составила 5.7 и 5.8 месяцев, соответственно).
До сих пор не имеется окончательных выводов о лучших режимах химиотерапии для пациентов с BRCA ассоциированным раком молочной железы [III, B]. В настоящее время при выборе адъювантного лечения для больных раком молочной железы с наличием BRCA мутации должны использоваться стандартные прогностические факторы.
Читайте также:

