Braf мутация при раке легких
Мутации гена BRAF у пациентов с немелкоклеточным раком легкого
При отсутствии активирующих мутаций EGFR следующим этапом целесообразно тестирование на определение мутации гена BRAF V600.
Среди пациентов с НМРЛ примерно у 30% наблюдаются мутации, в отношении которых может быть применена различная таргетная терапия 1. Ежегодно примерно у 36 тысяч человек во всем мире, или у 1-3% пациентов с диагнозом рак легкого, в основном – при аденокарциноме, выявляется BRAF V600 положительный НМРЛ [5,6]. Пациентам с раком легкого рекомендуется проводить тестирование на биомаркеры, чтобы подобрать подходящую таргетную терапию [7]. Гистологические характеристики НМРЛ при мутации BRAF V600E позволяют предполагать высокую агрессивность опухоли [8]. При BRAF V600E мутантном НМРЛ результаты химиотерапии на основе препаратов платины менее благоприятны [7,9].
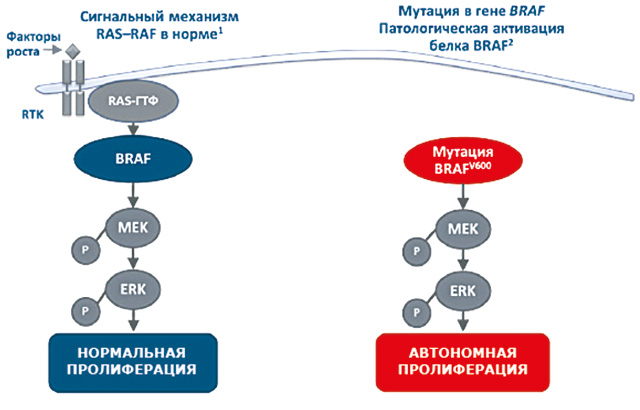
Сигнальный путь RAS/RAF/MEK/ERK вовлечен в развитие немелкоклеточного рака легкого (НМРЛ) и меланомы, а также в другие виды злокачественных новообразований. Мутации BRAF вызывают конститутивную активацию данного сигнального пути [10].
Эффективность BRAF/MEK ингибиоторов для лечения взрослых пациентов с распространенным НМРЛ с мутацией гена BRAF V600
Пациентам с раком легкого рекомендуется проводить тестирование на биомаркеры, чтобы подобрать подходящую таргетную терапию.
Дабрафениб и траметиниб являются таргетными препаратами, подавляющими активность различных представителей семейства серин-треониновых киназ, а именно BRAF и MEK1/2 в сигнальном пути RAS/RAF/MEK/ERK. Данный сигнальный путь вовлечен в развитие немелкоклеточного рака легкого (НМРЛ) и меланомы, а также в другие виды злокачественных новообразований. Комбинация препаратов дабрафениб и траметиниб сильнее замедляет рост опухоли, чем монотерапия.
Применение комбинации препаратов дабрафениб и траметиниб у пациентов с распространенным НМРЛ с мутацией в гене BRAF V600 основано на безопасности и эффективности дабрафениба в сочетании с траметинибом согласно результатам многоцентрового нерандомизированного открытого исследования II фазы в трех когортах, в котором участвовали пациенты с НМРЛ IV стадии с мутацией BRAF V600 (36 пациентов, ранее не получавшие химиотерапию, и 57 пациентов, ранее получавшие химиотерапию). Согласно оценке частоты объективного ответа (ЧОО), первичной конечной точки исследования, у 36 пациентов, ранее не получавших химиотерапию и принимавших 150 мг дабрафениба 2 раза в сутки и 2 мг траметиниб 1 раз в сутки, ЧОО составила 61,1% (95% ДИ: 43,5-76,9%) [13]. У 68% пациентов в данной группе не наблюдалось прогрессирование заболевания спустя 9 месяцев. Медианы длительности ответа (ДО) и выживаемости без прогрессирования (ВБП) в группе пациентов, ранее не получавших химиотерапию, на момент одобрения еще не были достигнуты [13]. В группе пациентов, ранее получавших химиотерапию и принимавших данные препараты в той же дозировке, ЧОО составила 66,7% (95% ДИ: 52,9-78,6%) [13]. Ответ характеризовался устойчивостью, медиана ДО составила 9,0 месяца (95% ДИ: 6,9-16,0), медиана ВПБ – 9,7 месяца (95% ДИ: 6,9-19,6) [13].
К наиболее распространенным нежелательным явлениям (частота возникновения более 20%) относились лихорадка, тошнота, рвота, периферический отек, диарея, сухость кожи, потеря аппетита, астения, озноб, кашель, усталость, сыпь и диспноэ [13].
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.

Мутация EGFR
Эта мутация встречается преимущественно у некурящих людей. Обнаружение такой мутации на поздних стадиях рака представляет собой обнадеживающий признак, поскольку предполагает восприимчивость к лечению ингибиторами тирозинкиназы (препараты эрлотиниб и гефитиниб).
Транслокации ALK
По данным исследований, эта мутация при раке легкого более характерна у молодых и некурящих пациентов. Её обнаружение говорит о чувствительности к кризотинибу.
Мутация KRAS
Обычно данная мутация при лаке легкого встречается у курильщиков. Особой роли для прогноза не играет. При анализе статистических данных указано – встречались и случаи ухудшения состояния, и улучшения, что не позволяет сделать однозначный вывод о её влиянии.
Транслокация ROS1
Эта мутация, подобно транслокации ALK, преимущественно встречается у молодых, некурящих пациентов. В ходе клинических испытаний установлена высокая чувствительность таких опухолей к лечению кризотинибом, сейчас ведутся исследования препаратов нового поколения.
Мутация HER2
Обычно изменения представлены точечными мутациями. Опухолевые клетки в своей жизнедеятельности не зависят критическим образом от этой мутации, однако по результатам новых испытаний выявлен частичный положительный эффект у пациентов с комбинированным лечением посредством трастузумаба и цитостатических средств.
Мутация BRAF
Некоторые больные с мутациями этого гена (вариант V600E) поддаются лечению дабрафенибом, ингибитора белка B-RAF, кодируемого геном BRAF.
Мутация МЕТ
Ген МЕТ кодирует тирозинкиназный рецептор фактора роста гепатоцитов. Встречается увеличение числа копий этого гена (амплификация), при этом сам ген редко подвергается мутациям, и их роль изучена недостаточно.
Амплификация FGFR1
С данной амплификацией сталкиваются 13-26% пациентов с плоскоклеточным раком легких. Обычно распространена среди курящих пациентов, на практике предполагает неблагоприятный прогноз. Однако ведется соответствующая работа по разработке препаратов, направленных на это нарушение.
Основные принципы диагностики мутаций рака легкого
Чтобы точно диагностировать рак легких, предусмотрена бронхоскопия с забором биоптата для проведения цитологического и гистологического исследований. После того как из лаборатории поступит заключение о наличии мутации и выявленном типе мутации, будет составляться подходящая тактика медикаментозного лечения, назначаются соответствующие биологические препараты.
Биологическая терапия при злокачественных опухолях легких
Каждая программа терапии индивидуальна. Биологическая терапия предполагает работу с двумя типами лекарств, которые различаются по принципу воздействия на опухоль, но направлены на одинаковый окончательный эффект. Их цель – блокирование мутации клеток на молекулярном уровне, без вредного последствия для здоровых клеток.
За счет стабильного целевого действия исключительно на клетки опухоли удается приостановить рост злокачественных клеток уже спустя несколько недель. Чтобы поддержать достигнутый эффект, требуется продолжение курса приема препаратов. Лечение с помощью препаратов практически не сопровождается побочными эффектами. Но постепенно возникает невосприимчивость клеток к действующим компонентам лекарств, поэтому нужно корректировать лечение по мере необходимости.
Различия в лечении мутаций рака легкого
На долю мутации гена EFGR приходятся порядка 15% всех случаев. В таком случае для лечения может использоваться один из ингибиторов EGFR: эрлотиниб (Тарцева) или гефитиниб (Иресса); созданы и более активные препараты нового поколения. Данные лекарства обычно не вызывают тяжелых побочных эффектов, выпущены в форме капсул либо таблеток.
Транслокация генов ALK/EML4, на долю которой приходятся 4-7% всех случаев, предполагает назначение кризотиниба (Ксалкори); разрабатываются его более активные аналоги.
При опухолевом ангиогенезе для его подавления предполагается терапия с препаратом бевацизумаб (Авастин). Назначается препарат вместе с химиотерапией, значительно повышая эффективность данного лечения.
Каждая клетка организма подчиняется определенным законом и выполняет отведенные ей функции. Работа клеток программируется генетическим кодом, молекулы и белки регулируют жизнь клеток, обеспечивая бесперебойное функционирование организма. Однако в любом механизме могут происходить поломки, и наши гены – не исключение. Сегодня мы расскажем о мутациях в генах EGFR и BRAF. Тестирование на эти мутации помогает онкологам назначать эффективное лечение пациентам со злокачественными новообразованиями.
Биологические функции гена EGFR?
Таким образом стало понятно, что именно мутированный белок EGFR является мишенью препарата, и что перед назначением молекулярных ингибиторов EGFR должно проводиться молекулярно-генетическое тестирование. Существует несколько вариантов мутаций EGFR, две из них встречаются наиболее часто – Del19 и L858R. Они встречаются в 15-20% немелкоклеточных неплоскоклеточных опухолей легкого, наиболее часто – в аденокарциномах.
В каких случаях нужно сделать тест на мутацию EGFR?
Тест на мутации в гене EGFR позволяет онкологу принять решение о назначении пациенту с местно-распространенным или метастатическим немелкоклеточным раком легкого терапии низкомолекулярными ингибиторами EGFR (гефитиниб, эрлотиниб, афатиниб, осимертиниб и т.д.). Тест целесообразно назначать только тем пациентам, у которых обнаружена аденокарцинома лёгкого или другая разновидность немелкоклеточного неплоскоклеточного рака. Помимо этого, EGFR-тестирование рекомендуется всем пациентам с местно-распространенным или метастатическим, плоскоклеточным раком лёгкого, которые либо являются женщинами, либо не имеют анамнеза длительного и/или интенсивного курения.
Что делать, если в опухоли лёгкого обнаружена мутация в гене EGFR?
Идентификация мутации в гене EGFR в опухоли является основанием для назначения низкомолекулярных ингибиторов EGFR (гефитиниб, эрлотиниб, афатиниб, осимертиниб). Положительный эффект от лечения наблюдается практически у каждого пациента с мутацией EGFR.
Биологические функции гена BRAF
Процесс деления клеток в норме происходит при поступлении верного сигнала в клеточное ядро. Подобным сигналом являются специальные белки – факторы роста. Они прикрепляются к определённым рецепторам на поверхности клеточной оболочки и запускают внутри клетки ряд последовательных биохимических реакций. Результатом становится производство и накопление внутри клетки белков, которые необходимы для дальнейшего деления.
Наиболее частый тип мутации – это замена 600-ой по счету аминокислоты валин (V) в структуре белка на глутаминовую кислоту (E) (BRAF V600E).
Мутации BRAF встречаются при самых разных типах рака, чаще всего – при меланоме (40-60%), реже – при раке толстой кишки (5-10%), немелкоклеточном раке легкого (2-3%) и др. Помимо этого, генетические дефекты BRAF характерны для редкого онкогематологического заболевания – волосатоклеточного лейкоза (90-100%).
Открытие мутаций гена BRAF привело к созданию низкомолекулярных ингибиторов мутированного фермента BRAF (вемурафениб, дабрафениб). Эти препараты блокируют сигнальную цепочку, которую активирует мутация BRAF, и таким образом держивают рост опухоли.
В каких случаях нужно сделать тест на мутацию V600 BRAF?
Тестирование мутаций в гене BRAF необходимо для выбора тактики лечения при неоперабельной/метастатической меланоме кожи, распространенном немелкоклеточным раке легкого и раке толстой кишки. Присутствие мутации является необходимым условием для назначения ингибиторов BRAF (вемурафениб, дабрафениб). При раке толстой кишки наличие мутации BRAF свидетельствует о необходимости использования комбинации BRAF- и EGFR-ингибиторов.
Как сдать анализ на мутации в гене EGFR и BRAF?
Материалом для молекулярно-генетического тестирования являются опухолевые клетки. В качестве источника опухолевых клеток можно использовать как биопсийный материал, так и опухоль, удалённую в ходе хирургической операции.
В ходе первичного обследования онкологическому пациенту практически всегда выполняют биопсию, на основании которой происходит патоморфологическое подтверждение диагноза. Для этого каждый биоптат проходит многоэтапную химическую обработку, в результате которой создаётся специальный парафиновый блок. С одной стороны, это необходимо для получения качественного тонкого среза (толщиной 5 мкм) с целью патоморфологической диагностики. С другой стороны, в правильно подготовленном парафиновом блоке молекулы ДНК надёжно сохраняются на протяжении десятилетий. Эти же процедуры выполняются в отношение опухолевых тканей, удалённых в ходе операции. Правильное выполнение процедуры фиксации позволяет использовать образцы опухолей для молекулярно-генетического исследования ДНК спустя месяцы и годы после заливки образца в парафин.
Идеальным набором для молекулярно-генетического исследования является следующий комплект: парафиновый блок c тканью опухоли и одно стекло, окрашенное гематоксилином и эозином (всё перечисленное хранится в патологоанатомических архивах медицинских учреждений, а окраска гематоксилином и эозином – основная окраска, используемая в современной патоморфологической диагностике). Если медицинское учреждение по какой-либо причине не может предоставить блоки, то для молекулярно-генетического тестирования достаточно 5-10 неокрашенных срезов ткани опухоли на непокрытых стёклах толщиной 3-5 мкм и одно стекло, окрашенное гематоксилином и эозином.
Кроме того, для молекулярно-генетического исследования пригодны опухолевые клетки, полученные в результате цитологического исследования (мазки, цитоспины, цитоблоки). Для проведения теста необходимо, чтобы в препарате присутствовало не менее 200 (!) опухолевых клеток. Тип окрашивания (по Папаниколау, Романовского-Гимза, Лейшмана, Май-Грюнвальд и т.д.) не влияет на сохранность нуклеиновых кислот.
Требования к упаковке материала перед транспортировкой
- Закрывающийся пластиковый пакет или контейнер, либо картонная коробка
- Полное соответствие номеров отправляемых блоков и стёкол в направлении на тест и копии патоморфологического заключения.
- Лабораторные стекла должны быть обёрнуты плотной бумагой для избежания повреждений.
- Хранение производится при комнатной температуре, не допустим нагрев блоков и стёкол выше +50 о С.
В настоящее время многие молекулярно-диагностические исследования выполняются за счет средств территориальных фондов ОМС регионов России


Основной характеристикой рака является неконтролируемое деление злокачественных клеток. Рак может развиться почти в любом органе, но наиболее распространенными являются рак молочной железы, легких, толстого кишечника и предстательной железы. Однако у пациентов с одним и тем же диагнозом болезнь может протекать по-разному.
Сегодня ученые уже знают, что различия в течение заболевания опухолей одного вида во многом зависит от генетических характеристик опухоли. Например, известно, что при раке легких злокачественные клетки могут иметь различные генетические мутации, и современная медицина уже способна подобрать индивидуальные виды лечения.
Персонализированная медицина при лечении рака основывается на генетических характеристиках опухоли, главным образом на генетических мутациях. По результатам тестирования, пациентам подбирается индивидуальное лечение, причем зачастую оказывается, что наиболее подходящим будет препарат, который применяется сегодня для лечения другого типа рака. Такое возможно потому, что в некоторых случаях разные виды рака могут иметь одну и ту же генетическую мутацию.
На сегодня известно несколько основных генных мутаций при злокачественном поражении лёгких:
- Мутации в группе генов EGFR встречаются у 15 % больных с немелкоклеточным раком легких, как правило, среди некурящих людей. В группу EGFR входит также ген HER2, мутация которого встречается у 1-2 % пациентов с НМРЛ и обычно имеет характер точечных мутаций.
- Мутации гена KRAS встречаются у 20-25 % пациентов с немелкоклеточной аденокарциномой, обычно имеющих никотиновую зависимость.
- Мутации в гене NRAS встречается у 1 % пациентов с немелкоклеточным раком легких. Следует отметить, что гены NRAS и KRAS относятся к одному суперсемейству RAS.
- Амплификация в генах группы FGFR, особенно гена FGFR1, выявляется у 13-25 % больных, страдающих плоскоклеточным раком легких, как правило, среди курящих людей.
- Транслокации с участком гена ALK встречаются в 4 % случаев среди молодых некурящих мужчин, страдающих немелкоклеточной аденокарциномой.
- Транслокации между генами ROS1 и CD74, FIG или SLC24A2 встречаются у 1-2 % молодых пациентов с немелкоклеточным раком легких.
- Мутации в BRAF вовлечены в развитие НМРЛ, чаще всего встречается мутации гена V600E.
Традиционные методы лечения рака, такие как химиотерапия и лучевая терапия, уничтожают все быстро делящиеся клетки организма, что приводит к тяжелым побочным эффектам.

В результате биологического лечения, у большинства пациентов увеличивается продолжительность жизни и значительно улучшается ее качество, по сравнению с аналогичными показателями у пациентов, получающих традиционное лечение. Некоторые генетические анализы и биологические препараты при раке легких уже включены в Израиле в корзину лекарств больничных касс. Пациенты из-за рубежа могут пройти генетические тесты и приобрести необходимые препараты в рамках частной медицины.
Израильские учёные постоянно ищут новые, более эффективные таргетные лекарства. На сегодня в Израиле применяются следующие биологические препараты для лечения рака легких:
Прогресс в науке и медицине способствует развитию новых технологий и дает врачам все больше возможностей для лечения рака в Израиле. В мире действуют тысячи лабораторий, которые открывают новые механизмы развития опухолей и разрабатывают эффективные препараты. Нередки случаи, когда еще несколько лет назад считающиеся безнадежными пациенты получают лечение, которое позволяет значительно продлить им жизнь. Список таких препаратов постоянно пополняется, что внушает оптимизм врачам и пациентам.
Немелкоклеточный рак легкого (НМРЛ)
- плоскоклеточный рак (40% больных)
- аденокарцинома (40–50% больных)
- крупноклеточный рак (5–10% больных)
Мелкоклеточный рак легкого (МРЛ)
- МРЛ (15-20% больных)
Таргетная терапия является основой лечения пациентов с НМРЛ. Интенсивное исследование точных молекулярных механизмов рака легких выявило возможность не только избирательно влиять на патологический молекулярный каскад в опухолевой клетке при помощи таргетных препаратов, но также определять эффективность / побочные эффекты классической химиотерапии и давать прогноз развития заболевания и метастатического потенциала опухоли.
Возможность исследования свободноциркулирующей опухолевой ДНК ( технология жидкостной биопсии ) открывает новые горизонты в диагностике, мониторинге и лечении рака легкого.
В последнее время генетическое тестирование позволило выделить подтипы рака легкого с наличием активирующих мутаций в ряде онкогенов. Наибольшее значение имеют мутации в генах EGFR, BRAF, MET и транслокации с участием генов ALK и RET. Нарушения в этих генах являются мишенями для таргетной терапии.
В отличие от химиотерапии, которая убивает любые клетки, включая здоровые, таргетная терапия действует на раковые клетки специфическим образом, точечно на конкретную мишень. Таргетная терапия обладает гораздо меньшим спектром побочных эффектов в сравнении со стандартной химиотерапией.
Клиническое значение исследуемых
генов и возможности таргетной
терапии

Представляем тесты для анализа мутаций, связанных с эффективностю таргетных препаратов
Преимущества метода NGS по сравнению
другими методами для поиска соматических
мутаций в опухоли
| ХАРАКТЕРИСТИКА | NGS | ПЦР | СЕКВЕНИРОВАНИЕ ПО СЭНГЕРУ |
|---|---|---|---|
| Чувствительность (доля мутантного аллеля в образце) | 0.1% | 1% | 15-20% |
| Возможность определения точных координат мутации | + | - | + |
| Возможность исследования ранее не описанных мутации | + | - | + |
| Возможность исследования соматических мутаций в плазме | + | + | - |
Панели генов
Панели генов позволяют определить наличие мутаций сразу в нескольких генах, что дает возможность сразу подобрать оптимальное лечение и делают исследование экономически эффективным
Панель для рака легкого базовая
Базовая панель позволяет подобрать лечение таргетными препаратами за короткое время.
Гены входящий в панель: EGFR, BRAF, KRAS, NRAS

- Частота мутаций в гене EGFR при аденокарциноме легкого составляет 25%.
- Мутация L858R и делеции 19 экзона гена EGFR ассоциированы с наибольшим ответом на лечение ингибиторами тирозинкиназ: гефитинибом, эрлотинибом и афатинибом.
- Мутации в гене BRAF встречаются в 4% случаев немелкоклеточного рака легкого.
- Обнаружение мутации в гене позволяет назначить препараты ингибиторы BRAF: вемурафениб и траметиниб.
Мутации в генах KRAS и NRAS обнаруживаются почти у 30% пациентов с немелкоклеточным раком легкого. Наибольшая частота драйверных мутаций обнаруживается в гене KRAS. Мутации в генах KRAS и NRAS чаще всего взаимоисключающие с мутациями в гене EGFR и транслокациями гена ALK.
Базовая панель для рака легкого предоставляет почти половине пациентов с немелкоклеточным раком легкого важную информацию, определяющую дальнейшую тактику диагностики и лечения.
Обнаружение мутаций в генах EGFR и BRAF позволяет назначить пациенту таргетную терапию. В то же время наличие мутации в генах KRAS и NRAS избавляет пациента от дальнейшего поиска транслокаций с участием гена ALK.
Базовая панель выполняется с помощью секвенирования нового поколения (NGS), что позволяет одномоментно диагностировать несколько сотен мутаций по низкой цене.
Стоимость исследования 4 генов методом NGS соответствует стоимости исследования одного гена методом ПЦР, а в ряде случаев даже дешевле.
Вместе с базовой панелью возможно выполнение
исследования на транслокации гена ALK
Исследование транслокаций с участием ген ALK выполняется методом
флуоресцентной гибридизации in situ или FISH методом
- Транслокации с участием гена ALK встречается в 4% случаев НМРЛ. Обнаружение транслокации с участием гена ALK позволяет назначить таргетные препараты, ингибиторы тирозинкиназы ALK кризотиниб, церитиниб.
Панель для рака легкого базовая
Панель для рака легкого базовая
+ транслокации ALK

Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению – сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента – не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют молекулярно-генетическое тестирование – определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается молекулярно-генетическое тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все – мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
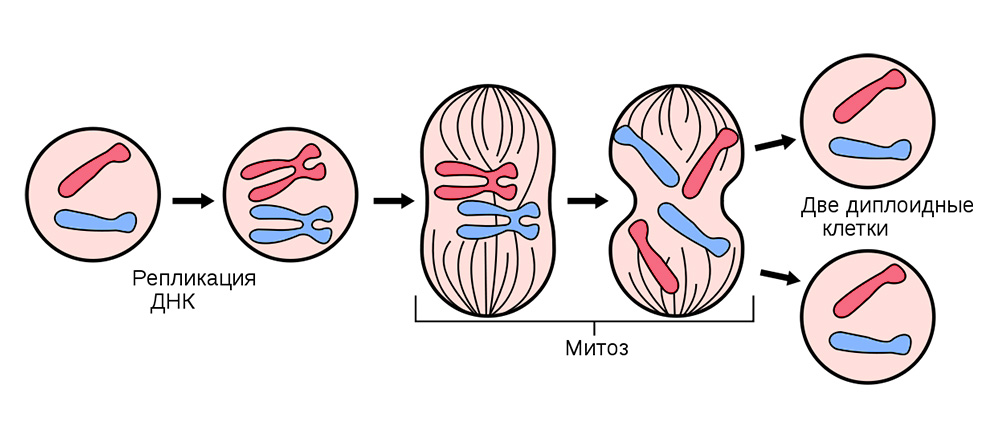
Деление соматических клеток происходит во всех органах и тканях
Иногда в процессе деления получаются сбои – мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида.
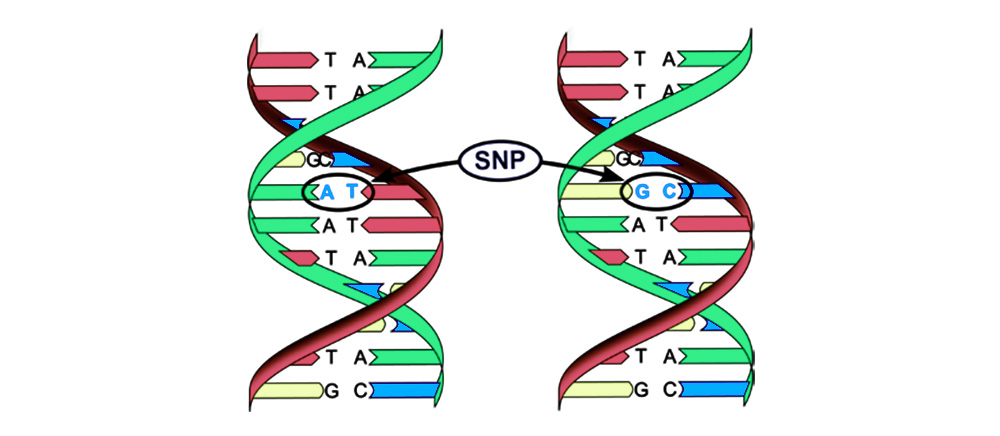
2. Хромосомные аберрации.
Делеция – утрата участка хромосомы. Происходят из-за обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё – этот ген в хромосоме больше не экспрессируется.
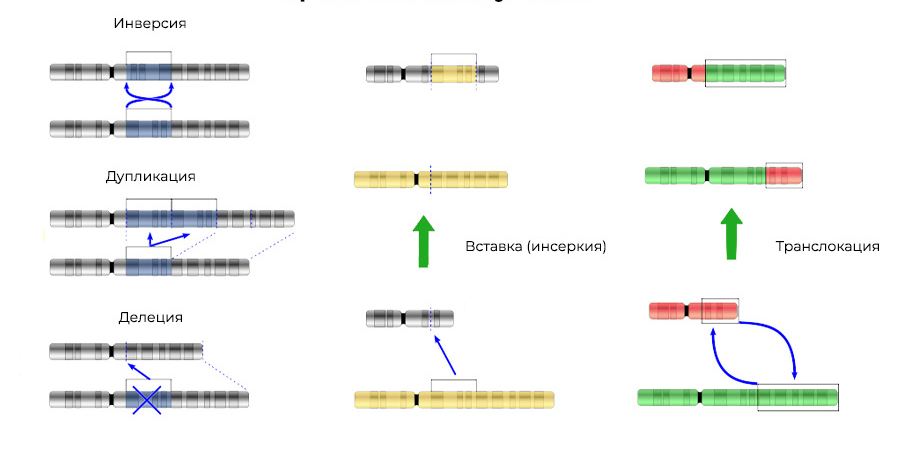
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы – в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
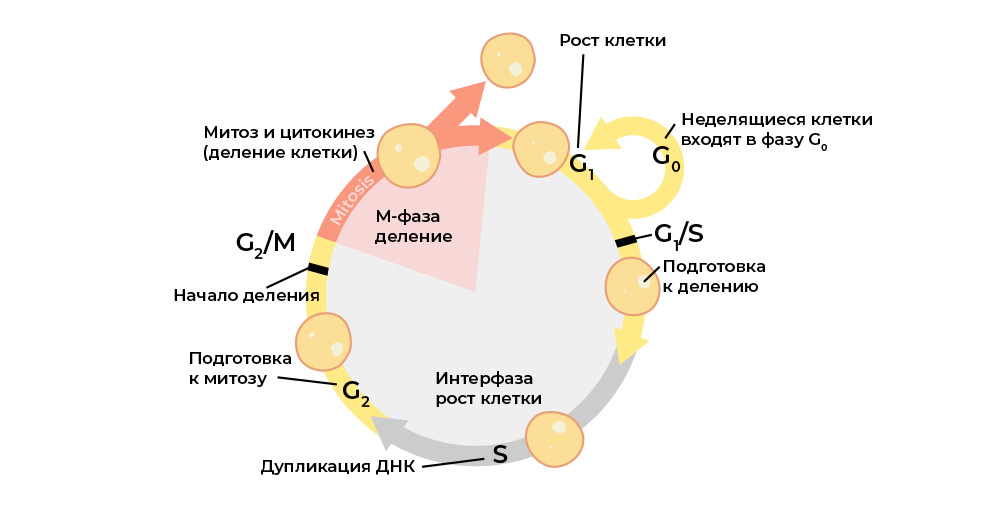
Каждый этап клеточного цикла контролируется белками-регуляторами
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) – две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF – немелкоклеточный рак легкого;
- BRAF – меланома;
- HER2 – рак молочной железы (РМЖ);
- KRAS – колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
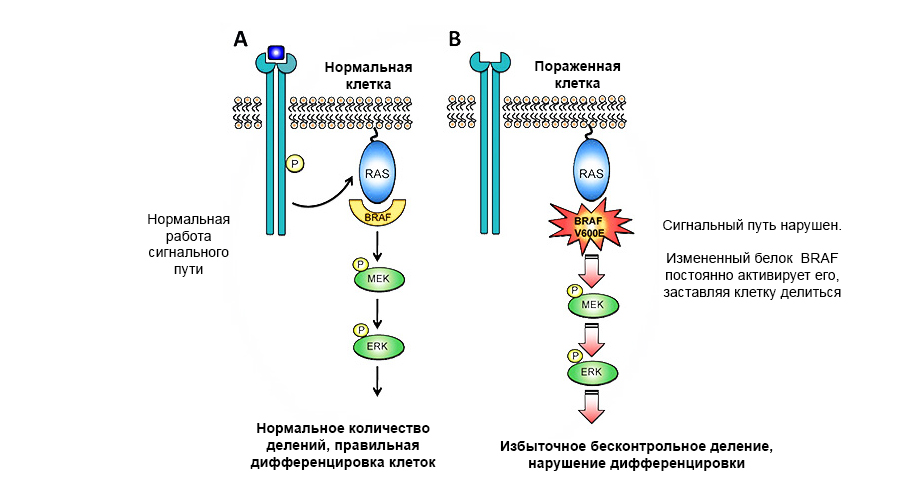
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
Гены-супрессоры опухоли (антионкогены) – напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация генов-супрессоров в результате мутации – резко увеличивает вероятность появления злокачественной опухоли.
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
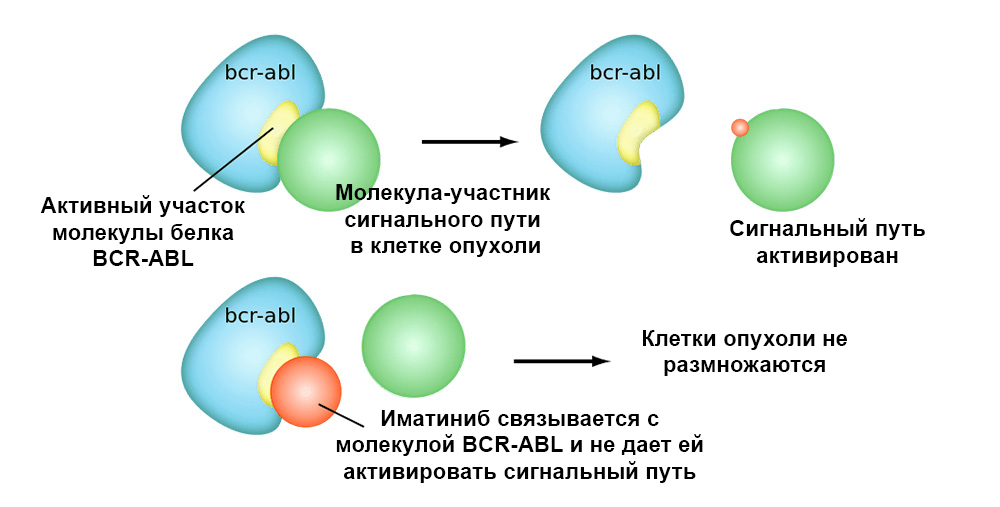
Иматиниб связывается с активным участком молекулы белка BCR-ABL, и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее – индивидуально подобранное для конкретного пациента – на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
обнаружим опухоль/метастаз на очень ранней стадии – по обрывкам ее ДНК в крови; - можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия – микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови – тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль – опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла – от кожи до опухоли – так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации – то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии – и даже визуализировать весь кариотип (хромосомный набор).
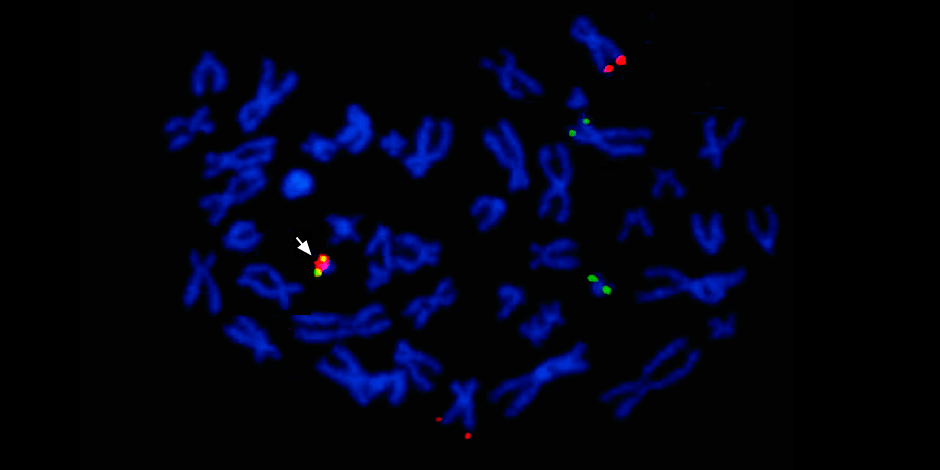
Под стрелкой слева – слияние красного и зеленого сигнала – свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) – нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения молекулярно-генетического профиля опухоли – начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, врачи-онкологи, иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, off-label – и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности – полезно для спокойствия пациента.

Отчет получается довольно увесистым – 30 страниц захватывающего чтения
В этом случае молекулярно-генетическое исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс – время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом – и остались немутировавшими. Да, мы назначаем препарат по результатам молекулярно-генетического теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака более-менее гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли – по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования – без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли – это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов молекулярно-генетические тестирования – все еще редкий случай, к сожалению – для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона – технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) – а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное молекулярно-генетическое тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел – нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF – у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Читайте также:

