Блокаторы роста раковых клеток

Питание играет важную роль, как в профилактике рака, так и в способствовании росту опухоли и метастаз. Проведенные исследования в США показали, что 75%-85% случаев диагностики рака вызваны нездоровым образом жизни и могли быть предотвращены с помощью изменения пищевых привычек.
Исследователи считают, что 30% смертей, вызванных раком, сегодня могли бы быть предотвращены только с помощью правильного питания.
Связь растительных продуктов с хорошо известными хемопротективными (противоопухолевыми) свойствами очевидна. Фитохимические вещества, которые в них содержатся, воздействуют на межклеточную коммуникацию, которая вызывает воспаление и стимулирует развитие рака в организме.
8 питательных веществ, которые помогают блокировать метастазы рака:
8 самых лучших питательных веществ, которые вы можете употреблять ежедневно для задержки развития рака. Включение в рацион продуктов, содержащих эти вещества, поможет подавить рост, значительно снизить риск развития и даже повернуть вспять прогрессирование рака.
- Урсоловая кислота
- Витамин D
- Куркумин
- ЭГКГ
- Сульфорафан
- Кверцетин
- Апигенин
- Лютеолин
Урсоловая кислота – это растительное масло и фитонутриент. Содержится в травах – таких как базилик священный, орегано, в яблочной кожуре и чернике.
Одной из ключевых характеристик раковых клеток является их способность нарушать механизм апоптоза клеток. Эта запрограммированная смерть клетки может рассматриваться как самоубийство клетки в целях предотвращения внутриклеточных нарушений. Нарушение апоптоза ведет к активизации метастазирования и росту опухоли.
Увеличение потребления урсоловой кислоты входит в курс лечения рака поджелудочной железы, шейки матки, легких, толстой кишки, кожи и груди.
Доказано, что урсоловая кислота разрушает механизмы выживания раковых клеток. В частности, урсоловая кислота запускает апоптоз, тем самым сдерживая репродукцию поврежденных ДНК и метастаз.
Витамин D очень важен для выработки противоракового белка, GC фактора активации макрофагов (MAF). Он же GcMAF (Globulin component Macrophage Activating Factor). GC MAF подавляет раковые метастазы и даже способен повернуть вспять их распространение. Ежедневное получение здоровой дозы витамина D поддерживает синтез GC MAF и, соответственно, останавливает прораковые рецепторы и энзимы, провоцирующие метастазы.
MAF (фактор активации макрофагов- белок, связывающий витамин D) – еще один белок, связанный с понижением раковой активности. Он непосредственно стимулирует ответ иммунной системы, подавляя рост кровеносного сосуда (ангиогенез), требуемый для миграции раковой клетки и роста опухоли. MAF нуждается в витамине D для транспортировки по кровеносным сосудам.
Витамин D эффективно подавляет рост и развитие опухоли и метастаз при раке простаты, груди, толстой и прямой кишки и меланоме. Увеличивайте уровень витамина D, ежедневно бывая на солнце, не пользуясь при этом защитными средствами от загара. Включайте в свой рацион продукты, богатые витамином D, включая промысловый лосось, органик и домашние яйца, грибы, ферментированные (непастеризованные) молочные продукты или цельное молоко от домашних коров.
Однако, наиболее здоровой диетой мы считаем диету без продуктов животного происхождения, — примечание от проекта МедАльтернатива.инфо
Куркумин входит в состав куркумы, придавая ей желтый цвет. Это мощный антиоксидант, который может предотвращать и лечить заболевания, связанные с хроническим воспалением, включая рак. Куркумин традиционно применялся в качестве лекарственного средства в китайской и индийской медицине для лечения различных заболеваний.
В качестве терапевтического средства куркумин входит в состав многочисленных медицинских препаратов для поддержания иммунной системы, поскольку он регулирует апоптоз и подавляет рост раковых клеток. Исследования показали, что куркумин действует как мощный антиоксидант. Он также блокирует выработку ФНО (фактора некроза опухолей), который усиливает про-воспалительные сигналы и стимулирует рост опухоли.
Клинические исследования показали, что куркумин подавляет пролиферацию раковых клеток и метастазы при различных видах рака, включая рак груди, легкого, матки, яичников, почек, мочевого пузыря, мозга, печени, поджелудочной железы, крови, ободочной и прямой кишок, неходжкиновской лимфоме.
Противораковое действие ЭГКГ (эпигаллокахетин-3-галлат) пристально изучается уже более трех десятилетий. ЭГКГ – это известное полифенольное соединение, высокая концентрация которого присутствует в зеленом чае. Это одно из целебных веществ, которое использовалось еще в древней китайской медицине. Считается, что употребление ЭГКГ подавляет рост опухоли в различных органах, таких как простата, мочевой пузырь, печень, кишечник, поджелудочная железа, легкие и ротовая полость.
Несмотря на то, что биологические механизмы, с помощью которых этот нутриент подавляет раковые клетки, еще не понятны, недавно было обнаружено, что ЭГКГ связывает рецептор белка 67LR, ответственного за раковую активность. Присоединяясь к канцерогенному белку, ЭГКГ подавляет метастазы, предотвращая ангиогенез, который ответчает за миграцию раковых клеток. ЭГКГ также стимулирует апоптоз, поддерживая разрушение раковых клеток.
Высокое содержание ЭКГК в зеленом чае способствует поддержанию здоровья тела. Исследования показывают, что ежедневное употребление зеленого чая улучшает кишечную микрофлору, что, в свою очередь, очень важно для оптимизации работы иммунной системы. Как минимум одна чашка зеленого чая ежедневно в сочетании с цельными продуктами и растительной диетой сможет поддержать организм в борьбе с хроническими заболеваниями и предотвратить рак.
Сульфорафан является одним из лучших хемопротективных веществ, которые предотвращают формирование свободных радикалов и рост опухоли. Он уменьшает воспаление и защищает от роста опухоли, поддерживая естественную детоксификацию, направленную на уничтожение токсинов и усиление иммунной реакции. Сульфорафан показал свою способность бороться с распространением рака путем подавления активации раковых клеток. Он сдерживает метастазы при раке селезенки, толстой кишки, простаты, желудка и груди. Капуста брокколи – один из самых эффективных продуктов, которые подавляют распространение рака в вашем теле. Капусту, брюссельскую капусту, брокколи, цветную капусту и другие крестоцветные овощи также следует включать в свое меню. Эти продукты имеют высокое содержание хемопротекторов – глютатионов, аминокислот, хлорофилла, различных витаминов и питательных веществ.
Кверцетин – это супер антиоксидант, который стимулирует естественную детоксификацию организма и демонстрирует естественные антираковые свойства. Высокое содержание кверцетина в вашем питании подавляет разрастание раковых клеток, снижает повреждения, вызванные окислением, и сдерживает активность мутирующего гена Р53, связанного с ростом опухоли.
Данный флавоноид показывает многообещающие результаты при лечении рака груди, крови, легких, кишечника, при нейробластоме.
Кверцетин содержится в больших количествах в луке, каперсах, ежевике, малине, черном и зеленом чае, в темной вишне, какао-порошке, капусте, яблоках и травах – шалфее и петрушке.
Этот флавоноид демонстрирует хемопревентивные свойства, подавляя разрастание раковых клеток в новые ткани и рост опухоли. Апигенин понижает активность свободных радикалов и помогает выводить токсины из организма. Используется для поддержания здоровья желудка, почек, печени и крови.
Апигенин препятствует миграции раковых клеток, тем самым предотвращая метастазирование. Исследователи обнаружили, что местное лечение, включающее экстракты апигенина, эффективно в подавлении роста рака кожи и уменьшении повреждения кожи в результате УФ облучения.
Апигенин содержится во многих фруктах и овощах – грейпфруктах, апельсинах и луке. Он также имеется в напитках из растений, включая ромашковый чай. Одним из лучших пищевых источников апигенина, который вы легко можете добавить в свой рацион, является петрушка. Добавляйте петрушку в качестве приправы в салаты и в ваши любимые блюда.
Лютеолин — еще один антиопухолевый флавоноид, входящий в растительную диету. Лютеолин содержится в зеленом перце, ромашковом чае и сельдерее. Доказано, что его антиоксидантные свойства защищают ткани легкого, печени и сердца от воспаления, а также борются против дегенеративного влияния раковой активности.
Несмотря на многочисленные исследования хемозащитных свойств лутеолина, не все его полезные свойства еще известны. Ученые убеждены в том, что эти цитрусовые флавоноиды – лютеолин и апигенин – несмотря на низкие концентрации в продуктах, оказывают более значительный профилактический антираковый эффект, чем обычные продукты.
Лютеолин препятствует активации раковых клеток, подавляя прораковые энзимы, блокируя скопление канцерогенов в новых тканях и помогая уничтожению токсичных агентов. Следовательно, лютеолин является эффективным антиоксидантом, оказывающим на организм человека антипролиферативное и анти-метастатическое действие.
Вывод
Важнейшим для здоровья является отказ от обработанной пищи, сахара, мяса и молочных продуктов, которые разрушают защитные свойства иммунной системы. Продукты питания должны подавлять раковые клетки. Употребляйте перечисленные выше 8 продуктов, которые стимулируют апоптоз раковых клеток, предотвращают ангиогенез и, соответственно, подавляют формирование раковой опухоли и распространение метастаз в другие части тела.
Внимание! Предоставленная информация не является официально признанным методом лечения и несёт общеобразовательный и ознакомительный характер. Мнения, выраженные здесь, могут не совпадать с точкой зрения авторов или сотрудников МедАльтернатива.инфо. Данная информация не может подменить собой советы и назначение врачей. Авторы МедАльтернатива.инфо не отвечают за возможные негативные последствия употребления каких-либо препаратов или применения процедур, описанных в статье/видео. Вопрос о возможности применения описанных средств или методов к своим индивидуальным проблемам читатели/зрители должны решить сами после консультации с лечащим врачом.
Чтобы максимально быстро войти в тему альтернативной медицины, а также узнать всю правду о раке и традиционной онкологии, рекомендуем бесплатно почитать на нашем сайте книгу "Диагноз – рак: лечиться или жить. Альтернативный взгляд на онкологию"

Применение противоопухолевых препаратов – важная часть комплекса мероприятий, призванных вылечить человека от рака, уничтожив все патологические клетки, замедлить рост злокачественного новообразования или продлить жизнь. За всю историю борьбы с онкологическими заболеваниями, ученые разработали немало средств, помогающих в лечении. Каждому пациенту грамотный врач может подобрать наиболее эффективный вид препарата и способ его введения.
Классификация противоопухолевых средств
Разные авторы в своих публикациях могут относить препараты к разным группам, так как многие средства уникальны по своему химическому составу и способу воздействия.
По механизму воздействия выделяют
- Цитотоксические. Основное действие – уничтожение клеток рака. Используются широко и повсеместно, в этой группе самое большое количество представителей и разновидностей.
- Цитостатические. Приостанавливают рост новообразования, препятствуя процессу деления.
Классификация, предложенная ВОЗ, представляет собой упорядоченный список противоопухолевых препаратов:
- Алкилирующие вещества.
- Антиметаболиты.
- Растительные алкалоиды.
- Противоопухолевые антибиотики.
- Другие цитостатики.
- Моноклональные антитела.
- Гормоны.
- Цитокины.
- Алкилирующие вещества — Химическая реакция присоединения к молекуле ДНК или другой органической структуре алкильной группы препарата, нарушает нормальный синтез белков клетки, блокирует ее размножение, приводит к образованию неправильной РНК.
- Антиметаболиты — Повреждают ДНК путем химического воздействия, благодаря схожести с необходимыми клетке молекулами-метаболитами. Препятствуют синтезу составных частей нитей ДНК, РНК, подавляют работу ферментов.
- Алкалоиды растительного происхождения — Нарушают процесс деления клетки, вмешиваясь в процесс образования митотических микротрубочек или изменяют механизм скручивания ДНК, что останавливает деление.
- Противоопухолевые антибиотики — Повреждают ДНК, после чего запускается процесс разрушения мембран, клетка перестает делиться.
- Другие цитостатики. Аналоги платины. Похожи по воздействию на препараты алкилирующего действия. Создают дополнительные химические связи между ДНК и платиной, что мешает клетке делиться. Ингибиторы топоизомеразы сходны с растительными алкалоидами.
- Гормонотерапия. Рост опухоли в железах внутренней секреции или органах-мишенях возможно остановить, насыщая организм определенными гормонами. Пример – рак молочной, щитовидной, предстательной железы. Гормональная терапия рака хорошо переносится и бывает очень эффективной.
Медицинская наука активно ищет эффективные средства для лечения онкологии, наиболее продвинутые направления —
- Молекулярно-целевая терапия. Включает два класса препаратов –
- моноклональные тела (могут связываться с белками клетки, что приводит к ее гибели или провоцировать реакцию естественного иммунитета);
- ингибиторы киназы (замедляют биохимические клеточные процессы).
- Иммунотерапия – наиболее интенсивно разрабатываемая отрасль, имеющая цель усилить иммунный ответ на возникновение рака, создать противораковую вакцину.
Побочное действие и эффективность
Чем больше концентрация противоопухолевых препаратов при раке внутри самой опухоли, тем выше их эффективность. Но нельзя бесконечно наращивать дозу. Большинство противоопухолевых средств токсично, и они имеют способность подавлять рост не только раковых клеток, но и здоровых, в зонах активного деления –
- в костном мозге при образовании клеток крови,
- при повреждениях слизистых,
- при заживлении ран,
- в желудочно-кишечном тракте,
- в зонах роста волос,
- в дыхательных путях,
- в репродуктивной системе.
Такое воздействие и вызывает серьезные побочные эффекты лекарственного лечения рака. Поэтому его проводят под тщательным наблюдением специалистов, которые подбирают каждому пациенту индивидуальные схемы приема препаратов.
Мы часто задумываемся о том, что нужно исключить из рациона, чтобы предотвратить развитие рака: рафинированный сахар, обработанные продукты и т.д. Это правильно, но, может быть, есть что-то ещё, что нам следовало бы сделать. Что если мы могли бы добавить некоторые продукты в наш рацион, чтобы победить рак?
Что такое ангиогенез?
Кровеносные сосуды могут приспособиться к любой среде, они подвержены воздействию, и организм имеет удивительную способность регулировать количество кровеносных сосудов в каждый определённый момент времени.
Ангиогенез происходит и когда человек здоров, и когда болеет. Через кровеносные сосуды кровь разносит кислород и питательные вещества по всему организму. Когда происходит формирование новой ткани, для её роста и поддержания необходим приток крови, обеспечить который без ангиогенеза, или формирования новых кровеносных сосудов, невозможно.
Организм может увеличить количество сосудов, или сократить его, когда это необходимо. Здоровый организм имеет контроль над этим процессом и может регулировать ангиогенез по мере необходимости.
Однако исследования показали, что при ряде заболеваний организм не в состоянии вырастить достаточное количество сосудов или не способен сократить их число, когда это становится нужно. Если кровеносных сосудов слишком много, получают подпитку такие болезненные состояния, как рак, артрит, потеря зрения, эндометриоз, ожирение и болезнь Альцгеймера. Если кровеносных сосудов слишком мало, не заживают раны, в результате чего прогрессируют инсульт, ишемическая болезнь сердца, выпадение волос, ацидоз, эректильная дисфункция и заболевание периферических артерий.
Во всём мире существует более 70 серьёзных заболеваний, которым подвержены миллионы людей – эти болезни могут по-разному проявляться, но при детальном рассмотрении все они имеют долю несбалансированного ангиогенеза в качестве общего знаменателя.
Теперь этот факт позволяет исследователям переосмыслить профилактику и лечение таких заболеваний.
Несбалансированный ангиогенез является отличительной чертой всех форм рака. В первую очередь важно понять, как начинается рак. Любая форма рака начинается с формирования микроскопической группы безвредных клеток. Они могут вырасти до размеров кончика шариковой ручки, причём своими силами, поскольку не имеют собственного кровоснабжения – отсутствие питательных веществ и кислорода означает отсутствие роста.
Патолого-анатомические исследования показали, что среди погибших в автомобильных авариях 40% женщин в возрасте от сорока до пятидесяти лет имеют микроскопические раковые образования в тканях молочных желёз, а 50% мужчин возрасте от пятидесяти до шестидесяти – в простате.
Раковые клетки питаются за счёт новых развивающихся сосудов, так что логично предположить, что как только кровоснабжение прекратится, опухоль больше не сможет питаться и, следовательно, погибнет. Достижения в исследовании ангиогенеза на основе этой теории показали положительные результаты как для животных, так и для человека.
Доктор Уильям Ли, глава Фонда Ангиогенеза, провёл обширное исследование в области ангиогенеза – новый комплексный подход к борьбе с болезнью путём восстановления врождённой способности организма контролировать ангиогенез. Медицинская терапия, которая либо стимулирует рост новых кровеносных сосудов, либо подавляет его, проходит испытания с большим успехом.
На сегодняшний день существует целый ряд процедур для лечения рака путём блокировки роста кровеносных сосудов, которые одобрены и используются для лечения рака толстой кишки, почек, молочной железы, легких, головного мозга и щитовидной железы. У многих пациентов наблюдалась стабилизация состояния или полная регрессия опухоли после применения этих препаратов.
Выявление рака на ранней стадии
Доктор Ли отмечает, что реакция на применение анти-ангиогенезных препаратов изучена не для всех форм рака, что стало причиной проведения дополнительных исследований, которые позволили вернуться к первопричине большинства форм заболевания. Он предположил, что одна из причин того, что некоторые формы рака реагируют на анти-ангиогенезную терапию лучше, чем другие, заключается в том, что зачастую приходится иметь дело с поздней стадией рака, когда он уже поразил большую часть организма. Как только болезнь приобретает угрожающие масштабы, её очень трудно (если не невозможно) вылечить.
Но что если существуют природные анти-ангиогенезные вещества, которые можно было бы включить в рацион, лишив тем самым раковые опухоли самой возможности на формирование? Это привело доктора Ли к мысли о том, чтобы уморить рак ещё до того, как он перерастёт в болезнь – прежде чем станет слишком поздно. Такой метод подойдёт как для здоровых людей, так и для тех, кого уже поразил рак.
Рацион – основной фактор
В 90-95% всех случаев раковые заболевания вызваны условиями окружающей среды, а не генетикой. Среди них 30-35% обусловлены неправильным питанием.
Можно ли насыщаясь заставить рак голодать? Ответ однозначен: да. Мать-природа в изобилии обеспечила нас щелочными продуктами, наделёнными свойством останавливать формирование кровеносных сосудов на его пути.
Здесь стоит задуматься не о том, что мы могли бы исключить из своего рациона, а что могли бы в него добавить, чтобы лишить рак питающих его кровеносных сосудов.
Выбирайте продукты с умом
Уже сегодня мы можем начать есть продукты, которые подавляют рост кровеносных сосудов, и тем самым сделать правильный выбор, который позволит нам оставаться максимально здоровыми, сохраняя раковые клетки в зачаточном состоянии. Вот некоторые из таких продуктов:
Яблоки
Черника
Клюква
Помидоры
Капуста кале
Чеснок
Базилик
Лук
Тимьян
Женьшень
Корень имбиря
Цветная капуста
Морковь
Брокколи
Кочанная капуста
Сладкий картофель
Листовая капуста
Цедра лимона
Апельсины
Персики
Грейпфруты
Льняное семя
Красный виноград
Клубника
Фасоль
Шпинат
Зелёный чай
Перец
Тыквенные семечки
Мёд
Оливковое масло
Грибы шиитаке
Грецкие орехи
Миндаль
Одни виды продуктов более действенны, чем другие, и в то время как исследования идут полным ходом, список полезных продуктов продолжает пополняться.
Когда в конце прошлого века я начал вплотную заниматься вопросами лечения рака, все противоопухолевые лекарства были, как их сейчас называют, конвенциональными. Эти классические препараты действуют на некие молекулярные объекты, необходимые как нормальным, так и опухолевым клеткам. Другими словами, в рамках этого подхода нельзя создать лекарство, которое затрагивало бы только патологические клетки.
Механизм действия конвенциональных препаратов может быть направлен на повреждение ДНК или напрямую (это самые старые противораковые средства), или с помощью воздействия на ферменты топоизомеразы и на синтез нуклеотидов, а также на пертурбацию микротрубочек, составляющих цитоскелет клетки, то есть на универсальные мишени, необходимые для поддержания нормального клеточного цикла любой клетки. Причина, по которой такие лекарства хорошо работают именно в опухолевых клетках, состоит в том, что контроль за клеточным циклом у них изменен, поэтому они более чувствительны к нарушениям его критических стадий.
Конечно, такие препараты будут неизбежно опасны для пациента – все знают о последствиях химиотерапии. Главное здесь – создать лекарство, которое будет эффективным в определенный момент применения в максимально нетоксичной дозировке, что позволит уменьшить опасность для здоровых клеток. Важно, что эти лекарства несут улучшение, так как убивают патологические клетки так быстро, что опухоль не всегда успевает запустить механизм сопротивления. Примером успешного применения конвенциональных средств может служить терапия рака яичек, благодаря которой сегодня выздоравливает до 90 % больных.
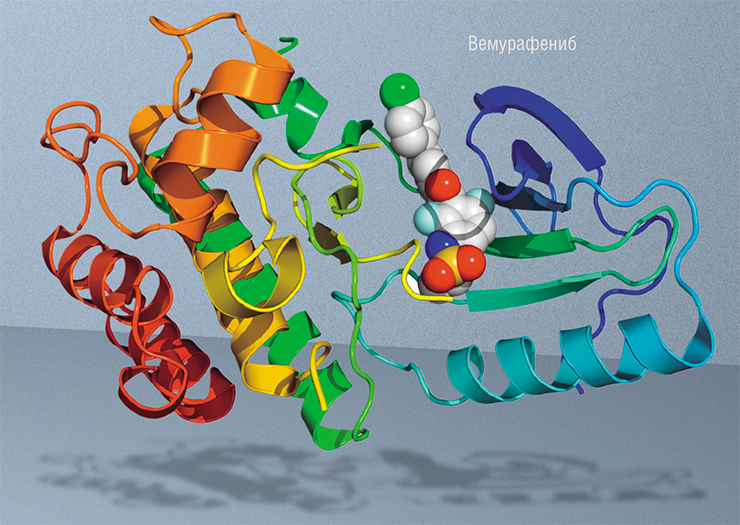
Важно то, что таргетные препараты действуют только на определенные опухоли, которые несут мишени для этих лекарств. Поэтому использование таких препаратов всегда требует персонализированной медицины, то есть тщательного подбора пациентов. Примером может служить очень частое заболевание – рак молочной железы, который сегодня практически всегда лечится только с использованием персонализированного подхода.
Если же в опухолях идентифицирован амплифицированный (многократно копированный) ген HER 2, то этих пациентов лечат препаратами, направленными именно на этот белок: антителами (например, трастузумабом) либо маленькими молекулами-блокаторами (например, лапатинибом). Если же рак не относится к этим двум группам, то эти опухоли классифицируются как тройной негативный рак молочной железы. К сожалению, общего успешного метода лечения таких опухолей пока нет.
Геномный анализ – ключ к успеху

В наши дни стратегия лечения всех видов рака становится все более и более стандартной. Сначала у пациента берут образец опухоли для анализа на разные маркеры. С помощью методов геномики определяется наличие тех или иных мутаций; методами транскриптомики оценивается экспрессия (активность) генов; методами протеомики изучаются клеточные белки. В зависимости от этих результатов назначается лечение. Иногда это иммунотерапия. В случае химиотерапии нужно понять, какие именно характеристики опухоли конкретного пациента помогают ей расти и выживать.
Вот хороший пример, почему нельзя создавать новые лекарства от рака вне рамок персонализированной медицины. В США в 2004 г. попала в тюрьму одна из самых популярных женщин 1990-х гг. – Марта Стюарт, владелица огромной продуктовой империи и собственного телевизионного шоу. Причиной послужило появление нового лекарства от рака – цетуксимаба, моноклонального антитела, воздействующего на трансмембранный рецептор тирозинкиназу EGFR, играющий важную роль в стимуляции роста опухоли, метастазировании и т. д. Компания ImClone провела первые клинические испытания на разных группах пациентов без индивидуального подбора. Результаты оказались неоднозначны, и Управление по надзору за качеством пищевых продуктов и медикаментов (FDA) лекарство не одобрило. Генеральный директор компании и некоторые другие акционеры, в числе которых была Стюарт, продали свои акции еще до объявления решения, что является серьезным уголовным преступлением.
Несколькими годами позже вышла статья, где цетуксимаб был испытан против рака прямой кишки. Оказалось, что если у опухолевых клеток была онкогенная мутация K-Ras, что бывает примерно в половине всех случаев, то лекарство вообще не работало. Но в остальных случаях оно было очень эффективным, и результаты исходных испытаний были бы совсем другими, если бы они проводились только на пациентах без мутации K-Ras. Это была первая демонстрация, что геномный анализ может быть ключом к успеху или провалу противоракового препарата.
Еще один пример относится к маленьким молекулам: сегодня мы можем синтезировать такие молекулы, способные очень селективно действовать на конкретный белок. В нашем случае это белок, который кодируется геном BRAF, – при меланоме кожи частота мутаций в этом гене составляет 30–70 %. И создатели препарата вемурафениб предназначали его для больных именно с такой мутацией.
Поначалу результаты лечения вемурафенибом были потрясающие. Например, в течение 15 недель терапии у пациента с меланомой по всему телу удалось добиться почти полной ремиссии. Но спустя время опухоль вернулась. Почему? Потому что опухолевые клетки приобрели устойчивость к лекарству. И такая устойчивость, к сожалению, развивается практически у всех пациентов, которых лечат любыми таргетными препаратами, и у большинства больных, которых лечат конвенциональными препаратами.
Лекарственная устойчивость – в чем причина?
Как у раковых клеток появляется лекарственная устойчивость? Этот феномен связан с изменением экспрессии (активности) генов в клетках, поврежденных химио-, радио- или иммунотерапией. Другими словами, речь идет о перепрограммировании транскрипции – переносе генетической информации с ДНК на молекулу РНК.
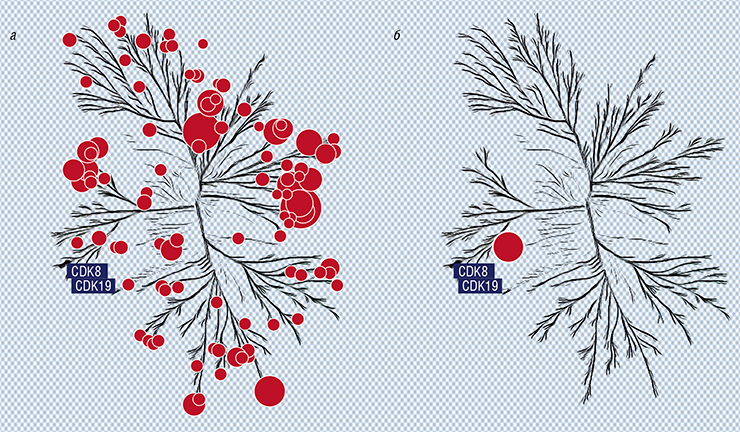
С помощью методов транскриптомики мы обнаружили, что в поврежденных опухолевых клетках начинает активироваться множество генов, кодирующих белки, которые выходят из клетки и стимулируют рост и выживание других опухолевых клеток, способствуя появлению метастазов, а также формированию лекарственной устойчивости. Нам удалось обнаружить некие маленькие молекулы, которые подавляют этот процесс, разработав и применив систему физического высокопроизводительного скрининга, позволившую оценить более сотни тысяч различных химических соединений. В то время это была огромная работа – сейчас мы можем виртуально анализировать десятки миллионов соединений при помощи новых компьютерных алгоритмов, что экономит время и уменьшает стоимость исследований.
Но зачем нашему организму вообще нужны ферменты, регулирующие транскрипционное перепрограммирование? Чтобы ответить на этот вопрос, вспомним, когда у нас происходят изменения в программе транскрипции, – в процессе развития организма. Более того, транскрипционное перепрограммирование играет в этом процессе критическую роль.
И действительно, если давать беременным мышам ингибитор CDK8/19, то развитие эмбрионов заблокируется. Когда же мы в течение 200 дней давали этот ингибитор взрослым мышам, то внешне с ними ничего не происходило, вес не менялся и т. д. Но когда тот же препарат давали животным, у которых был рак молочной или предстательной железы (в комбинации с гормональной терапией) либо в печени росли метастазы рака прямой кишки, то рост опухолей резко замедлялся.
К клиническим испытаниям
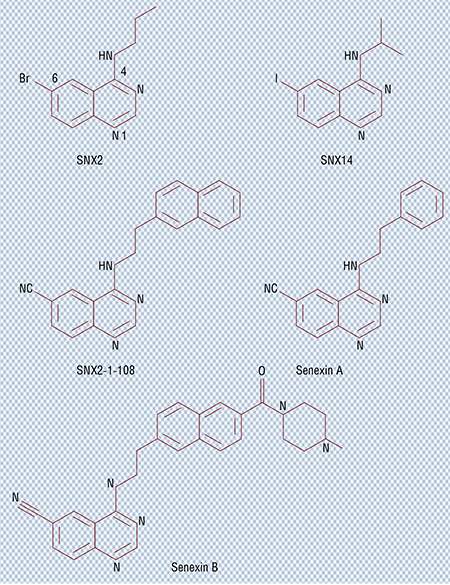
Мы протестировали большое количество уже известных противоопухолевых лекарств в комбинации с нашим ингибитором CDK8/19 и убедились, что таким образом практически всегда удается предотвратить возникновение лекарственной устойчивости или, по крайней мере, замедлить этот процесс. Дело осталось за малым: такие ингибиторы должны быть одобрены для практического применения. А для этого они должны работать как одиночные агенты, подавлять какие-то виды рака.
Чтобы обнаружить такие мишени, мы вновь обратились к геномике. Сейчас существуют специальные компьютерные программы, с помощью которых можно узнать, как активация конкретного гена отражается на выживании больного с определенным видом рака. С помощью одной из таких программ мы сделали подборку разных видов рака, для которых уровень CDK8/19 коррелирует с худшим прогнозом. В нее вошли, например, рак предстательной железы, рак шейки матки и аденокарциномы пищевода. Такие корреляции предполагают, что в этих случаях можно пользоваться нашими ингибиторами.
Показательная история связана с раками молочной железы и яичников. Мы получаем разные результаты, если разделяем этих больных на две группы: белые американцы и афроамериканцы. Среди белых CDK8/19 оказывает большой эффект при раке груди и очень слабый – при раке яичников. У афроамериканцев все с точностью наоборот. Это еще один наглядный пример, как важно для клинических испытаний предварительно проводить геномные исследования.
Мы сейчас сконцентрировались на двух видах рака. Первый – это андроген-независимый рак предстательной железы (андрогены – мужские гормоны). Как известно, общим методом лечения рака предстательной железы является антигормональная терапия. Когда рак развивается и прогрессирует, уровень CDK19 растет. К тому времени, когда опухоль приобретает независимость от андрогенов, он становится неизлечимым, и тогда же мы видим резкое увеличение экспрессии и CDK8, и CDK19.
В экспериментах на лабораторных мышах наш ингибитор CDK8/19, в комбинации с гормональной терапией, полностью подавлял рост опухоли, в которой был активен ген, кодирующий вариант андрогенового рецептора, из-за которого этот рак становится устойчивым ко всем видам современного лечения. Животные при этом не теряли в весе и жили гораздо дольше.
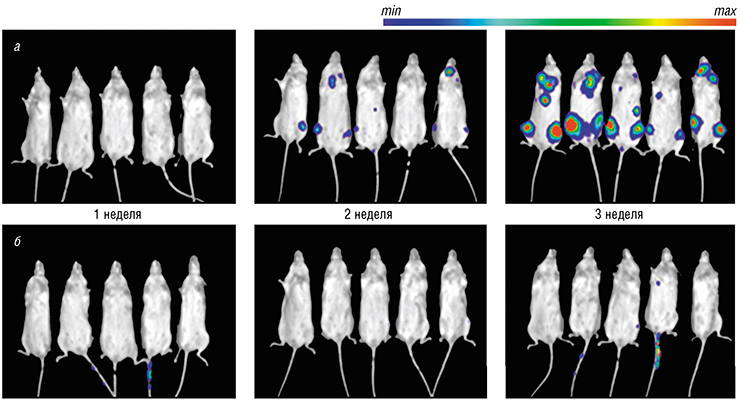
Второй вид рака – это лейкемия, болезнь кроветворной системы, в первую очередь острая миелоидная лейкемия. Это – единственный известный на сегодня рак, рост которого во многих случаях подавляется ингибиторами CDK8/19 не только у животных, но и в культуре ткани человека. Чтобы узнать, насколько хорошо пациенты будут реагировать на наше лекарство, мы вводили мышам раковые клетки, помеченные ферментом люциферазой, катализирующим реакцию, сопровождаемую биолюминесценцией. Оказалось, что у контрольных животных лейкемия распространяется по всему телу через шесть недель, а у животных, которые получали ингибитор CDK8/19, она почти не распространяется.
Мы протестировали большое количество образцов опухолевых клеток, взятых от больных лейкемией, и обнаружили, что около 40 % из них высокочувствительны к ингибитору CDK8/19. Таким образом, если мы хотим начать лечение пациентов с лейкемией, нам в первую очередь нужно определить, для кого из них такая терапия будет эффективна. С помощью методов геномики и транскриптомики мы обнаружили несколько генов, часть которых наиболее активна в опухолевых клетках, устойчивых к ингибитору CDK8/19, а другая часть – в чувствительных. Таким образом мы получили критерии, по которым можно судить, будут ли конкретные пациенты отвечать на наши лекарства.
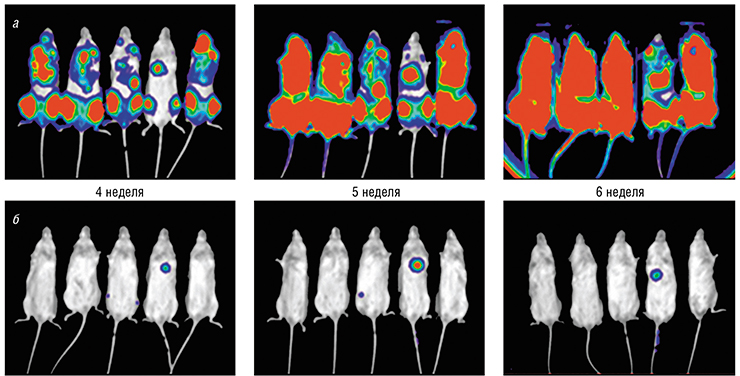
Важно то, что острая миелоидная лейкемия относится к орфанным, то есть редким, заболеваниям, исследования которых и разработку соответствующих лекарств в США поддерживает государство. Это означает, что мы можем получить одобрение на наше лекарство гораздо быстрее, чем если бы речь шла о лечении широко распространенных заболеваний.
Раковые клетки, конечно, могут приобрести устойчивость и к нашим ингибиторам транскрипционного перепрограммирования. Самым чувствительным к ним видом рака оказалась лейкемия. Поэтому мы провели селекцию, получив лекарственно устойчивые клетки лейкемии, и обнаружили некоторые вещи (пока не опубликованные), которые подсказывают нам, что нужно делать в таких случаях. То есть в принципе у нас уже есть обходная стратегия.
В любом случае устойчивость к этим ингибиторам возникает гораздо позднее, чем к другим лекарствам, потому что они сами подавляют ее развитие. Кроме того, при терапии рака никогда не используется одно лекарство, обычно их смесь. И если мы докажем, что в случае с конкретным раком (той же лейкемией) это лекарство существенно улучшает выживаемость пациентов, то его быстро одобрят для практического применения. А это означает, что его можно будет тестировать в комбинации с другими противораковыми средствами. И в этом случае мы ожидаем увеличение эффективности терапии.

Chen M., Liang J., Ji H. et al. Cdk8/19 Mediator Kinases Potentiate Induction of Transcription by Nfkappab // Proc Natl Acad Sci USA. 2017. V. 114. N. 38. P. 10208–10213.
Liang J., Chen M., Hughes D. et al. Cdk8 Selectively Promotes the Growth of Colon Cancer Metastases in the Liver by Regulating Gene Expression of Timp3 and Matrix Metalloproteinases // Cancer Res. 2018. V. 78. N. 23. P. 6594–6606.
McDermott M. S., Chumanevich A. A. Lim C. U. et al. Inhibition of CDK8 mediator kinase suppresses estrogen dependent transcription and the growth of estrogen receptor positive breast cancer // Oncotarget. 2017. V. 8(8) P. 12558–12570.
Porter D. C., Farmaki E., Altilia S. et al. Cyclin-dependent kinase 8 mediates chemotherapy-induced tumor-promoting paracrine activities // Proc Natl Acad Sci USA. 2012. V. 109. N. 34. P. 13799–13804.
Roninson I. Seeking favors from nature // Journal Cancer Biology & Therapy. 2005. V. 4. N. 7. P. 794–799.
Читайте также:

