Безрецидивная выживаемость при раке

Все пациенты по-разному реагируют на диагноз онкологического заболевания. Многие предпочитают избегать информации, которая может быть неприятной, в то время как другие ищут максимально точные ответы. Никто не может сказать, какая из этих стратегий является более правильной. Тем не менее, одним из частых вопросов онкологических пациентов является вопрос к врачу о предполагаемой продолжительности жизни. В онкологии для предполагаемой оценки продолжительности жизни пациентов используются различные статистические термины, многие из которых непонятны для пациента. В данном материале описаны основные термины, которые используют врачи для определения прогноза при онкологических заболеваниях.
Важно понимать, что ни один врач не может точно ответить пациенту на вопрос о его продолжительности жизни. Срок жизни любого человека зависит от многих факторов, не все из которых связаны с болезнью. Предполагаемая продолжительности жизни онкологического пациента зависит от:
- Вида злокачественной опухоли и её расположения в организме (локализации);
- Стадии заболевания, включая размеры и распространенность опухоли;
- Биологических особенностей опухоли. её агрессивности и скорости роста, а также некоторых генетических особенностей раковых клеток;
- Чувствительности опухоли к проводимому лечению;
- Возраста и общего состояния здоровья пациента.
Для оценки эффективности различных методов лечения применяются статистические методы, которые позволяет оценить выживаемость групп пациентов. Наиболее часто оцениваются следующие показатели выживаемости:
Разновидностью общей выживаемости является относительная выживаемость пациентов, которая является наиболее удобным показателем для оценки выживаемости пациентов пожилого возраста. При оценке этого показателя оценивается соответствие выживаемости пациентов определенного возраста со злокачественным новообразованием с выживаемостью людей схожего возраста, но без наличия онкологического заболевания.
Пример 1: 5-летняя выживаемость пациентов с диагнозом рака шейки матки составляет 68%. Это означает, что 68 пациенток из 100 переживает 5 лет с момента постановки диагноза.
Пример 2: медиана выживаемости пациенток с диагнозом определенной злокачественной опухоли составляет 60 месяцев. Это означает, что 50% пациенток с данным заболеванием переживают 5-летний срок с момента постановки диагноза.
Именно указанные выше показатели используются в клинических исследованиях (подробнее про клинические исследования – здесь) для того, чтобы оценить эффективность различных методов лечения и сделать вывод о целесообразности их применения.
Для графического отображения показателей выживаемости используются специальные графики, на которых изображаются так называемые "Кривые Каплана-Майера" (Рисунок 1).
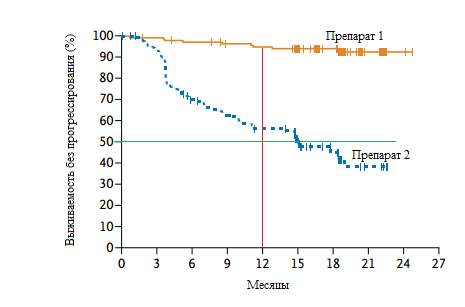
Рисунок 1. Пример кривых Каплана-Мейера по выживаемости без прогрессирования пациентов в одном из исследований. Красной линией обозначена 1-летняя выживаемость без прогрессирования, зеленой - медиана выживаемости без прогрессирования. Из графика видно, что препарат 1 демонстрирует значительные преимущества перед препаратом 2.
Таким образом, предсказать точную продолжительность жизни для отдельного пациента является крайне трудной задачей. Для предположительной оценки выживаемости врачи используют статистические данные, полученные в ходе проведения клинических исследований, в которых участвовало большое количество пациентов с определенными видами и стадиями опухолей. Такие оценки позволяют оценить среднюю выживаемость в больших группах пациентов, однако эту статистику бывает трудно перенести на отдельного пациента. Кроме того, методы лечения злокачественных опухолей постоянно совершенствуются, по этой причине данные такой статистики могут не учитывать все многообразие доступных методов лечения.
К примеру, Ваш врач может сообщить, что он оценивает прогноз течения заболевания как благоприятный. Это означает, что имеющиеся данные указывают на чувствительность опухоли к терапии и высокую вероятность хорошего контроля болезни в течение длительного времени, достижения длительной ремиссии – или даже излечения.
Подводя итоги, следует еще раз подчеркнуть следующие основные моменты:
- Статистика позволяет оценить выживаемость больших групп пациентов, но не позволяет предсказать прогноз течения заболевания и точную продолжительность жизни отдельного пациента;
- Статистика выживаемости может значительно отличаться при различных типах и стадиях опухолевого процесса, возраста пациента и проводимого лечения;
- Показатели общей выживаемости и выживаемости без прогрессирования широко применяются в клинических исследованиях для того, чтобы оценить эффективность изучаемого метода лечения;
- Статистические данные дают врачам полезную информацию для выбора наиболее подходящего метода лечения, но являются лишь одним из факторов, которые необходимо учитывать при выработке плана лечения.
III РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
НЕОАДЪЮВАНТНОЕ ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ.
Э.К. Возный, Н.Ю. Добровольская, С.Н. Гуров, С.А. Большакова.
Научно-исследовательский центр рентгенорадиологии МЗ РФ, Москва
Более 100 лет тому назад родилась концепция радикализма в лечении опухолевых заболеваний. Впервые об этом упоминает William Holsted, когда описывает метод удаления молочной железы, впоследствии названный его именем. Он считал, что рак молочной железы является локо-региональным заболеванием, поэтому радикальное хирургическое вмешательство может способствовать удалению всех опухолевых клеток и "излечению" больного.
На протяжении всего ХХ века с помощью открытий в области физики, химии, биологии и других фундаментальных наук, мы все больше проникаем в механизмы функционирования опухолевых клеток, их распространения в организме, выявления факторов, влияющих на эти процессы.
При изучении процессов метастазирования было показано, что отдаленные микрометастазы могут присутствовать у 30%-90% пациентов с первичным раком молочной железы (РМЖ), даже на ранних его стадиях.
Все эти открытия способствовали развитию системных методов воздействия на злокачественный процесс с целью элиминации отдаленных опухолевых отсевов и, таким образом, достижения максимального радикализма в лечении. Полученные позитивные результаты позволили рекомендовать химиотерапию как дополнительное лечение после радикальных операций, для профилактики развития отдаленных метастазов и местных рецидивов.
Этому способствовали результаты преклинических исследований доктора B. Fisher и его коллег, которые показали, что удаление первичного очага повышает скорость роста метастазов. Как оказалось это происходит за счет стимуляции влияния сывороточного фактора роста на опухолевые клетки. В это же время в опытах in vivo было продемонстрировано, что введение циклофосфана или тамоксифена предотвращает это воздействие, и чем раньше начата адъювантная терапия, тем лучше результаты лечения.
Совсем недавно вошла в практику неоадъювантная (первичная, индукционная) химиотерапия. Первоначально ее применение ограничивалось местно-распространенными неоперабельными формами РМЖ, но по мере накопления и анализа клинических данных она стала использоваться и при операбельных формах заболевания.
Какие же цели ставят перед собой врачи проводя неоадъювантную химиотерапию?
- уменьшение объема первичной опухоли;
- уменьшение размеров и количества пораженных лимфатических узлов;
- увеличение числа консервативных хирургических вмешательств;
- элиминация отдаленных микрометастазов;
- увеличение безрецидивной и общей выживаемости;
- изучение факторов прогноза (патоморфоза опухоли, индекса апоптоза, Bcl-2; Ki-67) и в зависимости от этого планирование адъювантного лечения.
При проведении неоадъювантной химиотерапии мы имеем возможность in vivo оценить ее эффективность и, соответственно, при отсутствии ответа опухоли на проводимую терапию применить альтернативные схемы. Первичная опухоль является неспецифическим индикатором ответа микрометастазов на проведение предоперационного лечения. В некоторых работах получены данные о корреляции ответа первичной опухоли, отдаленных микрометастазов и выживаемости больных.
В данной ситуации мы можем термин адъювантная заменить на "слепая" терапия, так как все видимые проявления заболевания уже убраны и у нас отсутствует возможность оценивать эффективность лечения и, соответственно, изменять его, при необходимости.
Конечно же, исследователей интересуют и факторы прогноза при проведении предоперационной терапии, чтобы основываясь на них строить дальнейшую стратегию лечения.
В исследованиях Royal Marsden (количество больных=185), в работах Миланской и Эдинбургской групп было показано, что наиболее важными прогностическими факторами безрецидивной и общей выживаемости является объективный ответ опухоли на лечение и статус аксиллярных лимфатических узлов после проведенной терапии. В тех случаях, когда мы достигаем полного клинического и патоморфологического эффекта в опухоли и аксилярных лимфатических узлах, получены и наилучшие отдаленные результаты. В работах Эдинбургской группы получены интересные данные: 10-тилетняя выживаемость пациентов с отсутствием пораженных лимфатических узлов при патоморфологическом исследовании составляет 90%, при метастатической инвазии 1-3 лимфатических узлов - 52% и при инвазии 4-9 лимфатических узла - 18%.
Нам кажется, что здесь важно упомянуть о значении патоморфоза опухоли. В определенной степени он связан с уровнем объективного ответа и, следовательно, является одним из слагаемых, влияющих на выживаемость пациентов. Степень патоморфоза можно считать индикатором ответа опухоли на лечение, что также помогает врачам в выборе дальнейшей тактики лечения. Так, например, при 0-I степени патоморфоза опухоли, возможно, следует применить какие-то альтернативные схемы химиотерапии при проведении адъювантного лечения.
Работа по оценке значения неоадъювантного лечения проведена в нашем институте. До сих пор еще остается спорным вопрос о количестве курсов предоперационной химиотерапии. Для нас было важным выяснить, какое количество курсов необходимо провести, чтобы получить наибольший эффект и выяснить как влияют полученные результаты на эффективность лекарственной терапии, какова взаимосвязь объективного эффекта и степени лекарственного патоморфоза. В исследование включена группа в количестве 89 человек, получавших неоадъювантную химиотерапию по схеме CAF. Максимальное число курсов было 6, но так как количество больных с каждым разом уменьшалось, то мы оценили только 4 курса. В таблице 1 представлены результаты неоадъювантной химиотерапии в зависимости от количества курсов.
Таблица 1.
Влияние количества курсов неоадъювантной химиотерапии на эффективность лечения.
| Количество курсов | 2 | 3 | 4 |
| Число больных | 89 | 47 | 29 |
| Общий эффект (ПР+ЧР) | 47 (52,8%) | 29 (32,5%) | 14 (15,7%) |
| Полная регрессия | 17 (19,1%) | 9 (10,1%) | 6(6,7%) |
| Частичная регрессия | 30(33,7%) | 20 (22,4%) | 8 (8,9%) |
| Стабилизация | 41(46,0%) | 18 (20,2%) | 15 (16,8%) |
| Прогрессирование | 1 (1,1%) | - | - |
При анализе полученных результатов видно, что после двух курсов химиотерапии полный эффект зарегистрирован у 17 (19,1%) больных, после трех курсов он проявился еще у 9 (10,1%), а после проведения четырех курсов - у 6 (6,7%) пациентов, таким образом была выявлена группа пациенток, чувствительных к лекарственному лечению. Общий эффект после проведения всех 4 курсов химиотерапии составил - 35,9%.
В нашей работе была проанализирована зависимость степени лекарственного патоморфоза от количества курсов. Стабилизация заболевания после 2 курсов терапии была получена у 41 (46,0%) больной, после радикального хирургического лечения выявлен патоморфоз I и II степени у 18 (20,2%) и 23 (25,8%) пациенток, соответственно. Далее 47 женщинам был проведен 3курс лечения, у 18 (20,2%) из них не отмечено нарастания эффекта, поэтому им был проведен 2 этап лечения - хирургический. Патоморфоз I степени проявился у 1 (1,1%), II степени - у 9 (10,1%), III степени - у 7 (7,8%), IV степени - у 1 (1,1%) пациентки.
После 4 курсов химиотерапии у 29 больных была выполнена мастэктомия, в этой группе также был прослежен патоморфоз: II степени - у 3 (3,3%), III степени - у 11 (12,3%), IV степени - у 1 (1,1%). Итак можно сделать вывод, что при нарастании объективного эффекта лечения увеличивается и количество больных с более высокой степенью лекарственного патоморфоза.
В таблице 2 представлены данные влияния количества проведенных курсов неоадъювантной химиотерапии на общую и безрецидивную выживаемость.
Таблица 2.
Влияние количества курсов на общую и безрецидивную выживаемость.
| Количество курсов | 2 | 3 | 4 |
| Число больных | 89 | 47 | 29 |
| Общая выживаемость: | |||
|---|---|---|---|
| 3 года | 88,6 +/- 8,5% | 89,0 +/- 6,5% | 90,0 +/- 1,7% |
| 5 лет | 51,1 +/- 9,9% | 54,0 +\- 7,3% | 57,7 +/- 7,3% |
| 10 лет | 33,0 +/- 13,0% | 39,6 +/- 9,8% | 37,5 +/- 11,3% |
| Безрецидивная выживаемость | |||
| 3 года | 87,6 +/- 6,2% | 88,0 +/- 6,5% | 90,0 +/- 2,7% |
| 5 лет | 44,2 +/- 6,7% | 45,0 +/- 7,3% | 46,7 +/- 7,3% |
| 10 лет | 25,0 +/- 11,8% | 29,6 +/- 9,8% | 28,5 +/- 1,3% |
При анализе общей выживаемости трехлетние результаты практически не отличаются во всех трех группах, при пятилетнем сроке наблюдения отмечается незначительное увеличение выживаемости у больных с 4 курсами химиотерапии, при десятилетнем сроке наблюдения прослеживается нарастание увеличения общей выживаемости от курса к курсу, если после 3 курсов она составила 33%, то после 4 курсов - 37,5% (р=0,023).
При сравнении безрецидивной выживаемости можно также констатировать зависимость ее продолжительности от количества проведенных курсов лекарственной терапии, здесь также получены статистически достоверные результаты (р=0,032).
Из всего вышесказанного можно сделать вывод, что увеличение количества курсов неоадъювантной химиотерапии в группе больных с нарастанием объективного эффекта лечения и, соответственно, степени лекарственного патоморфоза способствует увеличению общей и безрецидивной выживаемости.
Важными факторами прогноза ответа опухоли на лечение являются следующие биологические параметры - индекс апоптоза (АИ), индекс пролиферации (Ki-67), и Bcl-2 (экспрессия белков). Работа по оценке биологических параметров ответа опухоли на лечение была также проведена в госпитале Royal Marsden. Полученные результаты подтверждают гипотезу о том, что апоптоз и пролиферация клеток зависимы друг от друга: снижение уровня апоптоза и пролиферации при повышении значения Bcl-2можно трактовать как появление резистентности клеток рака молочной железы к цитостатикам. В этом же исследовании проводили сравнение значений индекса апоптоза до и через 24 часа после проведения химиотерапии. Если эти результаты подтвердятся при проведении большого рандомизированного исследования, то мы получим уникальную возможность прогнозирования ответа опухоли на проводимое системное лечение сразу же после его начала, что даст нам возможность скорректировать план и схемы терапии.
Переходя от факторов прогноза к причинам, побудившим ученых начать рандомизированные исследования по изучению роли индукционной химио и гормональной терапии, следует отметить, что в работах на животных, перед хирургическим вмешательством проводилась системная терапия цитостатиками и тамоксифеном. Результатом данной работы стало увеличение общей выживаемости. Предположили, что удлинение продолжительности жизни явилось следствием уменьшения опухолевой диссеминации во время операции. Успех более раннего проведения системной терапии согласуется с гипотезой Goldie-Goldman, которая обосновывает необходимость более раннего воздействия на метастазы, учитывая возможность образования химиорезистентных мутантных клеток.
Интерес представляют данные одного из основополагающих исследований В-18, проведенное по эгидой NSABP (National Surgical Adjuvant Breast and Bowel Project), целью которого было сравнить безрецидивный промежуток и выживаемость в группах с неоадъювантной и адъювантной химиотерапией. Также перед учеными стояла задача определить насколько уменьшение размеров первичной опухоли или пальпируемых лимфатических узлов коррелирует с удлинением безрецидивной и общей выживаемости, а также насколько такой подход к лечению способствует увеличению уровня консервативных хирургических вмешательств.
В исследование было включено 1523 пациентки с первично-операбельными формами РМЖ и ожидаемой продолжительностью жизни - 10 лет. Набор больных производился в течение 5 лет с 1988 по 1993 годы. Для проведения химиотерапии как в неоадъювантном, так и в адъювантном режимах была выбрана схема АС (доксорубицин 60мг/кв.м и циклофосфан 600мг/кв.м) каждые 3 недели, всего планировалось провести 4 курса . Все женщины старше 50 лет принимали тамоксифен в дозе 20мг в день. Лучевую терапию начинали в течение 4 недель после проведения консервативной операции в группе с предоперационной химиотерапией (1), в группе в адъювантной химиотерапией (2) лучевая терапия проводилась в течение 4 недель после её окончания.
В первую группу было набрано 747, во первую -759 пациенток. Объективный эффект получен у 80% больных, полная регрессия опухоли (ПР) - у 36%, патоморфологическая полная регрессия (ППР) - у 26%. Уменьшение размеров лимфатических узлов отмечено у 89%, при этом ПР получена у 73% женщин. Количество консервативных хирургических вмешательств в первой группе увеличилось на 12% от планируемого уровня, при этом следует отметить, что у пациенток с размером опухоли > 5,1см - число органосохраняющих операций увеличилось до 175%.
Оценивая результаты этого исследования можно сказать, что наиболее важными факторами, влияющими на выбор тактики хирургического вмешательства является размер опухоли и статус лимфатических узлов. Чаще всего такой объем операции предполагалось выполнить пациенткам без поражения лимфатических узлов, возраст в данной ситуации не играл роли.
При анализе данных по безрецидивной и общей выживаемости в этих двух группах выяснилось, что значительных различий по этим двум параметрам в течение 5 лет наблюдения получено не было. В первой группе безрецидивная выживаемость составила 67,3% и 66,7%, соответственно, во второй. Также значительных различий не было получено при сравнении результатов отдаленной безрецидивной выживаемости - 73,2% и 73,3%, соответственно.
Конечно же, многих интересует вопрос об уровне местных рецидивов. За время наблюдения процент локо-региональных рецидивов составил 5,8% в послеоперационной группе и 7,9% в предоперационной группе. При этом полученные различия недостоверны.
Оказалось, что в развитии местных рецидивов наиболее значимую роль играет возраст (р 49 лет), то есть там, где женщины принимали тамоксифен. Аналогичные данные получены и в других работах. Поэтому одним из перспективных направлений в развитии стратегии неоадъювантной терапии является внедрение различных эндокринных препаратов. Например, в Великобритании уже начато рандомизированное исследование, где больные набираются в 3 группы, в одной пациентам предлагается прием только тамоксифена, в другой - аримидекса, в третьей - комбинации тамоксифен + аримидекс. Его целью является определить клинические и/или биологические различия (уровень пролиферации) при трех методах лечения.
Подводя итоги проведенных клинических исследований, мы можем сказать, что неоадъювантная химиотерапия может способствовать уменьшению размеров первичной опухоли, размеров и количества пораженных лимфатических узлов, что дает нам возможность увеличить число выполняемых органосохраняющих операций. Кроме того, она позволяет элиминировать отдаленные микрометастазы и помогает спланировать адъювантное лечение в зависимости от полученного патоморфоза опухоли и таких факторов прогноза, как экспрессия Bcl-2, индекса апоптоза и индекса пролиферации опухолевых клеток - Ki-67.
Единственным контраргументом для проведения предоперационной химиотерапии является проблема местного контроля за заболеванием. Исследования, в которых пациентам проводилось хирургическое лечение и лучевая терапия показали, что риск развития местного рецидива возрастает при увеличении объема пораженных тканей. Например, выявлено, что иногда две разные формы опухоли - внутрипротоковый рак и инвазивный рак могут занимать одинаковые объемы в молочной железе при обследовании на предоперационном этапе, хотя, обычно, внутрипротоковый рак имеет значительно меньшие размеры. Существует опасность, что какое-то число опухолевых клеток может оказаться за границей резекции. Весь вопрос в том, сколько их осталось в молочной железе? На данном этапе ответом могут служить данные, полученные при микроскопическом изучении краев резекции.
Во Франции, была проведена работа, где в одной группе на первом этапе лечения проводилась химиотерапия и лучевая терапия с последующей туморэктомией (она выполнена 47 пациенткам с остаточной опухолью Поделиться |
Корякин А.В., Сивков А.В., Ощепков В.Н., Рощин Д.А., Алексеев Б.Я., Аполихин О.И., Каприн А.Д.
Совершенствование диагностических технологий при неизменно высокой заболеваемости раком предстательной железы (РПЖ) позволяет выявлять это заболевание на ранних стадиях, что и обуславливает рост интереса к малоинвазивным методам локальной терапии [1]. Высокая клиническая эффективность и низкая травматичность брахитерапии сделали ее одним из методов выбора в лечении локализованного РПЖ [2].
Важным аспектом ведения онкологических пациентов является индивидуальное прогнозирование течения злокачественного процесса. Научно обоснованное определение прогноза позволяет не только получить представление об эффективности проведенного вмешательства, но и разработать индивидуальную тактику дальнейшего наблюдения и лечения. В настоящее время отдаленные результаты лечения методом 125 I брахитерапии достаточно хорошо изучены, определены критерии отбора пациентов и дозиметрические показатели для осуществления эффективного лечения [3]. Однако существует нерешенное противоречие в, казалось бы, общепринятом постулате о зависимости эффективности лечения от дозы радиации: увеличение дозы, влекущее за собой повышение частоты осложнений, вовсе не обязательно связано с лучшими результатами безрецидивной выживаемости [4,5]. Одно из первых сообщений, в котором высказывалось частичное несогласие с классическими постулатами лучевой терапии о прямой зависимости доза-реакция, поступило от D. Ash и соавт. (одного из пионеров метода брахитерапии в Европе). В 2006 г. ими приведены данные 667 пациентов, перенесших брахитерапию в госпитале Leeds в период 1995-2001 гг. Авторы сообщили об отсутствии значимой корреляции между D90 (дозой, получаемой 90% железы) и онкологическими результатами для всех пациентов, которые получили больше или меньше 140 Гр (р=0,43), как и для получивших больше или меньше 130 Гр (р=0,14). Однако анализ по группам риска показал, что у пациентов низкого риска была статистически значимая корреляция между D90 и контролем уровня простатспецифического антигена (ПСА) (р14 мл/сек, объем ПЖ 0,05) по основным показателям.
Таким образом, распределение больных по возрасту, стадии, степени дифференцировки опухоли, общему состоянию и сопутствующим соматическим заболеваниям в сравниваемых группах однородно (p>0,05), что позволило провести адекватный сравнительный анализ результатов лечения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
До лечения средний уровень общего ПСА в I группе составлял 7,3±2,4 нг/мл, во II – 8,1±2,5 нг/мл. Через 60 месяцев средний уровень упал до 9% и 12% от исходного в I группе и II группах, соответственно. При этом в обеих группах больных выявлены статистически значимые различия по сравнению с исходными показателями (р 125 I.
Комплекс математико-статистического анализа включал корреляционный и регрессионный методы. На первом этапе были изучены показатели обследования больных до начала лечения и дозиметрические показатели после лечения, возможно значимые для прогнозирования безрецидивной выживаемости – 7 прогностических факторов, с помощью которых построена математическая модель индивидуального прогнозирования безрецидивной выживаемости (табл. 2).
Для отбора наиболее значимых прогностических факторов при построении модели использована процедура пошагового регрессионного анализа показателей.
На основании регрессионного анализа выделенных факторов прогноза была построена математическая модель индивидуального прогнозирования ожидаемой безрецидивной выживаемости больных с локализованным РПЖ после проведения низкодозной брахитерапии.
Таблица 2. Набор факторов для прогнозирования безрецидивной выживаемости больных с локализованным раком предстательной железы
| Факторы прогноза | Градации | Обозначения, используемые в уравнениях |
|---|---|---|
| 1. Возраст на момент операции | полных лет | Х1 |
| 2. Стадия | 1,2 | Х2 |
| 3. ПСА | нг/мл | Х3 |
| 4. Объем предстательной железы | см 3 | Х4 |
| 5. Оценка по шкале Gleason | балл | Х5 |
| 6. D90 фактический, после имплантации | Гр | Х6 |
| 7.V100 фактический, после имплантации | % | Х7 |
Уравнение регрессии после 125I брахитерапии:
Формула модели имеет следующий вид: 
где z = a0+a1X1+a2X2+. + anXn a0,a1,a2,…an – коэффициенты модели.
ОБСУЖДЕНИЕ
В литературе описывается несколько десятков прогностических моделей для определения эффективности лучевой терапии и, в частности, брахитерапии. В таблице 3 представлены сравнительные характеристики 14 прогностических моделей для пациентов, перенесших брахитерапию предстательной железы и опубликованных после 2007 года. Наиболее часто встречающиеся прогнозируемые параметры в этих публикациях: ББРВ, вероятность развития метастатического заболевания или смерти от РПЖ, общая выживаемость.
Из всех представленных прогностических моделей, наиболее высокая точность заявлена у L. Potters и соавт., модель разработана на когорте из 5931 пациента и прошла внутреннюю валидизацию [8]. Модель прогнозирует вероятность 9-летней ББРВ.
Для 11 моделей, которые также рассчитывают вероятность рецидива, данные по точности не представлены. Еще три модели являются внешней валидизацией номограмм Каттана, при этом они обладают невысокой точностью (площадь под ROC кривой 0,49, 0,51 и 0,66).
Также важно отметить, что большинство прогностических средств, представленных в таблице, были разработаны на популяциях США, что также стоит учитывать при применении их в других регионах. Оптимальным представляется инструмент, который уже прошел внешнюю валидизацию на многонациональных когортах.
Отличие разработанного нами способа от других заключается в том, что в качестве факторов прогноза использовали следующую комбинацию клинических параметров: уровень ПСА до операции, объем ПЖ, градация по Gleason. Кроме того, учитывали дозиметрические показатели после проведения низкодозной брахитерапии D90 (Гр), V100 (%), что в конечном итоге позволило разработать модель, характеризующейся хорошей точностью – 0,79.
ЗАКЛЮЧЕНИЕ
Результаты нашей работы подтверждают, что тщательное обследование и правильный подбор пациентов, а также строгое соблюдение дозиметрических критериев позволяют добиваться наилучших результатов при лечении локализованного РПЖ методом 125I брахитерапии. При этом проблема индивидуального прогнозирования эффективности брахитерапии локализованного РПЖ остается весьма актуальной, достаточно сложной и еще не вполне решенной. Разработанная прогностическая модель может послужить инструментом при планировании новых клинических исследований, в том числе для изучения предсказательной точности на сроках, превышающих 5 лет, а также в группах пациентов повышенного риска. Использование критериев индивидуального прогнозирования бБРВ позволяет оценить эффективность проведенного лечения и составить план дальнейших диагностических и лечебных мероприятий.
ЛИТЕРАТУРА
Статья опубликована в журнале "Экспериментанльная и клиническая урология" №1 2019, стр. 51-56
Рак предстательной железы (РПЖ) диагностируют у 32 – 40% мужчин старше 50 лет. В половине случаев это локализованный рак, то есть опухоль не выходит за пределы простаты. Стандартом лечения в такой ситуации считается радикальная простатэктомия – одномоментное удаление новообразования. Не уступает по радикальности и лучевая терапия, которую часто рассматривают как альтернативу операции. Тем не менее, лечение не всегда эффективно. Иногда болезнь возвращается спустя несколько месяцев или лет после радикального лечения. Такое состояние называется рецидивом рака предстательной железы, который может быть локальным или местным, системным и биохимическим.
Вероятность рецидива после радикальной простатэктомии составляет от 10 до 28% в первые 5 лет после вмешательства. Это зависит от строения опухоли, соматического состояния пациента, размера новообразования. Например, если радикальную простатэктомию выполняли на стадии T3а (рак распространяется на клетчатку вокруг простаты), вероятность возрастает до 45%.

Развитие рецидива в течение 5 лет после лучевой терапии составляет 12 – 38%. При этом будут иметь значение не только особенности новообразования, но и доза облучения – чем она меньше, тем выше риски. Вид воздействия (брахитерапия или дистанционное) большой роли не играет.
Если же говорить о сроках в целом, 45% случаев регистрируются в течение 2 лет после радикального лечения, 77% – в пределах 5 лет, 96% – на протяжении 9 лет.
Биохимический рецидив
Протекает бессимптомно и определяется исключительно по результатам анализа на уровень простатспецифического антигена (ПСА или PSA). Это особый белок, который есть только в тканях предстательной железы. Соответственно, после ее удаления, уровень простатспецифического антигена должен резко снизиться до значений, не определяемых стандартными методами исследований. Если же, спустя некоторое время, уровень ПСА начинает вновь возрастать, это может означать лишь то, что в организме остались клетки опухоли, которые начали размножаться. Биохимический рецидив после радикальной простатэктомии диагностируют, когда уровень ПСА систематически увеличивается через три измерения подряд на 0,2 нг/мл и более, интервал между исследованиями больше или равен 2 неделям.
Подобная ситуация возможна и после радиотерапии. Конечно, при облучении часть тканей железы остается жизнеспособной и уровень ПСА не опускается до неопределяемых значений. Поэтому за исходную точку берут самый низкий уровень антигена.
Критерием биохимического рецидива считается повышение показателя PSA более чем на 2 нг/мл по сравнению с минимальным значением, отмечавшимся у больного.
Биохимический рецидив рака предстательной железы лечат облучением ложа простаты, иногда вместе с захватом области регионарных лимфоузлов.
Локальный рецидив
Локальный рецидив рака простаты после радикальной простатэктомии регистрируется в 15 – 35% случаев. Местным — считается появление очага опухоли в области расположения удаленной предстательной железы при отсутствии поражения лимфоузлов и отдаленных метастазов. Этот очаг должен быть визуализирован, то есть виден на УЗИ, компьютерной томограмме, при МРТ-обследовании или ПЭТ — КТ. Его злокачественность должна подтверждаться гистологически – то есть после взятия биопсии и исследования под микроскопом.
Клинических симптомов на ранней стадии обычно не бывает. Чаще всего во время очередного профилактического обследования у пациента обнаруживают вновь повысившийся уровень ПСА, после чего проводят углубленную диагностику и выявляют местный рост опухоли. Если пациент, вопреки рекомендациям, не обследуется профилактически после радикального лечения и рецидив на ранних стадиях не выявлен, на поздних этапах развития возвращаются некоторые симптомы запущенных стадий рака простаты: боли в промежности и над лобком, задержка мочи, запоры.

Лечение локального рецидива РПЖ зависит от того, какой метод был использован ранее.
Если первично возникший рак лечили с помощью лучевой терапии, при рецидиве выполняют радикальную простатэктомию (РПЭ). При этом вероятность послеоперационных осложнений выше, чем если бы хирургическое вмешательство было сделано при первичном раке: после облучения возрастает опасность повреждения прямой кишки, увеличивается кровопотеря во время вмешательства, высок риск возникновения недержания мочи, или, наоборот, контрактуры (патологического сокращения) шейки мочевого пузыря. 5-летняя безрецидивная выживаемость после операции 55 – 69%.
Если же первично была выполнена РПЭ, при лечении рецидива рака используют лучевую терапию. 5-летняя безрецидивная выживаемость при этом зависит от исходного уровня ПСА. Если он меньше 0,2 нг/мл, показатель 5-летней безрецидивной выживаемости достигает 77%, при 0,2 нг/мл опускается до 34%, а если уровень ПСА доходит до 1 нг/мл, прогноз расценивается как неблагоприятный.
Из экспериментальных методов, достоверной статистики эффективности которых пока нет, применяется криоабляция (замораживание) и воздействие сфокусированным ультразвуком высокой интенсивности (HIFU-терапия). Несмотря на то, что предварительные результаты исследований эффективности методик довольно обнадеживающие, в официальные гайдлайны эти манипуляции пока не включены.
Системный рецидив
Случается и так, что на момент радикального лечения остались недиагностированные микрометастазы, которые продолжили свое развитие после вмешательства. В этом случае трудно отличить системный рецидив (возобновление роста новообразования) от системной прогрессии опухоли (продолжения развития не удаленных очагов).
Отчасти, их можно различить по следующим критериям:
- повышение концентрации ПСА менее чем через год после операции;
- уровень ПСА удваивается за 4 – 6 месяцев;
- 8 – 10 баллов по шкале Глисона.
Системный рецидив клинически проявляется такими же симптомами, как и метастатический рак. Поскольку злокачественные новообразования предстательной железы метастазируют в кости, легкие, печень, возникают признаки поражения этих органов:
- боли в костях;
- патологические переломы;
- повышенный уровень кальция и щелочной фосфатазы крови;
- боли в позвоночнике;
- парезы, параличи (при сдавлении спинного мозга);
- боли в подреберье;
- увеличение печени;
- анемия.
Эти проявления сопровождаются общим недомоганием, повышением температуры до 37-38, потерей аппетита, резким снижением массы тела.
При системном рецидиве, равно как и при прогрессии рака предстательной железы применяют гормонотерапию, чаще всего – кастрацию.
Метастазы в кости подвергаются радиотерапии – облучение помогает уменьшить интенсивность болевого синдрома.
Читайте также:

