Бевацизумаб при раке молочной железы
На конгрессе ESMO 2014, проходившем в Мадриде, Испания, в рамках сессии по раку молочной железы (представленные публикации) исследователи показали результаты рандомизированных клинических исследований III фазы IMELDA и TANIA при HER2-негативном метастатическом раке молочной железы. В исследовании IMELDA добавление капецитабина к поддерживающей терапии бевацизумабом привело к статистически и клинически значимому улучшению выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ). Также была достигнута первичная цель исследования TANIA, показавшего статистически значимое улучшение ВБП на фоне поддерживающей терапии бевацизумабом после прогрессирования на терапии первой линии с добавлением бевацизумаба.
Улучшение результатов химиотерапии первой линии с помощью поддерживающей терапии может влиять на показатели ОВ. Комбинация бевацизумаба с химиотерапией первой линии значительно улучшает ВБП у пациентов с HER2-негативным местно рецидивирующим/метастатическим раком молочной железы. Преимущество бевацизумаба наиболее выражено при комбинированной терапии с таксанами. Кумулятивная токсичность не позволяет продолжать терапию таксанами до наступления прогрессирования заболевания.
До отмены регистрационного статуса режима бевацизумаб/доцетаксел в 2011 году эта комбинация считалась целесообразной опцией для первой линии терапии HER2-негативного метастатического рака молочной железы, обоснованием этому служили результаты исследования III фазы. При добавлении поддерживающей терапии бевацизумабом до наступления прогрессирования заболевания после максимум 9 курсов химиотерапии первой линии препаратом доцетаксел было отмечено значительное улучшение показателей ВБП и частоты ответов (ЧО) на лечение.
В открытом рандомизированном исследовании III фазы IMELDA оценивалась целесообразность переключения пациентов, продолжающих терапию ингибиторами VEGF, на менее токсичный режим химиотерапии с другим механизмом действия с целью обеспечения большей эффективности поддерживающей терапии. Предполагалось, что после исходного режима бевацизумаб/доцетаксел добавление капецитабина к поддерживающей терапии бевацизумабом, продолжающейся до наступления прогрессирования заболевания, поможет улучшить ВБП. Результаты исследования были представлены доктором Joseph Gligorov из отделения медицинской онкологии Университетской больницы Тенона, Париж, Франция.
В исследование включали пациентов с HER2-негативным измеряемым метастатическим раком молочной железы с общим статусом по шкале ECOG 3 степени тяжести (главным образом, ладонно-подошвенный синдром, гипертензия, но также и тромбоэмболии). Развитие ладонно-подошвенного синдрома привело к прекращению терапии капецитабином у 10% пациентов.
В рамках рандомизированных клинических исследований III фазы было показано, что добавление бевацизумаба к химиотерапии первой или второй линии значительно улучшает ВБП при HER2-негативном местно рецидивирующем/метастатическом раке молочной железы. Поддерживающая блокада VEGF может иметь значение для длительного контроля над заболеванием. В открытом рандомизированном исследовании III фазы TANIA оценивали дальнейшую терапию бевацизумабом у больных местно рецидивирующим/метастатическим раком молочной железы, ранее получавших лечение данным препаратом. Результаты исследования были представлены Gunther von Minckwitz, генеральным директором Немецкой группы по изучению заболеваний молочной железы (German Breast Group) и университетской клиники женского здоровья в Ной-Изенбурге, Германия.
Пациенты с HER2-негативным местно рецидивирующим/метастатическим раком молочной железы, у которых было выявлено прогрессирование заболевания во время/после ≥12 недель первой линии терапии бевацизумабом в комбинации с химиотерапией, были рандомизированы в соотношении 1:1 в группы химиотерапии второй линии с добавлением бевацизумаба или без (15 мг/кг каждые 3 недели или 10 мг/кг каждые 2 недели).
Факторами стратификации были: статус гормональных рецепторов; время до прогрессирования на терапии первой линии ( 1,5 × верхние границы нормы).
Вторая линия терапии продолжалась до наступления прогрессирования заболевания, неприемлемой токсичности или отказа от дальнейшего участия в исследовании. В группе химиотерапии, при наступлении прогрессирования заболевания, пациенты получали третью линию химиотерапии без добавления бевацизумаба (не проводился кроссовер); пациенты, исходно рандомизированные в группу химиотерапии в комбинации с бевацизумабом, при наступлении прогрессирования получали химиотерапию третьей линии и бевацизумаб.
Выбор режима химиотерапии проводился на основании предпочтений исследователя, но двойные комбинации не допускались: паклитаксел, наб-паклитаксел, доцетаксел, капецитабин, гемцитабин, пегилированный липосомальный доксорубицин, непегилированный липосомальный доксорубицин, доксорубицин, эпирубицин, винорельбин, циклофосфамид, иксабепилон и эрибулин (только для терапии третьей линии).
Первичной конечной точкой исследования являлась ВБП от момента рандомизации до второго прогрессирования заболевания/летального исхода. Дополнительные конечные точки включали: ВБП на фоне терапии второй линии в предварительно определенных подгруппах, ВБП на фоне терапии второй и третьей линии, рассчитанную от момента рандомизации до третьего прогрессирования заболевания/смерти, частоту объективных ответов на терапию второй линии; ОВ; безопасность; качество жизни и биомаркеры.
Размер выборки был рассчитан на основании предполагаемой медианы продолжительности ВБП 7-9,3 месяца и ОР 0,75. События ВБП, достигнутые у 384 из 488 пациентов, обеспечивают 80% статистическую мощность исследования при ошибке первого рода α = 0,05.
Результаты исследования TANIA
На конгрессе ESMO 2014 исследователи представили результаты предварительного анализа ВБП на фоне терапии второй линии. Конечные точки в отношении терапии третьей линии будут представлены в заключительном анализе.
За период с января 2011 по апрель 2013 года в исследование были включены 494 пациента (247 человек в группу химиотерапии и 247 – в группу химиотерапии с добавлением бевацизумаба). Исходные характеристики пациентов были сопоставимы в группах химиотерапии vs химиотерапия в комбинации с бевацизумабом: медиана возраста 54 vs 56 лет; тройной негативный фенотип 23,1% vs 19,8%; период без проявлений заболевания ≤12 месяцев 9,7% vs 7,3%.
Капецитабин наиболее часто становился препаратом выбора для терапии второй линии: 59,7% в группе химиотерапии и 60,4% в группе химиотерапии с добавлением бевацизумаба.
Медиана периода наблюдения была сопоставима в обеих группах. На момент закрытия базы данных 20 декабря 2013 года медиана ВБП на фоне терапии второй линии составила 4,2 месяца в группе химиотерапии и 6,3 месяца в группе химиотерапии с добавлением бевацизумаба (стратифицированное ОР=0,75; p=0,0068). Подгрупповой анализ ВБП с учетом факторов стратификации также оказался более благоприятным для группы бевацизумаб/химиотерапия.
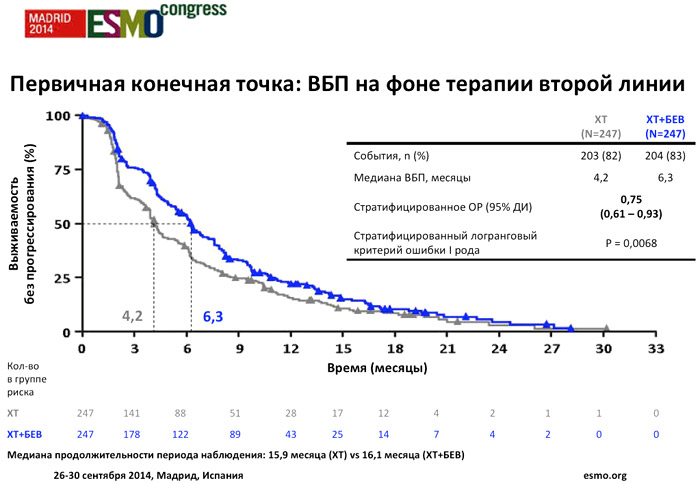
Не было отмечено статистически значимой разницы между двумя группами в отношении частоты наилучших объективных ответов (16,8% vs 20,9%). Однако стабилизация заболевания была зарегистрирована у 33,5% пациентов в группе химиотерапии и у 48,9% пациентов в группе бевацизумаб/химиотерапия.
Медиана продолжительности ответа составила 10,6 vs 8,3 месяца для пациентов, получавших химиотерапию или бевацизумаб в комбинации с химиотерапией.
Частота побочных эффектов была незначительно выше в группе, получавшей бевацизумаб в комбинации с химиотерапией:
- гипертензия (7,1% vs 13,5%),
- протеинурия (0,4% vs 6,9%),
- венозные тромбоэмболические события (2,1% vs 3,3%),
- фебрильная нейтропения (1,7% vs 3,3%),
- застойная сердечная недостаточность (0,4% vs 2,0%),
- кровотечения (1,7% vs 0,4%),
- артериальные тромбоэмболические события (1,3% vs 0%),
- осложнения процесса заживления ран (0% vs 0,8%),
- прободение органов желудочно-кишечного тракта (0% vs 0,4%),
- фистула/абсцесс (0% в обоих группах).
Выводы исследования TANIA
Исследователи заключили, что была достигнута первичная конечная точка исследования, показав статистически значимое улучшение ВБП на фоне поддерживающей терапии бевацизумабом после прогрессирования заболевания на терапии первой линии с добавлением бевацизумаба. Данные по безопасности терапии второй линии соответствовали результатам предыдущих исследований бевацизумаба при местно рецидивирующем/метастатическом раке молочной железы. Заключительные данные ОВ и ВБП с момента рандомизации до прогрессирования на терапии третьей линии/летального исхода, а также результаты по безопасности терапии третьей линии ожидаются к середине 2015 года.
Доктор Hope Rugo, который также участвовал в обсуждении результатов данного исследования, прокомментировал, что в исследовании TANIA была предпринята попытка выяснить влияние химиотерапии по сравнению с таргетной монотерапией в качестве поддерживающей терапии после ответа на лечение. Фактически 85% пациентов получали таксаны в первую линию химиотерапии (73% паклитаксел). Была отмечена необычайно высокая ВБП на фоне терапии первой линии. Почти 60% пациентов получали капецитабин во вторую линию. ВБП была выше на фоне поддерживающей терапии бевацизумабом; также было отмечено увеличение частоты стабилизации заболевания, но не ЧОО и, как и в предшествующих исследованиях, наибольшее преимущество было отмечено у больных с тройным-негативным фенотипом рака молочной железы.
Кроме того, терапия бевацизумабом сопровождалась более тяжелой токсичностью (гипертония, протеинурия, нейтропения).
Поддерживающая химиотерапия улучшает ВБП и ОВ после ответа на химиотерапию первой линии. Неясные дополнительные преимущества бевацизумаба должны быть сбалансированы с затратами на лечение и токсичностью. Не следует назначать монотерапию бевацизумабом в качестве поддерживающей терапии у данных пациентов. Примерно у 75% больных отмечается положительный статус гормональных рецепторов, что указывает на возможную роль поддерживающей гормональной терапии.
Доктор Rugo заключил, что на сегодняшний день роль бевацизумаба в лечении рака молочной железы неясна.
После презентации на конгрессе ESMO 2014 результаты исследований IMELDA и TANIA будут опубликованы в журнале Lancet Oncology.
- Abstract 352O – Efficacy and safety of maintenance bevacizumab (BEV) with or without capecitabine (CAP) after initial first-line BEV plus docetaxel (DOC) for HER2-negative metastatic breast cancer (mBC): IMELDA randomised phase III trial.
- Abstract 353O – Efficacy and safety in TANIA, a randomised phase III trial of continued or reintroduced bevacizumab (BEV) after 1st-line BEV for HER2-negative locally recurrent/metastatic breast cancer (LR/mBC).
Спонсором клинических исследований IMELDA и TANIA является компания Ф. Хоффманн-Ля Рош.
У пациентов с метастатическим раком молочной железы (MBC) рандомизированные контролируемые исследования оценивали бевацизумаб в качестве лечения первой линии, что улучшало скорость ответа опухоли и выживаемость без прогрессирования (PFS) при добавлении к химиотерапии. В Марокко мы провели обсервационное исследование для изучения клинических особенностей, лечения и прогноза, связанного с химиотерапией на основе бевацизумаба, в лечении первой линии HER2-отрицательного MBC.
В исследование было включено 19 женщин. У всех этих женщин был диагностирован отрицательный MBC HER2 в Национальном институте онкологии в Рабате (Марокко) в период с января 2009 года по декабрь 2010 года. Средний возраст пациентов составлял 48,1 года. У четырех пациентов (21%) наблюдалось метастатическое заболевание при диагнозе, а 15 пациентов (79%) получали лечение для первого метастатического рецидива. Кость, печень и легкие были наиболее частыми местами метастазов. Пациентов наблюдали до апреля 2011 года. Большинство пациентов имели объективный ответ; 15,8% от полного ответа, 47,3% частичного ответа и 21,1% от стабилизации. Медиана PFS оценивалась в 11,5 месяцев. Анализ подгрупп показал статистически значимое различие (тест на ранжирование: p = 0,01); PFS для пациентов, получавших Бевацизумаб — еженедельный паклитаксел, оценивали в 18,1 месяца и на 9,1 месяца для пациентов, получавших комбинацию Бевацизумаб — Доцетаксел. Это преимущество в PFS было связано с приемлемым профилем безопасности.
Как показано в этом исследовании, химиотерапия на основе бевацизумаба в первой линии лечения HER2-отрицательного MBC в Марокко и особенно в сочетании с таксанами расширяет PFS, что подтверждается в недавнем метаанализе 3 рандомизированных контролируемых исследований фазы III.
Метастатический рак молочной железы (MBC) редко излечивается, а медианная выживаемость после развития метастатического заболевания составляет всего от 2 до 3 лет [1]. Хотя многие химиотерапевтические агенты доступны для лечения MBC, медианная продолжительность жизни не улучшилась до недавнего времени.
Многочисленные исследования показали, что ангиогенез и, в частности, избыточная экспрессия VEGF (сосудистый эпидермальный фактор роста) играют существенную роль в росте, прогрессировании и метастатическом потенциале рака молочной железы 2. После этого VEGF стал основной целью антиангиогенной терапии.
Бевацизумаб является гуманизированным рекомбинантным моноклональным антителом, которое специфически блокирует связывание VEGF с высокоаффинными рецепторами [6]. У пациентов с MBC рандомизированные контролируемые исследования, оцениваемые Bevacizumab как лечение первой линии, показали улучшение скорости ответа опухоли и выживаемости без прогрессирования (PFS) при добавлении к химиотерапии 8. Однако ни одно из испытаний не показало значительного преимущества для выживания. Совсем недавно метаанализ трех рандомизированных контролируемых исследований III фазы подтвердил, что добавление Bevacizumab к схемам химиотерапии дает существенную пользу женщинам с MBC с точки зрения PFS и объективного ответа (OR), но не в общей выживаемости (ОС ) [10].
Цель нашей работы — сообщить гистологические и терапевтические характеристики, описать OR и профиль безопасности и в основном проанализировать PFS пациентов, получавших химиотерапию на основе бевацизумаба, в лечении первой линии HER2-отрицательного MBC, особенно в марокканском населении.
Это наблюдательное институциональное исследование. Мы проводили поиск записей пациентов в Отделе клинической онкологии в Национальном институте онкологии Рабата в период с января 2009 года по декабрь 2010 года для всех опухолей, кодируемых как HER2 (рецептор человеческого эпидермального фактора роста), отрицательный MBC. В исследовании были соблюдены этические правила для медицинских исследований с участием людей, как это предусмотрено в Декларации WMA Хельсинки. Наш местный комитет больниц одобрил это исследование, и пациенты дали свое согласие. Файлы 19 HER2 отрицательных пациентов с MBC, лечившихся в нашем учреждении, были тщательно проанализированы.
У всех пациентов был установлен гистологически доказанный диагноз рака молочной железы. Статус рецептора HER2 / neu оценивали с использованием IHC (иммуногистохимия) или FISH (флуоресценция in situ гибридизации). Показатель экспрессии HER2 / neu онкопротеинов оценивали с использованием теста Hercep Test, набрали 0 (отсутствует) или 1+ (слабый), а отрицательность амплификации гена HER2 / neu была подтверждена FISH, если оценка 2+ (умеренная) в тесте Hercep.
Это исследование исключило HER2 положительный MBC, и все пациенты получали уже первую линию лечения MBC с или без Bevacizumab.
Среди 19 пациентов, получавших HER2-отрицательный MBC, у 4 (21%) было метастатическое заболевание при диагностике, а 15 (79%) получили лечение первого метастатического рецидива (после медианного времени 32,8 месяца после адъювантного лечения локализованного заболевания).
Пациентов наблюдали до апреля 2011 года. Все пациенты, которые не были пересмотрены на последней консультации, снова связались по телефону.
Оценка ответа проводилась с использованием критериев RECIST (критерии оценки ответа на солидные опухоли). Полный ответ (CR) был определен как полное исчезновение всех доказательств заболевания. Частичный ответ (PR) определялся как уменьшение по меньшей мере 30% от суммы наибольших диаметров каждого целевого поражения без появления новых повреждений. Прогрессирование определяли как увеличение как минимум 20% от суммы наибольших диаметров каждого целевого поражения или появление одного или нескольких новых повреждений.
Выживаемость без прогрессирования была рассчитана с даты начала лечения до прогрессирования или до даты последнего посещения.
Данные анализировались с использованием Win-hospital; электронный CRF (форма отчета о делах). Описательная статистика с 95% доверительным интервалом (ДИ) рассчитывалась в соответствии со стандартной процедурой. Кривые выживания были построены с использованием метода Каплана-Мейера. Для сравнения кривых выживаемости использовался логарифмический тест. Тест проводился с уровнем значимости 5%.
Средний возраст пациентов составил 48,1 года. Инфильтрационная протоковая карцинома была преобладающим гистологическим подтипом, и у большинства пациентов были раковые опухоли SBR (Scarff, Bloom и Richardson) II степени (47,3%) и положительные гормональные рецепторы (63,1%) (таблица 1).
Клинико-патологические характеристики пациентов
Как указано в таблице 2 ниже, сайт метастаза был переменным; (63,1%), печени (47,3%) и легких (47,3%). Однако следует подчеркнуть, что проценты в таблице 2 не составляют до 100% из-за перекрытия
Используемые химиотерапевтические режимы были разными. Семь пациентов (36,8%) получали Бевацизумаб (10 мг / кг в день 1 и 15) — Паклитаксел (90 мг / м2 в день 1, 8 и 15) каждые 4 недели, а 7 других пациентов (36,8%) получали Бевацизумаб (15 мг / кг в день 1) — Доцетаксел (100 мг / м2 в день 1) каждые 3 недели. Комбинация Bevacizumab (15 мг / кг в день 1) — Паклитаксел (175 мг / м2) каждые 3 недели была получена 2 пациентами (10,5%), а 2 других пациента (10,5%) получали Бевацизумаб (15 мг / кг на 1 день) — капецитабин (1000 мг / м2 с 1 по 14 день). Только 1 пациент (5,2%) использовал протокол Бевацизумаб (15 мг / кг в день 1) — Navelbine (25 мг / м2 в день 1 и 8)
Среднее число полученных циклов составляло 10 циклов (от 1 до 31)
После медианного числа 6 курсов химиотерапии на основе бевацизумаба у большинства пациентов был объективный ответ; 3 пациента (15,8%) достигли CR, 9 (47,3%) достигли PR, а 4 пациента (21,1%) получили стабилизацию при лечении. Однако у 3 пациентов (15,8%) заболевание прогрессировало (табл. 3)
Оценка ответа на лечение
После медианного наблюдения в течение 24 месяцев медианная PFS оценивалась в 11,5 месяцев. Анализ подгрупп показал статистически значимое различие (тест на ранжирование: p = 0,01); PFS для пациентов, получавших Бевацизумаб — еженедельный паклитаксел, оценивался в 18,1 месяца, а в 9,1 месяца для пациентов, получавших комбинацию Bevacizumab — Docetaxel (рисунок 1)
Кривая Каплана-Мейера для выживания пациента.
Химиотерапия на основе бевацизумаба, как правило, хорошо переносилась (гипертензия 2-го уровня у одного пациента, который хорошо управлялся лечением, а легкая эпистаксия отмечена у 3 пациентов). Только одна серьезная токсичность была отмечена у одного пациента, представленного кровавой диареей 3-й степени, требующей прекращения лечения (таблица 4)
Рост и развитие опухолей зависят от ангиогенеза [11]. Фактор роста эндотелия сосудов (VEGF) является ключевым проангиогенным медиатором, сверхэкспрессированным во многих опухолях и связанным с плохим прогнозом, что делает его привлекательной мишенью для развития биологической терапии [12]. Агенты, которые нацелены на ангиогенез, процесс, необходимый для всех типов солидной опухоли, могут принести пользу всем пациентам с раком молочной железы, независимо от характеристик пациента и / или болезни. Показано, что ингибирование передачи сигналов VEGF обеспечивает контроль роста опухоли и метастазирования, вызывая регрессию сосудистой сети опухоли, нормализацию выживающей сосудистой сети и ингибирование дальнейшего ангиогенеза опухолей [13,14].
Бевацизумаб представляет собой гуманизированное моноклональное антитело, которое специфически связывает VEGF, препятствуя его взаимодействию с рецепторами на сосудистых эндотелиальных клетках и тем самым ингибируя его проангиогенные эффекты [15, 16]. Bevacizumab в настоящее время одобрен для лечения MBC, метастатического колоректального рака, немелкоклеточного рака легкого и рака почки [17,18]. Он также одобрен в Соединенных Штатах для лечения рецидивирующей мультиформной глиобластомы [17].
Доклинические доказательства того, что таксаны имеют антиангиогенные, а также цитотоксические эффекты, указывают на возможный синергизм с агентами, нацеленными на VEGF [19,20]. Это вызвало большой интерес к комбинации антиангиогенных биологических агентов с таксанами. В настоящее время Bevacizumab является самым продвинутым анти-VEGF-агентом в разработке, с клиническими данными, доступными из трех исследований III фазы у пациентов с MBC [7,9,21-23].
Рак молочной железы – наиболее распространенное онкологическое заболевание среди женщин во всем мире. По статистике ВОЗ удельный вес этой патологии составляет 16% от всех случаев онкологических заболеваний среди женского населения. Рак молочной железы встречается в любом возрастной группе, но с возрастом риск развития этого заболевания увеличивается, резко возрастая после 40 лет. За последнее время заболеваемость раком молочной железы выросла во всех странах. Не более 5% в структуре этой заболеваемости занимают семейные и генетические раки.
Рак молочной железы представляет собой злокачественное новообразование, которое развивается в результате раковой трансформации эпителиальных клеток протоков молочной железы (протоковый рак молочной железы), либо эпителия долек молочной железы.
На сегодняшний день конкретная причина развития рака молочной железы не известна, но существует ряд факторов комплексно повышающих риск развития заболевания:
- курение, алкоголь, недостаток физической активности, лишний вес;
- избыточное пребывание на солнце, сильный стресс, механическое повреждение груди;
- ранняя первая менструация, поздний климакс, малочисленные и поздние роды, аборты, недолгое кормление грудью.
В настоящее время единственный самый надежный способ борьбы против злокачественных новообразований молочной железы – это ранняя его диагностика, что дает возможность достичь полного выздоровления в процессе лечения в 94% случаев.
Современные терапевтические мероприятия, которые используются при раке груди, предусматривают применение хирургических методов лечения в сочетании с одним из методов адьювантной терапии (лучевая терапия рака молочной железы, гормональной терапии, химиотерапии, иммунотерапии).
Одним из препаратов, используемых в качестве средства адьювантной терапии рака молочной железы, является бевацизумаб. Этот препарат представляет собой рекомбинантные моноклональные антитела, ингибирующие эндотелиальный фактор роста сосудов. В 2008 году бевацизумаб прошел регистрацию в Управлении по контролю над качеством пищевых продуктов и лекарственных средств США (Food and Drug Administration, FDA) как средство первой линии терапии рака молочной железы в фазе метастазирования, негативного по рецепторам к человеческому эпидермальному фактору роста 2. Данные, свидетельствовавшие о значимом улучшении выживаемости без прогрессирования болезни, но не выживаемости в целом, на фоне лечения бевацизумабом и паклитакселом в сравнении с терапией одним паклитакселом, явились основанием для проведения ускоренной регистрации препарата в FDA. Это в свою очередь явилось основанием для проведения ряда клинических исследований эффективности применения бевацизумаба с другими химиопрепаратами.
18 ноября 2011 года FDA заявил об аннулировании регистрации бевацизумаба в комбинации с паклитакселом для лечения метастазирующего рака молочной железы. В свете этого события весьма своевременными явились результаты исследования В-40 NSABP , в рамках Национального проекта по адъювантной терапии рака молочной железы и кишечника и исследования GBG44 (GeparQuinto).
Оба исследования являются одними из первых исследований неоадьювантной терапии рака молочной железы, для которых опубликованы предварительные результаты. Исследования были спланированы таким образом, что в случаях рак молочной железы метастазы за конечную клиническую точку принималась суррогатная клиническая конечная точка – выживаемость пациенток без прогрессирования рака. Такая тактика более рациональна, так как подобные пациенты имеют много большую продолжительность жизни, чем длится исследование и, как правило, получают ряд других препаратов системного действия, которые также могут повлиять на такую конечную точку, как общая выживаемость. Вместе с тем остается нерешенным вопрос, а действительно ли значимое улучшение выбранной суррогатной клинической точки имеет достоверное прогностическое значение успешной терапии пациенток с ранней стадией рака молочной железы? Этот вопрос можно решить, только имея сведения о рецидивировании онкологического процесса и выживаемости пациентов, полученные в продолжающихся клинических исследованиях адъювантной и неоадъювантной терапии бевацизумабом.
Противоречивые мнения относительно лечения новообразований молочной железы бевацизумабом выходят далеко за рамки учения об ангиогенезе опухолей молочной железы и включают вопросы относительно использования суррогатных клинических конечных точек в клинических исследованиях, также экономическую аргументацию в условиях постоянного роста цен на лекарственные препараты для лечения рака.
Именно с такой позиции необходимо рассматривать результаты исследований NSABP B-40 и GBG44, так как оба они продемонстрировали значимое улучшение второй суррогатной клинической конечной точки – полной морфологической ремиссии, на фоне терапии бевацизумабом.
Основной целью представленных исследований явилось получение ответа на вопрос возможно ли добиться увеличения частоты полной морфологической ремиссии у пациенток с неметастазирующим раком молочной железы на фоне комбинированной терапии бевацизумабом с другими химиотерапевтическими препаратами. Оба исследования продемонстрировали улучшение этого показателя. В исследовании GBG44 частота полной морфологической ремиссии на фоне комбинированной терапии бевацизумабом на 3,5% выше, чем без такой терапии (полная морфологическая ремиссия в этом исследовании – отсутствие остаточной опухоли в молочной железе и лимфатических узлах). В исследовании NSABP B-40 частота ремиссии была выше на 6,3% 9 (полная морфологическая ремиссия в этом исследовании – отсутствие остаточной опухоли только в молочной железе). Разница в результатах обоих исследований теряла статистическую значимость при использовании более строгого определения морфологической ремиссии – отсутствие остаточной опухоли только в молочной железе.
В комбинированной терапии рака молочной железы в рамках исследований GBG44 и NSABP B-40 применяли схему, включающую доцетаксел вместо применения паклитаксела в исследовании, результаты которого явились основанием для начальной регистрации бевацизумаба. В результате использования в комбинированной терапии паклитаксела и бевацизумаба медиана выживаемости без прогрессирования опухоли составила около 1 года в трёх независимых исследованиях, что, возможно, лучше, чем выживаемость без прогрессирования, которая была получена при использовании других схем с бевацизумабом, когда проводилась химиотерапия при раке молочной железы с метастазами.
Одной из возможных причин такой разницы является то, что положительный эффект бевацизумаба является химиотерапевтически специфичным и в случае комбинации с паклитакселом в большей степени проявляется синергизм антиангиогенного эффекта данного препарата, чем в других комбинациях.
Противоречивые данные были получены при проведении подгруппового анализа в исследованиях GBG44 и NSABP B-40.
Вместе с тем, у пациенток с раком молочной железы позитивным по гормональным рецепторам частота полной морфологической ремиссии значимо возросла в исследовании NSABP B-40, а в исследовании GBG44 разницы продемонстрировано не было.
Эффективность бевацизумаба у женщин с диагностированным позитивным по гормональным рецепторам раком молочной железы является неожиданной и может служить основанием для разработки новой гипотезы.
В настоящее время объединенные группы специалистов из обоих исследований проводят анализ биомаркеров и возможно результаты этой совместной работы позволят определить прогностически достоверно значимые биомаркеры ответа на бевацизумаб, что в свою очередь улучшит эффективность использования этого препарата в терапии у женщин с раком молочной железы за счет целенаправленного отбора кандидатов.
Несмотря на то, что исследования GBG44 и NSABP B-40 проведены качественно, существующие противоречия в отношении терапии бевацизумабом не получили разрешения. Если суррогатные клинические конечные точки, используемые в представленных исследованиях, окажутся прогностически достоверно значимыми для роста общей выживаемости при ранней степени рака молочной железы, то будет доказана обоснованность суррогатных конечных точек в клинических исследованиях и решение Управления по контролю над качеством пищевых продуктов и лекарственных средств США об аннулировании регистрации бевацизумаба в комбинированной терапии рака молочной железы окажется под вопросом.
Вместе с тем, учитывая высокую стоимость расходов и ограниченность ресурсов здравоохранения всех стран на лечение раковых заболеваний, любое положительное влияние на выживаемость бевацизумаба или других препаратов на основе нуклеиновых кислот будет сопоставляться с затратами на мероприятия по разработке новых молекулярно-ориентированных лекарственных препаратов.
Читайте также:

