Bcl 2 при лимфомах
Реципроктная транслокация t(14;18) обнаруживается в большинстве лимфом с фолликулярной морфологией и в одной трети диффузных крупноклеточных лимфом ( Tsujimoto et al., 1984 ; Cleary, Sklar, 1985 ; Tsujimoto, Croce, 1986 ; Yunis et al., 1987 ; Weiss et al., 1987 ). Частота такой транслокации зависит, по-видимому, от региона ( Amakawa et al., 1989 ; Pezzella et al., 1990 ). Так, при фолликулярной лимфоме эта транслокация чаще всего обнаруживается в США (90%), с промежуточной частотой встречается в Европе (70%) и лишь изредка в Японии (30%) ( Amakawa et al., 1989 ).
Как показали молекулярно-генетические исследования, при транслокации t(14;18) обычно осуществляется перенос гена bcl-2 ( B cell lymphoma/leukemia-2 ), расположенного на хромосоме 18, в транскрипционно активный иммуноглобулиновый локус, расположенный в бенде 14q32 (ген IgH ) ( Cleary et al., 1986 ; Seto et al., 1988 ; Tsujimoto et al., 1988 ). При этом происходит дерегуляция гена bcl-2 , являющегося окоген ом ( Reed et al., 1988 ).
В 70% случаев при t(14;18) разрыв происходит в небольшой (около 100 пар нуклеотидов) 3'-нетранслируемой области экзона 3 гена bcl-2 ( mbr - major breakpoint region), расположенной в 18q21 ( Tsujimoto et al., 1985 , Tsujimoto et al., 1987 ; Tsujimoto, Croce, 1986 ; Cleary, Sklar, 1985 ). Точки разрыва в локусе IgH расположены обычно точно на 5'конце сегментов JH ( Bakhshi et al., 1985 ).
Анализ первичной структуры 3'-горячей точки гена bcl-2 , по которой происходит разрыв при транслокации, позволил обнаружить в ней сигнальные последовательности, участвующие в процессе рекомбинации генов Ig . Все это позволило сделать вывод о прямом участии V-(D)-J-рекомбиназы в транслокации хромосом t(14;18) . Эта рекомбиназа, в частности, осуществляет разрыв на хромосоме 14.
Менее понятен механизм разрыва хромосомы 18. Недавно получены указания на участие в этом процессе эндогенной нуклеазной активности, присутствующей в ранних В-клетках ( Jaeger et al., 1991 ). Эти авторы выделили из ядерных экстрактов В-клеток белок с мол. массой 45 кД, который избирательно связывался с гомопурин-гомопиримидиновой последовательностью гена bcl-2 , расположенной на 5'-границе mbr .
Поскольку перемещение гена bcl-2 осуществляется именно в локус IgH есть основания думать, что этот процесс происходит на стадии пре-В-клеток.
Имеется между тем и иная точка зрения. Были, в частности, получены данные, говорящие о том, что разрыв на хромосоме 18 не происходит в месте сигналов для рекомбиназы ( Bakhshi et al., 1987 ). Авторы обнаружили не полностью реципрокный характер транслокации t(14;18) . При этой транслокации часто происходит делеция области, расположенной между сегментами DH и JH, а также появляются экстрануклеотиды в местах соединения der(14) и der(18). Все это предполагает, что незаконное спаривание осуществляется между концами сегментов DH;and JH на хромосоме 14 и двунитевыми разрывами на хромосоме 18 ( Tsujimoto et al., 1988 ). Согласно данным Кнеба с соавт. ( Kneba et al., 1991 ), полученным при анализе 165 NHL с t(14;18) , при которой формируется слитая последовательность bcl-2 /JH за счет разрыва в mbr , встречается только в трех подгруппах лимфом: центробластно-центроцитарных (39%), центробластных (6%) и иммуноцитарных (8%).
Слитая последовательность формирует ген ( bcl-2 - IgH ), который экспрессируется конститутивно с образованием различных химерных транскриптов ( Cleary, Sklar, 1985 ), кодирующих белок Bcl-2 , неотличающийся от белка, синтезируемого на неперестроенном гене bcl-2 . Вместе с тем показано, что в ряде случаев транслоцированный ген bcl-2 содержит, подобно гену c-myc в клетках BL , соматические мутации, которые вызывают изменения в кодирующей области ( Seto et al., 1988 ; Tanaka et al., 1992 ). Поскольку при фолликулярной лимфоме происходит гипермутация в локусе IgH ( Cleary et al., 1986 ), которая в норме осуществляется на очень специфичной стадии развития В-клеток, имеются основания считать, что в отличие от BL (см. выше) при фолликулярной лимфоме В-клетки проходят эту стадию.
Вместе с тем анализ, проведенный Хуа с соавт. ( Hua et al., 1990 ), не позволил выявить соматические мутации в гене bcl-2 ни в одной из 12 проанализированных фолликулярных лимфом. Эти авторы считают, что нарушение роста и дифференцировки при данных В-клеточных лимфомах обусловлено скорее всего аномальной экспрессией гена bcl-2 , а не его структурными изменениями.
В связи с противоречивостью данных относительно соматических мутаций, изменяющих Bcl-2 при фолликулярных лимфомах, возник вопрос, не являются ли они результатом применения хемотерапии к пациентам. Исследуя больных с транслокацией t(14;18) , которые не подвергались лечению от этого заболевания, Танака с соавт. ( Tanaka et al., 1992 ) обнаружили 6 точечных мутаций в кодирующей области гена bcl-2 в 3 из 5 опухолей, причем у 2 пациентов была выявлена идентичная транзиция C - T. Наличие такой транзиции, характерной для Ig-генов и транслоцируемого гена c-myc ( Zajac-Kaye et al., 1988 ; Morse et al., 1989 ), а также выявление кластера из 4 точечных мутаций в транслоцируемом гене bcl-2 у одного из пациентов, позволил авторам сделать вывод о действии соматического гипермутационного механизма, ассоциированного с Ig-генами . Поскольку в данном случае ген bcl-2 располагался на расстоянии примерно 300 кб от локуса IgH , этот механизм может работать на большой дистанции от Ig-генa . Между тем вопрос о роли соматических мутаций в прогрессии лимфом остается открытым.
Известно, что транслоцированный ген bcl-2 активно экспрессируется в фолликулярных лимфомах, а неизмененная аллель является транскрипционно молчащей ( Seto et al., 1988 ). Причина транскрипционной дерегуляции транслоцированного гена bcl-2 пока остается не до конца ясной. Поскольку энхансер гена IgH при транслокации оказывается рядом с геном bcl-2 , было постулировано, что подстановка гена bcl-2 в цис-положение по отношению к этому потенциальному энхансеру и вызывает дерегуляцию гена. Как показало исследование, проведенное Ридом с соавт. ( Reed et al., 1989 ), экспрессия гена bcl-2 в клетках с t(14;18) изменяется на уровне транскрипции. В отличие от нормальных лимфоцитов, в лимфомных клетках транскрипция происходит постоянно на высоком уровне.
Неопределенность, в частности, связана с тем, что иногда точки разрыва при фолликулярной лимфоме располагаются в других местах гена bcl-2 , например, в 10-20% случаев они локализуются 3' по отношению к гену в так называемой области mcr (minor cluster region), которая лежит на расстоянии около 30 кб от гена ( Cleary et al., 1987 ). Изредка разрывы обнаруживают и на 5'-конце гена bcl-2 . Такая "горячая точка" транслокации характерна, например, для фолликулярной лимфомы, в которой обнаружен необычный порядок расположения рекомбинирующих генов ( Tsujimoto et al., 1987 ). В данном случае при транслокации произошла, по-видимому, инверсия или bcl-2 , или локуса IgH .
Хиллион с соавт. ( Hillion et al., 1991 ) обнаружили три фолликулярных лимфомы с вариантной транслокацией t(2;18)(p11;q21) , при которой разрыв в гене bcl-2 произошел на 5'-конце, а переместился он в локус IgK . Это напоминает ситуацию, имеющую место при вариантной транслокации в случае BL, когда идет перемещение локуса c-myc в локус IgL . Поскольку во всех 3 описанных Хиллионом с соавт. лимфомах разрыв происходил в одной и той же 5'-области гена bcl-2 , можно говорить о наличии еще одного "горячего" кластера. Как показал специально проведенный анализ ( Adachi, Tsujimoto, 1990 ), в 5'-горячей точке гена bcl-2 содержатся элементы, потенциально способные принимать Z-форму, а сигнальные последовательности, обнаруженные в 3'-горячей точке, отсутствуют.
Таким образом, транслокации гена bcl-2 могут осуществляться с помощью различных молекулярных механизмов. Вероятно перестройкам, происходящим между bcl-2 и IgH , способствует открытая конформация этих генов, экспрессирующихся в пре-В-клетках. Рекомбинация же bcl-2 и IgL происходит, когда bcl-2 уже не экспрессируется, но при этом, возможно, в открытой конформации остается 5'-концевой домен гена.
В результате транслокации хромосом при лимфомах ген bcl-2 экспрессируется в В-клетках постоянно ( Seto et al., 1988 ). Предполагается, что белок Bcl-2 в норме может участвовать в фолликулярной организации лимфоцитов, а нарушения в локусе bcl-2 могут приводить к развитию слабых (indolent) лимфом, дифференцировка которых напоминает архитектуту нормальных лимфоузлов ( Koduru, Offit, 1991 ).
При фолликулярной лимфоме в результате хромосомной транслокации часто образуется новая генная структура, обеспечивающая транскрипцию гибридной мРНК : bcl-2 / IgH (конкретно bcl-2 /JH или bcl-2 /DH). При этом может осуществляться соединение гена bcl-2 с Сgammma-областью IgH -гена. Гамма-локус Ig-ген а является гипермутабельным и, как оказалось, транслоцированный в этот локус ген bcl-2 содержит соматические мутации ( Seto et al., 1988 ). Позднее, однако, Хуа с соавт., исследуя возможные механизмы возникновения фолликулярной лимфомы, обнаружили ( Hua et al., 1990 ), что во многих случаях имеет место не образование гибридного продукта, а лишь усиление экспрессии гена bcl-2 . При этом выяснилось, что мутации в кодонах 7 или 129, которые были известны ранее ( Seto et al., 1988 ), не обязательны при возникновении лимфомы, хотя и являются доволно частым со- бытием ( Tanaka et al., 1992 ).
Белок Bcl-2 , кодируемый геном bcl-2 , относится к классу G-белков ( Haldar et al., 1989 ). В норме этот белок, частично ассоциирован с клеточной мембраной, а также обнаруживается в перинуклеарном эндо- плазматическом ретикулуме ( Tsujimoto, Croce, 1988 ; Chen-Levy et al., 1989 ). Он экспрессируется в пре-В-клетках, но отсутствует в терми- нально дифференцированных В-клетках. Считается, что Bcl-2 блокирует программированную клеточную смерть в В-клетках и поддерживает способ- ность к иммунному ответу ( Nunez et al., 1991 ). Интересно также, что белок Bcl-2 , обладает гомологией с одним из белков EBV ( Cleary et al., 1986 ). Показана комплементация продуктов генов bcl-2 и c-Ha-ras , которые имеют сходную локализацию и сходные биохимические свойства ( Reed et al., 1990b ). Котрансфекция этих белков в фибробла- сты грызунов приводила к морфологической трансформации клеток.
Котрансфекция Bcl-2 с ядерными онкобелками (например, c-Myc ) не вызывала подобный эффект. В то же время продукты онкогенов c-myc и c-Ha-ras комплементируют друг с другом. Следовательно, сходные онкобелки ( Bcl-2 и c-Ha-Ras ) регулируют, по-видимому, различные комплементарные пути, приводящие к клеточной трансформации.
Анализ двух линий лимфомных клеток из японских больных, проведенный Амакава с соавт. ( Amakawa et al., 1990 ), показал, что при фолликулярной лимфоме наряду с транслокацией хромосом имеет место амплификация хромосомы 18q-, которая происходит в результате дупликации.
Фолликулярная лимфома является опухолью из клеток фолликулярных центров (центроцитов — мелких клеток с расщепленным ядром и центробластов — крупных клеток с нерасщепленным ядром). В зависимости от пропорции крупных клеток выделяют три цитологических типа фолликулярных лимфом. Иммуноморфологические критерии диагностики имеют наиболее важное значение при мелкоклеточных фолликулярных лимфомах и позволяют дифференцировать эти лимфомы от мантийно-клеточных, лимфом из малых лимфоцитов/ХЛЛ и лимфом маргинальной зоны. Характер роста мелкоклеточных (I цитологический тип) фолликулярных лимфом может быть различным.
По нашим данным, основанным на углубленном морфологическом изучении иммунологически верифицированных мелкоклеточных В-клеточных лимфом, в 60 % наблюдений опухолевые клетки формируют нодулярные структуры. Нодули, как правило, имеют четкие границы, располагаются равномерно по срезу лимфатического узла. В 25,7 % случаев опухолевый рост имеет смешанный, нодулярно-диффузный, характер.
В 14,3 % опухолевые клетки растут диффузно. Следует отметить, что без иммунофенотипической верификации диагноза подобное исследование было бы невозможным.
Важной в дифференциальной диагностике фолликулярной лимфомы с реактивными фолликулярными гиперплазиями является гиперэкспрессия белка BCL-2. Считается, что это происходит в результате активации протоонкогена BCL-2, попадающего под контроль регуляторных генов иммуноглобулинов при транслокации 14;18. Данная транслокация встречается практически при всех фолликулярных лимфомах в странах Западной Европы и Америке (более 90 % случаев), а в России отмечена только у 10 % больных фолликулярными лимфомами.
Гиперэкспрессия BCL-2 может иметь патогенетическое значение при фолликулярной лимфоме, способствуя тому, что опухолевые клетки не погибают апоптозом, как это происходит с нормальными клетками зародышевых центров фолликулов лимфатических узлов.
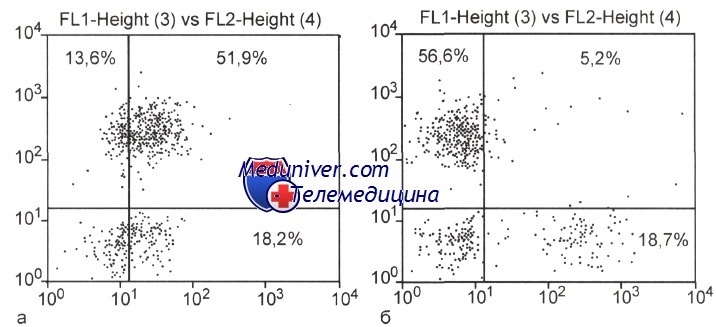
Коэкспрессия антигена CD23 (а) и отсутствие антигена CD5 (б) на CD20-позитивных лимфоцитах костного мозга при фолликулярной лимфоме.
На оси абсцисс — FITC; на оси ординат — РЕ.
Частота экспрессии белка BCL-2 убывает по мере нарастания пропорции центробластов при фолликулярной лимфоме. BCL-2 не имеет дифференциально-диагностического значения при разграничении фолликулярной лимфомы от других В-клеточных лимфом низкой степени злокачественности, так как большинство из них также экспрессируют этот белок. Кожные фолликулярные лимфомы часто бывают BCL-2-негативными.
Фолликулярные лимфомы по иммунологическому фенотипу отличаются от ХЛЛ и мантийно-клеточных лимфом. Опухолевые клетки экспрессируют В-клеточные антигены (CD19, CD20, CD22, CD79a) обычно в сочетании с CD10 и/или CD23. По нашим данным, молекула CD10 выявляется примерно в 43 % фолликулярных лимфом I цитологического типа. Этот маркер более характерен для клеток нодулей, чем для межфолликулярных злокачественных В-клеток.
Отмечается экспрессия мембранных иммуноглобулинов классов M+/-D, реже — G или А. Клетки светлых центров фолликулов, являющиеся субстратом фолликулярных лимфом, подвержены соматическим гипермутациям Ig-генов, поэтому мембранные иммуноглобулины могут быть экспрессированы неотчетливо (с точки зрения оценки клональности по L-цепям иммуноглобулинов) или даже отсутствовать (чаще на центробластах). Мембранные молекулы CD5, CD43, а также ядерный белок циклин D1 отсутствуют при фолликулярных лимфомах. Только в единичных случаях фолликулярных лимфом III цитологического типа отмечена экспрессия CD43.
В зонах фолликулов присутствует сеть фолликулярных дендритных клеток (CD21+ CD23+), что отмечается в 70 % фолликулярных лимфом I цитологического типа.
Опухолевые клетки фолликулярной лимфомы экспрессируют ядерный белок BCL-6.
В большом проценте случаев фолликулярные лимфомы лейкемизируются, что делает возможным постановку диагноза и проведение иммунологического мониторинга путем иммунологического исследования лимфоидных клеток крови и костного мозга.
Важную роль играют иммунологические методы дифференциальной диагностики при фолликулярных лимфомах.
Фолликулярная лимфома
Фолликулярная лимфома (ФЛ) или лимфома фолликулярных центров является второй по частоте подгруппой В-клеточных неходжинских лимфом (НХЛ) (15-30% от всех НХЛ).
В настоящее время наблюдается повышение заболеваемости ФЛ во многих странах.
Течение заболевания характеризуется длительной общей выживаемостью при одновременном наличии системных рецидивов.
Мужчины и женщины заболевают с одинаковой частотой при среднем возрасте больных в момент установления диагноза 50-60 лет. Клинически фолликулярная лимфома имеет вялотекущий характер в большинстве случаев; симптоматика в целом скудная и зависит от топики лимфоаденопатии.
Заболевание наиболее часто начинается с увеличения периферических лимфоузлов или селезенки, лимфоузлы средостения увеличиваются редко. Увеличение парааортальных лимфоузлов вызывает ощущение дискомфорта в брюшной полости или появление других локальных симптомов. Экстранодальная локализация наблюдается у 10% пациентов, в основном в желудочно-кишечном тракте; редко поражается кожа. Менее чем у 20% больных выявляется интоксикационный синдром.
Костный мозг вовлекается в процесс примерно в 50% случаев с картиной типичной нодулярной инфильтрации. У 10% больных отмечается лимфоцитоз и циркуляция опухолевых клеток в периферической крови.
Гистологически при ФЛ структура лимфоузла напоминает нормальные зародышевые центры. Центроциты и центробласты формируют неопластические терминальные центры. Характер роста обычно фолликулярный, но в редких случаях носит диффузный характер. Цитогенетически у 90% пациентов с фолликулярной лимфомой определяется t (14; 18) (q32; q21).
Эта транслокация ведет к гиперэкспрессии протеина BCL-2. Однако общая выживаемость больных коррелирует не с гиперэкспрессией генов в клетках опухоли, а с гиперэкспрессией генов в инфильтрирующих опухоль иммунных лимфоцитах. В 85% случаев при ФЛ встречается t (16; 20) (q32; q21). Клетки ФЛ (суспензия клеток опухоли или гистологические препараты) имеют фенотип CD19+, CD20+, CD10+, CD3-, CD5-.
Стадия фолликулярной лимфомы устанавливается с учетом количества пораженных лимфатических зон и с учетом количества бластов:
стадия I - количество бластов менее 5%,
стадия II - количество бластов 5-15%,
стадия III - количество бластов более 15%.
Более поздние стадии расцениваются как IIIа стадия (сочетание центроцитов и бластов) или IIIб (диффузное преобладание бластов). Клинически стадии протекают более медленно с рецидивами, в то время как стадии III и IIIа имеют более агрессивное течение и поэтому при них терапия должна проводиться по протоколам лечения диффузной В-крупноклеточной лимфомы (ДВККЛ).
Факторами риска (ФНП) при ФЛ являются: мужской пол, пожилой возраст, большая масса опухоли, интоксикационный синдром, инфильтрация костного мозга, повышение лактатдегидрогеназы (ЛДГ) выше 700 Ед/л или повышение уровня р2-микроглобулина.
Согласно рекомендациям FLIPI (Follicular lymphoma international prognostic index) выделяют три прогностические группы в соответствии с наличием ФНП: группа благоприятного прогноза (0-1 ФНП), промежуточная (2 ФНП), неблагоприятного прогноза (более 3 ФНП).
Несмотря на отнесение больных к группе благоприятного прогноза в момент установления диагноза, в 40% случаев ФЛ в финале трансформируется в диффузную крупноклеточную иммунобластную лимфому, требующую проведения терапии по соответствующим протоколам. При этом часто выявляется del (6); возникновение мелкоклеточной лимфомы ассоциируется с t (8; 14)(q24; q23)
Наблюдение показано у пациентов с отсутствием симптоматики в III-IV стадиях, которые не имеют интоксикационного синдрома или других осложнений, обусловленных лимфомой. Пациенты должны регулярно проходить обследование для уточнения активности процесса. Полихимиотерапия (ПХТ) начинается при признаках прогрессирования заболевания: нарастание интоксикации, увеличение лимфоузлов, поражение костного мозга.
Лучевая терапия показана в стадиях при отсутствии bulk disease: облучение вовлеченных в процесс зон в суммарной очаговой дозе (СОД) 40 Гр. Хотя такая терапия вызывает длительные ремиссии, рецидив неизбежен. Комбинированная терапия в начальных стадиях (ПХТ+лучевая терапия) вызывает более длительные ремиссии у пациентов с ФЛ, но общая выживаемость сравнима с таковой при проведении только лучевой терапии. Поэтому проведение комбинированной терапии не рекомендуется в ранних стадиях ФЛ.
ПХТ показана при появлении симптомов прогрессирования после периода наблюдения. Монохимиотерапия алкилирующими препаратами приемлема для пациентов с наличием противопоказаний для более агрессивной полихимиотерапии.
Применяются различные протоколы ПХТ: CHOP, R-CHOP, FCM, R-FCM или более интенсивные схемы ПХТ при наличии ранних рецидивов. Включение в схемы полихимиотерапии ритуксимаба (aнти-CD20-антител) приводит к уничтожению клеток лимфомы вследствие комплемент- и антитело-обусловленной клеточной цитотоксичности.
В комбинации ритуксимаба и ПХТ результаты сравнимы с эффектом от проведения миелоаблативной консолидации. Поддерживающая терапия rINF удлиняет безрецидивную выживаемость, но вызывает побочные эффекты. Новым направлением терапии является применение ингибиторов протеосом, блокаторов BCL-2 и адоптивной иммунотерапии.
Пациенты молодого возраста с наличием ФНП при наличии синдрома интоксикации или больших опухолевых масс являются кандидатами на проведение миелоаблативной химиоконсолидации с последующей ауто- трансплантации гемопоэтических стволовых клеток (ТГСК). Алло-ТГСК с проведением миелоаблации или редуцированного кондиционирования является единственным методом излечения при генерализованных стадиях фолликулярной лимфомы и рекомендуется при рецидивах заболевания.
Лимфомы маргинальной зоны
Лимфомы маргинальной зоны представлены:
Моноцитоидный тип лимфомы маргинальной зоны встречается преимущественно у лиц пожилого и старческого возраста, часто выявляется в I-II стадиях и не имеет тенденции к ранней диссеминации. Первыми проявлениями болезни могут быть поражение лимфоузлов или наличие локальных экстранодальных очагов опухоли.
Часто поражаются селезенка, печень, молочная железа, слюнные железы. Риск развития моноцитоидной НХЛ повышается у пациентов с аутоиммунными заболеваниями типа синдрома Сьегрена и тиреоидита Хашимото (не исключается, что данные заболевания могут быть ранними проявлениями моноцитоидной неходжинской лимфомы).
Иммунофенотип, формирование опухолевой ткани в лимфоидном органе и ее морфологические особенности позволяют считать, что эта опухоль формируется из В-клеток маргинальной зоны фолликула. Опухолевые клетки экспрессируют антигены CD5, CD10, CD11c, PCA-1. В лечении применяется спленэктомия; ПХТ по протоколам FC или FCR вызывает длительные ремиссии.
MALT-лимфомы
Согласно классификации ВОЗ, лимфомы, происходящие из мукозоассоциированной лимфоидной ткани, относятся к экстранодальным лимфомам маргинальной зоны MALT-типа и составляют 8% от всех НХЛ. Для них характерно развитие первичного очага в эпителиальной ткани (желудок, легкие, слюнные, щитовидная и паращитовидные железы, реже - тонкий кишечник), лимфоэпителиальная деструкция и вялое клиническое течение.
В эпителиоидных тканях в норме лимфоидные клетки отсутствуют и появляются там обычно при хронической инфекции. Установлена причинная связь (90%) MALT-лимфомы желудка с инфицированием Helicobacter pylori (HP). Эрадикация HP может привести к ремиссии MALT-лимфомы.
Средний возраст пациентов с MALT-лимфомой желудка около 60 лет с одинаковой частотой заболеваемости у мужчин и женщин. Наиболее частыми симптомами являются диспепсии и эпигастральный дискомфорт, очень редко - классический интоксикационный синдром. При ФГДС на слизистой желудка находят реактивные В-клеточные фолликулы с центроцитоидоподобными лимфоидными клетками мелких и средних размеров.
Наиболее часто опухоль локализуется в антральном отделе, мультифокальное поражение определяется в 35% случаев. В момент установления диагноза MALT-лимфома диссеминирована у 30% больных: выявляется поражение костного мозга, множественное поражение лимфоузлов, экстранодальные очаги; повышен уровень в2-микроглобулина. Типичные клетки лимфомы имеют фенотип CD20+, CD21+, IgM+, CD5-, CD10-, IgD-, циклин D-.
С MALT-лимфомой специфически ассоциированы транслокации: t (11; 18) (q21; q21), t (1; 14) (p22; q32) и t (14; 18) (q32; q21). В результате t (11; 18) образуется химерный сливной ген, который специфически связан с MALT-лимфомами, не отвечающими на эрадикацию HP; при этой транслокации значительно реже бывает трансформация в ДВККЛ. t (1; 14) и t (14; 18) соответственно, дерегулируют экспрессию BCL10 и MALT1.
Стадия I: опухоль локализована в желудочно-кишечном тракте (ЖКТ)
Стадия II: опухоль в ЖКТ выходит за пределы первичной локализации: вовлечение перигастральных или перимезентериальных лимфоузлов:
- II2: вовлечение парааортальных или паракавальных лимфоузлов
- II3: пенетрация серозных оболочек с вовлечением прилегающих органов или тканей
Стадия III при MALT-лимфомах не выделяется
Стадия IV: диссеминация процесса или вовлечение супрадиафрагмальных лимфоузлов
Вариант терапии MALT-лимфомы зависит от наличия HP, стадии заболевания, наличия t (11; 18) и признаков трансформации в ДВККЛ.
Эрадикация HP проводится во всех случаях комбинацией трех препаратов в течение 10-14 дней:
- омепразол 20 мг 2 раза в день,
- кларитромицин 500 мг 2 раза в день,
- амоксициллин 1,0 гр. 2 раза в день; при непереносимости препарата назначают метронидазол 500 мг 2 раза в день.
Пациентам в стадии генерализации проводит терапию как и при других вариантах вялотекущих лимфом: полихимиотерапия с включением ритуксимаба (протоколы R-CHOP, R-FCM). С учетом активации NF-kB протеина можно проводить таргентную терапию с применением ингибиторов протеосом.
Лимфомы зоны мантии
Клиническими проявлениями являются: генерализованная лимфоаденопатия, гепатоспленомегалия; у 60% больных имеет место поражение костного мозга, около 30% пациентов имеют интоксикационный синдром. У некоторых пациентов лейкемическая диссеминация может быть найдена в момент установления диагноза.
В 10% случаев поражается желудочно-кишечный тракт по типу множественного полипоза. В начальной стадии опухоль имеет нодулярный характер роста, который при прогрессировании процесса сменяется диффузным. При гистологическом исследовании выявляется мономорфная пролиферация лимфоидных клеток малой и средней величины в сочетании с фолликулярными дендритическими клетками.
Опухолевые клетки имеют фенотип CD19+, CD20+, CD5+, CD22+, CD24+, CD10-HLA-DR, циклин D1+ в сочетании с экспрессией IgM. Лимфомы зоны мантии имеют специфический маркер t (11; 14) (q13; q32); при этой транслокации происходит реаранжировка гена BCL-1 c последующей экспрессией циклина D1.
ЛЗМ имеют неблагоприятный прогноз в связи с относительной резистентностью клеток опухоли к химиопрепаратам. Терапия по протоколам R-CHOP и Hyper-CVAD в 90% случаев позволяет достичь ремиссии, но ее длительность невелика. Применение меченых антител (миелоаблативная радиохимиотерапия) повышает общую выживаемость у пациентов моложе 65 лет.
В редких случаях при локализованных стадиях с малой величиной лимфоузлов лучевая терапия может вызывать длительные ремиссии. Алло-ТГСК может быть рекомендована при рецидиве заболевания.
В последнее время большое внимание уделяется применению ингибиторов протеосом в терапии НХЛ при резистентности к проводимой ПХТ. Протеосомы являются ферментным комплексом, необходимым для деградации протеинов, вовлеченных в процесс роста и выживания клеток, в частности, вовлеченных в процесс контроля клеточного цикла.
Они модулируют уровень циклина, циклинзависимых киназ и их ингибиторов р21, р23, р53; играют центральную роль в транскрипции, контролируя уровень NF-kB. Аномальная активация NF-kB при гиперэкспрессии обратных киназ может привести к прогрессированию лимфом, а также к резистентности опухолевых клеток к ПХТ и радиационному воздействию.
В частности, подтип В-активированной ДВККЛ характеризуются накоплением NF-kB белка в ядрах клеток. Обычно регулируемые NF-kB протеины блокируют апоптоз, воздействуя на гены семейства BCL-2 и на гены семейства ингибиторов апоптоза. NF-kB влияет на процесс пролиферации, вовлекая такие таргентные гены, как циклин-D2 и c-myc, а также индуцирует продукцию IL-6 и IL-10 при неходжинских лимфомах.
Ингибирование протеосом вызывает антинеопластический эффект, воздействуя на различные регуляторные механизмы, включая апоптоз, подавляет клеточный рост и снижает экспрессию генов, участвующих в процессе клеточной адгезии, миграции и ангиогенеза.
Высокоактивным ингибитором протеосом, связывающим активные центры фермента, является бортезамид (велкейд). Его антилимфомный эффект при ЛЗМ обусловлен различными механизмами, включая подавление прогрессии клеточного цикла, индукцию апоптоза и подавление ангиогенеза. Он ингибирует экспрессию NF-kB и циклина-DL.
При применении бортезамида получены хорошие результаты в терапии лимфом зоны мантии и ДВККЛ (подтип из активированных В-лимфоцитов). Возможна комбинация бортезамида в комбинации с полихимиотерапией ингибиторами гистондеацетилазы (HDAC) и активаторами апоптоза. Изучается эффект применения в терапии ЛЗМ более мощного ингибитора протеосом - карфилзомида.
Новое направление в терапии лимфом зоны мантии - применение ингибиторов HDAC, которые восстанавливают экспрессию генов тумор-супрессоров и/или генов-регуляторов клеточного цикла в клетках НХЛ и блокируют пролиферацию этих клеток. Терапия ЛЗМ препаратом этой группы - субероиланилидингидроксаликовой кислотой - SAHA (вориностат) вызывает остановку митоза в G1 или G2 фазе, а также дерегулирует циклин-D1 hD2, активируя р53, р21, р27.
Дериваты рапамицина - темзиралим и эверолим - вызывают остановку клеточного цикла путем снижения уровня циклина D1. Возможно их применение в виде монохимиотерапии или в сочетании с ритуксимабом и другими препаратами при прогрессировании или рецидиве лимфом зоны мантии.
Еще одним направлением в терапии ЛЗМ является применение иммуномодуляторов - талидамида и леналидамида. Они оказывают прямое цитотоксическое действие на некоторые типы клеток, модулируют иммунитет посредством изменения продукции цитокинов и клеточных изменений опухолевых клеток, реактивных Т- и NK-клеток, вызывая индукцию апоптоза путем обратной регуляции сосудистого эндотелиального фактора роста (VEGF).
Леналидамид как иммуномодулятор и ингибитор протеосом, является высокоэффективным препаратом в лечении лимфомы из малых лимфоцитов, ЛЗМ, ФЛ, множественной миеломы, периферической Т-клеточной лимфомы и ДВККЛ.
В качестве терапии второй линии или при рефрактерности к проводимой ПХТ при НХЛ высокой степени злокачественности рекомендуются следующие протоколы:
винкристин 1,4 мг/м2 в/венно в 1-й день,
преднизолон 60 мг/м2 внутрь 1-5 дни,
этопозид 100 мг/м2 в/венно 1-3 дни,
новантрон 10 мг/м2 в/венно в 1-й день.
Протокол применяется при НХЛ низкой степени злокачественности с интервалом в 28 дней.
блеомицин 10 мг/м2 в/венно 1,5 дни,
адрибластин 50 мг/м2 в/венно в 1-й день,
циклофосфан 750 мг/м2 в/венно в 1-й день,
винкристин 1,4 мг/м2 в/венно в 1-й день,
преднизолон 60 мг/м2 внутрь 1-5 дни.
Протокол применяется при неходжинских лимфомах высокой степени злокачественности с интервалом 21 день.
Pro-MACE-Cyta-BOM:
циклофосфан 650 мг/м2 в/венно в 1-й день,
адрибластин 25 мг/м2 в/венно в 1-й день,
этопозид 120 мг/м2 в/венно в 1-й день,
преднизолон 60 мг/м2 внутрь 1-15 дни,
цитарабин 300 мг/м2 в/венно в 8-й день,
блеомицин 5 мг/м2 в/венно в 8-й день,
винкристин 1,4 мг/м2 в/венно в 8-й день,
метотрексат 120 мг/м2 в/венно в 8-й день,
лейковорин 100 мг внутрь 9-10 дни.
Протокол применяется при НХЛ высокой степени злокачественности с интервалом 21 день.
MIME:
метилгаг 500 мг/м2 в/венно 1,14 дни,
ифосфамид 1000 мг/м2 в/венно 1-5 дни,
метотрексат 30 мг/м2 в/мышечно в 3-й день,
этопозид 100 мг/м2 в/венно 1-3 дни.
Интервал между курсами - 21 день.
цитарабин 300 мг/м2 в/венно 1, 8, 15 дни,
блеомицин 6 мг/м2 в/венно 1, 8, 15 дни,
этопозид 120 мг/м2 в/венно 1-3 дни,
прокарбазин 100 мг/м2 внутрь 10-21 дни.
Интервал между курсами - 35 дней.
пентостатин 2-1 мг/м2 в/венно в 1-й день,
циклофосфан 600 мг/м2 в/венно в 1-й день,
ритуксимаб 375 мг/м2 в/венно в 1-й день.
Интервал между курсами - 21 день.
Применяется для лечения рефрактерных форм хронического лимфолейкоза (ХЛЛ).
Курсы 1, 3, 5, 7:
циклофосфан 300 мг/м2 в/венно 2 раза в сутки - 1-3 дни,
месна 6500 мг в/венно инфузоматом в течение 72 часов,
винкристин 2 мг/м2 в/венно 4, 11 день,
адриамицин 50 мг/м2 в/венно 4-й день,
дексаметазон 40 мг внутрь 1-4, 11-14 дни.
Курсы 2, 4, 6, 8:
метотрексат 1000 мг/м2 в/венно инфузоматом в течение 24 часов - в 1-й день,
цитарабин 3000 мг/м2 в/венно 2 раза в сутки - 2, 3 день,
лейковорин 15 мг/м2 в/венно через 12, 18, 24 часа после завершения инфузии,
метотрексата.
В отсутствие цитопении курсы 2, 4, 6, 8 начинаются сразу после окончания курсов 1, 3, 5, 7; если есть цитопения, то введение гранулоцитарного колониестимулирующего фактора (Г-КСФ) в дозе 10 мкг/кг подкожно начинают с первого дня перерыва после 1, 3, 5, 7 курсов; Г-КСФ вводится до выхода из агранулоцитоза.
Введение месны начинают одновременно с инфузией циклофосфана и завершают через 72 часа. Одним из осложнений лечения неходжинских лимфом является развитие вторых злокачественных новообразований - примерно в 12% случаев.
Риск развития острого миелоидного лейкоза (ОМЛ) наиболее высок при ПХТ с включением алкилирующих агентов, препаратов нитрозомочевины и высокодозной ПХТ. Заболеваемость ОМЛ достигает максимума через 5-7 лет, чаще как исход миелодиспластического синдрома (МДС) и не поддается лечению. Частота солидных опухолей - рак молочной железы, легких - начинает нарастать через 5-7 лет наблюдения и достигает максимума через 20 лет после проведения лучевой терапии.
Контрольные осмотры при НХЛ проводятся каждые три месяца на протяжении первых 2-х лет, каждые 6 месяцев в течение последующих трех лет, затем - один раз в год. Развернутый анализ периферической крови и определение уровня ЛДГ проводятся на 3, 6, 12, 24 месяцах наблюдения, а затем при появлении подозрительных симптомов.
Оценку функции щитовидной железы проводят больным, получавшим лучевую терапию на область шеи на 1, 2, 5 годах наблюдения. Компьютерную томографию исходных очагов поражения проводят на 6, 12, 24 месяцах после окончания лечения.
После проведения лучевой терапии на область грудной клетки в пременопаузальном возрасте, а также в возрасте до 25 лет женщин следует подвергать скринингу для исключения индуцированного рака молочной железы, сначала по клиническим данным, а после 40-50 лет - с помощью маммографии.
Читайте также:

