Барий взаимодействует с хлором
Барий хлористый — неорганическое вещество, которое 
можно рассматривать как соль соляной кислоты. С точки зрения химии — бинарное соединение. Синоним названия — хлорид бария. Формула BaCl2. Получают реактив термохимическим способом из концентрата природного барита.
Тонкозернистый порошок белого или сероватого цвета с мелкими бесцветными кристалликами. Водорастворим, слабо растворим в спирте и спиртовых растворах, не растворим в эфирах. Из водных растворов выкристаллизовываются бесцветные кристаллогидраты с одной или двумя молекулами воды. Реактив огне- и взрывобезопасен. Проявляет диамагнитные свойства.
Химически достаточно активная соль. Реагирует с другими солями в водных растворах, если в результате получается нерастворимое соединение, выпадающее в осадок. Это свойство используется в аналитике для обнаружения сульфат-ионов. Хим. реактив способен образовывать двойные соли, эвтектические смеси, а с бромидом бария — твердые растворы.
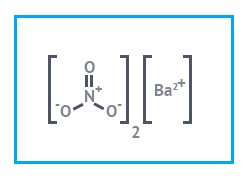 | 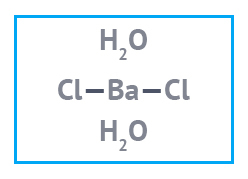 | 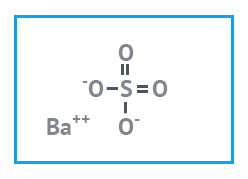 |
| Барий азотнокислый Имп. | Барий хлористый | Барий сернокислый |
Меры предосторожности
Барий хлористый безводный и его кристаллогидраты крайне токсичны. Отравление приводит к необратимым последствиям для головного мозга и серьезному поражению почек, селезенки, желудочного тракта, параличу и потере зрения. Попадание реактива с пылью оказывает негативное воздействие на органы дыхания. Опасно также попадание пыли или раствора в глаза или на кожу.
При проглатывании следует сразу же вызвать врача и промыть желудок 1%-ным раствором сернокислого натрия или магния. Если порошкообразный реактив рассыпан, его нельзя заливать водой. Его следует изолировать, засыпать песком и потом утилизировать.
Работать с хлористым барием следует в спец. одежде, респираторе, резиновых перчатках и защитных очках. Помещение должно быть оборудовано вентиляцией, а места возможного сильного запыления — локальным укрытием и дополнительной местной вентиляцией. В лабораториях для работы с хлоридом бария используют вытяжной шкаф.
Хранят реактив в полиэтиленовых мешках, в сухом помещении, строго следят за тем, чтобы он не контактировал с водой. Перевозят любым крытым транспортом, кроме самолета.
При нагревании BaCl2 разлагается с выделением химически активного хлороводорода, поэтому пожарные должны быть извещены, если в зоне пожара оказались значительные количества реактива.
- В химпроме для получения солей бария и реактивов
![]()
на основе бария; пигментов, в том числе таких популярных как баритовый желтый и касселева зелень. - Входит в состав электролитов, использующихся при электролитическом получении химически чистого магния и алюминия.
- Часть смесей, применяющихся для закалки сталей режущих марок.
- В технологии горячего прессования в металлургии.
- В сталелитейном производстве — для цианирования (насыщения верхнего слоя металлической поверхности углеродом и азотом).
- Для обработки кож с целью их осветления и утяжеления.
- Входит в состав массы, из которой изготавливают керамические изделия.
- В аналитической химии — для обнаружения в растворах присутствия серной кислоты или сульфатов (выпадает белый осадок).
- Для уничтожения насекомых-вредителей растений в сельском хозяйстве.
Характеристики и физические свойства хлорида бария
Он хорошо растворяется в воде, при этом не подвергаясь гидролизу, так как образован сильной кислотой и сильным основанием.

Рис. 1. Хлорид бария. Внешний вид.
Основные характеристики хлорида бария приведены в таблице ниже:
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Температура разложения, o С
Растворимость в воде (20 o С), г/100 мл
Получение хлорида бария
В лабораторной практике для получения хлорида бария используют следующие реакции:
Химические свойства хлорида бария
В водном растворе хлорид бария диссоциирует на ионы:
Он хорошо растворяется в концентрированной азотной кислоте и разлагается серной, но нерастворим в концентрированной хлороводородной кислоте.
Хлорид бария вступает в реакции обмена с другими солями только в случае образования в качестве продуктов нерастворимого вещества, газообразного или малодиссоциирующего соединения:
Применение хлорида бария
Хлорид бария используют в кожевенном деле, при производстве керамических изделий, пигментов, а также в химическом анализе, как качественный реактив для обнаружения сульфат-анионов.
Примеры решения задач
| Задание | Вычислите массу хлорида бария, который может прореагировать с концентрированным раствором серной кислоты объемом 100 мл (массовая доля H2SO4 98%, плотность 1,8365 г/мл). Определите объем хлороводорода, выделяющийся в результате этой реакции. |
| Решение | Запишем уравнение реакции: |
Найдем массу раствора серной кислоты, а также массу растворенного вещества H2SO4 в нем:
msolution =100 × 1,8365 = 183,65г.
Рассчитаем количество моль серной кислоты (молярная масса равна 98 г/моль):
Согласно уравнению реакции n (H2SO4) :n (HCl) = 1: 2. Значит,
n(HCl) = 2 × n(H2SO4) = 2 × 1,84 = 3,86 моль.
Тогда, объем выделившегося хлороводорода будет равен:
V (HCl) = 3,86 × 22,4 = 82,432 л.
Согласно уравнению реакции n(H2SO4) :n (BaCl2) = 1: 1. Значит,количество вещества карбоната хлорида бария равно:
Тогда масса хлорида бария, вступившего в реакцию будет равна (молярная масса – 208 г/моль):
m (BaCl2) = 1,84 × 208 = 382,72г.
| Задание | Вычислите массу бария, который необходим для получения хлорида бария массой 7,9 г по реакции взаимодействия с хлором. |
| Решение | Запишем уравнение реакции взаимодействия бария и хлора с образованием хлорида бария: |
Рассчитаем число моль хлорида бария (молярная масса – 208 г/моль):
n (BaCl2) = 7,9 / 208 = 0,04моль.
Согласно уравнению реакции n(BaCl2) :n(Ba) = 1:1, значит,
Масса бария необходимого для получения хлорида бария по реакции взаимодействия с хлоромравна (молярная масса – 137 г/моль):

Барий хлористый — белый кристаллический порошок, без запаха, легко растворим в воде, не горюч, пожаро- и взрывобезопасен, токсичен.
Формула: BaCl2*2H2O
Синоним: барий хлорид, хлорид бария, барий хлористый двухводный, барий хлористый 2-водный.
Международное название: Barium chloride dihydrate.
Барий хлористый (барий хлорид) возможно получить различными способами, например:
- взаимодействие металлического бария с хлором;
- взаимодействие оксида бария с соляной кислотой;
- взаимодействие гидроксида бария с соляной кислотой (реакция нейтрализации);
- взаимодействие сульфида бария с хлоридом кальция;
- взаимодействие карбоната бария с соляной кислотой и др.
ОБЛАСТЬ ПРИМЕНЕНИЯ
Металлургия
Хлорид бария используют для получения магния и сверхчистого алюминия, как шихтовочный материал.
Химическая промышленность
Хлорид бария используют для получения солей бария в производстве красителей, хлоридов натрия и бария реактивных квалификаций, очистки растворов от хроматов и сульфатов.
Машиностроение
Хлорид бария применяют для термической обработки изделий, закалки быстрорежущего инструмента, в качестве нагревательной среды в технологии горячего прессования металлов, цианирования деталей.
Лёгкая промышленность
Хлорид бария применяют для утяжеления и осветления различных видов кожи.
Сельское хозяйство
Хлорид бария используют для борьбы с вредителями.
Физико-химические показатели бария хлористого (хлорида бария, бария хлористого 2-водного) ГОСТ 742-78
Норма для сорта
Массовая доля хлористого бария (BaCl2•2H2O), %, не менее
Массовая доля нерастворимого в воде остатка, %, не более
Массовая доля натрия, %, не более
Массовая доля кальция, %, не более
Массовая доля железа, %, не более
Массовая доля сульфидов в пересчете на BaS, %, не более
Требования безопасности бария хлористого (хлорида бария, бария хлористого 2-водного) ГОСТ 742-78
Основные свойства и виды опасности
Твердое вещество (кристаллический порошок или гранулы от белого до светло-серого цвета). Растворим в воде.
Взрыво- и пожароопасность
Пожаро- и взрывобезопасен. Не горюч.
Опасность для человека
Высокотоксичен. Вызывает воспалительные заболевания головного мозга, изменение печени и склероз селезенки. При вдыхании пыли возможно воспаление легких и бронхов. При попадании в пищеварительный тракт возможны острые и хронические отравления. При остром отравлении - тошнота, жжение в пищеводе, колики, параличи, расстройство зрения.
Средства индивидуальной защиты
Изолирующий защитный костюм КИХ-5 в комплекте с изолирующим противогазом ИП-4М или защитный общевойсковой костюм Л-1 или Л-2 в комплекте с промышленным противогазом с патроном Гф, перчатки из дисперсии бутилкаучука, специальная обувь.
При малых концентрациях в воздухе (при повышении ПДК до 100 раз) - спецодежда, автономный защитный индивидуальный комплект с принудительной подачей в зону дыхания очищенного воздуха с патронами ПЗУ, ПЗ-2, фильтрующий респиратор "ФОРТ-П", универсальный респиратор "Снежок-КУ-М".
Необходимые действия в аварийных ситуациях
Отвести вагон в безопасное место. Изолировать опасную зону в радиусе не менее 50 м. Откорректировать указанное расстояние по результатам химразведки. Удалить посторонних. В опасную зону входить в защитных средствах. Пострадавшим оказать первую помощь.
При утечке, разливе и россыпи
Сообщить в ЦСЭН. Не прикасаться к просыпанному веществу. Просыпания оградить земляным валом, собрать в емкости, герметично закрыть. Не допускать попадания в водоемы, подвалы, канализацию.
Россыпь собрать без применения влаги в металлическиеемкости с соблюдением мер предосторожности, герметично закрыть. Место россыпи изолировать песком, промыть большим количеством воды, обваловать и не допускать попадания вещества в поверхностные воды. Срезать поверхностный слой почвы с загрязнениями, собрать и вывезти для утилизации. Места срезов засыпать свежим слоем грунта.
Меры первой помощи
Вызвать скорую помощь.
Свежий воздух, покой, чистая одежда, тщательное удаление вещества тампоном, обильно промыть слизистые глаза. Госпитализация! В глаза - раствор альбуцида 30%, тетрациклиновая мазь, на кожу повязку с синтомициновой эмульсией. Ингаляции масляные с эфедрином, новокаином, димедролом. При угрозе отека легких - преднизолоном до 200 г, новокаином, димедролом. При попадании внутрь - промыть желудок через зонд водой.
Упаковка, транспортировка и хранение
Барий хлористый технический упаковывают в трехслойные бумажные мешки, в трехслойные бумажные мешки с вложенными пленочными мешками-вкладышами или в пятислойные ламинированные мешки. Допускается упаковывать продукт в мягкие специализированные контейнеры разового использования.
Барий хлористый технический транспортируют всеми видами транспорта (кроме воздушного) в крытых транспортных средствах в соответствии с правилами перевозки грузов, действующими на транспорте данного вида.
Барий хлористый технический хранят в закрытых складских помещениях, отдельно от других продуктов.
Гарантийный срок хранения продукта - 2 года со дня изготовления.
БАРИЯ ХЛОРИД BaCl2
бесцветные кристаллы. До 925 °C устойчива а-модификация с ромбич. решеткой (а = = 0,7823 нм, b = 0,9333 нм, с = 0,4705 нм, пространственная группа Рпта), при 925–961 °C — β-модификация с кубич. решеткой (пространств, группа Fm3m); 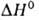
перехода 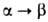
17,36 кДж/моль. Т. пл. 961 °C, т. кип. 2047 °C; плотн. 3,856 г/см 3 ; C 0 p 75,14 Дж/(моль∙К); 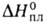
15,9 кДж/моль, 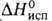
241,4 кДж/моль, 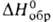
−844,0 кДж/моль, 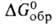
−795,8 кДж/моль; 5^8 123,7 Дж/(моль∙К). Диамагнитен. Растворимость в воде (г в 100 г): 31,7 (0 °C), 36,2 (20 °C), 58,7 (100 °C). Немного раств. в спирте, не раств. в эфире. С AlCl3, LiCl, NaCl, BaSO4, ВаTiO3, BaWO4 образует эвтектич. смеси, с ВаВг — непрерывный ряд твердых растворов, с некоторыми солями — соединения, напр. CaCl2*BaCl2, 2KCl*BaCl2, 2CsCl*BaCl2. Из водных растворов кристаллизуется ди-гидрат — бесцветные кристаллы с моноклинной решеткой (а = = 0,7136 нм, b = 0,1086 нм, с = 0,6738 нм, 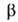
=91,08°, z = 4, пространственная группа Р21/п); плотн. 3,097 г/см 3 ; 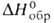
−1446,4 кДж/моль; при 100 °C обезвоживается. Известен также моногидрат — бесцветные кристаллы с ромбич. решеткой (пространств, группа Ртсп).
Получают Б. х.: прокаливанием смеси баритового концентрата с коксом и CaCl2 при 900–1000 °C (BaSO4 + 4C + CaCl2 → BaCl2 + CaS + 4CO); взаимод. BaS с соляной кислотой, раствором NaCl в соляной кислоте, водными растворами MgCl2, NH4C1, C12; p-цией BaC2, BaCO3, Ba(OH)2 или Ва(OOCCH3)2 с соляной кислотой. Б. х. — применяют в производстве пигментов ( напр., баритового желтого BaCrO4, касселевой зелени ВаMnO4), др. соед. Ва, в качестве добавки в электролиты при получении Mg, для закалки быстрорежущей стали (в виде расплавов смеси BaCl2 с хлоридами щелочных и щел.-зем. металлов), как компонент керамики, реактив на ион SO4 2− , для утяжеления и осветления кожи в кожевенной промышленности, как зооцид. Б.х. токсичен; ПДК 0,5 мг/м 3 .
Ключевые слова: барий, нахождение в природе бария, применение бария, физические и химические свойства бария, соединения бария: оксид бария, гидроксид бария, пероксид бария, карбонат бария, нитрат бария, галогениды бария, хлорид бария, бромид бария, сульфат бария, токсикология бария.
Барий(Ba) находится в главной подгруппе II группы периодической системы элементов Д. И. Менделеева. Порядковый номер этого элемента 56, атомная масса 137,36. Металлический барий — мягкий металл серебристого цвета, быстро разрушающийся на воздухе, кристаллизующийся в кубической гранецентрированной системе. Металлический барий впервые получил Дэви в 1808 г., затем — А. Гунтц в 1901 г.путем восстановления оксида бария металлическим алюминием.
Природный барий состоит из смеси семи стабильных изотопов: 130 Ва, 132 Ва, 134 Ва, 135 Ва, 136 Ва, 137 Ва, 138 Ва. Наиболее распространенным является изотоп 138 Ва (71,66%) .Известно также 15 радиоактивных изотопов бария и четыре изомера. Изотопы 131 Ва и 133 Ва получают при облучении бария в ядерном реакторе. Изотопы с атомной массой от 138 до 145 являются продуктами деления урана. Изотоп 138 Ва с периодом полураспада 1,77 дней получают, облучая церий тяжелым изотопом водорода дейтерием.Самый важный изотоп бария — 140 Ва. Он образуется при распаде урана, тория, плутония; выход составляет 6,35%, период полураспада 13,4 дня. 140 Ва хроматографически извлекают из смеси продуктов распада.
НАХОЖДЕНИЕ В ПРИРОДЕ БАРИЯ
Барий—довольно распространенный элемент. Содержание его в земной коре составляет 5 • 10 -2 вес.%. В космосе приходится 3,68 атома бария на 106 атомов кремния.В природе барий в основном встречается в виде различных минералов. Минералы бария (тяжелый шпат, оксид бария, сульфат бария) были известны начиная с XVII в.
Барит BaSО4 (тяжелый шпат, персидский шпат) содержит
65% ВаО. Барит встречается в природе в виде гранул, бесцветных трубчатых кристаллов; примеси окрашивают его в желтый, коричневый, красный, голубой, зеленый или черный цвет. Барит может содержать также сульфат стронция (баритоцелестин), сульфаты свинца и радия.
Витерит ВаСОз (
78% ВаО) — минерал с серым или желтым оттенком, встречается в небольших количествах в России, Англии, Японии, США. Витерит может содержать карбонат кальция или стронция.
Цельзиан Ba[Al2Si2О3] (бариевый полевой шпат) встречается редко (в Швеции, России, Англии), представляет собой бесцветные моноклинные призмы, может быть окрашен в красный и черный цвета оксидами железа и марганца.
Гиалофан K2Ba[Al2Si4О12] (бариевый полевой шпат) — бесцветные, прозрачные кристаллы (примеси окрашивают его в. желтый, голубой или красный цвет), встречается в России, Швеции, Швейцарии, Франции.
Известны также следующие минералы бария:
ПРИМЕНЕНИЕ БАРИЯ
Промышленный метод получения металлического бария основан на алюмотермическом восстановлении бария в вакууме при 1200—- 1250° С.Сырой металлический барий очищают перегонкой в вакууме при температуре 800° С и давлении 1—1,5 мм рт. ст. в специальной аппаратуре. Электролиз расплавленных солей бария ввиду высокой растворимости бария в расплавленных хлоридах применяется только для получения сплавов бария с тяжелыми металлами.
Барий находит применение при металлотермическом восстановлении америция и кюрия. Излучения изотопов 138 Ва и 137 Ва используют в качестве стандартов в гамма-спектрометрии. Радиоактивные изотопы бария применяются для изучения перемещений прибрежных песков, исследования катодных потерь в электровакуумных лампах и процессов катализа.
Сплавы бария с алюминием и магнием используют в технике глубокого вакуума в качестве поглотителей газов (геттеров). Барий входит также в антифрикционные сплавы на свинцовой основе и применяется в качестве присадок к никелю для цементирования рыхлых пород при бурении нефтяных скважин. Он является составной частью типографских сплавов и используется в радиотехнике.
Оксид, пероксид и гидроксид бария находят применение для получения перекиси водорода и в пиротехнике для приготовления воспламенительных составов. Сульфид бария служит сырьем для получения солей бария, фторид бария применяется в производстве эмалей, при рафинировании алюминия. Перхлорат бария — хороший осушитель. Титанат бария, благодаря простому способу приготовления, нашел применение в качестве сегнетоэлектрика. Цирконат бария — огнеупорный материал, используется в керамической промышленности. Ацетат бария находит применение в качестве протравы при крашении шерсти и в ситцепечатании. Окрашенные соединения бария (хромат, манганат) являются хорошими пигментами, используются в качестве наполнителя при производстве резины и бумаги. Платиноцианид бария используется для изготовления флуоресцирующих экранов.
Многие соединения бария поглощают рентгеновские лучи и γ-излучение, служат в качестве защитных материалов в рентгеновских установках и ядерных реакторах, а также применяются в качестве контрастного вещества при рентгеноскопических исследованиях.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА БАРИЯ.
Барий представляет собой тягучий, ковкий металл серебристо-белого цвета.Он существует в двух аллотропных модификациях: α-модификация устойчива до 375° С; β-модификация возникает при 375° С и устойчива до температуры плавления. Барий кристаллизуется по типу кубической объемноцентрированной решетки.
Ниже приводятся важнейшие физические константы бария :
Плотность (20° С), г/см 3 3,76
Температура плавления, °С 710
Температура кипения, °С 1637 -1640
Теплота плавления, кал/г-атом 2070±80
Твердость по Бринелю, кГ/мм2 4,2
Модуль упругости, кГ/мм 2 1290
Атомный радиус, А 2,21
Ионный радиус Ва 2+ А 1,38
Энергия ионизации, ккал/г-атом
Нормальный потенциал, В (вычисл.) —2,92
Поперечное сечение поглощения тепловых нейтронов, барн/атом 1,17
По химической активности барий превосходит кальций и стронций. Он быстро окисляется на воздухе, покрываясь слоем оксида, пероксида и нитрида. Хранят его под слоем керосина или петролейного эфира. При нагревании на воздухе барий легко воспламеняется и сгорает. Энергично разлагает воду и образует соединения со многими элементами.При нагревании барий взаимодействует с водородом и азотом, образуя достаточно прочные соединения — гидриды и нитриды (ВаН2 и Ва3N2). Карбид бария ВаС2 может быть получен в дуговой печи при нагревании окиси бария с углем. С фосфором барий образует устойчивое соединение — фосфид бария Ва3Р2, получаемый восстановлением фосфорнокислой соли сажей при температуре дуговой печи.При нагревании сульфата бария до 1200° С в восстановительной атмосфере получают сульфид бария. Существует ряд полисульфидов бария, образующихся при взаимодействии BaS с серой; при 400° С все эти соединения вновь переходят в односернистое соединение. Барий способен непосредственно реагировать с галогенами, образуя соли соответствующих галогеноводородных кислот. Со свинцом, никелем, сурьмой, оловом, железом барий образует сплавы. При взаимодействии бария с разбавленными кислотами (НС1, H2SО4, HNО3) получаются соответствующие соли (ВаСl2, BaSО4, Ba(NО3)2). Все растворимые соли бария сильно ядовиты.
СОЕДИНЕНИЯ БАРИЯ
Наиболее характерная для бария степень окисления +2, но известны соединения, в которых степень окисления равна +1, например ВаС1.
Оксид бария ВаО образуется при взаимодействии бария с кислородом, имеет низкую температуру плавления, после охлаждения из расплавленного состояния застывает в кристаллическую массу. В технике ВаО большей частью получают прокаливанием карбоната бария с углем.
Оксид бария представляет собой бесцветные кристаллы, плотность 5,98 г/см 3 , легко переходящие на воздухе в карбонат бария, энергично взаимодействует с водой с выделением тепла, переходя в гидроксид. На холоду оксид бария взаимодействует с хлором, при нагревании — с кислородом, серой, азотом, углеродом, сероуглеродом, двуокисью серы, свинца и кремния, окисью хрома и железа. Оксид бария восстанавливается при нагревании магнием, цинком, алюминием, кремнием до металла.
Гидроксид бария Ва(ОН)2 в безводном состоянии представляет собой белый аморфный порошок, плавится не разлагаясь, образуется при действии воды на металлический барий или оксид бария. В промышленности для получения гидрооксида бария обрабатывают сульфид бария перегретым паром. При нагревании до 650° С в токе воздуха кристаллогидраты превращаются в оксид или пероксид бария.
При обычных условиях гидроксид бария Ва(ОН)2∙8Н2О — бесцветные моноклинные кристаллы. Растворимость Ва(ОН)2 в воде повышается с ростом температуры (90,8 г ВаО в 100 г Н2О при 80°С). Водный раствор Ва(ОН)2 (баритовая вода) применяется в лабораториях для открытия карбонат- и сульфат-ионов.
Пероксид бария ВаО2 получают нагреванием окиси бария в токе воздуха до 600° С или сильным прокаливанием гидроокиси, нитрата или карбоната в токе воздуха в присутствии следов воды. Соединение представляет собой белый порошок, трудно растворимый в воде, с водой образует гидраты, при 600° С ВаО2 разлагается до ВаО. Применяется пероксид бария в основном как исходный продукт для получения перекиси водорода.
При нагревании пероксида бария под высоким давлением кислорода получают ВаО4 — неустойчивое вещество желтого цвета, разлагающееся при 50—60° С.
Карбонат бария ВаСО3 — белые бесцветные кристаллы с ромбической решеткой; плотность 4,3—4,4 г/см3. В природе карбонат бария встречается в виде минерала витерита.Карбонат бария отщепляет СО2 только при высокой температуре— 1400° С. В воде ВаСО3 труднорастворим, легко растворим в соляной и азотной кислотах. Растворимость в воде повышается в присутствии солей аммония или угольной кислоты.
Нитрат бария при обычных условиях — бесцветные кристаллы с простой кубической решеткой, плотность 3,24 г/см 3 . Растворимость Ba(NО3)2 составляет 32,2 г в 100 г воды при 100° С.
Для нитрата бария характерны следующие кристаллогидраты:
Ba(NО3)2∙4H2О, Ba(NО3)2∙2H2О. При сильном нагревании в присутствии восстановителей нитрат бария разлагается:
Галогениды бария. Хлорид бария при обычных условиях существует в виде дигидрата ВаС12∙2Н2О; представляет собой бесцветные кристаллы с моноклинной решеткой, плотность 3,10 г/см 3 . При нагревании до 100° С теряет кристаллизационную воду. Хлорид бария в безводном состоянии — белая масса, плавящаяся при 878° С, хорошо растворим в воде (60 г ВаС12 в 100 г Н2О при 104,1° С) почти нерастворим в спиртах, эфире. Сильно ядовит!
Бромид бария ВаВг2 в безводном состоянии—белая масса, плавящаяся при 847 С, уд. вес 4,79; хорошо растворяется в воде (149 г ВаВг2 в 100 г Н2О при 100 0 С); кристаллизуется из водных растворов в виде дигидрата ВаВг2 ∙ 2Н2О.
Дегидратация происходит только при температурах больше 100°С. Растворим в этиловом и метиловом спиртах.
Иодид бария из водных растворов кристаллизуется в виде гидратов с различным содержанием молекул воды, гигроскопичен. Для иодида бария характерны следующие кристаллогидраты: BaJ2∙7H2О, BaJ2∙6H2О, BaJ2∙2H2О, BaJ2∙H2О. В безводном состоянии иодид бария представляет собой белую массу, уд. вес 4,92. В твердом состоянии и в растворе на воздухе иодид бария темнеет. Хорошо растворим в воде (270 г BaJ2 в 100 г Н2О при 100° С) и спиртах.
Фторид бария BaF2 получают в виде прозрачных мелких кристаллов, уд. вес 4,83; в воде практически не растворяется (1,63 г/л при 18°С), растворим в соляной, азотной и фтористоводородной кислотах.
Сульфид бария BaS — бесцветные кубические кристаллы, плотность 4,25 г/см 3 . Известен также гексагидрат сульфида бария BaS∙6H2О. Сульфид бария взаимодействует на холоду с водой и кислотами. Выпариванием водного раствора сульфида бария при обычной температуре получают кислый сульфид бария (бисульфид), кристаллизующийся в виде бесцветных призм Ba(HS)2∙4H2О. Дегидратацию проводят в атмосфере водорода при нагревании.
Хлорат бария (хлорноватокислый барий) в обычном состоянии существует в виде моногидрата Ва(С1Оз)2∙Н2О; представляет собой бесцветные моноклинные кристаллы, плотность 3,18 г/см 3 при нагревании до 120° С теряет кристаллизационную воду, при дальнейшем нагревании разлагается на хлористый барий и кислород. При трении, ударе или нагревании в смеси с горючими веществами хлорат бария взрывоопасен.
Платиноцианат бария при обычных условиях существует в виде кристаллогидрата Ba[Pt(CN4) ]∙4Н2О желто-зеленого цвета. При нагревании до 100° С теряет две, а при 150° С — четыре молекулы воды. Плохо растворим в воде. Под действием рентгеновых лучей или радиоактивного излучения флуоресцирует.
Сульфат бария BaSО4 встречается в природе в виде минерала барита. Плотность бесцветных моноклинных кристаллов равна 4,5 г/см 3 . Сульфат бария разлагается при 1600° С, плохо растворяется в воде; серная кислота (уд. вес 1,853) растворяет до 14% BaSО4, который переходит в H2[Ba(SО4)2]. Ввиду низкой растворимости сульфат бария используется в качестве осаждаемой и весовой формы при аналитическом определении ионов SО4 2- и Ва 2+. Сульфат бария растворяется в хлорной воде, бромистоводородной и иодистоводородной кислотах, в бикарбонатах щелочных металлов.
Хромат бария (хромовокислый барий) — ярко-желтое кристаллическое вещество. Плохая растворимость его в воде используется в аналитической химии для отделения и определения бария.
ТОКСИЧЕСКОЕ ДЕЙСТВИЕ БАРИЯ.
. Соединения бария вызывают воспалительные заболевания головного мозга и его мягкой оболочки с преимущественным поражением мозжечка, продолговатого мозга и дна четвертого желудочка . Действуют также на гладкую и сердечную мускулатуру — влияют на миокард, вызывая спазм сосудов. При отравлении ВаСl2 доминирующим фактором является повышенная проницаемость капилляров, сопровождающаяся кровоизлияниями и отеками . Малые дозы ВаСl2 и Ba(NО3)2 стимулируют деятельность костного мозга, большие — угнетают ее и вызывают дегенеративные изменения печени, склероз селезенки. Смерть обычно наступает от паралича сердца. Ядовитость солей бария зависит от степени их растворимости. Практически не ядовит сульфат бария (чистый), сильно токсичны — хлорид, нитрат, хлорат, ацетат, карбонат и сульфид. При хроническом отравлении, накапливаясь преимущественно в костях, барий оказывает лейкозогенное действие на костный мозг; включаясь в минеральный обмен, энергично вытесняет фосфор и кальций , что может привести к остеопорозу.
Читайте также:


