Аппарат от рака мозга
Во многие клиники техника уже поступила. Это - одно из направлений нацпроекта "Здоровье". В основе работы аппаратуры - использование радиоактивных препаратов, которые медики окрестили "умными пулями".
Несколько минут в гамма-камере и вот она, радиоизотопная диагностика в действии, точнее на экране врачебного монитора. Это две проекции тела пациента: вид спереди и сзади. Красные области - повышенное накопление радиоактивного фармпрепарата. На этом снимке - в телах позвонков, грудине и костях таза, то есть злокачественные образования там.
Еще полгода назад в институте Герцена такое исследование проводили в два этапа. У врачей на него уходило гораздо больше времени, у больных - сил. И то, и другое иногда играет решающую роль в выздоровлении.
Валерий Чисов, главный онколог Минздрава РФ: "Цель программы - добиться раннего выявления онкологических заболеваний. Если мы этого добьемся, то значительная часть больных будет подвергнута местному хирургическому лечению и только небольшая часть будет подвергнута лучевому лечению, химиотерапии".
Не всякая радиация убивает, здесь та, которая лечит, с порога заявляют впервые попавшим в так называемые чистые помещения завода. За свинцовыми стенами в спецлаборатории спецруки производят чудодейственные пилюли. На языке ученых-разработчиков – радиофармперпараты или умные пули.
Олег Егоров научный консультант ФГУП "Завод медрадиопрепарат" ФМБА России: "Это те препараты, которые позволяют доставлять источник радиации, изотоп, непосредственно к очагу заболевания".
Радиоактивная глюкоза для диагностики распространения опухолей, радиоактивный йод для лечения. Например, опухоли щитовидной железы. Это совместный проект Минздрава и Росатома по созданию фармацевтических препаратов нового поколения. Чем активнее разработки ядерной физики будут использоваться в онкомедицине, полагают врачи, тем быстрее онкодиагностика достигнет уровня западноевропейских стран.
Линейный ускоритель электронов - комплекс, используемый в лучевой терапии. Аппарат такого класса единственный в России, их всего 2 в Европе. За последние 20 лет медицина не просто шагнула вперед, она взлетела, признаются медики.
С одной стороны, это облегчает их работу, но с другой - неимоверно осложняет: на этой научной высоте им необходимо задержаться ненадолго, чтобы осмыслить всю эту науку.
Лечение с помощью этого аппарата - это почти радиохирургия, когда важна каждая десятая миллиметра. В облучении опухолей головного мозга или, например, глаза, где малейшая неточность может просто лишить пациента зрения. Раньше при таких показаниях врачи вообще за это не брались.
Сегодня такое лечение доступно пациентам в столице, второй комплекс совсем недавно заработал в Хабаровске. До 2015 года онкологическая программа в рамках нацпроекта "Здоровье" должна встать на европейские рельсы, заявляют в Минздраве.
Подобное суперсовременное медицинское оборудование появится в 38 онкоцентрах в разных регионах России. В этом году в Челябинске открылся первый региональный ПЭТ-центр. Позитронно-эмиссионная томография - самая передовая и сложная диагностическая процедура. До этого ее можно было пройти только в Москве и Санкт-Петербурге.
Андрей Важенин главный врач Челябинского онкологического центра: "Это поиск микрометастазов, это оценка ответа на химиолучевое лечение в течение первой недели".
В области возможностей ранней диагностики и контроля лечения Южноуральский регион уже назвали лидером. Но помощь здесь будет оказываться и пациентам из других округов и даже гражданам других государств. Кроме того, в ближайшие годы в России появятся три центра протонной терапии: в Обнинске, Томске и Димитровграде. Где будут лечить больных, которым противопоказано или не подходит хирургическое вмешательство.
По прогнозам ученых, все это ежегодно позволит спасать около 4 с половиной тысяч жизней. И результат уже есть - за три месяца этого года медики впервые отмечают снижение - почти на процент - смертности от рака.

Опухолью головного мозга принято называть любое новообразование, сформировавшееся внутри черепа. Независимо от разновидности, болезнь всегда приводит к негативным для здоровья последствиям. Поэтому сегодня особое внимание уделяется ее своевременной диагностике и грамотному лечению.
Обязательно ли лечение
Если протекающий процесс является доброкачественным, он все равно несет с собой угрозу, поскольку по мере роста новообразование начинает давить на жизненно важные соседние структуры. Из-за этого повышается внутричерепное давление и появляются различные неврологические проблемы — от головных болей и головокружений до эпилептических приступов, нарушения координации движений, чувствительности конечностей, памяти и речи. Все это может привести к инвалидности и летальному исходу.
Если же речь идет о злокачественных новообразованиях головного мозга, состояние больного стремительно ухудшается. Прогноз в этом случае крайне неблагоприятный. Поэтому при обнаружении новообразований, независимо от их природы, требуется скорейшее медицинское вмешательство.
Причины появления опухоли головного мозга у взрослых и детей
Согласно официальной статистике, около 6 % из всех новообразований приходится на опухоли в черепной коробке. В детском возрасте они встречаются реже, у пожилых риск развития доброкачественных или злокачественных образований выше, а лечение проходит сложнее. Хотя до сих пор нет точных данных о том, по каким причинам клетки меняют структуру и начинают неконтролируемо расти. Выявлена взаимосвязь между развитием опухолевых процессов и следующими факторами:
- некоторые генетические заболевания, онкология у родственников;
- воздействие токсинов, канцерогенов, ионизирующего излучения;
- иммунодефицитные состояния;
- черепно-мозговые травмы;
- внутриутробные нарушения развития мозговых тканей плода.
Классификация заболевания
Кроме деления на доброкачественные и злокачественные, выделяют классификацию на первичные и вторичные опухоли — во втором случае они возникают в результате распространения злокачественных процессов из других органов.
Для лечения значимым является то, в каких клетках и тканях возникло новообразование. Среди часто встречающихся первичных опухолей называют следующие:
- развившиеся непосредственно из мозговых тканей;
- менингиомы — опухоли оболочек;
- невриномы — образования в нервах черепа;
- аденома гипофиза.
По местонахождению новообразования могут располагаться в верхних или нижних отделах, полушариях, срединных структурах или основании головного мозга.
Симптомы опухоли головного мозга
В лечении новообразований решающую роль играет своевременная диагностика. Поэтому для человека важно вовремя заметить изменение своего состояния и обратиться к врачу. Назовем основные признаки опухоли:
- головные боли — интенсивные, приступообразные, распирающие, с которыми не удается справиться привычными способами;
- головокружения, вплоть до потери равновесия;
- рвотные позывы, не связанные с приемом пищи;
- расстройства двигательных функций — мышечная слабость, спазмы или гипертонус;
- снижение зрения, слуха или обоняния;
- проблемы с памятью, речью, концентрацией внимания, изменения характера.
При регулярных головных болях и наличии еще хотя бы одного симптома необходимо пройти диагностику, чтобы исключить или подтвердить подозрения в развитии онкологии головного мозга.
Обследование при опухолях
Современная медицина использует широкий инструментарий. В комплекс могут входить:
- позитронно-эмиссионная томография (ПЭТ);
- офтальмоскопия;
- компьютерная (КТ) и различные виды магнитно-резонансной томографии (МРТ); (одни из основных методов)
- пункция тканей и биопсия спинно-мозговой жидкости.
Врач может назначать не все виды диагностики, выбирая наиболее информативные для конкретного случая.
Лечение опухолей головного мозга
Хирургические методы, химиотерапия и лучевая терапия при объемных образованиях головного мозга используются комплексно.
При опухоли головного мозга обычно проводится операция по ее удалению — это традиционно считается наиболее эффективным. К сожалению, если образование находится в труднодоступном месте, площадь поражения слишком велика или с большой долей вероятности раковые клетки уже распространились на другие участки мозга, риск задеть жизненно важные отделы больше, чем шансы на улучшение состояния пациента.
| Стоимость лечения | |
| Опухоли головного мозга от 270 000 |
Точная стоимость лечения определяется только после консультации с врачом
- О центре
- Специалисты
- Новости
- Партнеры
- Отзывы
- Запись на приём
- Стоимость лечения
- Консультация
- Диагностика
- FAQ
- Статьи
- Аппарат Кибернож
- Уникальность системы
- Показания к лечению
- Противопоказания
- Как происходит лечение
- Сравнение методов
- Дистанционная
- Комбинированное лечение
- Лечение
- Опухоли головного мозга
- Рак легкого
- Рак печени
- Рак почки
- Рак предстательной железы
- Рак носоглотки
- Опухоль спинного мозга
- Опухоль ЦНС у детей
- Рак поджелудочной железы
- Опухолевое поражение костей
- Метастазы
- Невралгия тройничного нерва
- Пяточная шпора

Еще недавно метастазы в головной мозг при раке считались смертельным приговором. Но сегодня ситуация меняется. Системная таргетная терапия в сочетании с радиохирургией позволяют значительно повысить эффективность лечения и даже добиться стойкой ремиссии, то есть фактически остановки болезни.
Наш эксперт — заведующий отделением радиотерапии и радиохирургии НИИ нейрохирургии имени Н. Н. Бурденко, член-корреспондент РАН, профессор, доктор медицинских наук, член Московского общества нейрохирургов, Ассоциации нейрохирургов России, Всемирной и Американской ассоциации нейрохирургов (WFNS, AANS), Американского и Европейского общества радиационных онкологов (ASTRO, ESTRO), Международного общества по стереотаксической радиохирургии (ISRS) Андрей Голанов.
Разрушать патологические очаги внутри головного мозга сегодня можно амбулаторно: это безболезненно, эффективно и в значительной степени безопасно. Такие вмешательства нейрохирурги проводят без скальпеля, даже не касаясь черепа. Причем это происходит при минимальной лучевой нагрузке. Это стало возможно благодаря таким установкам, как гамма-нож (применяется при патологиях исключительно внутри головы) и кибернож (используется также на других частях тела).

Главное — точность
Еще в середине прошлого века известный шведский нейрохирург, профессор Ларс Лекселл предложил метод радиохирургии: очень точное (прецезионное) подведение ионизирующей энергии от внешне расположенного источника радиации к мишени, то есть к относительно небольшому участку патологической ткани внутри головы. В 1968 году он же создал первую радиохирургическую установку: гамма-нож. Изобретение стало революционным и ознаменовало собой начало нового направления в медицине.
Первоначально метод применяли лишь при неврологических проблемах (болевых синдромах, в том числе невралгии тройничного нерва, двигательной патологии, такой, как паркинсонизм и другие гиперкинезы). Но подлинный расцвет радиохирургии начался после появления техники для визуализации: КТ и МРТ. Показания к применению метода расширились: оказалось, что однократное подведение относительно высокой дозы ионизирующей энергии способно предотвращать развитие опухоли и даже приводить к уменьшению метастатических очагов.
До появления киберножа — роботизированной установки с использованием линейного ускорителя, изобретенного американским нейрохирургом Джоном Адлером, — стереотаксическая техника могла применяться только внутри черепа. Сегодня же таких ограничений нет, и во всех современных установках для лучевой терапии местоположение мишени определяется непосредственно во время облучения. Это позволяет подводить высокие дозы ионизирующей энергии точно к мишени, расположенной в любой части тела.
Не сбить прицел

Без риска осложнений
Радиохирургическим способом сегодня лечат метастазы в головном мозге (при раке молочной железы, кожи, легких), а также сами опухоли, как доброкачественные (менингиомы, невриномы, аденомы), так и злокачественные. Правда, при раке головного мозга (глиоме) кибернож используют только как вторичный метод после проведенного комбинированного лечения. Также этим способом можно лечить и артериовенозные мальформации (аневризму сосудов головного мозга, которая является главной причиной инсультов у молодых).
По эффективности радиохирургия вполне сопоставима с обычной операцией, но позволяет добиться результата без трепанации, повреждения черепа и кожи головы. Не требуется общей анестезии и долгого восстановления, не возникает опасности инфекций и кровотечений. Операция проводится амбулаторно, хорошо переносится, не имеет ограничений по возрасту и состоянию здоровья. А еще она совместима с другими видами лечения. Например, для ее проведения не нужно прерывать курс химиотерапии.
Радиохирургия, в том числе с использованием киберножа, является единственным выходом, когда у пациента опухоль или метастаз располагаются в труднодоступных зонах мозга или там, где применение обычной операции сопряжено с высоким риском ухудшения состояния пациента, а стандартная лучевая терапия недостаточно эффективна.
Раньше при одиночных небольших метастазах в головном мозге не было иного выхода, кроме облучения всей головы. Но сегодня можно воздействовать прицельно лишь на патологический участок, избегая тем самым развития осложнений (в том числе неврологических и психических).
В лечении крупных метастазов используется также и предоперационное облучение, которое не только повышает успех последующей операции, но и снижает возможность дальнейшего роста и распространения опухоли.

Как самолетом слетать
Радиофобией страдают многие люди. Некоторые из-за боязни радиации лишний раз и рентген не сделают (даже если надо), и маммографию проигнорируют. Что уж говорить о радиохирургии, при которой используются высокие разовые дозы лучевой энергии (в 10-20 раз выше по сравнению со стандартным облучением). Бытует мнение, что после такого вмешательства (даже успешного) риск появления нового рака повышается в разы.
Но на самом деле это не так. За лечебный сеанс тело пациента получает дозу радиации как при полете на самолете. Особенностью радиохирургии является резкое уменьшение лечебной дозы ионизирующей энергии за пределами зоны воздействия. То есть лучевая энергия попадает только на сам патологический участок, но уже через несколько миллиметров доза становится безопасной для окружающих нормальных тканей. Как показали крупные зарубежные исследования с участием большой группы пациентов, проведенные, в частности, в Великобритании, радиохирургическое лечение даже через 10 и более лет после его проведения не приводило к значимому увеличению риска развития злокачественных опухолей по сравнению с популяцией.

Размер имеет значение
Увы, не любая опухоль может быть разрушена кибер- или гамма-ножом. Каждый случай рассматривается особо, с учетом характера первичного очага, состояния и возраста пациента и проведенного ранее лечения.
При крупных размерах опухоли, или когда в нее вовлечены функционально значимые структуры, например, зрительные нервы, необходимо проводить облучение в стандартном режиме. К тому же радиохирургия не заменяет современную микронейрохирургию. При наличии у пациента большой, но операбельной опухоли, сопровождающейся отеком и/или компрессией (сдавливанием) мозгового вещества и выраженной неврологической симптоматикой или повышенным внутричерепным давлением, лучше предпочесть прямую операцию.
Другое ограничение — это множественный характер поражения: при местно распространённом раке лишь в 60% случаев можно применить кибернож, хотя сегодня облучают и до 10 и более метастазов за одну фракцию при их небольшом размере.

фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко

фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко


фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко
фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко
Глиома — это аномальное разрастание опухолевой структуры в мозговой ткани человека. Это образование представлено совокупностью очень разных клеток, это "гетерогенная опухоль" по терминологии ученых. Особенностями глиомы считают ее отличное от других опухолей происхождение и отсутствие метастазирования. Однако ее опухолевые клетки обладают способностью мигрировать в здоровую ткань мозга, что значительно усложняет ее лечение. Глиобластома — самая агрессивная стадия глиомы.
Традиционные подходы: хирургическое удаление опухоли, лучевой метод и химиотерапия, к сожалению, не очень продлевают жизнь пациентам. Хирургическое вмешательство не позволяет полностью удалить опухолевые клетки, так как, во-первых, нейрохирург не может удалить лишнее, щадя жизненно важные ткани мозга; во-вторых, опухоль представляет собой неровную структуру без четких границ, и неизвестно, сколько опухолевых клеток уже проникло в ткани здорового мозга. Лучевое лечение и химиотерапия способны лишь притормозить рост опухоли, но не остановить его.
Развитие молекулярных методов позволило изучить глиомы на уровне генов. Результатом исследований явилось изменение классификации Всемирной организации здравоохранения в 2016 году, куда вошли понятия о ключевых для развития глиом мутациях нескольких генов. Классификация стала более четкой и основанной не на визуальных особенностях клеток опухоли, а на их молекулярных характеристиках.
Но и это не очень продвинуло терапию заболевания и не улучшило перспективы пациентов. Ученые во всем мире создают международные консорциумы для поиска решения.
Она объединила специалистов в области медицины, биологии, химии, физики и биоинформатики, которые разрабатывают новые подходы к диагностике и лечению глиомы. Физики, химики, биологи и медики активно ищут отличия между различными формами злокачественности глиомы.
Предполагается, что успех может быть достигнут при трех условиях: 1) максимально ранней диагностике, 2) усовершенствовании технологий, позволяющих четко визуализировать опухоль и максимально полно удалить ее, 3) индивидуальной терапии для целевого подавления опухолевых клеток на основе анализа молекулярных характеристик опухоли.
Демаркация границ опухоли
При хирургическом удалении опухоли крайне важно не затронуть жизненно важные зоны мозга. Одна из передовых технологий — это операция на головном мозге с пробуждением пациента во время удаления опухоли. В мозге нет болевых рецепторов, и достаточно местного обезболивания. Врач во время операции разговаривает с пациентом и просит его решать простые задачки. Нарушение поведения пациента говорит о том, что врач вторгся в опасную зону. Подобный подход позволяет оперировать опухоли, которые раньше считались неоперабельными.
К успешным достижениям в этой области можно отнести разработку российских нейрохирургов и физиков, которые используют методику интраоперационной нейровизуализации глиом. Перед операцией пациенту вводят перорально 5-аминолевулиновую кислоту (5-АЛК), которая совершенно безопасна для человека, поскольку является промежуточным продуктом обмена в организме. Эта кислота превращается во флуоресцирующее вещество протопорфирин IX.
«Одна из задач, поставленных перед наукой руководством России,— найти эффективные способы диагностики, обнаружения и лечения онкологических заболеваний, среди которых выделяются глиомы головного мозга человека. Российский фонд фундаментальных исследований в кратчайшее время создал соответствующее направление в своей работе: за несколько месяцев был сформирован рубрикатор, собран пул экспертов, проведены конкурсы и открыто финансирование.
Удивительным кажется тот факт, что это флуоресцирующее вещество накапливается именно в опухоли, делая ее видимой при использовании нейрохирургами специальной приставки к операционному микроскопу. Подобная технология позволяет максимально полно удалить опухоль.
На сегодня самый значительный технический прорыв наблюдается в области дооперационной диагностики опухоли. Магнитно-резонансная томография (МРТ) позволяет охарактеризовать расположение и объем опухоли еще до операции. Используют МРТ с контрастным усилением в трех проекциях и в трех режимах.
Также используют МРТ-спектроскопию для оценки метаболизма в опухоли и установки степени анаплазии (потеря клеткой внешних характеристик, по котором ее можно отнести к какому-нибудь типу), а МРТ-перфузию — для определения объема крови, проходящего через опухоль.
Появилось очень важное для пациента исследование — функциональное МРТ-картирование, которое необходимо для определения близости двигательных, речевых, зрительных зон мозга к опухоли. Это необходимо для того, чтобы нейрохирург мог рассчитать, как ему удалить опухоль, нанеся минимальный урон пациенту.
Всемирная организация здравоохранения в 2007 году ввела принцип классификации глиом, разбив их по степени злокачественности и по характеристикам клеток опухоли на четыре группы, которые назвали степенями (Grade). Самая доброкачественная I Grade, самая агрессивная IV Grade, или по-другому — глиобластома. Классификация использовала гистологические характеристики опухолевых клеток. В 2016 году ВОЗ вводит новую классификации глиом, которая требует при постановке диагноза опираться не только на гистологические особенности клеток опухоли, но и на результаты иммуногистохимии и FISH-анализа и секвенирования. Требуется оценивать мутации IDH1/2 и ТР53, делеции ATRX и ко-делеции 1p/19q.
Молекулярный паспорт опухоли
Но одних этих достижений оказывается недостаточно. Опухоли сильно отличаются друг от друга на генетическом уровне. Современные молекулярные подходы позволили характеризовать глиомы по ряду маркеров, однако ученые находят все новые генетические нарушения, которые влияют на чувствительность опухоли к терапии. Вполне вероятно, что через некоторое время ВОЗ предложит новую классификацию опухолей, основанную на большей выборке генетических нарушений и более приближенную к индивидуальной медицине.
Кроме того, растет понимание, что важны не только мутационные исследования генома пациента, но также нужно обратить внимание на транскриптом (результат прочтения генов в данном организме) и протеом опухолевых клеток (набор белков в них, синтезированных в результате прочтения их генома). Они сильно меняются и могут служить как диагностическим фактором, так и терапевтической мишенью. Так, например, обнаружено, что в опухоли часто изменяются транскрипты (молекула РНК) известных генов, подобное нарушение может приводить к продуцированию измененного белка или вовсе к тому, что белок не будет продуцироваться. Эти изменения могут служить для диагностики степени злокачественности, а также могут войти в панель прогностических признаков.
Новые направления в лекарственной терапии глиомы



Фото: предоставлено проф. А,В Головиным
Фото: предоставлено проф. А,В Головиным
Фото: предоставлено проф. А,В Головиным
Современные препараты химиотерапии стимулируют гибель опухолевых клеток. Но они также уничтожают и нормальные активно делящиеся клетки организма, что ухудшает общее состояние пациента. При этом не достигается полная гибель опухолевых клеток глиомы. Подобное лечение не позволяет продлить жизнь пациенту на длительный срок. Нужно искать новые подходы. Один из векторов таких исследований — это таргетная терапия, которая увеличивает вероятность доставки терапевтических молекул-киллеров непосредственно к клеткам опухоли. Например, есть разработки по использованию наночастиц, которые позволяют доставлять к клеткам глиомы пониженные дозы токсических веществ.
Как определить, преобладание какого типа клеток наблюдается в той или иной глиоме? Как понять, какое лекарство на нее подействует и насколько оно будет эффективно? Можно поставить еще много вопросов, ответы на которые можно дать, получив клеточные культуры из опухолевой ткани пациента. По ним мы можем проанализировать состав опухоли, оценить маркеры, характерные именно для этой опухоли, оценить способность клеток мигрировать и охарактеризовать их. Все современные технологии и новые лекарства могут быть проверены на клеточных культурах глиомы человека. Наконец, можно подобрать вариант терапии (условия лучевой терапии, химиотерапию), которые будут лучшими именно для этого пациента, а это большой шаг к индивидуальной терапии для каждого пациента.
Другой подход предполагает использование онколитических вирусов, которые могут как стимулировать апоптоз (образно говоря, принуждение к самоубийству) опухолевых клеток, так и вызывать иммунный ответ, который также приводит к гибели клеток опухоли. Несмотря на ряд недостатков этой терапии, известно, что некоторые из подобных вирусов уже проходят первую и вторую фазы клинических испытаний.
Появилось новое направление по применению структурированных малых молекул ДНК и РНК, называемых аптамерами, которые предполагают использовать в терапии глиом вместо антител, а также для диагностики опухолей. И такие разработки ведутся у нас в стране. Выбирается мембранный белок, наиболее характерный для опухолевой клетки, и подбирается к нему высокоточный аптамер (как ключ к замку). Подобный аптамер может служить для терапии, диагностики, а также для таргетной доставки другого лекарства.
Нельзя не упомянуть развитие иммунотерапии опухоли, за что была вручена Нобелевская премия по медицине 2018 года. Разрабатываются антитела, которые способны заставить клетки собственно иммунной системы пациента узнавать опухоль и уничтожать ее, как все чужеродное.
Понять происхождение глиом
Он не бессмертен.
Галина Павлова, доктор биологических наук, профессор РАН, заведующая лабораторией нейрогенетики и генетики развития Института биологии гена РАН
PDF-версия
- 18
- 19
- 20
Лучевая терапия - это метод лечения, основанный на применении ионизирующего излучения. Метод применяется в медицинской практике более 120 лет. За это время произошли колоссальные изменения в техническом оснащении метода: от первых примитивных аппаратов с источниками радия (отсюда другое название метода – радиотерапия) до суперсовременных установок, оснащенных мощными компьютерами и позволяющими исключительно точно направлять пучок ионизирующего излучения на очаг болезни.
В основе эффекта противоопухолевой лучевой терапии лежит способность ионизирующего излучения воздействовать на генетический аппарат (ДНК) клетки, лишая ее возможности к воспроизведению и, таким образом, приводя ее к гибели.
Виды лучевой терапии
Существует три основных вида лучевой терапии:
- наружная (дистанционная) лучевая терапия,
- брахитерапия,
- лечение жидкими радиоактивными изотопами.
При наружной (дистанционной) лучевой терапии источник излучения находится вне тела пациента.
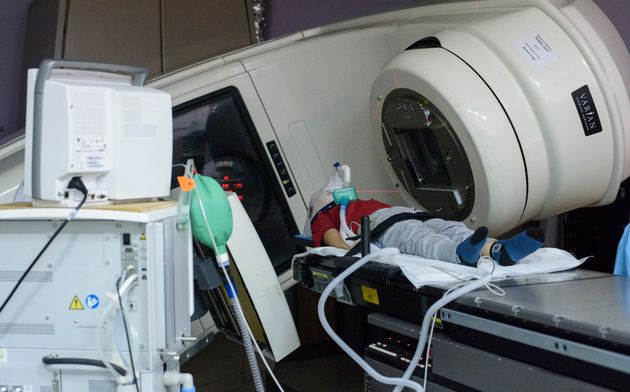
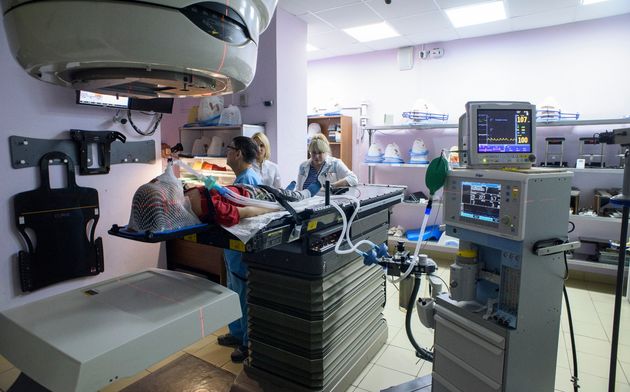
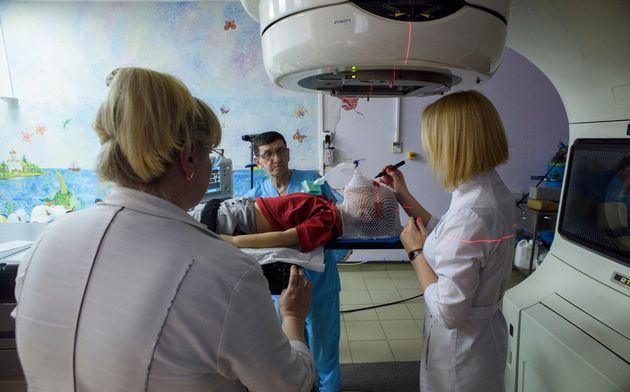
В случае брахитерапии (внутритканевой лучевой терапии) радиоактивный излучатель вводится непосредственно в опухоль. При лечении жидкими радиоактивными изотопами они вводятся в кровеносное русло или внутрь и избирательно фиксируются очагом заболевания.
Наружное облучение
В практике нейроонкологии в подавляющем большинстве случаев используется наружное облучение, которое проводится при помощи гаммаустановок, в которых в качестве источника излучения применяется радиоактивный изотоп (кобальт-60 или цезий-137) , или линейных ускорителей электронов, в которых жесткое рентгеновское излучение генерируется при ударении ускоренных электронов об мишень, или ускорителей протонов. Принципиальной разницы в противоопухолевом эффекте излучения из этих источников нет, но излучение линейного ускорителя и протонный пучок позволяют получать более отграниченный от окружающих тканей очаг воздействия, что снижает риск радиационного повреждения здоровых тканей.
Наружное облучение может проводиться фракционно, с использованием разовых фракций от 1,5 до 5 Гр в течение достаточно длительного периода (до 1,5 месяцев). Это проводится с расчетом того, что при каждой очередной фракции облучения повреждаются клетки опухоли, находящиеся в радиочувствительной фазе своего жизненного цикла. При этом суммарная доза облучения доводится до 45-78 Гр.. В части случаев, при небольших размерах опухоли используется радиохирургия: наружное облучение в разовой дозе 15-25 Гр. Это массивное облучение по противоопухолевому эффекту равнозначно фракционированному, но оно применимо только в небольшом числе случаев.
Побочные явления лучевой терапии
При лечении опухолей мозга могут наблюдаться побочные явления в виде появления или усиления головной боли, тошноты, рвоты, усиления выраженности неврологических нарушений. Врачи в таких случаях назначают дополнительные препараты, позволяющие купировать эти явления. К концу курса в большинстве случаев в зоне входа пучков излучения выпадают волосы, но они в дальнейшем вырастают.
Наиболее неприятными осложнениям облучения головного мозга являются возможные отдаленные последствия в виде некоторого снижения функциональных возможностей мозга. Однако большой опыт многолетнего наблюдения за такими больными свидетельствует, что они вполне адаптируются к социальным условиям.
Вторым неприятным осложнением является риск задержки роста костей в зоне входа пучков.
Искусство врача-радиотерапевта заключается именно в максимальном ограничении облучения здоровых тканей и рациональном фракционировании дозы облучения.
После лучевой терапии опухолей мозга возможны отсроченные реакции в виде головной боли, тошноты, повышения температуры тела. Это наблюдается в сроки до 3-х месяцев после окончания лечения. В таких случаях врачи назначают противоотечные средства, которые позволяют быстро купировать все симптомы.
После лучевой терапии пациент должен избегать тепловых процедур (бани, перегревание на солнце), травм, разумно ограничивать время просмотра телепередач и работы на компьютерах.
Грей ( обозначение: Гр , Gy ) — единица измерения поглощённой дозы ионизирующего излучения в Международной системе единиц ( СИ ). Поглощённая доза равна одному грею , если в результате поглощения ионизирующего излучения вещество получило один джоуль энергии в расчёте на один килограмм массы .
Читайте также:

