Антитела при исследовании опухолей

Антитела в иммунной системе
Как антитела лечат рак?
Иммунная система использует как клетки, так и клеточные продукты для атаки на чужеродные вещества в организме. Антитела, один из самых известных продуктов иммунной системы, представляют собой огромные белки, которые прилипают к микроскопической области мишени, называемой антигеном. Антитела продуцируются В-лимфоцитами, также называемыми плазматическими клетками. Антитела дрейфуют и циркулируют в организме. Когда антитело входит в тесный контакт с антигеном, который он распознает, он связывает его или присоединяется к антигену.
Антитела, которые прикреплены к антигенам, служат, как красные флаги, другим частям иммунной системы.
Моноклональные антитела
Антитела иммунной системы
Обычно иммунная система генерирует огромное количество антител, которые распознают целый ряд различных антигенов - и даже различные уголки и трещины одного и того же антигена.
В лаборатории ученые научились принимать одно специфическое антитело и делать много его копий. Термин моноклональный относится к процессу изготовления копий одного антитела из одного клона клеток, то есть одной уникальной родительской клетки и ее потомства из клеточного деления. Некоторые моноклональные антитела используют генную инженерию для объединения частей из разных источников в одно новое синтезированное антитело, имеющее характеристики, которые желательны для лечения.
Моноклональные антитела, которые работают самостоятельно
Моноклональные антитела используются вместе с другими противоопухолевыми препаратами, включая химиотерапию, облучение и хирургию.
Моноклональные антитела, которые отравляют раковые клетки
Поскольку химическое или токсическое вещество находится на антителе, оно концентрируется на раковые клетки, и идея состоит в том, что это уменьшит повреждение нормальных клеток по всему телу.
В поисках нового подхода к лечению злокачественных опухолей В-клеток, которые не поддаются лечению, группа исследователей, возглавляемая доктором Даниэлем Валлера, разрабатывает целенаправленный подход, который использует фрагменты антител. Используя генную инженерию, они делали антитела, которые связываются с CD19 и CD22 на клетках рака В-клетки, которые также имеют бактериальный дифтерийный токсин, присоединенный к антителу. В результате получился так называемый иммунотоксин, который называется DT2219.
Иммунотоксины не являются абсолютно новыми, однако их все еще активно исследуют и разрабатывают. На сегодняшний день большинство успехов достигнуто в лечении рака крови. Препятствия для успешного использования иммунотоксинов в солидных опухолях включают плохое проникновение в опухоль и иммунный ответ на токсиновый компонент терапии. Как только пациент устанавливает иммунный ответ на токсин, это ограничивает количество циклов терапии, которые могут быть получены.
Иммуногистохимическое исследование в онкологии – это разновидность исследования ткани с помощью специальных реактивов по принципу антиген-антитело.
При иммуногистохимическом исследовании используются реактивы, которые содержат антитела, отмеченные специальными веществами.
Антитело – это белок, который связывается в тканях с определенными молекулами - антигенами, после чего возникает реакция. Если же таких молекул нет, то и реакции не будет.
По этому признаку можно судить, присутствует в ткани интересная нам молекула или нет. Это похоже на то, если нанести на белый стол бесцветный клей. Невооруженным глазом на белом фоне он практически незаметен, но стоит насыпать на стол мелкого песка, как клей становится виден за счет прилипших песчинок.
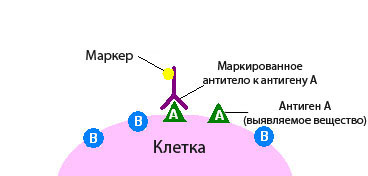
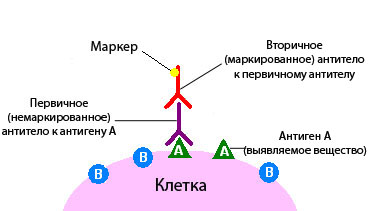
По правилам иммуногистохимическое исследование при раке всегда проводится в специализированной лаборатории. Для его проведения необходима опухолевая ткань, полученная в результате биопсии или операции.
Иммуногистохимическое исследование проводится для определения наличия в опухолевых клетках различных точек приложения, например, наличие рецепторов эстрогенов (ER) и прогестеронов (PR). Также иммуногистохимия выполняется для определения показателя Ki-67 (индекс пролиферативной активности опухолевых клеток), гиперэкспрессии белка Her2neu, VEGF (сосудистый фактор роста), р53.
Иммуногистохимическое исследование при раке выполняется для того, чтобы понять, какими препаратами можно лечить злокачественную опухоль, и к каким видам препаратов она чувствительна.
Самый распространённый анализ, определяемый при иммуногистохимическом исследовании, это наличие рецепторной чувствительности к гормонам у опухоли.
ER и PR - протеиновые рецепторы на поверхности опухолевых клеток.
В организме человека постоянно вырабатываются гормоны - эстроген и прогестерон. Эти гормоны воздействуют на ER и PR рецепторы, что приводит к стимуляции роста опухолевых клеток.
Определение Эстрогеновых и Прогетестероновых рецепторов является одним из важнейших моментов, определяющих чувствительность опухоли к терапии гормональными препаратами.
Чаще всего наличие рецепторов ER/PR определяют при раке молочной железы. Их наличие дает возможность, помимо стандартных методов лечения, применить гормональную терапию.
При гормон позитивном раке молочной железы, назначаются препараты: Тамосксифен, Экземестан (Аромазин), Летрозол (Фемара), Анастразол (Аримидекс), Гексэстрол (Синестрол) и другие.Также, считается, что гормонально-зависимый рак молочной железы отличается спокойным течением и редким метастазированием.
Чувствительность опухолевых клеток к гормональной терапии выражается в баллах от 0 до 10. Опухоль считается гормонозависимой, начиная с 2-х баллов. и требует добавления к лечению гормональной терапии.
Her2Neu - это рецептор эпидермального фактора роста раковой клетки. Это - ген, который воздействует на мембранные рецепторы клетки, и стимулирует её к усиленному делению.
В некоторых опухолях (чаще всего рак молочной железы, рак пищевода, рак желудка) присутствует гиперэкспрессия (повышенная активность) Her2Neu, что вызывает быстрое деление опухолевой клетки и её повышенную активность.
Также снижается эффективность химиотерапии, лучевой терапии, гормональной терапии. Из-за этого опухоли с Her2neu позитивным статусом отличаются агрессивным течением.
Существует две методики определения наличия у опухоли гена Her2neu:
Результаты иммуногистохимического исследования выражаются в баллах:
- 0-1 означает, что опухоль без гиперэкспрессии Her2neu.
- 3 означает, что опухоль с гиперэкспрессией Her2neu.
2. Метод FISH (Флуоресцентная гибридизация in situ)
В отличие от иммуногистохимического исследования, при котором определяются белки, при методе FISH определяется наличие генов, кодирующих протеины Her2neu. В зависимости от их наличия, определяется гиперэкспрессия Her2neu.
Определение гиперэкспрессии рецептора Her2neu в опухоли молочной железы является очень важным для дальнейшего назначения лечения.
В современной онкологии гиперэкспрессию Her2neu определяют, чтобы понять, необходимо ли добавление к лечению ингибиторов Her2neu. Для лечения опухолей с гиперэкспрессией рецептора Her2Neu активно и успешно используются таргетные препараты Трастузумаб (Герцептин), Пертузумаб (Перьета), Трастузумаб-эмтанзин (Кадсила), Бейодайм (Трастузумаб+Пертузумаб). Эти препараты прицельно блокируют рецепторы Her2neu, тем самым останавливая активный рост опухолевых клеток и повышая их чувствительность к химиопрепаратам. Добавление таргетной терапии к стандартной химиотерапии при лечении Her2neu позитивных опухолей, серьезно увеличивает общую выживаемость и результат противоопухолевого лечения.

Ki-67 - это маркер пролиферативной активности опухолевой клетки. Данный параметр оценивается в процентах и показывает, сколько процентов опухолевых клеток активно делятся.
Если Ki-67 меньше 15%, опухоль считается слабоагрессивной, при показателе Ki-67 от 30 до 50% опухоль считается агрессивной, а при показателе Ki-67 выше 50% опухоль является высокоагрессивной.
Также Ki-67 является фактором прогноза течения опухолевого заболевания и ответа опухоли на химиотерапевтическое лечение. Определяется это простым способом: чем ниже показатель Ki-67, тем хуже опухоль реагирует на химиотерапевтическое лечение. И наоборот - чем выше показатель Ki-67, тем лучше опухоль будет отвечать на химиотерапию.
Белок p53 - это транскрипционный фактор, регулирующий клеточный цикл. В быстро делящихся клетках обнаружено увеличение концентрации белка р53 по сравнению с клетками, делящимися медленно, что обусловлено высоким риском их онкогенности.
Белок p53 предотвращает образование злокачественных опухолей в нашем организме. В норме, антионкоген р53 находится в неактивном состоянии, а при появлении повреждений ДНК в здоровой клетке - активируется.
Функция белка р53 состоит в удалении тех клеток, которые являются потенциально онкогенными. Это называется - индуцированный апоптоз, уничтожение потенциально опасной клетки.
При иммуногистохимическом исследовании, повышенное содержание белка p53 обнаруживается в 50% злокачественных клеток, что позволяет им беспрепятственно делиться и избегать апоптоза (уничтожения).
Количество белка p53, определяют в дополнение к показателю Кi67, для того, чтобы понять насколько агрессивна опухоль и определить дальнейшее течение болезни. Если уровень белка p53 высокий, значит опухоль не агрессивная и не склонна к метастазированию и быстрому росту. Если же, показатель белка p53 низкий, то значит опухоль агрессивна и склонна к быстрому росту в окружающие ткани и метастазированию.

VEGF – это сигнальный белок, вырабатываемый клетками для активного роста новых сосудов в уже существующей сосудистой системе.
Есть несколько видов белка VEGF, и каждый воздействует на определенный рецептор VEGFR (Vascular endothelial growth factor receptor). Для того чтобы активно делиться, опухоли нужно питание, а для этого нужны сосуды, по которым это питание будет поступать. Именно по этой причине в опухолевых клетках содержится повышенное содержание белка VEGF - для того, чтобы в короткие сроки строить сосудистые сети.
Наличие белка VEGF в опухоли говорит о возможности применения таргетной терапии такими препаратами, как Бевацизумаб (Авастин), Рамуцирумаб (Цирамза), Афлиберцепт (Залтрап). Они перестраивают сосудистую сеть опухоли, тем самым лишая её питания.
Чаще всего определение гиперэкспрессии белка PD-1 и его лиганд PDL-1 и PDL-2 необходимо при меланоме, немелкоклеточном раке легкого, раке желудка и раке почки.
Для того чтобы отобрать пациентов, которым показана иммунотерапия, проводится определение наличия экспрессии PD-1 и его лиганд PDL-1 и PDL-2, при помощи флюоресцентной гибридизации in situ (FISH). При наличии экспрессии PD-1 и его лиганд PDL-1 и PDL-2, показано применение иммунотерапии препаратами Пембролизумаб (Кейтруда), Ниволумаб (Опдиво), Атезолизумаб (Тецентрик).
В современной онкологии иммуногистохимическое исследование играет очень важную роль, так как при помощи этого исследования онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
Исследование клеток ткани, которое проводится с помощью специальных реактивов.
ИГХ, иммуногистохимия, иммуногистохимический анализ.
Immunohistochemistry, IHС, immunohistochemical analysis.
Какой биоматериал можно использовать для исследования?
Образец ткани / образец ткани в парафиновом блоке.
Как правильно подготовиться к исследованию?
- Специальной подготовки не требуется.
Общая информация об исследовании
Иммуногистохимическое исследование клинического материала проводится в целях выявления в нем искомых веществ. Готовые гистологические препараты обрабатываются специальными реактивами, содержащими меченые специфические антитела к выявляемому веществу, которое в данной ситуации служит антигеном. Если искомое вещество находится в исследуемом материале, то антитело связывается с его определенными участками. В результате этого между ними образуется комплекс и происходит окрашивание ткани.
Данный метод используется в диагностике различных патологических состояний, особенно велика его роль в области онкологии. Иммуногистохимическое (ИГХ) исследование помогает не только диагностировать опухоль, определить ее нозологический вариант, выявить первичный опухолевый очаг и обнаружить раковое перерождение клеток, но также спрогнозировать варианты течения заболевания и успешность лечения. К факторам, влияющим на прогноз, относятся рецепторы к эстрогенам и к прогестерону, Ki-67 (маркер активности опухоли), her-2 neu (эпидермальный фактор роста, определяет чувствительность опухоли к химиопрепарату трастузумабу/герцептину), VEGF (сосудистый фактор роста), Bcl-2, р53 и др. В отличие от иммуногистохимического анализа, их невозможно определить при обычном гистологическом исследовании.
Также этот метод нашел применение в диагностике системных заболеваний соединительной ткани и болезней почек, позволяет выявлять бактерии и вирусы в изучаемых тканях, например вирус Эпштейна - Барр, папиллома-вирус, Helicobacter Pylori (у больных хроническим гастритом), микобактерии при диагностике туберкулеза и др.
На основе ИГХ-анализа врач получает заключение с положительными и отрицательными маркерами, и это помогает подтвердить или опровергнуть гипотезу других клинико-лабораторных исследований.
Рак шейки матки относится к наиболее распространенным видам рака у женщин. Эпидемиологические и лабораторные данные подтверждают роль человеческого папиллома-вируса (ВПЧ, HPV) в качестве запускающего агента для подавляющего большинства предраковых и злокачественных поражений эпителия слизистой оболочки шейки матки. При этом ДНК ВПЧ могут быть обнаружены в 95-100% всех случаев.
Вирус папилломы человека представляет собой небольшие циркулярные двухцепочечные вирусы дезоксирибонуклеиновой кислоты (ДНК), принадлежащие к семейству Papillomaviridae. Известно более 130 типов ВПЧ. Они классифицируются по степени риска, основанного на их связи с цервикальной карциномой. ВПЧ 16 и 18 являются наиболее часто встречающимися типами высокого риска. Внедряясь в эпителиальные клетки, вирус вызывает в них дефекты генов, тем самым способствуя развитию опухоли. При помощи ИХГ легко обнаружить в клетках, пораженных HPV, экспрессию белков p16 и p18, и их позитивность сильно коррелирует с позитивностью HPV. Это помогает различить неопухолевую дисплазию (как результат воспаления) и опухолевую (вызванную вирусом папилломы и способную переродиться в рак), а также позволяет провести дифференциальную диагностику дисплазии умеренной и высокой степени тяжести (CIN II/III) и начальных форм рака шейки матки, выявление поражений, склонных к прогрессированию и развитию инвазивной карциномы. В дисплазиях умеренной и высокой степени (в 80-100% случаев CIN II и практически во всех случаях CIN III) и инвазивном раке шейки матки определяется усиленная экспрессия белка p16, и она усиливается по мере нарастания тяжести поражения.
У женщин с плоскоклеточными интраэпителиальными поражениями низкой степени тяжести очаговая и диффузная экспрессия свидетельствует о прогрессировании заболевания. Отсутствие или очаговая экспрессия p16 в поражениях высокой степени может служить дополнительным признаком благоприятного течения патологического процесса.
Применяется иммуногистохимическое исследование и при дифференциальной диагностике целиакии.
Целиакия – это системное заболевание, обусловленное генетической непереносимостью глютена или соответствующих проламинов, которые содержатся в семенах злаков. Характеризуется данная патология повреждением слизистой оболочки тонкой кишки (развитием атрофической энтеропатии), появлением в сыворотке крови специфических антител и широким спектром глютензависимых клинических проявлений. Заболевание встречается в два раза чаще среди женщин, чем среди мужчин, может впервые проявиться как в детстве, так и у взрослых. Целиакия может протекать с ярко выраженной или со стертой клинической картиной, а также без гастроэнтерологической симптоматики. Чаще всего встречается стертый вариант течения заболевания, поэтому диагностика глютеновой энтеропатии (ГЭ) затруднена.
На первичном лабораторном этапе проводится серологическое исследование, определяющее в крови специфические биомаркеры. Лицам с положительными результатами показана эндоскопия тонкой кишки с биопсией и последующим гистологическим и ИГХ анализом взятого материала.
Известно, что целиакия сопровождается повышением числа лимфоцитов внутри эпителиальных клеток тонкой кишки. При этом отличительной особенностью является то, что большинство интраэпитиальных лимфоцитов (ИЭЛ) несут на своей поверхности специфический Т-клеточный рецептор (CD3 γ и CD3δ-положительные клетки). Чем активнее протекает заболевание, тем больше ИЭЛ. Эта особенность используется при проведении иммуногистохимического исследования, позволяющего определить преобладающий тип лимфоцитов. Особенно важен этот анализ, когда существует расхождение между данными серологического исследования и гистологической оценкой на стандартных участках.
Для чего используется исследование?
- Для определения вида и подвида опухоли, степени ее злокачественности и распространенности онкологического процесса;
- для дифференциальной диагностики пролиферативных заболеваний;
- для определения этиологического фактора, вызвавшего изменения в клетках;
- для подбора эффективной терапии;
- для оценки пролиферативной активности клеток опухоли;
- для оценки эффективности лечения;
- для диагностики рецепторного статуса при онкологическом заболевании (например, раке молочной железы, предстательной железы);
- для определения первичного очага опухоли;
- для выявления злокачественного потенциала пораженных клеток;
- для первичного отбора пациентов для диспансерного учета и дальнейшего обследования;
Когда назначается исследование?
- При дифференциальной диагностике дисплазии (высокой и умеренной степени) и начальной стадии рака шейки матки;
- при раке молочной железы, желудка, предстательной железы в целях определения чувствительности к различным видам терапии;
- при определении степени злокачественности и оценки прогноза заболевания;
- при оценке эффективности терапии;
- при поиске источника метастазов;
- при диагностике гастроинтестинальных стромальных опухолей (GIST) с помощью расширенной панели антител, включающей DOG1;
- при диагностике нейроэндокринных опухолей;
- при дифференциальной диагностике целиакии, сопровождающейся неясной гистологической картиной;
- при расхождении результатов серологического исследования и гистологической оценки.
Что означают результаты?
Диапазон значений индивидуален для каждого заболевания, зависит от используемых антител.
Расшифровка результатов исследования содержит информацию для лечащего врача и не является диагнозом.
Проводится морфологическая оценка препарата (опухоли классифицируются согласно ВОЗ), дается описательный ответ с указанием оценки экспрессии антитела. ИХГ всегда следует использовать в качестве дополнения к морфологическому исследованию, результаты не следует интерпретировать изолированно.
Что может влиять на результат?
При некоторых заболеваниях есть факторы, которые могут влиять на результат. Так, при диагностике целиакии назначение безглютеновой диеты до исследования может приводить к получению ложноотрицательного результата.
Кто назначает исследование?
Онколог, гинеколог, гастроэнтеролог, терапевт, педиатр.
Литература
- Далленбах-Хеллвег Г., Трунк М.Й., Кнебель Дебериц М. Традиционные и новые молекулярные методы для ранней детекции рака шейки матки//Архив патологии 2004 - №5 - с. 35-39.
- Brunner M, Koperek O, Wrba F, Erovic BM, Heiduschka G, Schoppper C, et al. HPV infection and p16 expression in carcinomas of the minor salivary glands. Eur Arch Otorhinolaryngol. 2012;269:2265–9.
- Galgano MT, Castle PE, Atkins KA, Brix WK, Nassau SR, Stoler MH. Using biomarkers as objective standards in the diagnosis of cervical biopsies. Am J Surg Pathol. 2010;34:1077–87.
- McCluggage WG. Immunohistochemistry as a diagnostic aid in cervical pathology. Pathology. 2007;39(1):97–111.
Литературные данные, свидетельствующие о возможности участия В-лимфоцитов в усилении роста опухоли, можно рассматривать в двух аспектах: первый — непосредственное влияние В-лимфоцитов, второй — значение противоопухолевых антител, хотя очевидно, что оба аспекта тесно связаны между собой.
В изучение этого вопроса большой вклад внесли исследования Н. Schreiber и его коллег (Т. Wu, P. Monach, D. Rowley, D. Mumburg и др.).
По мере накопления соответствующих данных выяснилось, что как В-лимфоциты, так и антитела против опухолевых антигенов при определенных условиях могут быть факторами усиления роста опухоли.
В-лимфоциты
В одной из ранних работ на модели перевивных опухолей было показано, что у мышей, дефицитных по В-лимфоцитам, опухоли развиваются медленнее и значительно чаще наблюдается регрессия опухоли.
Согласно этим данным авторы сформулировали заключение, что В-лимфоциты супрессируют возможность регрессии опухоли, и этот факт может быть положен в основу нового направления, связанного с изучением механизмов иммунологического усиления с участием В-лимфроцитов.
Со временем появились сведения, которые давали возможность в определенной мере объяснить усиление роста опухоли под влиянием В-лимфоцитов. В опытах с использованием нормальных мышей и дефицитных в отношении В-лимфоцитов были получены данные, из которых следовало, что в присутствии В-лимфоцитов СD4+Т-лимфоциты не способны оказывать помощь цитотоксическим лимфоцитам (ЦТЛ).
Это послужило основанием для заключения об ингибирующем влиянии В-лимфоцитов на Т-зависимый противоопухолевый иммунитет. Полученные данные, согласно точке зрения авторов, могут помочь в объяснении наблюдений, из которых следует, что противоопухолевые антитела, часто появляющиеся как в опухолевой ткани, так и сыворотке крови больных раком, могут принимать участие в усилении роста опухоли.
В установление возможных причин стимулирующего влияния В-лимфоцитов на рост опухоли определенную ясность вносят данные, которые показывают, что оно может быть связано со способностью В-лимфоцитов снижать уровень IFNy и IL-12.
Такие сведения были получены при исследовании влияния различных фракций клеток селезенки мышей-опухоленосителей: нефракционированные клетки селезенки продуцировали IFNy и IL-12, при элиминации В-лимфоцитов продукция этих цитокинов усиливалась, а при добавлении В-лимфоцитов — уменьшалась.
Механизм ингибирующего влияния В-лимфоцитов авторы объясняют тем, что процесс их взаимодействия с Т-лимфоцитами (CD40/CD40L) сопровождается снижением уровня IL-12, участвующего в усилении продукции IFNy.
Механизм иммуностимулирующего действия был исследован также при обследовании больных раком кишечника. Установлено, что среди В-лимфоцитов периферической крови больных появляются клоны этих клеток с аномальным фенотипом, которые экспрессируют на своей поверхности (при снижении количества клеток, экспрессирующих CD19) CD21 и/или sTn-антиген.
Удалось также показать, что при частичном удалении В-лимфоцитов уменьшалось число CD21-положительных клеток, не изменялось содержание sTn-положительных клеток, но тяжесть течения процесса у большого количества больных снижалась.
Эти данные заслуживают особого внимания, так как они свидетельствуют о том, что не все В-лимфоииты, а лишь определенные их клоны могут быть причастны к иммуностимуляции роста опухоли. Необходимо поэтому расширение спектра исследований в этом направлении с характеристикой соотвествующего фенотипа В-лимфоцитов.
Продолжая это направление исследований, авторы указанной работы отметили еще один важный факт: после экспозиции В-лимфоцитов с опухолевыми антигенами они приобретают способность усиливать рост опухоли in vivo и in vitro.
При выяснении механизма этого усиления удалось показать, что иммунные комплексы, в состав которых входят антигены опухоли и противоопухолевые антитела, вступают во взаимодействие с опухолевыми клетками, экспрессирующими FcyRI, что сопровождается усилением их пролиферации и потерей опухолевых антигенов. Такая пролиферация, индуцированная иммунными комплексами, связана с сигналом трансдукции, обусловленным фосфатидилинозитолкиназой-3.
Из этих данных следует принципиальное предположение: иммунные комплексы и FcyRI опухолевых клеток усиливают рост и формируют метастатический фенотип.
Имеются данные, которые позволяют склоняться к точке зрения, что инфильтрация ткани В-лимфоцитами может служить благоприятным фоном для перехода предопухолевых изменений в злокачественный процесс.
Такие данные получены при исследовании гиперкератоза, дисплазий и плоскоклеточной карциномы языка. Установлено, что при инфильтрации CD4+-, CD8+-, CD14+-, CD19+- и СD20+-лимфоцитами наиболее существенно изменялись В-лимфоциты, инфильтрирующие пораженные участки; инфильтрация В-лимфоцитами была незначительной в нормальной ткани и наиболее выраженной при малигнизации.
Как отмечено в первой части монографии, В-лимфоциты могут индуцировать В-клеточную толерантность, которая является результатом их взаимодействия с Т-лимфоцитами. Наряду с этим хорошо известно, что такое взаимодействие — необходимое условие для индукции иммунологического ответа.
Для выяснения причин этих противоположных эффектов использовали модели Т-зависимой и Т-независимой В-клеточной активации. В результате исследований получены данные о снижении уровня ответа ЦТЛ при использовании различных путей активации В-клеток, что сопровождалось ослаблением пролиферации, секреции цитокинов и цитотоксической активности цитотоксических лимфоцитов.
Негативное влияние В-лимфоцитов нивелировалось антителами против TGFв1, который экспрессировался на поверхности В-лимфоцитов и мог быть причиной снижения уровня ответа ЦТЛ. Эти данные позволяют авторам предполагать существование нового механизма развития анергии ЦТЛ с участием TGFв1, экспрессируемого на поверхности В-лимфоцитов.
К настоящему времени уже на молекулярном уровне получены данные, приближающие к более полному пониманию причин неоднозначной роли В-лимфоцитов в опухолевом процессе. Такие данные получены при изучении спонтанного трансгенеза В-лимфоцитов человека, использования плазмиды ДНК, кодирующей тяжелую цепь иммуноглобулина, клеток лимфомы Беркитта, трансформированных вирусом Эпштейна-Барр, и наивных В-лимфоцитов периферической крови.
Впервые было показано, что наивные В-лимфоциты располагают программой для спонтанной интернализации ДНК, которая может обусловливать новые иммунологические функции этих клеток.
Возможные пути включения В-лимфоцитов в стимуляцию роста опухоли представлены на рис. 62.

Рис. 62. Включение В-лимфоцитов в стимуляцию роста опухоли
Противоопухолевые антитела
Наряду со способностью участвовать в стимуляции роста опухоли на клеточном уровне В-лимфоциты как предшественники плазматических клеток могут включаться в этот процесс и с помощью противоопухолевых антител.
Хорошо известно, что в сыворотке крови как больных злокачественными новообразованиями, так и животных с различными моделями опухолевого процесса обнаруживаются противоопухолевые антитела, роль которых в противоопухолевой защите обсуждалась ранее.
Противоопухолевые антитела обнаруживаются и внутри различных опухолей. Несмотря на то, что этот факт, как и инфильтрация опухоли плазматическими клетками, известен давно, четкого определения, в каких случаях они появляются и каково их значение, до настоящего времени нет.
Исследование солидных опухолей, в частности меланом, показало, что антитела находятся не только внутри опухоли, но и на поверхности опухолевых клеток. Со временем было обнаружено, что антитела могут препятствовать ответу цитотоксических лимфоцитов и усиливать опухолевый рост.
Есть основания полагать, что роль противоопухолевых антител в значительной мере предопределяется тем, какие опухолевые антигены индуцировали их синтез. При использовании гликопротеина (STGP) — опухолеассоциированного антигена, секретируемого рядом опухолей, в опытах на модели инвазивного рака отмечен высокий уровень антител класса G против этого антигена и повышение их уровня, что коррелировало с опухолевой инвазией.
Важным аспектом этих исследований является констатация того, что наличие антител против указанного антигена сочеталось с локальным выделением IL-1в, IL-6 и VEGF стромальными клетками.
Параллельно с увеличением концентрации антител в сыворотке крови выявлена интенсивная инфильтрация опухоли IgG-положительными опухолевыми клетками. Вывод, к которому приходят авторы, таков: гуморальный иммунологический ответ, индуцированный гликопротеином, секретируемым опухолью, усиливает инвазию и метастазирование путем выделения стромальными клетками провоспалительных цитокинов.
В усилении роста опухоли могут участвовать не только противоопухолевые антитела изотипа G. Такой способностью обладают также антитела класса М. При решении вопроса, могут ли анти-IgM-моноклональные антитела генерировать избирательное связывание клеток меланомы В16 сингенными фибробластами и лимфоцитами, получены следующие данные.
Установлено, что анти-IgM-антитела увеличивают колонизацию опухолевых клеток и их агрегацию — свойства, которыми не обладают интактные IgM- и IgG-подобные фрагменты. Более того, химически синтезированный IgG-подобный фрагмент противоопухолевых aнти-IgM-антител снижает уровень колонизации и агрегации опухолевых клеток.
Полученные данные ярко демонстрируют разнонаправленность эффектов анти-IgМ-антител, так как наряду с противоопухолевым действием они могут способствовать гематогенной диссеминации опухолевых клеток. На рис. 63 представлены возможности стимуляции роста опухоли под влиянием противоопухолевых антител.

Рис. 63. Стимулируюшее влияние противоопухолевых антител на рост опухоли
В настоящее время уже появляется информация, которая приближает к объяснению неравнозначности влияния на рост опухоли как В-лимфоцитов, так и противоопухолевых антител на генетическом уровне.
Фундаментальной основой подобных исследований служит установленный факт, согласно которому прогрессия опухолевого процесса часто сопровождается появлением новых антигенов, способных индуцировать синтез антител.
Многие из этих антигенов — результат генетических мутаций, которые особенно часто сопровождают поздние стадии процесса. К сожалению, об этих изменениях известно немного, однако доказано, что новые антигены не снижают своей иммуногенности, а следовательно, могут распознаваться иммунологической системой и генерировать иммунологический ответ.
Поэтому представляются очень важными и оригинальными исследования, проведенные М. Spiotto, М. Reth и Н. Schreiber, которые использовали методические подходы, позволяющие индуцировать генетические рекомбинации в стабильных опухолевых клетках.
Такая рекомбинация привела, в частности, к увеличению экспрессии белка, усиливающего зеленую флюоресценцию клетки (EGFP) с последующей выработкой антител против этого белка. Появление новых антител свидетельствовало о генетических изменениях, наступивших в процессе роста, которые могут быть предвестниками последующей прогрессии.
Хорошо известно, что появление противоопухолевых антител во многих случаях сопровождается образованием иммунных комплексов. Эти комплексы с включением различных механизмов могут как системно, так и локально способствовать усилению роста опухоли. Особенности влияния иммунных комплексов на рост опухоли представлены на рис. 64.

Рис. 64. Возможные механизмы повреждающего действия иммунных комплексов при опухолевом процессе
Роль В-лимфоцитов и противоопухолевых антител в усилении роста опухоли
Анализируя материал о роли В-лимфоцитов и противоопухолевых антител в усилении роста опухоли, нельзя не отметить, что объем данных по этому вопросу сравнительно невелик. Тем не менее возможность иммуностимуляции с участием как В-лимфоцитов, так и противоопухолевых антител очевидна.
К настоящему времени остается открытым вопрос о том, существует ли подобно CD4+CD25+- и СD8+СD28-Т-лимфоцитам субпопуляция В-лимфоцитов с негативной регуляцией. Однако весьма вероятно предполагать наличие фенотипа В-лимфоцитов, который формируется при определенных условиях и может способствовать усилению роста опухоли.
Такую способность В-лимфоциты приобретают при их взаимодействии с иммунными комплексами, в состав которых входят антигены опухолей и противоопухолевые антитела.
Оценка роли В-лимфоцитов и противоопухолевых антител в стимуляции роста опухоли тесно связана с изучением антигенов, способных индуцировать синтез противоопухолевых антител, значение которых может изменяться в зависимости от особенностей антигена и стадии процесса. Успех дальнейшего изучения роли В-лимфоцитов и противоопухолевых антител в стимуляции роста опухоли зависит от разработок соответствующих экспериментальных моделей.
Одним из центральных механизмов усиления роста опухоли с участием противоопухолевых антител является их препятствие к распознаванию и действию цитотоксических клеток.
Читайте также:

