Антигены к раковым клеткам
Главным вопросом в иммунологии опухолей является вопрос об антигенах опухолевых клеток. Несмотря на довольно длительную предысторию, их молекулярное клонирование и идентификация находятся лишь в начале пути. Причина этого заключается в том, что лишь немногим более 10 лет назад были разработаны методы, позволяющие выделить из молекул МНС антигенные пептиды, определить их первичную структуру и МНС-связываюшие мотивы, необходимые для связывания с различными аллельными формами молекул МНС.
Комплекс этих методов включает в себя разрушение клеток мягкими неионными детергентами, иммуноаффинную хроматографию на колонках с иммобилизованными моноклональными антителами к индивидуальным молекулам МНС, кислотную элюцию пептидов из них разделение пептидов методом высокоэффективной жидкостной хроматографии и определение первичной структуры деградацией по Эдману либо массспектрометрией.
Работы по идентификации МНС-связывающих мотивов для различных аллельных форм молекул МНС продолжаются, и можно надеяться, что вскоре они будут раскрыты для большинства аллельных форм мыши и человека. В опухолевых клетках обнаруживается ряд антигенов, которые могут иметь клиническое значение в разработке методов иммунотерапии рака. Для идентификации этих антигенов в последние годы используют различные подходы. Один их них стал возможным после того, как Т-лимфоциты. инфильтрирующие опухоль, научились длительно культивировать в культуре in vitro, с сохранением их специфичности и цитолитических свойств.
Метод основан на получении экспрессирующих библиотек к ДНК опухолевых клеток в клеточных линиях, экспрессирующих молекулы МНС человека, что позволяет проводить их скрининг по способности вызывать цито-токсическую реакцию при добавлении CTL, выделенных из опухолей пациентов и поддерживаемых в культуре in vitro. Следующее за этим определение первичной структуры кодируемого продукта позволяет предсказать наиболее вероятные последовательности распознаваемых пептидов опухолевого антигена, используя алгоритм, основанный на знании позиций якорных аминокислотных остатков, обусловливающих связывание пептидов с конкретными аллельными формами молекул МНС.
Одним из наиболее успешных приложений этого метода является цикл работ Терри Буна с соавт., позволивший идентифицировать несколько групп сперматогональных анигенов.
Уникальные антигены опухолей, распознаваемые сингенными или аутологичными Т-клетками 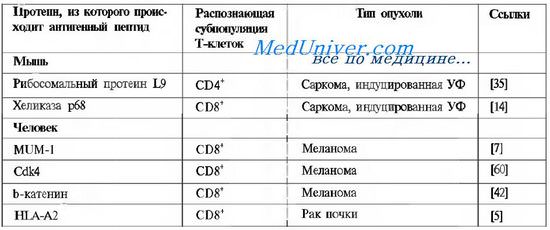
Трансформация и прогрессия опухоли могут сопровождаться экспрессией новых антигенов, становящихся мишенями иммунной атаки организма с появлением в крови антител к ним. Метод, называемый SEREX (Serological identification of antigens by recombinant expression cloning), основан на молекулярном клонировании антигенов из экспрессирующих библиотек к ДНК опухолевых клеток с использованием антител, присутствующих в сыворотках раковых больных. Применение данного метода позволяет найти антигены опухолевых клеток, к которым иммунная система не обладает толерантностью и способна ответить. Эти серологически определяемые антигены также могут быть мишенью для CTL.
В сответствии с тем, как опухолевые антигены распределены на клетках опухоли и нормальных клетках организма, они могут быть разделены на опухольспецифические и опухолеассоциированные. Первая группа представлена уникальными антигенами опухолевых клеток, возникшими в результате мутаций. Большинство химических или физических канцерогенов являются мутагенами. Начиная с 1995 г. идентифицированы несколько генетических источников уникальных антигенов мышиных и человеческих опухолей. В каждом случае антиген появлялся в результате соматической мутации — т. е. генетического изменения, отсутствующего в аутологичной ДНК нормальных клеток. В таблице представлено описание свойств нескольких уникальных антигенов опухолевых клеток.
Как видно из таблицы, эти антигены не принадлежат к какому-либо отдельному семейству. Все эти антигены в той или иной мере вовлечены в процессы канцерогенеза, и мутации определяются в функциональных участках этих белков. Потенциальной мишенью Т-клеток могут также быть продукты мутантного протоонкогена RAS, туморогенный потенциал которого проявляется в результате активирующих мутаций. В силу того, что RAS локализован внутри клетки, продукция антител к его мутантным продуктам не может привести к отторжению, но мутантные пептиды могут презентироваться молекулами МНС классов I и II и распознаваться Т-клетками. Мишенью противоопухолевого ответа также может быть белок, кодируемый супрессорным геном р53, мутантные продукты которого накапливаются в клетках из-за нарушения процессов его деградации.
Опухолеспецифические антигены также могут образовываться в результате внутренних делеций или хромосомных транслокаций, в некоторых случаях приводящих к экспрессии химерных белков и появлению новых аминокислотных замен в точках слияния. Широко известным примером является экспрессия химерного белка BCR/ABL при некоторых лейкемиях
По всей видимости, к группе опухолеспецифических антигенов можно отнести антигены опухолей, кодируемые генами онкогенных вирусов. Вирус SV-40, вирусы полиомы и папилломы человека способны к случайной интеграции в геном клетки, которую они трансформируют. Экспрессия вирусных белков этих ДНК-содержащих вирусов, необходимых для поддержания трансформированного фенотипа опухолевой клетки, обусловливает существование опухолеспецифических антигенов, которые могут быть мишенями для распознавания цитотоксическими Т-лимфоцитами. В отличие от трансформирующих продуктов ДНК-содержащих онковирусов, продукты генов РНК-содержащих ретровирусов очень сходны с эндогенными клеточными онкогенами, и поэтому могут вызывать, в лучшем случае, слабый иммунный ответ.
Несмотря на то, что опухолеспецифические антигены являются истинными антигенами, эффективность иммунного ответа на которые подтверждается широким рядом экспериментальных работ, реальное их применение в иммунотерапии опухолей в клинике является вопросом будущего из-за трудности идентификации таких антигенов у индивидуальных пациентов.
Опухольассоциированные антигены являются привлекательной мишенью для разработки иммунотерапевтических подходов к лечению рака в связи с тем, что они с относительно высокой частотой встречаются на различных типах трансформированных клеток. Тем не менее существенным препятствием для их использования служит то что они являются нормальными антигенами нормальных клеток, и поэтому иммунная система в той или иной мере толерантна к ним. По всей видимости1 эти антигены, подобно другим нормальным антигенам организма, вызывают делецию клонов Т-клеток с высокоаффинными рецепторами в тимусе. В результате иммунный ответ на них, как правило, недостаточно эффективен, что выражается в отсутствии значительных достижений при попытках их клинического использования.

Опухолевый антиген — вещество, вырабатываемое в онкоклетках и вызывающее у человека иммунный ответ. Антиген рака является опухолевым маркером в идентификации клеток с наличием злокачественного процесса. По этой причине он активно применяется в онкотерапии.
В качестве ракового антигена может выступать любой белок, который продуцируется в клетках опухоли. Эти белки появляются по причине мутации протооонкогена и опухолевого супрессора. В результате образуются аномальные белки, названные антигенами.
Классификация раковых антигенов
Мутация генов может привести к образованию аномального белка. По степени выраженности эти белки разделяют на две категории:
- Опухолеспецифические антигены — вещества, находящиеся только в онкоклетках.
- Опухолевык антигены, находящиеся как в обычных, так и в раковых клетках.
Онкология в соответствии с молекулярной структурой различает следующие раковые антигены:
- мутированные онкогены и супрессоры;
- антигены, продуцируемые онковирусами;
- клеточные гликолипиды и гликопротеины;
- антигены конкретных заболеваний;
- онкофетальные антигены.
- Опухолевые антигены могут использоваться для диагностики некоторых заболеваний:
- Раковый антиген 125 используется при диагнозе рака яичников.
- Альфафетопротеин (AFP) - при гепатоцеллюлярной карциноме.
- Эпителиальный опухолевый антиген — рак молочной железы.
- Карциноэмбриональный антиген (CEA) — рак кишечника, иногда легких и молочной железы.
- Тирозиназа — диагностика меланомы.
- Продукты РАН, р 53 — опухоли различного характера.

Особого внимания заслуживает раковый антиген 125 — белок на поверхности раковых опухолей. Тест на наличие ракового антигена 125 измеряет содержание белка в крови и используется в качестве онкомаркера при диагностике заболевания и во время проведения терапии.
Анализ проводится из образца крови или жидкости брюшной полости и грудной клетки. Все тесты используют антитела, направленные на выявление наличия белка СА 125. Анализ антигена может определить место развития ракового процесса.
Нормальное значение СА 125 представляет менее 35 единиц. Допустимый диапазон варьируется в зависимости от общей картины заболевания.
Высокий уровень СА 125 может быть вызвано следующими состояниями:
- воспалительные заболевания тазовых органов;
- миомы и эндометриоз матки;
- заболевания печени и почек;
- первый триместр беременности;
- рак матки, раковых труб и яичников;
- опухоли поджелудочной железы, пищевода, кишечника, легкого, молочной железы;
- новообразования в брюшной полости через лимфу.
Этот антиген имеет еще одно название — раково-эмбриональный антиген — элемент, описывающий набор связанных гликопротеинов в клеточной адгезии. Этот антиген производится в желудочно-кишечной ткани в период внутриутробного периода. По этой причине у взрослых детей СЕА присутствует только в небольшом количестве. При некоторых формах онкологии показатели содержания этого антигена увеличиваются, что позволяет констатировать возможность наличия раковых клеток.
Повышенный уровень раково-эмбрионального антигена может свидетельствовать о следующих процессах организма:
- наличии доброкачественных опухолей;
- наличие инфекций или воспалительных процессов;
- гибель опухолевых клеток.
В идеале после специальной терапии уровень карциноэмбрионального антигена должен снижаться. Если же после лечения уровень этого антигена остается без изменений, то это означает неэффективность мер или рецидив болезни.
Высокий показатель содержания раково-эмбрионального антигена свидетельствует о наличии онкологических процессов:
- рак щитовидной железы;
- рак желудка;
- рак молочной железы;
- рак прямой и толстой кишки.
Выявление содержания раковых антигенов применяется в нескольких случаях:
- ранняя диагностика опухоли кишечника, поджелудочной железы, желудка;
- анализ эффективности выбранных методов лечения;
- контроль за общим состоянием, возможностью рецидива и наличием метастаз.
Особенно часто для определения раковых заболеваний на ранних стадиях используются именно онкомаркеры, действие которых направлено на выявление наличия раковых антигенов.
Внедрение в клинико-диагностическую практику многоэтапных мероприятий с использованием онкомаркеров позволяет выявить группы риска в отношении онкологии. Чаще всего на подобную диагностику направляются лица, имеющие подозрительную симптоматику. Эта задача успешно решается с помощью клинической лабораторной диагностики, определяющей количественное значение с помощью тест-системы иммуноферментного анализа (ИФА).
Оборудование для анализа является доступным для большинства онкоцентров. Обследование возможно как по направлению врача, так и самостоятельно.
Опухолевый антиген ‒ это вещество, которое вырабатывается в онкоклетках, вызывая у человека иммунный ответ. Раковый антиген является полезным опухолевым маркером в идентификации клеток со злокачественным процессом, а также может применяться с целью онкотерапии.
Любой белок, продуцируемый в клетке опухоли, может выступать в качестве ракового антигена из-за своей аномальной структуры. Такие белки образуются в результате мутации соответствующего гена. Мутация протоонкогенов и опухолевых супрессоров приводит к образованию аномальных белков, названных антигенами. Примеры опухолевых антигенов включают продукцию РАН и р53.
Раковый антиген – классификация
Мутация иных генов, не связанных с образованием опухоли, может привести к синтезу аномальных белков. В зависимости от выраженности, они распределяются на две категории:
- Опухолеспецифические антигены, присутствующие только в клетках с явно выраженным злокачественным процессом.
- Опухолевые антигены, что находятся как в раковых клетках, так и в обычных.
В соответствии к молекулярной структуре и источнику, онкология различает такие раковые антигены:
- продукты мутированных онкогенов и супрессоров;
- опухолевые антигены, производимые онковирусами;
- онкофетальные антигены;
- измененные клеточные поверхности гликолипидов и гликопротеинов;
- антигены конкретного типа заболевания.
Связь опухолей с раковыми антигенами
Опухолевые антигены из-за их содержания в мутированных клетках могут использоваться в определении некоторых онкозаболеваний, в частности:
- Альфафетопротеин (AFP) в изобилии содержится в опухолях зародившихся клеток и гепатоцеллюлярной карциноме.
- Карциноэмбриональный антиген (CEA) находится в раке кишечника, а также иногда выявляется в легких или при раке молочной железы.
- Раковый антиген 125 образуется при диагнозе “рак яичников“.
- Эпителиальный опухолевый антиген наблюдается в раке молочной железы.
- Тирозиназа присутствует в меланоме.
- Патологические продукты РАН, р 53 могут выявляться в различных опухолях.
Раковый антиген 125

Раковый антиген 125 представляет собой белок, обнаруженный на поверхности многих раковых клеток яичника, а также в иных видах опухолей. Тест на СА-125 измеряет количество белка в крови и работает как онкомаркер, а также отслеживает терапевтический эффект лечения и возможность рака после операции (рецидив).
Измерение ракового антигена 125
Анализ проводится из образца крови, а также жидкости, взятой из грудной клетки или брюшной полости. Все тесты базируются на использовании антител, направленных на белок СА 125 (техника моноклональных антител).
При выявлении злокачественной опухоли, распространившейся на другие участки, анализ антигена поможет узнать, в какой именно клетке начался раковый процесс. Высокий уровень СА 125 является признаком того, что рак первоначально образовался в яичнике.
Нормальное значение представляет менее 35 единиц на миллилитр. Однако, допустимый диапазон может варьироваться в зависимости от лаборатории и общей картины заболевания.
Диагностическое значение анализов
Высокое значение анализа может быть вызвано и иными условиями:
- воспалительными заболеваниями тазовых органов;
- эндометриозом или миомой матки;
- заболеваниями печени, такими как гепатит или цирроз, а также панкреатитом;
- первым триместром беременности.
Типы рака и высокое значение теста включают такие заболевания:
- рак яичника, маточных труб или матки;
- злокачественные опухоли поджелудочной железы, желудка, пищевода, печени, молочной железы, толстой кишки или легкого;
- новообразования, которые распространились на слизистую оболочку брюшной полости, в том числе лимфому.
Карциноэмбриональный антиген (СЕА)
При некоторых видах рака эти сывороточные уровни поднимаются, что указывает на возможность использования карциноэмбрионального анализа в качестве онкомаркера.
Нормальный диапазон уровня карциноэмбрионального антигена, аккумулированный в крови, для некурящего взрослого составляет Диагностическое значение
Повышенный уровень карциноэмбрионального антигена может свидетельствовать о таких процессах:
- Наличие доброкачественных опухолевых клеток. При этом показатели не поднимаются выше 10 нг/мл.
- Инфекции или воспалительные заболевания кишечника, цирроз печени, панкреатит.
- Гибель опухолевых клеток вследствие воздействия химиотерапии или радиационного лечения.
Польза тестирования особенно оправдана в исследованиях, проведенных на рак желудочно-кишечного тракта. Когда уровень СЕА аномально высокий до операции или другого вида лечения, после успешной терапии он должен снизиться к нормальному показателю. Если же показатели остаются высокими, эта ситуация может свидетельствовать о прогрессировании или рецидиве заболевания. Кроме того, уровень > 20 нг/мл, выявленный до начала терапии, часто связан с метастазированием опухоли.
Условия высоких показателей наличия раково-эмбрионального антигена характеризируют такие онкологические процессы, как:
- рак толстой и прямой кишки;
- рак поджелудочной железы, желудка, молочной железы, некоторых видов рака щитовидной железы.
К настоящему времени известен ряд антигенов этой группы: альфа-фетапротеин (АФП), раково-эмбриональный антиген, плацентарная щелочная фосфатаза, эмбриональный преальбумин, специфический в-гликопротеин, NFA, NCA-1, NCA-2 и др.
Целесообразность выделения их в отдельную группу объясняется тем, что в отличие от антигенов, представления о которых были изложены выше, раково-эмбриональные антигены имеют достаточно четкие отличия, главные из которых: синтез их начинается уже с 4-8 недель беременности и в соответствии с законами эмбриогенеза, ген, который их кодирует, должен быть репрессирован сразу после рождения.
Многие из этих антигенов рассматриваются как достаточно надежные маркеры развития злокачественного процесса. Однако, несмотря на то, что обнаружение их в определенном количестве случаев (с различиями в уровне и частоте выявления) при тех или иных онкологических заболеваниях имеет важное диагностическое значение, следует иметь в виду, что диагностическая надежность определения этих антигенов значительно колеблется.
Кроме того, к сожалению, факт их наличия не всегда ассоциируется со злокачественным процессом и появление раково-эмбриональных антигенов может наблюдаться и при отсутствии последнего.
Рассмотрение и оценка диагностической значимости определения различных раково-эмбриональных антигенов — предмет внимания соответствующих специалистов. Однако изложение общих сведений о них представляется целесообразным исходя прежде всего из двух положений: первое — достаточно частое появление этих антигенов при некоторых опухолевых процессах и биохимическое сходство между ними и опухолевыми антигенами, в частности по изоферментному составу (пируваткиназа, аденилатциклаза, глютаминаза, лактатдегидрогеназа, ДНК-полимераза и др.); второе — появившиеся в последние годы данные о том, что определенные детерминанты раково-эмбриональных антигенов могут быть мишенями для распознавания лимфоцитами.
Как уже указывалось, синтез раково-эмбриональных антигенов начинается на ранних этапах эмбриогенеза и их появление кодируется соответствующими генами, которые репрессируются сразу после рождения. Появление этих антигенов при раковом процессе свидетельствует об активации кодирующих их генов.
Причины такой активации, а следовательно и появления раково-эмбриональных антигенов окончательно не установлены. Очевидно, что существенную роль в этом играют особенности гистогенеза той или иной опухоли, иногда их появление может быть связано с нарушением синтеза эмбриональных белков, а также другими причинами.
К настоящему времени наиболее изучены а-фетапротеин и раково-эмбриональный антиген.
Альфа-фетапротеин
Как отмечено во вступительной части монографии АФП — первый идентифицированный опухолевый антиген, выявленный Г.И. Абелевым и коллегами в лаборатории Л.А. Зильбера еще в конце 50-х годов XX ст. В 1964 г. Ю.С. Татаринов обнаружил аналогичный антиген в сыворотке больных первичным раком печени.
Указывалось также, что альфа-фетапротеин выделяется из ткани гепатомы мышей и представляет собой гликопротеин с молекулярной массой 70 кД (в белковой части имеется 30 аминокислотных остатков, а углеводы составляют до 4 %).
Синтез АФП начинается уже на 4-й неделе внутриутробного развития и осуществляется клетками энтодермального происхождения с максимумом на 12-16-й неделях и резким снижением в течение 3-й недели после рождения. Рецепторы к этому маркеру обнаружены на клетках разных типов, а синтезировать его способны также опухолевые клетки печени, желудка, яичка и др.
Повышение уровня альфа-фетапротеина в сыворотке крови рассматривается как специфический признак опухолевого процесса, однако он повышается и при другой патологии печени (циррозе, гепатите). При онкологических заболеваниях в структуре АФП происходят определенные изменения и в коровой части углеводных цепей появляется фукозилированный остаток N-ацетилглюкозоамина.
Иммуноцитохимическое определение экспрессии альфа-фетапротеина на клетках первичных опухолей и метастатических узлов, а также в серозных полостях может быть важным дополнением в сложном процессе диагностики опухолевого заболевания.
Раково-эмбриональный антиген
Раково-эмбриональный антиген (РЭА) выделен P. Gold и J. Freedman в 1965 г. и относится к большой группе родственных белков, многие из которых встречаются и при другой патологии, например облучении.
Представляет собой гликопротеин, белковая часть которого имеет одну полипептидную цепь с молекулярной массой 180 кД; углеводный компонент составляет 50-60 %. Гены, кодирующие РЭА, принадлежат к большому семейству генов, в состав которых входят также гены Т-клеточного рецептора, антигенов главного комплекса гистосовместимости (ГКГ) I и II классов, некоторые онкогены и др.
Этот белок имеет высокую гомологию с другими членами этого семейства, а крупная молекула РЭА содержит несколько антигенных детерминант. Раково-эмбриональный антиген появляется на ранних этапах развития и синтезируется, в основном, клетками эктодермального происхождения (различных отделов кишечника, печени, поджелудочной железы) и может вновь появляться при неопластическом процессе.
РЭА различных опухолей отличаются своим углеводным составом. Имеются данные, авторы которых рассматривают РЭА как дифференцировочный антиген при опухолях желудочно-кишечного тракта, молочной железы, легкого; частота его обнаружения при низкодифференцированных опухолях выше, чем при высоко- и умереннодифференцированных.
Наряду с этим возможно появления раково-эмбрионального антиген и при многих неонкологических заболеваниях (поллипозе кишечника, панкреатитах, гастритах, гепатитах, язвенной болезни и др.), что свидетельствует о необходимости осторожной оценки диагностической значимости РЭА. Тем не менее появляются сообщения о том, что РЭА может быть использован как прогностический критерий.
Например, при исследовании немелкоклеточной карциномы рака легкого показано, что повышенный уровень экспрессии раково-эмбрионального антигена может быть надежным прогностическим параметром и независимым маркером констатации метастазов в лимфатические узлы.
Очистка РЭА, которая неизбежно приводит к той или иной степени его денатурации, может обусловливать и появление новых антигенных детерминант, что значительно снижает степень специфичности РЭА.
Несмотря на активное изучение раково-эмбрионального антигена ряд вопросов, связанных с этим антигеном, остается неясным. Прежде всего это касается структурных различий между РЭА нормальных и трансформированных тканей. Не в полной мере ясна и характеристика антигенных детерминант, которые определяют специфичность данного антигена.
Несмотря на то, что к РЭА получены моноклональные антитела с высокой специфичностью, полных доказательств наличия соответствующих опухолеспецифических детерминант в раково-эмбриональном антигене пока нет.
Плацентарная щелочная фосфатаза
Плацентарная щелочная фосфатаза, впервые описанная W. Fishman 1968 г., существует в нескольких изоформах и кодируется тремя независимыми генами, которые находятся в области первой хромосомы.
В различных злокачественно трансформированных клетках можно выявить и различные изоформы плацентарной щелочной фосфатазы. Последняя обнаруживается во многих опухолях: раке яичника и яичка, гепатоме, раке почки и других новообразованиях различного происхождения.
В связи с тем, что продукт гена плацентарной щелочной фосфатазы в некоторых тканях может подвергаться различной степени гликозилирования, возможно его представление различными белками, которые приобретают тканеспецифичность (костную, почечную, печеночную).
Трофобластный гликопротеин
Трофобластный гликопротеин (ТБГ) впервые идентифицирован Ю.С. Татариновым и В.М. Масюковым в 1970 г. при исследовании сывороток крови беременных женщин. ТБГ — гликопротеин с молекулярной массой 42 кД, гомологичен с РЭА по первичной структуре.
Однако вопрос о том, принадлежит ли он к семейству РЭА, остается неясным. Обнаруживается в клетках опухолей яичника, яичка, тератом, а также при эндометриозе, хорионэпителиоме и раке молочной железы.
Отмечено, что трофобластный гликопротеин чаще выявляется в клетках высокодифференцированных опухолей, чем низкодифференцированных. До настоящего времени нет четкого ответа на вопрос, продуцируются ли ТБГ опухолевой клеткой, но доказано, что он может синтезироваться фибробластами.
Эмбриональный преальбумин
Эмбриональный преальбумин (ЭПА), выделенный и описанный Ю.С. Татариновым в 1976 г., синтезируется клетками мезодермального происхождения, а также опухолевыми клетками соединительнотканной природы и рака яичника. Отличительная особенность этого антигена по сравнению с другими раково-эмбриональными — локализация в цитоплазме.
Как уже указывалось, одной из причин рассмотрения раково-эмбриональных антигенов при обсуждении вопроса о распознавании опухолевых антигенов стали данные нынешнего тысячелетия о том, что эти антигены и их пептиды могут распознаваться лимфоцитами. Значительное количество информации имеется в отношении раково-эмбрионального антиген.
В связи с тем, что количество РЭА — онкофетального гликопротеина увеличивается при многих злокачественных опухолях (раке желудка, кишечника, легкого и др.), к настоящему времени получено достаточно оснований для его оценки как серьезного кандидата для иммунотерапии. Подтверждением этому служат следующие данные.
Из РЭА выделен пептид РЭА652 (TYCFVSNL), который представляется цитотоксическими лимфоцитами (ЦТЛ) с участием молекул HLA-A24. В настоящее время проводятся клинические испытания использования дендритных клеток, нагруженных РЭА652 и адъювант-ными цитокинами lFNa и TNFa, при раке легкого.
Получены данные о том, что рецептор ЦТЛ содержит домен, специфический для раково-эмбрионального антигена. Установление этого факта стало возможным благодаря использованию рекомбинантного рецептора Т-лимфоцитов, который состоял из связывающего домена одной цепи антитела (single chain antibody — scFv) и оказался специфичным для РЭА.
Этот домен был представлен в виде IgG, в частности CH/CH3(Fc), который объединял СОЗ-зета-сигнальные цепи. Культивирование опухолевых клеток, экспрессирующих раково-эмбриональный антиген, с Т-лимфоцитами, несущими такой рецептор, сопровождалось активацией цитотоксических клеток, продукцией IFNy, что и привело к заключению об использовании их для адоптивной иммунотерапии РЭА-положительных опухолевых клеток.
Расширение исследований в области изучения РЭА позволило получить новую информацию: циркулирующий раково-эмбриональный антиген может быть связан с развитием метастазов, в частности при колоректальном раке; идентифицирован рецептор для РЭА и две его изоформы — REARa и REARP, которые экспрессируются на поверхности клеток Купфера. Очищение от РЭА происходит путем эндоцитоза макрофагами и клетками Купфера.
Прогресс в изучении раково-эмбрионального антигена проявился и в выделении еще одного пептида-агониста — CAPI-6D, который вызывает генерацию цитотоксических лимфоцитов. Такие ЦТЛ не только могут лизировать клетки карцином человека, которые экспрессируют РЭА, но и усиливать продукцию GM-CSF, IFNy, TNFa, IL-2. CAPI-6D не связан с молекулами ГКГ, и это дает основание для предположения, что его эффекты осуществляются только на уровне Т-клеточного рецептора.
Вакцинация дендритными клетками, нагруженными ДНК РЭА-трансгенных мышей с карциномой Lewis, была использована для прерывания периферической Т-клеточной толерантности. Проведенные исследования показали, что такая вакцина может быть эффективной в лечении рака легкого с целью профилактики метастазов после оперативного удаления опухоли.
Приведенные, а также другие имеющиеся данные свидетельствуют о том, что, поскольку ряд пептидов раково-эмбрионального антигена может распознаваться рецепторами Т-лимфоцитов и активировать их цитотоксичность, вполне обосновано рассматривать их как перспективные для иммунотерапии, что подтверждается уже начавшимся проведением соответствующих предклинических испытаний, включая и адоптивную иммунотерапию с использованием цитотоксических лимфоцитов, специфичных к РЭА.
Это направление исследований успешно развивается, в настоящее время получены различные РЭА-вакцины, которые оказались эффективными в индукции РЭА-специфического Т-клеточного ответа, особенно при их применении с различными ко-стимулирующими молекулами.
Читайте также:

