Анестезия при опухоли в гортани
Микроларингоскопия
Операция – Исследование гортани при помощи операционного ларингоскопа (+иссечение/биопсия)
Время – 10-30 мин
Положение – На спине, валик под плечи, голова разогнута
Практические рекомендации – Микроларингеальная трубки и традиционная ИВЛ. ТВА и струйная вентиляция инжектором Сандерса (О2 с присасыванием воздуха) через специальную инжекторную иглу, присоединенную к операционному ларингоскопу, полужесткому трахеальному катетеру или крикотироидотомической игле/канюле.
- Микроларингеальная трубка — это длинная ЭТТ диаметром 5 мм с большей манжетой низкого давления.
- Позволяет поддерживать анестезию ингаляционными анестетиками.
- Обеспечивает защиту от аспирации крови/ интраоперационного раневого отделяемого в легкие, но до некоторой степени ограничивает хирургу обзор гортани.
- ИВЛ необходима вследствие высокого сопротивления микроларингеальной трубки. Для обеспечения адекватного дыхательного объема параметры респиратора устанавливают на длительный медленный вдох
- Давление вдоха в контуре будет высоким вследствие сопротивления ЭТТ, подавление в дыхательных путях пациента за трубкой будет ниже
Вентиляция, осуществляемая инжектором Сандерса (О2 + подсасываемый воздух) через:
- Инжекционную иглу, присоединенную (маленьким завинчивающимся зажимом) к проксимальному концу операционного ларингоскопа с началом вентиляции после правильного сопоставления ее с гортанью. Существуют иглы различных размеров с разной скоростью газотока. Эта методика не подходит, если принципиально важен хороший обзор гортани. Недостатком является риск засасывания дыма и раневого отделяемого в трахею при вентиляции.
- Полужесткий трахеальный катетер (обычный катетер для отсасывания не подходит) с кончиком, заведенным до середины длины трахеи. Существуют специальные катетеры с портом для забора проб газов или выполненные из лазер-устойчивых материалов.
- Крикотироидотомическую иглу/канюлю, до индукции проведенную под местной анестезией через крикотироидную мембрану и направленную к карине. Существуют несколько видов, в качестве альтернативы может быть использована игла Туохи. Есть риск попадания газа в ткани в случае смещения иглы.
Индукцию выполняют в операционной или начинают с микроларингеальной трубки, которую затем, когда в операционной все готово, удаляют, заменяя на струйную вентиляцию (последняя методика невозможна при применении крикотироидотомической иглы).
- Следует убедиться, что наркозный аппарат расположен достаточно удобно для проведения вентиляции лицевой маской при индукции/пробуждении.
- Для поддержания необходима ТВА (инфузия пропофола).
- Вентилируют с нормальной частотой, регулируя вдыхаемый поток (изменяя установки инжектора или размер иглы) до уровня, продуцирующего движения грудной клетки, подобные таковым при традиционной вентиляции. При струйной вентиляции точно оценить соотношение поток/давление нелегко — потенциальный риск баротравмы.
- Вентиляцию следует прекращать постепенно, по окончании работы хирурга.
- Основным преимуществом струйной вентиляции является минимальная обструкция поля зрения хирурга.
- По окончании операции либо прекращают струйную вентиляцию по восстановлению спонтанного дыхания, либо, прекратив, продолжают вентилировать лицевой или ларингеальной маской до восстановления самостоятельного дыхания.
- Обычно курильщики, часто пожилые люди, имеют типичны заболевания сердечно-сосудистой системы.
- Тщательная оценка дыхательных путей на наличие обструкции. Анамнез, обследование, клиническое ЛОР-обследование, рентгенография и КТ могут помочь, но при наличии стридора любой выраженности она неоспорима.
- До начала индукции необходимо проверить готовность всего оборудования, включая набор для крикотиреотомии, и убедиться, что хирург готов в случае необходимости выполнить экстренную трахеостомию.
- При подозрении на обструкцию дыхательных путей, начинают с обеспечения безопасной их проходимости.
- Заклеить глаза.
- Короткодействующие опиоиды (альфентанил, ремифентанил) смягчают в процессе операции гипертензивную реакцию, которая может быть выраженной.
- Мышечные релаксанты обычно важны: мивакуриум или суксаметониум дробно (гликопирролат/атропин для предупреждения брадикардии одновременно со второй дозой суксаметониия).
- Орошение гортани местным анестетиком снижает риск ларингоспазма, поскольку защищенность дыхательных путей при этом снижается, пробуждение должно быть в положении на левом боку, с опущенной головой.
- Анальгезия парацетамолом по требованию или диклофенаком орально/ректально.
- После операции из-за отека и без того скомпрометированных дыхательных путей может развиться стридор — для его предотвращения иногда применяют 8-12 мг дексаметазона в/в.
- Если планируется применение лазера, струйная вентиляция предпочтительна.
- Микроларингоскопия может быть использована для инъекции инертных материалов (Тефлон) в парализованные голосовые связки для улучшения фонации, хотя при введении избыточного количества возможна обструкция дыхательных путей.
- Применяется и высокочастотная струйная вентиляция, хотя она сложна и оценка ее затруднительна.
Трахеостомия
Операция – Введение трахеальной трубки через разрез на шее
Время – 20-30 мин
Положение – На спине, валик под плечи, кольцо под голову, возвышенное положение головы
Кровопотеря – В норме невелика, хотя возможно кровотечение из сосудов щитовидной железы
Практические рекомендации – ИВЛ, назальная ЭТТ, заменяемая на трахеостомическую в процессе операции. ЛМ — при несложных дыхательных путях, ИВЛ или СД. Может быть выполнена под местной анестезией.
- В большинстве случаев трахеостомия выполняется для проведения длительной ИВЛ в ОРИТ или по поводу обструкции дыхательных путей.
- Пациенты ОРИТ почти наверняка будут интубированы. Если вентиляция затруднена и уровень оксигенации критичен, в операционной используют респиратор из ОРИТ, применение ТВА предпочтительнее ингаляционных анестетиков.
- До начала индукции необходимо проверить готовность всего оборудования, включая набор для крикотиреоидотомии, и убедиться, что хирург готов в случае необходимости выполнить экстренную трахеостомию.
- Когда вскрыт просвет трахеи, ЭТТ удаляют, и хирург под прямым визуальным контролем вводит трахеостомическую трубку.
- ЭТТ фиксируют бинтом таким образом, чтобы ее можно было легко удалить во время операции. Наружную контрольную манжету также фиксируют в легкодоступном положении.
- Перед обкладыванием пеленками аспирируют из желудочного зонда (если установлен) и санируют ротоглотку.
- Глаза прикрывают тампонами и заклеивают.
- Обкладка пеленками не должна препятствовать доступу анестезиолога к ЭТТ для ее замены во время операции.
- Необходимы удлиненные шланги дыхательною контypa и трубки забора проб газов
- ЭТТ медленно подтягивают в верхнюю часть трахеи (но не удаляют полностью до тех пор, пока трахеостомическая трубка не установлена и зафиксирована со всей очевидностью) и присоединяют к дыхательному контуру новую трахеостомическую трубку по стерильному катетеру.
- Следует опасаться ложного газотока через вводимую трахеостомическую трубку, особенно у тучных пациентов. При наличии сомнений положение трубки стоит проверить при помощи капнографии или фибробронхоскопии.
- При констатации проблем трахеостомическую трубку удаляют, а ЭТТ продвигают вниз в трахею.
- Необходимо обеспечить регулярную санацию вновь наложенной трахеостомы (кровь, слизь).
- Увлажнять вдыхаемые газы.
- Анальгезия в палате пробуждения диклофенаком ректально или морфином в/в. Позднее обычно нужна лишь незначительная анальгезия.
- Вновь наложенная трахеостома часто бывает причиной значительного кашля – морфин, бензодиазепины или малые дозы пропофола помогут его преодолеть.
- По потребности назначают антиеметики.
При выпадении трубки ее обратная установка в течение нескольких первых дней может быть весьма затруднительной — часто оротрахеальная интубация окажется более практичным решением. Два стягивающих шва, оставленных на разрезе трахеи, помогут идентифицировать и открыть стому.
- Может быть выполнена под местной анестезией, хотя у сопротивляющегося пациента с нарушениями дыхания это будет нелегко.
- В ОРИТ процедура в настоящее время все чаще выполняется чрескожно с использованием дилатационной методики.
- Трахеостомия не идеальна для экстренного доступа к дыхательным путям. Крикотиреоидотомия более доступна и несет меньший риск кровотечения.
Ларингэктомия
Операция – Иссечение гортани (и надгортанника)
Положение – На спине, валик под плечи, кольцо под голову, возвышенное положение головы
Кровопотеря – От умеренной до значительной, совмещают от 2 до 4 единиц крови
Практические рекомендации – ИВЛ, назальная ЭТТ и заменяемая на трахеостомическую в процессе операции. Катетеризация периферической артерии, мочевой катетер, линия для ЦВД — если предполагается длительная/осложненная операция или есть показания по сердечно-сосудистым заболеваниям.
- Возможна та или иная степень обструкции дыхательных путей, но, вероятно, уже перенесенная недавно общая анестезия (при диагностической процедуре) подскажет способ обеспечения их безопасности.
- Если общей анестезии недавно не было, дыхательные пути осматривают, как для микроларингоскопии.
- Пациенты обычно курильщики; типично наличие проблем с питанием и сердечно-сосудистой/дыхательной системами.
- Процесс пробуждения с трахеостомой (затрудненное общение, санация мокроты, кашель, провоцируемый трахеостомической трубкой) необходимо тщательно разъяснить пациенту заблаговременно. Большую часть таких разъяснений лучше всех сделает логопед.
- Глаза необходимо прикрыть тампоном и заклеить пластырем, точки сдавления кожи защитить прокладками.
- Ввести тонкий зонд для кормления при индукции и надежно закрепить (может быть пришит к носовой перегородке).
- Необходимы обогревающие одеяла, увлажнитель с подогревом и обогреватель инфузионных сред.
- Для дыхательного контура и забора проб газов нужны удлиненные шланги и трубки.
- Значительная кровопотеря может быть скрыта обкладочными простынями позади шеи и не проявиться до самого конца операции.
- Поскольку вся шея на время операции скрыта, линию ЦВД обычно устанавливают доступом бедренным или в локтевой ямке (хотя можно использовать и подключичный).
- Антибиотикопрофилактика необходима по крайней мере в течение 24 ч.
- При трахеостомии полезна длинная трубка (армированная или специально профилированная), чтобы хирург мог работать вокруг новой стомы — необходима настороженность по поводу возможной интубации бронха.
- Перевод в БВЗ идеален. Увлажнять вдыхаемые газы.
- Обеспечить регулярную санацию вновь наложенной стомы отсосом (кровь, мокрота).
- Вновь наложенная трахеостома часто бывает причиной значительного кашля — морфин, бензодиазепины или малые дозы пропофола помогут его преодолеть.
- Анальгезия по требованию диклофенаком ректально, морфином вв/вм. Подходит для АКП, хотя анальгетические потребности в норме на удивление низки. Суспензия парацетамола (через назогастральный зонд) часто полезна в раннем послеоперационном периоде.
- По потребности назначают антиеметики.
- Настороженность относительно воздушной эмболии во время рассечения — ранним признаком будет внезапное падение уровня ЕТСО2.
- Пациентам, перенесшим ларингэктомию в прошлом и нуждающимся в другой операции, необходимо особое ведение вентиляции через стому. Применяют педиатрическую лицевую маску, повернутую на 180°, ЛМ, приложенную к шее, или интубируют пациента в сознании, после орошения трахеальной стомы местным анестетиком. Введение трахеостомической трубки после ларингэктомии обычно несложно, однако необходимо убедиться в отсутствии стеноза, рецидива опухоли и обязательно преоксигенировать.
- Некоторые предпочитают частичную ларингэктомию, с реконструкцией гортани и временной трахеостомией в качестве альтернативы лучевой терапии при ранних опухолях гортани.
Боль является неотъемлемым симптомом онкологических заболеваний. На заключительных стадиях болезни из терпимой она постепенно превращается в сильную, мучительную и постоянную. Хронический болевой синдром отягощает жизнь онкологического больного, угнетает не только физическое, но и психическое состояние.
Тема обезболивания при онкологии крайне актуальна для больных и их родственников. Современная медицина владеет широким арсеналом препаратов и методов для борьбы с болью при раковых опухолях. Более чем в 90% случаев болевой синдром удается купировать или уменьшить его интенсивность. Рассмотрим подробнее, как выстроена правильная схема обезболивания и на чем основаны передовые методы облегчения состояния онкологических больных.
Онкология и боль
Боль — это один из первых симптомов, который указывает на прогрессирование злокачественного процесса в организме. Если на ранней стадии рака на болевые ощущения жалуются не более трети пациентов, то по мере развития заболевания о них говорят практически всегда. Боль может вызывать не только сама опухоль, но и воспалительные реакции, приводящие к спазмам гладкой мускулатуры, поражения суставов, невралгия и раны после хирургического вмешательства.
К сведению
Как правило, боль при раке появляется на III и IV стадиях. Однако иногда ее может и не быть даже при критических состояниях больного — это определяется типом и локализацией опухоли. Известны факты, когда рак желудка IV стадии протекал бессимптомно. Может не вызывать боли опухоль молочной железы — неприятные ощущения в таких случаях появляются только когда метастазы охватывают костную ткань.
Болевой синдром можно классифицировать по разным признакам. Так, по степени интенсивности боли могут быть слабые, средние и сильные; по субъективной оценке — колющие, пульсирующие, сверлящие, жгучие; по продолжительности — острые и хронические. Отдельно остановимся на классификации боли по происхождению:
- Висцеральные — боли в области брюшной полости без четкой локализации, длительные, ноющие. Например, болезненные ощущения в области спины при раке почек.
- Соматические — боли в связках, суставах, костях, сухожилиях: тупые, плохо локализуемые. Для них характерно постепенное наращивание интенсивности. Появляются на поздних стадиях рака, когда метастазы образуются в костной ткани и вызывают поражение сосудов.
- Невропатические — боли, вызванные нарушениями в нервной системе. Например, давлением опухоли на нервные окончания или их повреждением. Такой тип ощущений вызывает также лучевая терапия или проведенная хирургическая операция.
- Психогенные — боли без физических поражений, связанные со страхом, депрессией, самовнушением пациента. Появляются в результате сильных эмоциональных переживаний и не поддаются лечению обезболивающими средствами.
На заметку
Боль — это защитная реакция организма и главный сигнал тревоги. Она придумана природой, чтобы указать человеку на проблему, заставить его задуматься и побудить к действию. Однако хроническая боль при онкологии лишена этих функций. Она вызывает у больного уныние, чувство безысходности, депрессию (вплоть до психических расстройств), препятствует нормальному функционированию организма, лишает возможности чувствовать себя полноценным членом общества. Боль отнимает силы, необходимые в борьбе с раковой опухолью. Прогрессивная медицина рассматривает такую боль как патологический процесс, который требует отдельной терапии. Обезболивание при раке — это не разовая процедура, а целая программа лечения, призванная сохранить социальную активность пациента, не допустить ухудшения его состояния и угнетения психики.
Итак, подбор эффективной терапии для устранения боли — сложная задача, которая требует поэтапного подхода. Прежде всего врачу необходим анамнез: причина боли (если она установлена), давность, локализация, интенсивность, изменение характера боли в связи со сменой времени суток и в зависимости от интенсивности физической нагрузки, тип анальгетиков, которые уже применялись, и их эффективность во время приема. Если пациент жалуется на сильную боль, в первую очередь необходимо исключить состояния, требующие неотложной помощи, например инфекции или патологическое поражение мозговых оболочек метастазами. Для этого назначают ультразвуковое исследование, магнитно-резонансную томографию, компьютерную томографию и другие исследования по усмотрению врача. Если неотложное состояние исключено, выбор метода обезболивания будет зависеть от выраженности боли и ранее применяемых анальгетиков.
Точное следование правильной схеме приема способно значительно отсрочить потребность в сильнодействующих препаратах. Случается, что пациенты принимают все анальгетики подряд, подбирая то, что поможет им лучше и быстрее. Это также является ошибкой, поскольку важно выяснить причину боли. Например, спазмы в брюшной полости снимают лекарствами, которые при костных болях окажутся неэффективными. Не говоря уже о том, что боли вообще могут быть связаны с онкологией только косвенно или вовсе не иметь к ней никакого отношения.
В рекомендациях экспертов ВОЗ выделено три ступени фармакотерапии, которые обеспечивают рациональное лечение болевого синдрома у онкологических больных. В соответствии со ступенью подбирают и препараты:
- при слабой боли — неопиоидные анальгетики;
- при усилении — легкие опиоидные препараты;
- при сильной боли — наркотическое обезболивание и адъювантная терапия.
Рассмотрим каждый этап более подробно.
Первая ступень. Начинают лечение болевого синдрома с ненаркотических анальгетиков и нестероидных противовоспалительных средств (НПВС). К ним относятся парацетамол, ибупрофен, аспирин, мелоксикам и другие. При боли в мышцах и суставах — диклофенак, этодолак и прочие. Все эти вещества воздействуют на периферические болевые рецепторы. В первые дни препараты могут вызывать общую усталость и сонливость, что проходит самостоятельно или корректируется изменением дозировки. Если прием таблеток не дает нужного результата, переходят к инъекциям.
Одним из основных факторов при выборе метода обезболивания при онкологии является не только эффективность действия, но и удобство для больного, влияние на качество его жизни. Раньше практически всегда использовались инвазивные методы — инъекции. Современные методы обезболивания разнообразны и максимально комфортны для пациентов.
Обезболивающие пластыри. Это способ трансдермального введения препарата. Пластырь содержит четыре слоя: защитная полиэфирная пленка, резервуар с действующим веществом (например, с фентанилом), мембрана, корректирующая интенсивность выделения, и липкий слой. Пластырь можно наклеить в любом месте. Фентанил высвобождается постепенно на протяжении трех суток. Действие наступает уже через 12 часов, после удаления концентрация лекарственного вещества в крови медленно снижается. Дозировка может быть разная, ее подбирают индивидуально. Пластырь назначают, как правило, в самом начале третьей ступени обезболивания при онкологии.
Эпидуральная анестезия. Лекарство вводят в эпидуральное пространство, расположенное между твердой мозговой оболочкой и стенками полости черепа или позвоночного канала. Препараты аналогичны спинальной анестезии. Эпидуральная анестезия используется, чтобы снять боль при раке, когда появились вторичные изменения в костях, а оральный и парентеральный методы введения уже не приносят результатов.
Нейролизис через ЖКТ при помощи эндосонографии. Нейролизис (невролиз) — это процесс разрушения ноцицептивного (болевого) нервного пути. Введение анальгетика происходит трансгастрально — через желудочно-кишечный тракт, точность обеспечивает эндоскопический ультразвуковой контроль. Такие методы местного обезболивания применяются, к примеру, при раке поджелудочной железы с эффективностью до 90%. Обезболивающий эффект способен сохраняться более месяца, в то время как наркотические анальгетики классическим способом пришлось бы вводить постоянно.
Введение препаратов в миофасциальные триггерные пункты. Миофасциальный болевой синдром выражается спазмами мышц и появлениями в напряженных мышцах болезненных уплотнений. Они называются триггерными точками и вызывают боль при нажатии. Инъекции в триггерную зону снимают боль и улучшают подвижность участка тела.
Вегетативные блокады. Блокировка нерва предусматривает введение препарата в точку проекции нерва, который связан с пораженным органом и вызывает боль. Например, блокада при раке поджелудочной железы ликвидирует боль на несколько месяцев. В зависимости от вида анестетика, процедуру проводят раз в год, раз в полгода или каждую неделю. Еще один плюс — минимальное количество негативных последствий.
Нейрохирургические вмешательства. В ходе процедуры нейрохирург перерезает корешки спинномозговых или черепных нервов, по которым проходят нервные волокна. Таким образом, мозг лишается возможности получать болевые сигналы. Разрезание корешков не приводит к утрате двигательной способности, однако может затруднить ее.
Анальгезия, контролируемая пациентом (PCA). Этот вид обезболивания основан на простом правиле: пациент получает анальгетики тогда, когда он этого хочет. В основе схемы лежит индивидуальное восприятие боли и необходимость приема анальгетиков. В европейских странах РСА принята в качестве стандарта постоперационного обезболивания. Метод прост и относительно безопасен. Однако пациентам необходимо проходить тщательный инструктаж.
Выбор конкретного метода обезболивания при раке зависит от многих факторов — вот почему так важны индивидуальный подход и тщательное обследование пациента, позволяющие врачу оценить эффективность метода, его целесообразность и возможные риски. Медики прочно утвердились в мысли, что болевой синдром необходимо лечить независимо от прогнозов по основному заболеванию. Устранение боли позволит предотвратить ее разрушительное действие на физическое, моральное и психическое состояние пациента, а также сохранить его социальную значимость.
В зависимости от длительности оперативного вмешательства, травматичности операции, а также сопутствующей патологии нами использованы следующие методы неингаляционной анестезии: атаралгезия (27,7%), нейролептанальгезия (12,3%), ГОМК-морфиновый наркоз (28,6%), ГОМК-фентаниловый наркоз (21,4%). Объем операции определялся накануне, в зависимости от чего осуществлялся выбор методов обезболивания и интубации.
Радикальные операции при распространенном раке слизистой оболочки полости рта весьма трудоемки, травматичны. В блок удаляемых тканей обычно входят значительная часть языка, дна полости рта, нижняя челюсть, нередко щека, мягкое нёбо или глотка. При наличии регионарных метастазов в блок удаляемых тканей включается также шейная клетчатка. Перед такой операцией хирургу и анестезиологу нужно решить вопрос о методе интубации.
При наличии тризма операцию лучше начать с трахеостомии и интубацию осуществлять через трахеостому. Если же операция должна начаться с вмешательства на шее (фасциально-футлярное иссечение шейной клетчатки или операция Крайла), интубацию целесообразнее провести через нос. В этих случаях после окончания расширенной операции производят трахеостомию.
Радикальные операции при раке гортани чаще всего бывают чрезвычайно травматическими и сложными. Так, ларингэктомия с фасциально-футлярным иссечением клетчатки шеи (или операцией Крайла) продолжается нередко от 3 до 5 часов. Обычно интубацию мы производим через трахеостому. Трахеостомия осуществляется под местной анестезией на фоне адекватной премедикации.
При радикальных операциях по поводу злокачественных опухолей щитовидной железы, рака нижней губы, кожи интубацию трахеи проводят через рот.
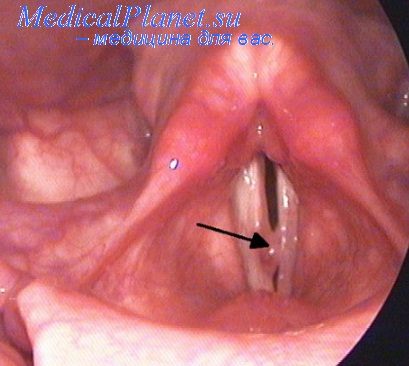
Период вводного наркоза является одним из сложных и ответственных моментов при обезболивании больных с опухолями в области головы и шеи. Сложность этого периода обусловлена спецификой патологического процесса и рядом сопутствующих заболеваний.
У больных с опухолями головы и шеи осложнения могут усугубляться нарушением легочной вентиляции органического порядка—локализацией новообразования в области щитовидной железы с прорастанием в трахею, корня языка, гортани, создающих препятствия для принудительной вентиляции легких. Огромные дефекты лица иногда исключают возможность создания герметичности системы аппарат—больной во время принудительной вентиляции легких.
Для вводного наркоза мы обычно пользуемся седуксеном из расчета 0,3—0,5 мг/кг массы больного. Период вводного наркоза занимает обычно не более 3—5 минут. Больным, склонным к аллергическим заболеваниям, а также с сопутствующей патологией сердечно-сосудистой системы, мы вводим внутривенно 10% раствор хлорида кальция. Это предупреждает выраженные изменения центральной и периферической гемодинамики, а также аллергические реакции (Солтан А. Ф., Камышов Я. М., 1979).
Поддержание наркоза на оптимальной глубине мы осуществляем с помощью оксибутирата натрия и центральных анальгетиков — морфина или фентанила. Обладающий достаточным снотворным действием оксибутират натрия является слабым анальгетиком, в связи с чем возникла необходимость увеличить его анальгетический эффект. Морфин не оказывает отрицательного влияния на тонус бронхов, увеличивает минутный и ударный индексы сердца, снижает периферическое сопротивление.
Способность морфина повышать сердечный выброс лежит в основе стабильности гемодинамики. Оксибутират натрия усиливает анальгезирующий эффект морфина и его угнетающее влияние на внешнее и внутреннее дыхание. Фентанил угнетает внешнее дыхание, однако этот процесс не сопровождается угнетением газообмена в тканях. Фентанил в сочетании с оксибутиратом натрия в меньшей мере угнетает внешнее дыхание.

- Трехступенчатая система коррекции болевого синдрома
- Как облегчить боль: описание этапов трехступенчатой схемы
- Как часто возникает боль при раке?
- В чем причина неудач в лечении боли?
- Технологии управления хроническими болевыми синдромами
- Обезболивающие при раке желудка
- Обезболивающие при раке легких
Зачастую первым и единственным симптомом онкологических заболеваний является боль. Она причиняет пациенту мучения, снижает качество жизни, приводит к депрессивным расстройствам, суицидальным намерениям и действиям.
Борьба с болевым синдромом — актуальная проблема в онкологии. Для того чтобы эффективно справиться с болью, врач должен правильно оценить ее причины, характер, интенсивность.
В Европейской клинике направление медицины боли развито очень хорошо. Наши врачи применяют все доступные методы, в том числе инновационные.
Трехступенчатая система коррекции болевого синдрома
Основным методом лечения боли в онкологии является медикаментозная терапия. В практике работы Европейской клиники используется трехступенчатая система обезболивания из ненаркотических и наркотических анальгетиков, которая позволяет эффективно купировать болевой синдром и держать его под контролем. Мы учитываем рекомендации Всемирного института боли (FIPP WIP, USA), Европейской Федерации Международной Ассоциации Изучения Боли (EF IASP).
Метод заключается в последовательном применении анальгетиков возрастающей силы действия в сочетании с адъювантной терапией по мере увеличения интенсивности боли. Важным принципом является начало фармакотерапии немедленно при появлении первых же признаков боли, пока не развилась сложная цепная реакция, которая приводит к хроническому болевому синдрому. Переход на более сильное обезболивающее производится, когда все препараты предыдущей ступени неэффективны в своих максимальных дозировках.
- На первой ступени при легкой боли эффективны нестероидные противовоспалительные средства (НПВСП).
- На второй ступени при умеренной боли применяются препараты, которые содержат комбинацию слабых опиатов и ненаркотических анальгетиков. К первым относят дионин, трамадол, промедол, проседол, трамал. Чаще всего применяется трамадол из-за высокой эффективности и удобства применения.
- На третьей ступени при сильной боли назначаются наркотические анальгетики: бупренорфин, морфин, фентанил, омнопон.
На любом этапе противоболевой терапии анальгетики необходимо принимать постоянно по часам. Доза корректируется с учетом вида и интенсивности болевых ощущений. Если препарат становится неэффективным, желательно заменить его на альтернативное средство аналогичной силы, но рекомендовать его пациенту, как более мощное.
В качестве анальгетиков часто применяют кортикостероиды — препараты гормонов коры надпочечников. Они оказывают мощное противовоспалительное действие, особенно важное при болях, вызванных компрессией нерва, при головной боли, обусловленной внутричерепной гипертензией, а также костных болях.
Анестезиолог-реаниматолог Вадим Сергеевич Соловьев об опиоидных анальгетиках:

Наши врачи следуют принципам терапии боли, провозглашенным ВОЗ:
Как облегчить боль: описание этапов трехступенчатой схемы
Пациенту назначают неопиоидные анальгетики: НПВС (Ибупрофен, Диклофенак, Кетопрофен и пр.), Парацетамол. При выборе препарата учитываются токсичность для печени и почек, присущие всем неопиоидным анальгетикам, а также токсичность для желудка неселективных НПВС, риски со стороны сердечно-сосудистой системы при применении селективных НПВС. Применение препаратов первой линии целесообразно сопровождать адъювантной и симптоматической терапией: блокаторы ионной помпы, кортикостероиды, спазмолитики, бензодиазепины, антигистаминные препараты и др.
Пероральный путь введения препаратов является предпочтительным, если пациент может принимать препараты через рот. Для пациентов со слабой или умеренно выраженной болью, у которых адекватный контроль боли не достигается регулярным пероральным приемом парацетамола или нестероидных противовоспалительных препаратов, добавление опиоидного анальгетика может обеспечить достижение эффективного обезболивания без неблагоприятных побочных эффектов. В качестве альтернативы возможно использование низких доз опиоидных анальгетиков (например, морфина, ТТС фентанила).
Как часто возникает боль при раке?
Боль возникает у 30% больных раком, которые получают лечение, и у 60–90% больных в связи с прогрессированием болезни. Основные источники возникновения боли при раке:
- собственно рак (45–90%);
- сопутствующие воспалительные реакции, приводящие к спазму гладкой мускулатуры (11–25%);
- боль в области послеоперационной ране после хирургического вмешательства (5–16%);
- сопутствующая патология, например, поражения суставов, артрит (6–11%), невралгия (5–15%).
Болевые синдромы при раке группируют:
- По происхождению болевого потока: висцеральные, соматические, невропатические, психогенные.
- По качественной субъективной оценке: жгучие, колющие, режущие, сверлящие, пульсирующие.
- По интенсивности: оценивают по специальным шкалам.
- По продолжительности: острые и хронические.
- По локализации: абдоминальные, кардиалгии, люмбалгии, мышечно-суставные и другие.
В связи со значительными различиями механизмов возникновения болевых ощущений, не существует универсального анальгетика для купирования всех видов болевых синдромов. Лечение всегда должно быть индивидуальным.
В чем причина неудач в лечении боли?
В силу отсутствия специальной подготовки по лечению боли даже у онкологов, а также в силу восприятия рака как инкурабельного заболевания, даже врачи-специалисты зачастую не осознают, что болью при раке можно управлять.
У 80–90% пациентов боль можно полностью ликвидировать, а у остальных ее интенсивность можно значительно ослабить. Для этого врачу необходимо учитывать каждый из источников и механизмов боли для подбора адекватной обезболивающей терапии при раке.
В клинической практике мы постоянно сталкиваемся с типичными ошибками при лечении болевого синдрома: неоправданно ранним назначением наркотических анальгетиков, применение чрезмерных дозировок препаратов, несоблюдение режима назначения анальгетиков.
Технологии управления хроническими болевыми синдромами
Европейская клиника оснащена всем необходимым оборудованием, включая индивидуальные носимые помпы, аппараты для дозированного введения. Клиника имеет требуемые законодательством Российской Федерации лицензии и разрешения. У нас функционирует хорошо оснащенное отделение терапии болевых синдромов, в нем работают врачи-специалисты в области медицины боли.
Воспользуйтесь быстрыми ссылками, чтобы узнать об интересующем вас методе обезболивания:
Обезболивание при раке 4 стадии позволяет значительно улучшить качество жизни пациента, уменьшить, а в большинстве случаев предотвратить страдания. Это помогает подарить неизлечимому больному дополнительное время, в течение которого он может активно общаться с родными и близкими, провести последние дни жизни без мучительных симптомов.
Это способ трансдермального введения препарата. Пластырь содержит четыре слоя: защитная полиэфирная пленка, резервуар с действующим веществом (например, с фентанилом), мембрана, корректирующая интенсивность выделения и липкий слой. Пластырь можно наклеить в любом месте. Фентанил высвобождается постепенно на протяжении 3 суток. Действие наступает уже через 12 часов, после удаления концентрация лекарственного вещества в крови медленно снижается. Дозировка может быть разная, ее подбирают индивидуально. Пластырь назначают, как правило, в самом начале третьей ступени обезболивания при онкологии.
Более щадящий по сравнению с предыдущим метод. Лекарство вводят в пространство, где формируются спинномозговые нервы. Препараты аналогичны спинальной анестезии. Эпидуральная анестезия используется, чтобы на долгое время снять боль, когда оральный и парентеральный методы введения уже не приносят результатов.
Катетеризационные методики позволяют обеспечивать длительное качественное обезболивание. Внедрение постановки порт-систем в эпидуральное и субарахноидальное пространство с применением местных, наркотических и адъювантных препаратов позволяют на продолжительное время избавится от болевого синдрома и снизить применение других анальгетиков, имеющих свои побочные эффекты.
Нейролизис (невролиз) — это процесс разрушения ноцицептивного (болевого) нервного пути.
Одним из наиболее эффективных методов является нейролизис чревного (солнечного) сплетения, которое располагается в забрюшинном пространстве в верхнем отделе живота и осуществляет иннервацию органов брюшной полости: желудка, печени, желчевыводящих путей, поджелудочной железы, селезенки, почек, надпочечников, толстого и тонкого кишечника до селезеночного изгиба.
Введение анальгетика происходит трансгастрально — через ЖКТ, точность обеспечивает эндоскопический ультразвуковой контроль. Такие методы местного обезболивания применяются, к примеру, при раке поджелудочной железы с эффективностью до 90%. Обезболивающий эффект способен сохраняться более нескольких месяцев, в то время как наркотические анальгетики классическим способом пришлось бы вводить постоянно.

Такой же качественный эффект обеспечивают фасциальные блокады и блокады нервов и сплетений.
Блокада нерва или нервного сплетения предусматривает введение препарата около нерва, который связан с пораженным органом и вызывает боль. Процедуры периферических блокад выполняются опытными специалистами при помощи ультразвуковой навигации, что позволяет более точно вводить анальгетический препарат в необходимое место, не затрагивая и не повреждая нервные структуры.
Использование в процессе блокады гормональных препаратов позволяет устранить боль на долгое время, а многократная блокада может убрать боль на несколько месяцев. В зависимости от вида анестетика, процедуру проводят раз в год, раз в полгода или каждую неделю. Еще один плюс — минимальное количество негативных последствий.
В основе этой технологии лежит выборочная термокоагуляция определенных нервов специальными электродами. Зона поражения аккуратно контролируется, позволяя воздействовать на очень небольшие участки, не повреждая расположенные рядом двигательные и чувствительные нервы. Восстановление после процедуры происходит очень быстро и почти без последствий, что позволяет пациенту вернуться к нормальной жизни.
Процедура может выполняться без госпитализации. Радиочастотное разрушение дает длительный эффект, который может длиться до года и более.
Частота развития осложнений и побочных эффектов очень мала. Если боль возобновляется, лечение может быть проведено повторно.
Пациенты с очевидными психическими нарушениями, с вторичными болями или наркотической зависимостью — это неподходящий контингент для нейродеструктивных манипуляций. Такие пациенты могут продолжать жаловаться на боли, даже если процедура проведена успешно. У пациента должен быть сформирован реалистический взгляд на исход лечения. Он должен понимать, что целью является уменьшение боли, а не полное ее устранение.
Перед нейродеструктивной процедурой обязательно проведение диагностической блокады. Хороший эффект от диагностической блокады может прогнозировать удовлетворительный результат нейродеструкции. Тем не менее, такую же диагностическую блокаду нужно повторить, по крайней мере, еще один раз, даже если ослабление боли было значительным, чтобы свести на нет эффект плацебо.
Если результат не совсем ясен, следует использовать дифференциальное блокирование. У пациентов с распространенной или мультилокальной болью результат лечения обычно не оправдывает ожидания. Пациент должен осознавать, что воздействие на один участок может не привести к достижению желаемого эффекта и, возможно, потребуется дополнительная деструкция для максимально возможного уменьшения боли.
Врачи Европейской клиники о радиочастотной абляции:

Следует избегать проведения процедуры на смешанных нервах, поскольку это может привести к потере кожной чувствительности и мышечной слабости. Деафферентационные боли могут усугубляться при деструкции поврежденного нерва. В том случае, когда боль имеет центральное происхождение (спинальная или выше), деструкция периферического нерва может вызывать увеличение болевой перцепции за счет элиминации входящего стимула. Лучшая альтернатива в этом случае — это нейроаугментация с TENS или стимуляция спинного мозга.
В ходе процедуры нейрохирург перерезает корешки спинномозговых или черепных нервов, по которым проходят нервные волокна. Тем самым мозг лишается возможности получать болевые сигналы. Разрезание корешков не приводит к утрате двигательной способности, однако может затруднить ее.
Этот вид обезболивания основан на простом правиле: пациент получает анальгетики тогда, когда он этого хочет. В основу схемы положено индивидуальное восприятие боли и необходимость приема анальгетиков. В европейских странах РСА принята в качестве стандарта постоперационного обезболивания. Метод прост и относительно безопасен. Однако пациентам необходимо проходить тщательный инструктаж.
PCA наиболее эффективна при использовании катетерных методов (эпидуральная, спинальная анестезия, блокада нервных сплетений с установкой катетера), а также порт-систем, как венозных, так и эпидуральных и интратекальных.
Лечением боли в нашей клинике занимаются сертифицированные специалисты анестезиологи, нейрохирурги, ангиохирурги и эндоскописты, предоставляется услуга обезболивания при 4 стадии рака.
Обезболивающие при раке желудка
Неприятные ощущения и боли испытывают примерно 70% пациентов, страдающих раком желудка. Как правило, боль локализуется в животе, но по мере прогрессирования опухоли может возникать и в других местах: в спине, ребрах, костях. В качестве симптома паранеопластического синдрома или побочного эффекта химиотерапии могут возникать нейропатические боли.
Помимо трехступенчатой системы, для борьбы с болью и дискомфортом при раке желудка применяют бензодиазепины, антидепрессанты, препараты гормонов коры надпочечников (преднизолон, дексаметазон), снотворные, антипсихотические средства. При болях в костях и патологических переломах назначают бисфосфонаты.
Врач может провести два вида нервных блокад:
- Блокада чревного сплетения помогает справиться с болью в верхней части живота. Блокируется проведение болевых импульсов по нервам желудка, печени, поджелудочной железы, желчного пузыря, кишечника, почек.
- Блокада подчревного сплетения помогает справиться с болью в нижней части живота. Во время нее блокируют нервы нижнего отдела кишечника, мочевого пузыря, яичек, пениса, предстательной железы, матки, яичников, влагалища.
Блокаду нервных сплетений можно проводить с помощью анестетиков и препаратов, которые временно повреждают нервы. При невролизе вводят препарат, который разрушает сплетение.
Обезболивающие при раке легких
Причиной боли в грудной клетке при раке легких может быть сама опухоль или перенесенное хирургическое вмешательство. Другие возможные причины:
- Метастазы в головном мозге приводят к головным болям.
- Метастазы органов брюшной полости приводят к болям в животе.
- Метастазы в костях приводят к костным болям, патологическим переломам.
- Паранеопластический синдром приводит к нейропатическим болям в разных частях тела.
- Боли — один из побочных эффектов химиотерапии.
Помимо обезболивающих уколов при онкологии легких с НПВС и наркотическими анальгетиками, помогают другие препараты, нервные блокады, лучевая терапия, паллиативные хирургические вмешательства.
Читайте также:

