Анализ на мутацию генов при раке яичников
Об этом мы поговорили с онкогинекологом, хирургом Владимиром Носовым, руководителем Клиники гинекологии и онкогинекологии Eвропейского медицинского центра – первой клиники в России, где персонализированная терапия онкогинекологических заболеваний стала стандартной практикой.
В своём нормальном состоянии эти гены участвуют в восстановлении ДНК после различных повреждений, тем самым защищая клетки от опухолевого перерождения. Если возникает мутация в этих генах, здоровые клетки оказываются не защищенными и сами могут становиться злокачественными. Вероятность заболеть раком груди при носительстве мутации гена BRCA 1/2 колоссальная — до 80%(в общей популяции у женщин без мутации — около 10-12%), риск заболеть раком яичников — до 40-45 %( в популяции —около 1,5%) .
В большинстве случаев назначение этих препаратов после первой линии химиотерапии обеспечивает ремиссию около 3 лет – это огромное достижение, еще никогда в онкогинекологии ремиссия при 3-4 стадии заболевания не продлевалась каким-либо лекарством на столь длительный срок.
Дальнейшие исследования позволили выяснить, что мутации могут быть не только герминогенными, то есть присутствующими во всех клетках организма. Дополнительные 15-20% мутаций генов BRCA происходят только в клетках опухоли, но в крови и других клетках организма их нет. Эти мутации называют соматическими. Они не передаются по наследству, не увеличивают риск развития других онкологических заболеваний, но пациенты, у которых обнаружены мутации в клетках опухоли, также являются кандидатами для лечения ингибиторами PARP.
В Институте онкологии EMC мы предлагаем всем пациентам с раком яичников провести полное секвенирование генов BRCA опухоли и крови. Это позволяет подобрать наиболее эффективную персонализированную терапию. Если речь идет о наследственной мутации – мы рекомендуем в обязательном порядке генетическое обследование детям, сестрам, братьям, родителям, а самим пациенткам-носителям мутации – также пройти дополнительный скрининг на рак молочных желез, риски которого колоссально повышены.
Плохое наследство
Наследственная мутация передается детям с вероятностью 50%, причем как по женской, так и по мужской линии. Носителям мы рекомендуем специальную программу наблюдения и профилактические мероприятия для снижения риска онкологических заболеваний, а также обсуждаем с ними вопросы сохранения репродуктивной функции.
Например, на днях я оперировал пациентку 57 лет с раком яичника. На плановой гистологии был подтвержден злокачественный характер опухоли. Мы провели генетическое исследование опухоли, выявили мутацию BRCA1. Затем было выполнено полное генетическое исследование по крови, чтобы понять, является ли мутация соматической (присутствующей только в опухоли) или герминогенной (наследственной). Выяснилось, что мутация наследственная. Мы рекомендовали пройти обследование двум дочерям пациентки, которые, к сожалению, унаследовали эту мутацию. Женщины-близнецы, им сейчас 31 год, обе еще не планировали беременность и роды. Я рекомендовал им обратиться к репродуктологу, провести стимуляцию и заморозить яйцеклетки, а в 35 лет, именно с этого возраста риски рака яичников начинают расти, удалить профилактически яичники и маточные трубы. В этом случае мы сохраняем матку, и в будущем они смогут выносить своих биологических детей.
Более того, во время ЭКО можно провести предимплантационную диагностику и подсадить эмбрионы, не унаследовавшие мутацию. Таким образом, будущее поколение уже будет защищено.
Рак эндометрия (рак тела матки) – самое распространенное онкогинекологическое заболевание у женщин. Сегодня подходы к его лечению также меняются благодаря персонализированной терапии.
До недавних пор считалось, что существует два типа рака эндометрия. Наиболее частый, первого типа, обычно возникает у полных пациентов, часто с сопутствующими диабетом и гипертонией. Второй – серозный, более агрессивный, не связанный с избытком эстрогенов. На основании клинической картины врачи принимали решение о необходимости дополнительного лечения после операции. Сегодня, благодаря лучшему пониманию биологии опухоли, мы знаем, что этих типов не два, а четыре. И для каждого из них предусмотрено определенное лечение. Чтобы определить, с каким типом рака эндометрия мы имеем дело, достаточно для начала провести иммуногистохимическое исследование.
Каждую опухоль эндометрия вне зависимости от стадии, мы тестируем на наличие определенных молекул, указывающих на благоприятный или менее благоприятный прогноз заболевания. Например, наличие мутации гена P53 говорит о менее благоприятном прогнозе. В этом случае мы рекомендуем не только наблюдение, но и дополнительное лечение с помощью химио-или лучевой терапии.
Некоторые раки матки, так же, как и некоторые раки яичников и молочной железы, имеют в своей основе генетический синдром – синдром Линча. Если мы находим проявления синдрома Линча в опухоли, мы направляем пациентов на полноценное генетическое тестирование. Это важно, потому что рак матки – не единственное заболевание, к которому предрасположены носители мутаций, вызывающих синдром Линча. В частности, у них повышен риск рака толстой кишки в молодом возрасте.
Часто первым возникает рак матки, через какое-то время развивается рак толстой кишки.
Поэтому носителям синдрома Линча рекомендуют начинать скрининг на рак кишки не в 45-50, а гораздо раньше — с 30 лет и делать колоноскопию раз в 6 или 12 месяцев, чтобы не пропустить развитие заболевания.
Выявление синдром Линча у пациентки с раком матки может повлиять и на лечение.
При поздних стадиях пациентам с синдромом Линча мы назначаем специфическую иммунотерапию препаратом пемпролизумаб, что позволяет улучшить прогнозы пациентов.
Генетическое профилирование опухоли – это колоссальный прорыв, который позволил нам подойти к полностью персонализированной терапии в онкологии, основанной не только на диагнозе, но и на понимании биологии опухоли. Для пациентов — это возможность получить точное узкоспециализированное лечение, дающее лучшие результаты, а в случае наследственных раков — возможность защитить будущие поколения от опасных заболеваний.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению — сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента — не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют тестирование — определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все — мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
Иногда в процессе деления получаются сбои — мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида
2. Хромосомные аберрации.
Делеция — утрата участка хромосомы. Происходят обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё — этот ген в хромосоме больше не экспрессируется.
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы — в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
Каждый этап клеточного цикла контролируется
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) — две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF — немелкоклеточный рак легкого;
- BRAF — меланома;
- HER2 — рак молочной железы (РМЖ);
- KRAS — колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
опухоли (антионкогены) — напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация в результате мутации — резко увеличивает вероятность появления злокачественной опухоли.
- мутации BRCA1, BRCA2 — рак молочных желез, яичников;
- мутации p53 — до 50% различных видов раковых опухолей, саркомы;
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
Иматиниб связывается с активным участком молекулы белка , и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее — индивидуально подобранное для конкретного пациента — на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
- обнаружим опухоль/метастаз на очень ранней стадии — по обрывкам ее ДНК в крови;
- можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия — микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови — тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль — опасаются, что ее это спровоцирует на рост. На сегодня не доступны исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла — от кожи до опухоли — так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации — то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии — и даже визуализировать весь кариотип (хромосомный набор).
Под стрелкой слева — слияние красного и зеленого сигнала — свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) — нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения профиля опухоли — начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, , иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, — и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности — полезно для спокойствия пациента.
Отчет получается довольно увесистым — 30 страниц захватывающего чтения
Кому это нужно?
В этом случае исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс — время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом — и остались немутировавшими. Да, мы назначаем препарат по результатам теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли — по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования — без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли — это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов тестирования — все еще редкий случай, к сожалению — для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона — технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) — а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел — нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF — у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Молекулярно-генетическое тестирование является неотъемлемой частью обследования и лечения онкологических больных во всем мире.
Причина появления опухоли – это мутации, т.е. генетические нарушения, возникшие в одной из миллиардов клеток человеческого организма. Эти мутации нарушают нормальную работу клеток, что приводит к их неконтролируемому и неограниченному росту, воспроизведению и распространению по организму - метастазированию. Однако наличие таких мутаций позволяет отличать опухолевые клетки от здоровых и использовать это знание при лечении больных.
Анализ опухоли каждого конкретного пациента и формирование индивидуального перечня потенциальных молекул-мишеней стало возможным благодаря внедрению методик молекулярно-генетического анализа в клиническую практику. Научная лаборатория молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова выполняет полный спектр современных молекулярно-генетических исследований для онкологических пациентов и их родственников.
Кому и чем могут помочь генетические исследования?
НМИЦ онкологии им. Н.Н. Петрова осуществляет полный комплекс мероприятий, связанных с диагностикой наследственной предрасположенности к раку молочной железы.
Любой человек является носителем каких-то мутаций, опасных либо для нас, либо для потомства. Первое направление исследований онкогенетиков – выявление наследственных мутаций с помощью секвенирования генома. Второе направление – исследование собственно опухоли, спектра приобретенных клеткой мутаций, в связи с которыми она возникла. Для этого тоже требуется исследование генома всего организма, чтобы сравнить последовательность ДНК опухоли с последовательностью ДНК в организме. Поэтому в будущем оно потребуется для лечения любой опухоли.
Молекулярно-генетические исследования можно сделать дистанционно
Для того, чтобы пройти генетическое обследование в НМИЦ онкологии им. Н.Н. Петрова не обязательно приезжать в Санкт-Петербург. Научная лаборатория молекулярной онкологии принимает материалы для исследований по почте. Послать отправление можно письмом или бандеролью как почтой России (средний срок доставки – 2 недели), так и экспресс-почтой (срок доставки 2-3 дня).
Пожалуйста, внимательно ознакомьтесь с информацией о том, куда и как отправлять биологические материалы, чтобы они сохранными дошли до НМИЦ онкологии им. Н.Н. Петрова, а также о том, как оплатить исследования и получить результат:
Материалы, которые необходимы для исследования:
- все патоморфологические материалы: парафиновые блоки и стекла. При низком качестве срезов или для выявления важных деталей могут понадобиться дополнительные срезы;
- венозная кровь.
Документы, которые необходимо вложить в бандероль:
- заполненное врачом направление на молекулярно-генетическое исследование
- Направление для молекулярно-генетического исследования опухолевого материала
- Направление на анализ наследственных мутаций в генах BRCA1/2 (стандартный и расширенный анализы наследственных мутаций)
- Направление на анализ наследственных мутаций (анализа полной последовательности генов BRCA1/2 и другие)
- копии паспортов пациента и плательщика - разворот с основной информацией + прописка (необходимо для предоставления платежной квитанции)
- контактная информация:
- номер мобильного телефона (для SMS-оповещения о готовности анализа)
- адрес электронной почты (для отправки результата на электронную почту) - копия выписного эпикриза или консультационного заключения (при наличии)
- копия гистологического заключения предоставляемого материала (при наличии)
Цены на молекулярно-генетические исследования указаны в прейскуранте.
Для каких молекулярно-генетических исследований необходима кровь пациента:
- наследственных мутаций (BRCA1,2 и т.д.)
- полиморфизм UGT1A1*28
- выявление коделеции 1p/19q + блоки и стекла
- подтверждение принадлежности патоморфологического материала пациенту
Особенности отправки пробирок с кровью:
- Необходимый объем венозной крови 3-5 мл.
- Забор крови может производиться в любое время суток вне зависимости от приема пищи.
- Кровь отбирается в пробирки с ЭДТА (фиолетовая крышка).
- Для перемешивания крови с антикоагулянтом, которым пробирка покрыта изнутри, закрытая пробирка должна быть несколько раз плавно перевернута вверх дном.
- При комнатной температуре пробирка с кровью может транспортироваться в течение двух недель.
Важно! Не забывайте вкладывать документы в посылку. Обязательно оставляйте номер телефона и адрес электронной почты.
С предрасположенностью к возникновению синдрома РМЖ/РЯ связано присутствие у таких пациентов мутаций в генах BRCA1 или BRCA2. Мутации являются наследственными – то есть, буквально в каждой клетке организма такого человека есть повреждение, которое передалось ему по наследству. Вероятность возникновения злокачественного новообразования у пациентов с мутациями BRCA1 или BRCA2 к 70 годам достигает 80%.
Однако, в каждой клетке присутствует две копии каждого гена — от мамы и от папы, поэтому вторая копия может компенсировать нарушение работы клеточных систем. Но вероятность выхода ее из строя также очень высока. При нарушении процессов восстановления ДНК в клетках начинают накапливаться и другие изменения, которые, в свою очередь, могут привести к злокачественной трансформации и росту опухоли.
Определение генетической предрасположенности к онкологическим заболеваниям:
На базе лаборатории молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова применяется проведение поэтапного анализа для пациентов:
- сначала исследуется присутствие самых частых мутаций (4 мутации)
- при отсутствии таковых и клинической необходимости возможно проведение расширенного анализа (8 мутаций) и/или анализа полной последовательности генов BRCA1 и BRCA2.
 |  |
На данный момент известно более 2 000 вариантов патогенных мутаций в генах BRCA1 и BRCA2. Кроме того, данные гены являются довольно большими – 24 и 27 экзонов соответственно. Поэтому полный анализ последовательностей генов BRCA1 и BRCA2 является трудоемким, дорогостоящим и длительным по времени процессом.
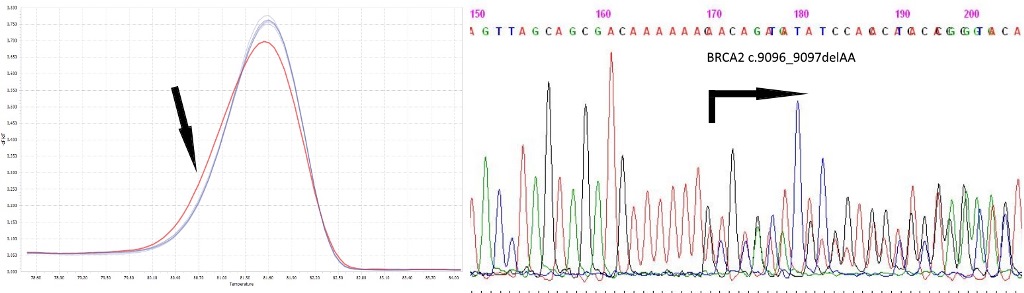
Анализ последовательности гена BRCA2, выявление мутации c.9096_9097delAA
В каких случаях нужно сдать анализ на мутации BRCA1 и BRCA2?
Национальная онкологическая сеть – National Comprehensive Cancer Network (NCCN) рекомендует направлять на генетическое исследование следующих пациентов:
- Пациенты до 45 лет с диагнозом рак молочной железы
- Пациенты в возрасте до 50 лет с РМЖ, если в семье есть хотя бы один близкий кровный родственник с таким диагнозом
- Также в том случае, если у пациента до 50 лет с РМЖ семейная онкологическая история неизвестна
- Если в возрасте до 50 лет диагностировано множественное поражение молочных желез
- Пациенты с РМЖ в возрасте до 60 лет — если по результатам гистологического исследования опухоль является трижды-негативной (отсутствует экспрессия маркеров ER, PR, HER2).
- При наличии диагноза рак молочной железы в любом возрасте — если присутствует хотя бы один из следующих признаков:
- не менее 1 близкой родственницы с РМЖ в возрасте менее 50 лет;
- не менее 2 близких родственниц с РМЖ в любом возрасте;
- не менее 1 близкой родственницы с РЯ;
- наличие не менее 2 близких родственников с раком поджелудочной железы и/или раком предстательной железы;
- наличие родственника-мужчины с раком грудной железы;
- принадлежность к популяции с высокой частотой наследственных мутаций (например, евреи Ашкенази);
- Все пациенты с диагностированным раком яичников.
- Если диагностирован рак молочной железы у мужчины.
- Если диагностирован рак простаты (с индексом по шкале Глисона >7) при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если диагностирован рак поджелудочной железы при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если рак поджелудочной железы диагностирован у уиндивидуума, принадлежащего к этносу евреев Ашкенази.
- Если у родственника обнаружена мутация BRCA1 или BRCA2
Выполнение молекулярно-генетического анализа должно сопровождаться генетическим консультированием, в ходе которого обсуждаются содержание, смысл и последствия тестирования; значение позитивного, негативного и неинформативного результатов; технические ограничения предлагаемого теста; необходимость информировать родственников в случае обнаружения наследственной мутации; особенности скрининга и профилактики опухолей у носителей мутаций и др.
Как сдать анализ на мутации BRCA1 и BRCA2?
Материалом для анализа является кровь. Для генетических исследований используют пробирки с ЭДТА (фиолетовая крышка). Сдать кровь можно в лаборатории НМИЦ или привезти из любой другой лаборатории. Кровь хранится при комнатной температуре до 7 дней.
 |  |
Особая подготовка к исследованию не нужна, на результаты исследования не влияют приемы пищи, прием лекарств, введение контрастных веществ и пр.
Пересдавать анализ через некоторое время или после лечения не потребуется. Наследственная мутация не может исчезнуть или появиться в течение жизни или после полученного лечения.
Что делать, если у женщины обнаружена мутация BRCA1 или BRCA2?
Для носителей патогенных мутаций разработан комплекс мероприятий по ранней диагностике, профилактике и терапии новообразований молочной железы и рака яичников. Если среди здоровых женщин своевременно выявить тех, у кого имеется генный дефект, есть возможность диагностировать развитие заболевания на ранних стадиях.
Исследователями были выявлены особенности лекарственной чувствительности BRCA-ассоциированных опухолей. Они хорошо реагируют на некоторые цитостатические препараты, и лечение может быть весьма успешным.
Для здоровых носителей BRCA-мутаций рекомендовано:
- Ежемесячное самообследование с 18 лет
- Клиническое обследование молочных желез (маммография или магнитно-резонансная томография) с 25 лет.
- Мужчинам-носителям мутации в генах BRCA1/2 рекомендовано проведение ежегодного клинического обследования грудных желез начиная с 35-летнего возраста. С 40 лет целесообразно выполнение скринингового обследования предстательной железы.
- Проведение дерматологического и офтальмологического осмотров c целью ранней диагностики меланомы.
Как предрасположенность к РМЖ и РЯ передается по наследству.
Часто у носителей мутаций BRCA1/BRCA2 возникает вопрос – всем ли детям она передалась и какие генетические причины появления наследственной формы РМЖ? Шансы передать повреждённый ген потомству составляют 50%.
Заболевание одинаково наследуется, как мальчиками, так и девочками. Ген, связанный с развитием рака молочной железы и рака яичников, расположен не на половых хромосомах, поэтому вероятность носительства мутации не зависит от пола ребенка.
Если мутация в нескольких поколениях передавалась через мужчин, очень сложно проводить анализ родословных, так как мужчины довольно редко болеют РМЖ даже при наличии генного дефекта.
Например: носителями были дедушка и отец пациентки, и у них заболевание не проявилось. На вопрос, были ли случаи онкологических заболеваний в семье, такая пациентка ответит отрицательно. При отсутствии других клинических признаков наследственных опухолей (ранний возраст/множественность опухолей), наследственная составляющая заболевания может быть не учтена.
При обнаружении мутации BRCA1 или BRCA2 всем кровным родственникам рекомендуется также пройти тестирование.
Почему при генетическом исследовании важно учитывать этнические корни?
Для многих этнических групп характерен свой набор частых мутаций. Национальные корни обследуемого необходимо учитывать при выборе глубины исследования.



Читайте также:





