Ампутация при остеогенной саркоме
Остеосаркома, остеогенная саркома – агрессивная злокачественная опухоль, клетки которой происходят из костной ткани. Это наиболее часто встречающаяся первичная злокачественная опухоль костей (первичные опухоли – то есть опухоли, возникающие в самих костях, – следует отличать от костных метастазов других опухолей).
Остеосаркома может прорастать в окружающие кость мягкие ткани – мышцы, жир, сухожилия. С кровотоком опухолевые клетки могут распространяться в отдаленные участки организма, давая метастазы. Наиболее типично метастазирование в легкие, однако метастазы иногда возникают и в других органах, включая головной мозг; возможно также поражение других костей. Соответственно, при остеосаркоме различают локализованную и метастатическую формы опухолевого процесса, то есть формы без отдаленных метастазов (поражена только кость и прилежащие ткани) и с метастазами. Также иногда выделяют три стадии заболевания: стадии I и II отвечают остеосаркоме соответственно низкой и высокой степени злокачественности, но без метастазов, а стадия III – метастазировавшей опухоли.
В зависимости от гистологических характеристик опухоли различают остеобластическую, хондробластическую и фибробластическую остеосаркому, а также некоторые редкие разновидности.
Остеогенная саркома может встречаться в любом возрасте, однако наиболее характерна для молодого взрослого и особенно для подросткового возраста. Большинство заболевших - от 10 до 30 лет. В среднем возрасте эта опухоль встречается очень редко. Около 10% заболевших – пожилые люди старше 60 лет; считается, что у них развитие опухоли может быть спровоцировано другими костными заболеваниями, возникшими к этому возрасту, или связано с перенесенным облучением. Мужчины болеют несколько чаще женщин.
Частота возникновения остеосаркомы составляет около 3-4 случаев на 1 миллион детей и молодых людей в возрасте до 20 лет.
Остеосаркома чаще всего возникает в период быстрого роста костей, и поэтому риск этой опухоли несколько больше у высоких подростков, особенно у мальчиков. Кроме того, повышенный риск остеосаркомы наблюдается при некоторых генетических аномалиях. Например, эта опухоль чаще встречается у детей с наследственной ретинобластомой (опухолью сетчатки), синдром Ли-Фраумени, некоторыми заболеваниями костей. Возможно также развитие остеосаркомы у людей, перенесших облучение, - например, в ходе лечения другой опухоли. Однако в большинстве случаев болезнь возникает у детей и молодых людей, у которых нет ни одного из перечисленных факторов риска.
Иногда остеосаркома возникает после травмы, и пациент или его родители считают, что именно травма спровоцировала опухоль. Но промежуток времени между травмой и обнаружением опухоли может сильно различаться, и трудно надежно доказать связь между возникновением остеосаркомы и предшествующими ушибами и переломами.
При остеогенной саркоме типичны жалобы на боль, обычно вблизи сустава, которая становится заметнее по ночам или при физической нагрузке – так, при поражении костей ноги может возникнуть хромота. Как правило, больные первоначально принимают эти явления за последствия мышечного перенапряжения или травмы, однако при остеосаркоме боли с течением времени не ослабевают, а усиливаются. К сожалению, на ранних стадиях опухолевого процесса нередко ставится ошибочный диагноз (миозит, невралгия, последствия травмы и т.п.), что ведет к потере времени и ухудшению прогноза. Поэтому при непонятных и долго сохраняющихся болях в костях следует посетить врача-онколога, чтобы в случае обнаружения опухоли своевременно начать лечение.
По мере развития опухолевого процесса и вовлечения соседних тканей, иногда через несколько недель после появления боли, возникает припухлость над участком опухоли. Затем зона припухлости увеличивается, возникает отечность, на коже видна венозная сеть. Движения в ближайшем суставе затруднены из-за боли. Иногда происходит патологический (то есть обусловленный болезнью) перелом кости, хотя это не очень частое явление.
При распространенной опухоли могут возникнуть симптомы общего характера, такие как утомляемость, нарушения сна, потеря веса, анемия, повышение температуры и т.д.
Как правило, первым шагом в диагностике остеосаркомы является рентгеновское исследование. На снимке виден очаг деструкции кости; нередко наблюдается так называемый козырек Кодмана (на участках, где надкостница приподнята опухолью и прерывается).
При обнаружении опухоли производится ее биопсия с последующим микроскопическим исследованием.
Компьютерная томография (КТ) позволяет точнее изучить опухоль, причем как внутрикостный компонент, так и распространение в окружающие мышечную и жировую ткани (внекостный компонент). Магнитно-резонансная томография (МРТ) дает дополнительную информацию: так, она полезна для изучения состояния костномозговой полости пораженной кости, а также для обнаружения метастазов саркомы в центральную нервную систему. Возможно также использование позитронно-эмиссионной томографии (ПЭТ). Рентгенография или компьютерная томография грудной клетки важны для обнаружения метастазов в легких. Остеосцинтиграфия используется для обнаружения метастазов в другие кости и/или многоочаговой формы болезни.
Определенное значение для прогноза имеет биохимический анализ крови, так как повышенные уровни лактатдегидрогеназы (ЛДГ, LDH) и щелочной фосфатазы чаще наблюдаются при более агрессивном течении болезни.
Необходимым этапом лечения остеосаркомы является хирургическое удаление опухоли. В случае его невозможности (например, опухоль поражает основание черепа или позвоночник) прогноз существенно ухудшается.
Несколько десятилетий назад операции по поводу остеогенной саркомы костей ног или рук практически всегда сводились к ампутации. Однако сейчас в большинстве случаев есть возможность провести щадящую операцию, то есть операцию, сохраняющую конечность. В этих случаях пораженный участок кости с окружающими тканями удаляется и заменяется либо искусственным эндопротезом, либо костным имплантантом. Для детей целесообразно использовать раздвижные эндопротезы, длину которых можно увеличивать по мере роста ребенка. К сожалению, при обширном опухолевом процессе, в который вовлечены сосуды и/или нервы, ампутация все равно может быть неизбежной.
Может применяться также хирургическое удаление крупных метастазов, прежде всего в легких.
Так как остеосаркома быстро распространяется, то удалить первичный очаг опухоли недостаточно: даже если макроскопически заметных метастазов нет, необходима химиотерапия, так как без нее выживаемость очень низка. При остеосаркоме химиотерапия используется как до удаления опухоли, так и после ее хирургического удаления, для уничтожения оставшихся опухолевых клеток. При этом после удаления опухоли производится ее исследование для оценки ответа на предшествующую химиотерапию и выбора стратегии последующего лечения.
Среди химиотерапевтических препаратов при остеосаркоме эффективны высокодозный метотрексат (в сочетании с лейковорином для минимизации побочных эффектов), доксорубицин, препараты платины, ифосфамид, этопозид. Применяется также комбинация BCD (блеомицин, циклофосфамид, актиномицин D) и т.п.
Лучевая терапия применяется очень редко, так как клетки остеосаркомы малочувствительны к облучению. Иногда облучение используют при невозможности полного удаления опухоли.
Результаты лечения остеогенной саркомы существенно улучшились за последние десятилетия. В различных исследованиях указываются разные цифры, но в целом доля выздоравливающих детей и молодых пациентов после комбинированного лечения по поводу остеосаркомы составляет около 70%. Особенно эффективно излечиваются локализованные формы, а также опухоли, хорошо отвечающие на химиотерапию. Прогноз зависит также от местонахождения опухоли и возможности ее полного хирургического удаления.
Среди отдаленных последствий лечения остеосаркомы обычно наиболее существенны последствия операции. Так, если была произведена ампутация руки или ноги, то необходимо ее протезирование и долгий процесс реабилитации. Кроме того, многим больным, особенно подросткам, в этой ситуации может потребоваться помощь психолога.
При операциях, сохраняющих конечность, также необходимы реабилитационные мероприятия. Возможные проблемы включают в себя износ эндопротеза и его инфицирование.
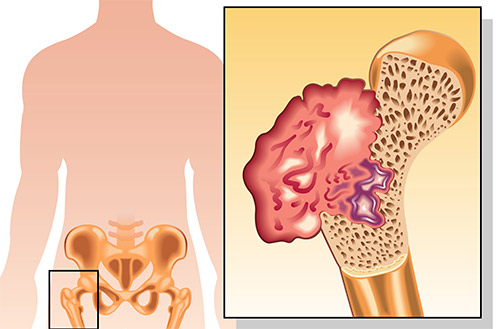
Остеосаркома — это злокачественная опухоль, произрастающая из клеток костной ткани. Это очень редкий вид новообразования, большинство видов которого характеризуется быстрым ростом и агрессивным течением. Остеосаркому не надо путать с метастазами в кости, поскольку те являются результатом распространения новообразований, первично развившихся в других органах.
Главной особенностью остеосаркомы является то, что ее клетки способны производить костную ткань, но она является незрелой. Из нее не может образовываться основное костное вещество, и в ней не происходит кальцинирования. Эта черта отличает остеосаркомы от других злокачественных и доброкачественных опухолей костей.
- Причины возникновения
- Симптомы
- Диагностика
- Лечение
- Осложнения
- Прогноз при остеосаркомах
- Профилактика
Что касается эпидемиологии, то частота заболеваемости составляет 10-26 случаев на 1 млн человек в год. Чаще страдает мужское население. Соотношение мужчин и женщин 1,36/1. Имеется два пика подъема заболеваемости. Первый приходится на возраст 10-14 лет, а второй на возраст старше 40 лет. Очень редко новообразование регистрируется у детей младше 5 лет.
Остеосаркомы плоских костей чаще наблюдаются у людей старшей возрастной группы. При этом, в основном страдает кость нижней челюсти и кости таза. Могут поражаться и позвонки.
Причины возникновения
Причины возникновения саркомы костей пока изучены недостаточно. Раньше считалось, что спровоцировать развитие опухоли могут травмы, но на сегодняшний день многие врачи склоняются к мнению, что травма только способствует скорейшему росту уже образованной остеосаркомы, но не ее возникновению.
Возможными предрасполагающими факторами являются:
- Воздействие ионизирующего излучения. Например, прохождение лучевой терапии. В этом случае остеосаркомы могут развиваться через несколько лет от момента завершения терапии.
- Наличие инородных тел в кости — импланты, ортопедические конструкции.
- Есть данные, что риски развития остеосаркомы выше у детей, у которых масса тела при рождении превышала 4046г, а также у людей с ростом выше среднего.
- Наличие генетических синдромов — врожденная ретинобластома, синдром Ротмунда-Томпсона, синдром Ли-Фраумени и др.
- Наличие доброкачественных новообразований костей — фиброзная дисплазия, костные кисты.
Однако чаще всего опухоль возникает de novo, без каких-либо предрасполагающих факторов.
Симптомы
Нарастание симптоматики при саркоме происходит постепенно. Сначала пациенты отмечают боль в области локализации опухоли. Она может быть сходна с болью при артритах, миозитах и миалгиях, усиливается по ночам или после физических нагрузок. Но в отличие от вышеперечисленных заболеваний, она со временем не ослабевает, а наоборот, усиливается.
Постепенно размеры новообразования увеличиваются, и в процесс вовлекаются мягкие ткани. Над местом поражения возникает припухлость. Кожа в этой области может быть покрасневшей, с усиленным венозным рисунком. В запущенных стадиях на ней образуются изъязвления.
При возрастании объема поражения, развиваются ограничения объема движения в пораженном сегменте скелета. Кроме того, может образовываться внутрисуставной выпот, патологические переломы (которые возникают без существенных нагрузок). На последних стадиях заболевания присоединяется потеря массы тела, вплоть до кахексии.
Диагностика
Для диагностики остеосаркомы используются следующие методы обследования:
- Клинический осмотр и сбор анамнеза.
- Рентгенологические исследования.
- Лабораторные исследования.
Во время осмотра доктор обращает внимание на локализацию боли, на изменения конфигурации пораженного сегмента, кожной гиперемии и венозного рисунка. Также отмечают наличие или отсутствие ограничений движения в пораженных конечностях.
Далее пациента направляют на рентгенологическое исследование. Это может быть простой рентген или компьютерная томография. В пользу остеосаркомы говорят следующие признаки:
С помощью компьютерной томографии более точно оценивают размеры новообразования, место его локализации и вовлеченность соседних мягких тканей (мышц, сухожилий, синовиальных оболочек). Также с ее помощью можно обнаружить скип-метастазы — близкорасположенные или прыгающие метастазы. С помощью МРТ оценивается вовлеченность в процесс костного мозга.

Для окончательной постановки диагноза и определения вида остеосаркомы, необходимо провести морфологическое исследование. Для этого с помощью биопсии берут небольшой фрагмент новообразования и направляют его в лабораторию для специального исследования.
Также в рамках диагностики осуществляют поиск отдаленных метастазов. Как правило, ограничиваются костями, легкими и головным мозгом, поскольку изолированное метастазирвание в другие органы встречается крайне редко. Для обследования легких и головного мозга проводят спиральную КТ. Для поиска метастазов в других костях скелета применяют сцинтиграфию или ПЭТ.
Лечение
Как правило, остеосаркома требует комплексного подхода в лечении, и с этой целью применяется хирургия, химиотерапия и лучевая терапия. Хирургия, как самостоятельный метод лечения, применяется только при низкозлокачественных остеосаркомах, например, при хондросаркоме. Если же опухоль высокозлокачественная, помимо операции потребуется длительный курс химиотерапии, чтобы уничтожить возможные метастазы и предотвратить их возникновение.
Как мы уже говорили, операция является краеугольным камнем в лечении большинства видов остеосарком. Стандартом является радикальное иссечение опухоли в пределах здоровых тканей. С этой целью проводят вмешательства в следующих объемах:
- Ампутации — полное удаление пораженной конечности или фрагмента скелета.
- Экзартикуляция — вычленение пораженного сегмента по линии суставной щели. При этом опиливание костей не производится.
- Органосохраняющие вмешательства.
На сегодняшний день, по возможности, стараются провести органосохраняющее лечение, например, удаление пораженного фрагмента кости с последующей костной пластикой или эндопротезированием сустава. В качестве костной пластики используются либо синтетические материалы, либо собственные костные ткани пациента, взятые из другого отдела скелета. При лечении детей используют растущие эндопротезы.
К сожалению, органосохраняющее лечение удается провести не всегда. Противопоказанием к нему служат:
- Наличие патологических переломов с сильным болевым синдромом.
- Обширное вовлечение в процесс мягких тканей, в частности мышц.
- Распад опухоли.
- Вовлечение в процесс кровеносных сосудов и нервных стволов на большом протяжении.
- Кровотечение из вовлеченных кровеносных сосудов.
- Наличие инфекционных осложнений со стороны опухоли.
- Наличие массивного обсеменения злокачественными клетками костных тканей.
- Выраженные симптомы интоксикации.
При обнаружении одиночных метастазов, также проводят их хирургическое удаление. Если имеются одиночные очаги в легких, проводят торакотомию, однако во время операции требуется тщательная пальпация обоих легких, поскольку есть высокая вероятность обнаружения большего количества метастазов, чем те, которые были выявлены лучевыми методами диагностики.
Некоторые остеосаркомы (саркома Юинга) являются радиочувствительными. При их лечении можно избежать операции и ограничиться облучением и химиотерапией. Но большинство костных опухолей резистентны к лучевому воздействию, поэтому данное лечение применяется только на распространенных стадиях для уменьшения болевого синдрома.
Химиотерапия имеет большое значение при лечении высокозлокачественных остеосарком. Ее назначают в неоадъювантных и адъювантных режимах, и у большинства пациентов продолжительность лечения может достигать 12 месяцев.
Неоадъювантная химиотерапия проводится в течение нескольких недель перед операцией. Ее целью является уменьшение размеров опухоли, создание условий для радикальной операции и определение индивидуальной химиочувствительности остеосаркомы. Последний момент является очень важным для определения прогноза заболевания.
Послеоперационная химиотерапия проводится в течение нескольких месяцев после удаления опухоли. Используются полихимиотерапевтические схемы, включающие в себя адриамицин, метотрексат в высоких дозах совместно с фолиевой кислотой, цисплатин и фосфамид. При выборе схемы послеоперационной ХТ основываются на ответе опухоли на неоадъювантную химиотерапию. Если ответ был неудовлетворительным, используют особые схемы лечения, которые называют постоперационной терапией спасения.
Осложнения
Остеосаркома может привести к развитию следующих осложнений:
- Патологические переломы — это переломы, которые возникают без воздействия травмирующего фактора. Дело в том, что остеосаркома приводит к нарушению остеогенеза, в месте локализации опухоли костная ткань не является достаточно прочной и не может выдержать обычную нагрузку, что приводит к образованию перелома от малейшего воздействия.
- При поражении ростовой пластинки трубчатых костей может нарушаться синхронный рост конечностей.
- При лечении заболевания может потребоваться обширная операция или ампутация конечностей, что приводит к инвалидизации пациента.
Прогноз при остеосаркомах
Прогноз заболевания будет зависеть от многих факторов, например:
- Место локализации опухоли. Наиболее неблагоприятно протекает остеосаркома, локализующаяся в области метафиза трубчатых костей, а, например, остеосаркома, которая располагается в области свода черепа, отличается более медленным течением и редко дает метастазы, даже если это высокозлокачественный тип опухоли.
- Размер первичного очага. Чем больше новообразование, тем хуже прогноз.
- Возраст и общее состояние пациента. Более благоприятно протекает остеосаркома у детей. Хуже обстоят дела у людей пожилого и старческого возраста ввиду изначально ослабленного здоровья и ограничений в проведении агрессивных курсов химиотерапии.
- Чувствительность новообразования к проводимому химиотерапевтическому лечению.
- Возможность проведения радикальной операции.
Раньше остеосаркома считалась агрессивной опухолью, и результаты ее лечения были неудовлетворительными даже после проведения обширных радикальных операций. Пятилетний рубеж переживало около 10% больных. На сегодняшний день с введением новых химиотерапевтических схем результаты лечения стали намного лучше. Пятилетняя выживаемость при локализованной опухоли составляет более 70%, а при хорошей химиочувствительности — 80%.
Профилактика
На сегодняшний день эффективных методов профилактики остеосаркомы нет, тем не менее может быть рекомендовано соблюдение общих принципов здорового питания и физической активности, борьба с вредными привычками.
Остеогенная саркома является наиболее частой первичной злокачественной опухолью костей, которая в течении роста образует остеоидную ткань или кость. Это чаще всего первичная костная злокачественная опухоль, дающая высокую смертность. Чаще поражает лиц мужского пола (соотношение 2:1). Почти две трети остеогенных сарком встречаются в возрасте от 10 до 40 лет. После 50 лет остеосаркома бывает очень редко. Главным образом поражаются трубчатые кости: на первом месте стоит бедренная кость, а именно ее дистальный конец, на втором месте – большеберцовая кость – ее проксимальный конец, на третьем месте – плечевая кость, также ее проксимальный конец.
Симптомы и признаки
Припухлость или объемное увеличение пораженной области наблюдается в 25% случаев уже при констатировании боли во время осмотра. В дальнейшей стадии возникает ограничение движений в прилегающем суставе. Это явление обычно наблюдается при полном развитии клинических признаков остеогенной саркомы. В тяжелых случаях возникают контрактуры. Кожа над опухолью бывает теплой, также могут появляться флебэктазии.
Лабораторные исследования
Биохимические методы исследования, особенно это касается исследования костного метаболизма (кальция, фосфора, фосфатов, а также белков) сами по себе для раннего диагностирования остеогенной саркомы не имеют решающего значения. Повышение щелочных фосфатов может указывать на степень злокачественности, а иногда также и на прогрессирующий рост опухоли.
Обыкновенно при остеогенных саркомах, имеющих высокую злокачественность, уровень щелочной фосфатазы повышается. Это повышение щелочной фосфатазы также обозначает активность и динамику болезни.
Остеогенные саркомы с нормальным уровнем фосфатазы протекают сравнительно несколько лучше, чем те, при которых уровень фосфатазы повышен.
Рентгенологическая картина
В периосте протекают реактивные изменения. Слоистые периостозы весьма частые при остеогенной саркоме, бывают большей частью тонкими, их можно видеть в раннем периоде. Сегментарные периостозы характерны для опухолей. Так называемый треугольник Кодмена – это шпорообразный неспецифический периостоз, возникающий вследствие отслоения периоста. Спикулы не являются специфическим симптомом для остеосаркомы. Речь идет о столбиках новообразованной кости с различным морфологическим распределением.
Томограммы могут помочь при уточнении некоторых характерных черт неоплазматического процесса, какими являются маленький деструктивный очаг со спикулами и начинающиеся литические и склеротические изменения.
Ангиография помогает при определении характера деструкции, кроме того, она имеет также значение для оценки лечебного аффекта. Обильность васкуляризации опухоли в виде причудливости сосудистого рисунка разного калибра составляет патогномоническую картину для остеогенной саркомы.
Макроскопические данные
Остеогенная саркома чаще всего начинается в метафизарной области диафиза внутри кости и распространяется в медуллярном канале с одной стороны по направлению к диафизу, а с другой стороны – к концу кости.
Опухолевая ткань имеет различный вид, цвет и консистенцию в зависимости от степени оссификации и от вторичных регрессивных изменений.
Иногда оссификация бывает так развита, что консистенция опухоли напоминает почти твердость слоновой кости, но несколько чаще, особенно на краю опухоли, устанавливают оссификацию в виде желтоватых точечных очагов и тяжей.
Остеолитические опухоли часто сопровождаются некрозом, проявляют псевдокистозное размягчение, геморрагии и телеангиоэктазии.
Гистологическая картина
Основной гистологической картиной остеогенной саркомы является саркоматозная соединительная ткань, способная образовать остеоид и кость. Однако детали картины являются очень вариабельными. В областях, в которых образование остеоида не происходит, клетки имеют продолговатую, веретенообразную или полигональную форму, а иногда принимают кубический или цилиндрический вид. Если эти клетки лежат близко друг от друга, такой участок может напоминать эпителиальную опухоль. В некоторых случаях наблюдается значительный полиморфизм клеток и сравнительно часто в остеогенной саркоме находят нерегулярные гигантские клетки. Кроме этих клеток, нередко имеются и хрящевые опухолевые элементы, возникающие непосредственно из недифференцированной опухолевой мезенхимы.
Образование опухолевого остеоида и кости выражено различно. Опухолевая оссификация начинается коллагенизацией межклеточного вещества. Коллагенные тяжи потом переходят в остеоид. В остеоидную ткань отлагаются кальциевые соли и таким образом возникает опухолевая кость, которая характеризуется значительной атипией.
Количество костных структур в разных опухолях различно. В опухолях с сильно выраженной оссификацией в межтрабекулярном костно-мозговом пространстве опухолевая кость образуется в значительном количестве и окружает первоначальные костные балки. В рентгенологической картине такие опухоли проявляются как склеротические участки остеогенной саркомы.
В остеолитической остеогенной саркоме или в остеогенном участке балки спонгиозной кости и сама кортикальная кость поддаются резорбции. В гистологической картине обыкновенно находят многочисленные остеобласты; опухолевый остеогенез бывает весьма незначительный. Иногда необходимо исследовать ткань с различных мест опухоли, чтобы определить хотя бы малейший признак образования кости.
Дифференциальная диагностика
Важна точная дифференциальная диагностика между остеогенной саркомой и хондросаркомой. Остеогенная саркома происходит из примитивных мезенхимальных клеток эндоста и периоста, из предшественников остеобластов. Напротив, хондросаркома возникает из хондроцитов, следовательно, из клеток, более или менее дифференцированных. Примитивная, злокачественно измененная пери- или эндостальная мезенхима может в опухолевой ткани остаться недифференцированной, может образовать остеоид и кость или даже опухолевой хрящ. Этим объясняется наличие хондросаркоматозных очагов или даже целых участков в остеогенной саркоме.
В хондросаркоме нередко происходит кальцификация и образование кости, однако путем метаплазии опухолевого кальцинированного хряща или же путем энхондральной оссификации. Для определения дифференциального диагноза между остеогенной саркомой и хондросаркомой важным является не количество кости или хряща в опухоли, но способ их образования.
Лечение
В настоящее время самой рациональной терапией остеогенных сарком, если они локализованы на конечностях, является радикальное оперативное вмешательство: ампутация при локализации первичного фокуса ниже верхней трети диафиза плечевой кости или бедренной кости; экзартикуляция при локализации остеогенной саркомы в проксимальном метафизе плечевой или бедренной кости; интерторакоскапулярная ампутация при распространении остеогенной саркомы в плече-лопаточную суставную сумку по направлению к лопатке; и интерилиоабдоминальная ампутация остеогенной саркомы при локализации в зоне тазобедренного сустава.
Паллиативные хирургические вмешательства, особенно резекции, имеют меньшее значение главным образом в том случае, если речь идет о самой низкой степени злокачественности.
- Список членов редколлегии
Федеральное государственное бюджетное учреждение науки
"Институт токсикологии Федерального медико-биологического агентства"
(ФГБУН ИТ ФМБА России)
Институт теоретической и экспериментальной биофизики Российской академии наук.
199406, Санкт-Петербург, ул.Гаванская, д. 49, корп.2
ТОМ 2, СТ. 38 (сс. 195-196) // Июль, 2001 г.
Остеогенная саркома- наиболее частая первичная опухоль костей у детей, занимает 6-е место по частоте среди всех злокачественных опухолей детского возраста. Опухоль происходит из примитивной кость-формирующей мезенхимы, характеризуется продукцией остеоида при злокачественной пролиферации веретеноклеточной стромы. Пик заболеваемости приходится на 2 декаду жизни. У мальчиков частота заболевания выше, тогда как в более раннем возрасте преимущественно болеют девочки (у которых в этот период костный возраст больше, нежели у мальчиков).
Развитие опухоли имеет некоторую связь с быстрым ростом кости. Дети, страдающие остеосаркомой, как правило, выше ростом, по сравнению с возрастной нормой, и болезнь поражает наиболее быстро растущие части скелета.
Развитие костных опухолей часто ассоциируется с травмой, но, скорее травма привлекает внимание врача и заставляет провести рентгенологическое исследование
Единственный агент внешней среды, известный как стимулятор костных сарком - ионизирующее излучение. Причем интервал между воздействием этого фактора и возникновением остеосаркомы может быть от 4 до 40 лет (в среднем 12 - 16 лет).
Среди страдающих болезнью Педжета 2% заболевают остеосаркомой, часто с множественным поражением костей.
Наличие доброкачественных опухолей костей (остеохондромы, энхондромы и т.д.) увеличивает риск заболевания остеосаркомой.
Среди пациентов, излеченных от ретинобластомы, 50% вторичных опухолей приходится на остеосаркому (ретинобластома- опухоль, часто имеющая наследственный характер), и при обоих заболеваниях встречаются одинаковые изменения в 13 паре хромосом.
Важную роль в патогенезе остеогенной саркомы играет мутация опухоль-супрессирующего гена Р-53. В некоторых случаях на развитие опухоли оказывает влияние также и инактивация других опухоль-супрессирующих генов -RBL (ретинобластома- супрессирующий ген- что подтверждает определенную связь этих заболеваний), DCC ген, выделенный из клеток колоно-карциномы (предполагают, что этот ген локализован в длинном плече 18 хромосомы, которое часто отсутствует в клетках человеческой остеосаркомы).
В настоящее время внимание исследователей привлекает изучение активности MDR гена, определяющего резистентность к лекарственной терапии, которая связана с Р-гликопротеинами, выделяемыми клетками остеосаркомы. Эти протеины обеспечивают защиту опухолевой клетки, снижая аккумуляцию ею химиопрепаратов.
Диагноз остеогенной саркомы основывается на гистопатологических критериях в совокупности с рентгенологическими данными. Стандартные гистологические варианты остеосаркомы - остеобластическая (50%), хондробластическая (25%) и фибробластическая- менее 20%
Редкие варианты остеосаркомы.
Телеангиэктатическая - рентгенологически напоминает аневризмальную костную кисту и гигантоклеточную опухоль, проявляется наличием литических очагов со слабо выраженным склерозом (Рис.12-1). Течение заболевания и ответ на химиотерапию практически не отличается от стандартных вариантов остеосаркомы.
Юкстакортикальная (параоссальная) - исходит из коркового слоя кости, опухолевая ткань может со всех сторон окружать кость, но как правило, не проникает в костномозговой канал. Мягкотканный компонент отсутствует, поэтому рентгенологически опухоль трудно отличить от остеоида. Как правило, эта опухоль низкой степени злокачественности, течет медленно, почти не дает метастазов. Тем не менее, параоссальная остеосаркома требует адекватного хирургического лечения, практически такого же, как стандартные варианты опухоли. В противном случае эта опухоль рецидивирует и при этом опухолевый компонент меняет степень злокачественности на более высокую, что и определяет прогноз заболевания.
Периоссальная - также, как и параоссальная, располагается по поверхности кости и имеет сходное течение. Опухоль имеет мягкотканный компонент, но не проникает в костномозговой канал.
Интраоссальные опухоли с низкой степенью злокачественности, хорошо дифференцированы, с минимальной клеточной атипией, могут быть расценены как доброкачественная опухоль. Но они также имеют тенденцию к местному рецидивированию с изменением опухолевого компонента на более злокачественный вариант.
Мультифокальная - проявляется в виде множественных очагов в костях, похожих друг на друга. Не ясно до конца, появляются ли они сразу, или происходит быстрое метастазирование из одного очага. Прогноз заболевания фатальный.
Экстраскелетная остеосаркома - редкая злокачественная опухоль, характеризующаяся продукцией остеоида или костной ткани, иногда вместе с хрящевой тканью - в мягких тканях, чаще всего, нижних конечностей. Но встречаются и поражения других областей, таких как гортань, почки, пищевод, кишечник, печень, сердце, мочевой пузырь и др. Прогноз заболевания остается плохим, чувствительность к химиотерапии очень низкая. Диагноз экстраскелетной остеосаркомы может быть установлен только после исключения наличия костных очагов опухоли.
Мелкоклеточная остеосаркома - высокозлокачественная опухоль, по своему морфологическому строению отличается от других вариантов, что определяет и ее название. Наиболее часто эта опухоль локализуется в бедренной кости. Мелкоклеточная остеосаркома (дифференциальный диагноз с другими мелкоклеточными опухолями) обязательно продуцирует остеоид.
Остеосаркома таза - несмотря на улучшение общей выживаемости при остеосаркоме, имеет очень плохой прогноз. Опухоль характеризуется быстрым и широким распространением в ткани и вдоль них, так как, в силу анатомического строения таза, не встречает на своем пути значительных фасциальных и анатомических барьеров.
Стадирование (Enneking WF, Spanier SS, Goodman MA, 1980, США)
Стадия IA - Высокодифференцированная опухоль. Очаг ограничен естественным барьером, препятствующим распространению опухоли. Отсутствие метастазов
Стадия IB - Высокодифференцированная опухоль. Очаг распространяется за пределы естественного барьера. Отсутствие метастазов
Стадия IIA - Низкодифференцированная опухоль. Очаг ограничен естественным барьером. Отсутствие метастазов.
Стадия IIB - Низкодифференцированная опухоль. Очаг распространяется за пределы естественного барьера. Отсутствие метастазов.
Стадия III - Наличие регионарных и отдаленных метастазов, вне зависимости от степени дифференцировки опухоли
Главным клиническим признаком остеосаркомы является боль над пораженной областью. Боль тупая, постоянная с постепенным нарастанием интенсивности. Характерным симптомом являются ночные боли. У 3/4 больных может присутствовать мягкотканный компонент. Конечность увеличена в объеме, часто выглядит отечной. Боль и увеличение объема приводят к нарушению функции. Длительность анамнеза составляет в среднем 3 месяца.
Характерно поражение метафизов длинных трубчатых костей. Наиболее частая локализация (примерно 50% случаев) - область коленного сустава- дистальная часть бедра и проксимальная часть большеберцовой кости. Часто также поражается проксимальная часть плечевой кости и бедренной кости, и средняя треть бедренной кости. Поражение плоских костей, особенно таза в детском возрасте встречается менее чем в 10% случаев (Рис.12-2).
Остеосаркома обладает огромной тенденцией к развитию гематогенных метастазов. К моменту установления диагноза 10%-20% пациентов уже имеют макрометастазы в легких, выявляемые рентгенологически. Но уже около 80% пациентов к моменту установления диагноза имеют микрометастазы в легких, не выявляемые рентгенологически, но видимые при компьютерной томографии. Поскольку кости не имеют развитой лимфатической системы, раннее распространение остеосаркомы в регионарные лимфоузлы встречается редко, но, если это имеет место, то является плохим прогностическим признаком. Другие зоны метастазирования- кости, плевра, перикард, почки, ЦНС.
Остеосаркома обладает и локальным агрессивным ростом, может распространяться на эпифиз и близлежащий сустав (чаще всего поражаются коленный и плечевой суставы), распространяясь вдоль внутрисуставных структур, через суставной хрящ, через перикапсулярное пространство, или, прямым путем, вследствие патологического перелома, и образовывать не прилежащие к ней очаги- сателлиты - "skip"-метастазы.
1. Полное рентгенологическое исследование.
Это исследование позволяет заподозрить наличие остеосаркомы у пациента, а также выявляет наличие мягкотканного компонента, патологического перелома, определяет размеры опухоли, и оптимальный уровень проведения биопсии.
Рентгенологические признаки остеосаркомы (Рис.12-3):
-метафизарная локализация в длинных трубчатых костях;
-наличие склеротических и литических очагов в кости, наличие васкуляризации;
-очаги патологического остеобразования в мягких тканях;
-нарушение целостности надкостницы с образованием "козырька" или "треугольника Кодмена";
-игольчатый периостит -" спикулы" (разрастание периоста в виде иголочек, расположенных перпендикулярно поверхности кости);
-рентгенография легких позволяет выявить макрометастазы (Рис.12-4).
Но множество рентгенологических находок могут вводить в заблуждение:
-высокодифференцированная опухоль;
-литические очаги или очаги с минимальным склерозом;
-ограничение очага костномозговым каналом;
-нетипичная периостальная реакция;
-редкая интраоссальная локализация;
-редкая скелетная локализация (мягкие ткани, череп, ребро и т.д.).
2. Морфологическое исследование опухоли.
Одной из частых причин невозможности проведения органосохраняющей операции является неудачно проведенная биопсия с местным обсеменением опухолевыми клетками, развитием патологического перелома. Поэтому биопсия должна проводиться хирургом и предпочтительнее проводить трепанобиопсию, нежели ножевую биопсия (для максимальной защиты прилежащих к опухоли тканей от контакта с биоптатом).
3. Остеосцинтиграфия (ОСГ) с Te-99- позволяет выявить другие очаги в костях, хотя повышение накопления изотопа не является специфическим. При проведении ОСГ в динамике по изменению процента накопления изотопа в очаге до- и после химиотерапии, можно достаточно точно судить об эффективности химиотерапии. Значительное снижение процента накопления изотопа в очаге достаточно точно коррелирует с хорошим гистологическим ответом опухоли на химиотерапию.
4. Компьютерная томография (КТ) очага- позволяет выявить точную локализацию опухоли, ее размеры, отношение опухоли к окружающим тканям, распространение ее на сустав. КТ легких позволяет выявить микрометастазы, не выявляемые рентгенологически.
5. Магнито-резонансная томография (МРТ).
Наиболее точный метод контрастирования опухоли, выявляющий ее отношение к окружающим тканям, сосудисто-нервному пучку, а также позволяющий определить динамику процесса при проведении химиотерапии, ее эффективность и, соответственно, планировать объем операции. В настоящее время МРТ проводится с контрастом, содержащим гадолиниум, который накапливается по периферии опухоли, четко отграничивая ее (Рис. 12-5).
В крупнейших онкологических клиниках мира используется усовершенствованный метод - DEMRI - динамический захват контрастного вещества, определяемый при МРТ. С помощью компьютера производится количественное определение (в%) опухолевых клеток, накапливающих контраст до- и после химиотерапии, тем самым определяя гистологический ответ опухоли на лечение еще в предоперационный период.
6.Ангиография - проводится перед операцией. Этим методом выявляют свободны или нет сосуды от опухоли, что определяет объем операции. При наличии в сосудах опухолевых эмболов, проведение органосохраняющей операции невозможно.
Факторы прогноза (по данным исследований COSS-77 -91)
1. Определение объема опухолевой массы.
Производится до начала лечения.
Для опухолей эллипсоидной формы: длина х ширина х толщина х 0,52
Для опухолей дискретного типа: длина х ширина х толщина х 0,785
Пациенты распределяются по группам, в зависимости от объема опухолевой массы:
1 группа - 70 мл и менее - благоприятная.
2 группа - 71 - 150 мл - промежуточная.
3 группа - более 150 мл - высокого риска.
При объеме опухоли более 200 мл у половины больных развиваются вторичные метастазы.
2. Гистологический ответ опухоли на химиотерапию.
Этот показатель выражается в процентном содержании живых опухолевых клеток во всей опухолевой ткани, которая удаляется во время операции после проведенной предоперационной химиотерапии (ХТ). Гистологический ответ опухоли на ХТ определяет прогноз заболевания и тактику дальнейшего лечения. В зависимости от количества живых опухолевых клеток определяются 6 степеней гистологического ответа (Grad.n.Salzer- Kuntschik, Wien):
I - полное отсутствие жизнеспособных опухолевых клеток;
II - единичные живые опухолевые клетки или участок с живыми опухолевыми клетками 50% живых опухолевых клеток;
VI - нет ответа на химиотерапию.
Вспомогательные прогностические факторы:
-уровень щелочной фосфатазы (высокий уровень ухудшает прогноз заболевания)
-локализация опухоли (центральная локализация и проксимальная часть бедра - наиболее неблагоприятные локализации).
Распределение больных по группам риска (в зависимости от них определяется степень интенсивности лечения) - (COSS-96).
Группа низкого риска - пациенты с объемом опухоли 70 мл и менее, независимо от степени гистологического ответа опухоли на ХТ (выживаемость в этой группе при адекватном лечении составляет 97%).
Группа высокого риска - с объемом опухоли более 150 мл при 5 и 6 степени гистологического ответа (выживаемость при стандартном лечении составляет 17%).
Стандартный риск - все остальные (выживаемость - 67%)
Каждая группа риска требует определенной терапии- более длительной и интенсивной при высоком риске, и менее интенсивной - в группе низкого риска.
До недавнего времени лечение остеосаркомы ограничивалось операцией (в частности, ампутацией конечности). Но, несмотря на это, выживаемость была крайне низкой - 15%-20%. Значительный прогресс в лечении достигнут в последние два десятилетия в результате развития адъювантной химиотерапии, а также технических средств диагностики.
Важнейшие компоненты лечения остеосаркомы.
1. Предоперационная химиотерапия всегда является первым этапом лечения и дает определенные преимущества:
-улучшение системного тумор-контроля - подавление микрометастазов в легких;
-улучшение контроля первичного очага, что расширяет возможности реконструктивных операций на конечностях;
-возможность объективно оценить гистологический ответ опухоли на химиотерапию, что часто определяет прогноз заболевания и тактику дальнейшего лечения.
В современных программах лечения остеосаркомы используются препараты: высокодозный метотрексат (8-12 г/м2), адрибластин, ифосфамид, препараты платины, (карбоплатин, цисплатин), этопозид.
2. Операция - второй обязательный этап лечения.
Развитие возможностей современной хирургии, а также средств контроля первичного опухолевого очага, позволяют улучшить качество жизни пациентов, применяя органосохраняющие операции. Большое распространение в мире получила имплантация эндопротеза суставов, а также замена резецированного участка кости ауто- и аллотрансплантатом. Однако, проведение органосохраняющих операций не всегда возможно по определенным причинам:
-поражение опухолью сосудисто-нервного пучка;
-патологический перелом (в настоящее время не является абсолютным противопоказанием к сохранению конечности);
-неправильно выбранное место проведения биопсии;
-инфицирование места биопсии;
-слишком молодой возраст больного (так как существует большой резерв роста конечностей); но для верхних конечностей это не имеет значения;
-предшествующие операции с обсеменением мягких тканей;
-большие размеры опухоли со значительным вовлечением в процесс мягких тканей.
Наличие метастазов при современном лечении не является противопоказанием к органосохраняющей операции.
При невозможности органосохраняющей операции производится ампутация с последующим протезированием конечности. Ампутация при современном протезировании оставляет большие возможности для ведения активного образа жизни и даже занятий спортом.
3.Послеоперационная химиотерапия - проводится с учетом гистологического ответа опухоли на химиотерапию (продолжение лечения, либо смена схемы терапии, либо прекращение терапии).
Вопрос проведения лучевой терапии дискутируется в отечественной литературе. Однако в большинстве крупнейших зарубежных клиник этот вопрос решен не в пользу данного метода лечения. В качестве примера приведем 20-летний опыт проведения предоперационной лучевой терапии с последующей операцией в детской клинике St. Jude (Мемфис, США): 84 пациента получали предоперационную ЛТ, 61 - не получали ЛТ. 5-летняя выживаемость (без ХТ) составила менее 20% в обеих группах больных.
В настоящее время развитие метастазов не предопределяет фатальный исход заболевания. Уровень современной торакальной хирургии позволяет удалить большое количество метастазов, проводя субсегментарную резекцию. При этом также используется предоперационная ХТ с определением гистологического ответа опухоли на лечение. В качестве химиопрепаратов 2-й линии используется карбоплатин и этопозид. Применение этих препаратов и радикальное удаление метастазов позволяют добиться 5-летней выживаемости у 55% больных со вторичными легочными метастазами (COSS-96).
При неэффективности стандартной ХТ используется высокодозная ХТ с применением колониестимулирующего фактора и пересадкой периферических стволовых клеток
В настоящее время производятся попытки применения других препаратов, помимо ХТ:
Липосомальный мурамил-трипептид - синтезированный липофильный аналог мурамил-дипептида. Он инкапсулирован на липосомах и имеет избирательную тропность к легочным макрофагам и циркулирующим моноцитам, активируя их и придавая им тумороцидные свойства
Верапамил и циклоспорин А - по данным ряда исследователей, снижают экспрессию Р-гликопротеина в опухоли, тем самым улучшая усваиваемость опухолевыми клетками химиопрепаратов. Отмечен хороший эффект применения этих препаратов вместе с ифосфамидом и этопозидом при распространенных формах остеогенной саркомы.
Читайте также:

