Амитриптилин больному с онкологией
В течение всего периода лечения боли важно применение вспомогательных препаратов для увеличения эффективности противоболевой терапии, лечение сопутствующих симптомов и обеспечение независимой аналгезии специфических типов боли. Эти вспомогательные препараты включают кортикостероиды, антиконвульсанты, антидепрессанты, нейролептики, местные анальгетики, гидроксизин и психостимуляторы.
Кортикостероиды вызывают разнообразные эффекты: поднимают настроение, оказывают противовоспалительное и противорвотное действие, повышают аппетит, иногда эффективны при лечении кахексии и анорексии. Поскольку они уменьшают отек головного и спинного мозга, то их используют в ургентных случаях для снижения повышенного внутричерепного давления и компрессии спинного мозга при эпидуральных метастазах.
Антиконвульсанты применяют для лечения нейропатической боли, особенно режущей или жгучей. С осторожностью эти препараты назначают больным, получающим иммуносупрессивную химиолучевую терапию перед трансплантацией костного мозга. При лечении нейропатической боли антидепрессантам отводится важная роль, т. к. им присущи противоболевые свойства, благодаря чему они потенцируют анальгетические эффекты опиоидов.
Пожалуй, наиболее хорошо изучен амитриптилин, поэтому данный трициклический антидепрессант служит препаратом выбора. Нейролептики, в частности метотримепразин, используют для лечения хронических болевых синдромов. В отличие от опиоидов этот препарат не снижает моторику кишечника и может быть эффективным при лечении запора, вызванного указанными выше препаратами, или при других до независимых побочных эффектах. Он также обладает противорвотным свойством и устраняет тревожность.
Для лечения нейропатической боли применяют местную аналгезию. Побочные эффекты этого метода могут быть более выраженными, чем при использовании других препаратов, применяемых для лечения нейропатической боли. Гидроксизин — это анксиолитический препарат с легким седативным и противоболевым свойствами, применяемый для лечения больных с синдромом тревоги, страдающих от боли. Этот антигистаминный препарат также оказывает противорвотное и противозудное действия.
Психостимуляторы, как было сказано выше, применяют для уменьшения заторможенности, вызванной опиоидами, когда подбор дозы, например ее уменьшение на фоне увеличения частоты приема, не дает ожидаемого эффекта.
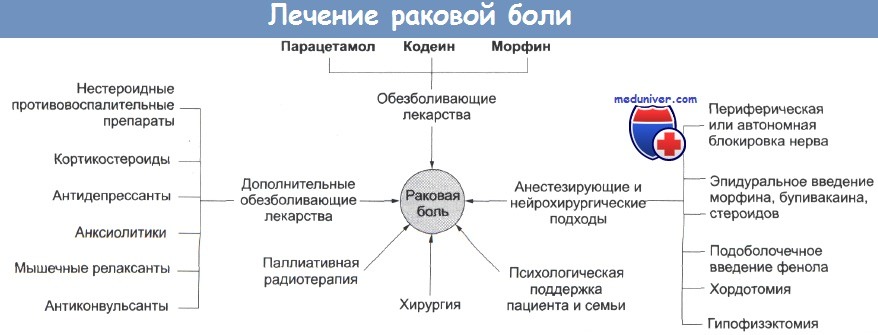
Больных следует настраивать на активное поведение и ухаживать за собой в меру своих сил. На всех этапах лечения наряду с препаратами и другими вмешательствами используют щадящие физические и психосоциальные методы устранения боли, эффективность которых во многом зависит от участия самой больной в обсуждении этой возможности. Общую слабость, дезадаптацию, боль и страдания, связанные с диагнозом злокачественного новообразования и его терапией, можно попытаться устранить с помощью воздействия на кожу теплом или холодом, массажем, давлением и вибрацией.
К сожалению, иногда применение этих методов способствует обострению боли перед последующим ее ослаблением. Амбулаторным больным следует назначать не только лечебную физкультуру, но и массаж. Упражнения полезны для лечения подострой и хронической боли, т. к. укрепляют ослабевшие мышцы, мобилизуют тугоподвижные суставы и помогают восстановить координацию движений, что способствует улучшению самочувствия и состояния сердечно-сосудистой системы. Иногда физиотерапевты советуют увеличить количество упражнений с весовой нагрузкой. Переворачивание больной в постели важно для поддержания правильного положения тела, предупреждения или ослабления боли и профилактики образования пролежней.
Иммобилизация эффективна только для стабилизации переломов или пораженных конечностей и/или суставов. Наконец, иглоукалывание, при котором в кожу вводятся небольшие иглы, может стать эффективной альтернативой общепринятым методам терапии.
Когнитивная поведенческая терапия — важная часть комплексного лечения боли. Она помогает больной преодолеть мучительный симптом с помощью чувства преодоления его и определенных навыков, включающих релаксацию и психотехнику, когнитивное отвлечение и центрирование, элементы психотерапии, методы биологической обратной связи, структурированную поддержку, а также общение с людьми из групп поддержки и советы священнослужителей.
За редким исключением, наиболее распространенные неагрессивные методы лечения боли должны предшествовать более интенсивным или инвазивным паллиативным подходам. Если некоторым больным поведенческая терапия, физиотерапия и медикаментозное лечение не помогают, показано более интенсивное или инвазивное лечение: облучение деструктивных костных метастазов, паллиативные хирургические вмешательства и блокада нервов.
Поскольку злокачественные новообразования вульвы и, реже, РЭ и РЯ выявляют у пожилых больных, при возникновении боли важно провести всестороннее обследование и активное лечение. У пожилых больных велик риск недостаточного обезболивания из-за снижения порога чувствительности боли, ожиданий, что они смогут со временем переносить ее лучше, и ошибочных представлений о целесообразности назначения опиоидов и их эффективности. Пожилым больным, страдающим от боли, необходимо уделить особое внимание при назначении препаратов, т. к. многие хронические сопутствующие заболевания увеличивают риск лекарственного взаимодействия и парадоксального влияния того или иного средства на основное, онкологическое заболевание.
Кроме того, нарушения визуальных, слуховых, двигательных и когнитивных функций можно оценивать с помощью более простой шкалы, но более часто.

- Вернуться в оглавление раздела "Онкология"
Для лечения НБ используют фармакотерапию, нелекарственные методы воздействия, (например чрезкожную электронейростимуляцию (ЧЭНС), иглорефлексотерапию), блокады местными анестетиками, деструктивные воздействия на зону вхождения корешков спинного мозга, в том числе и высокочастотный нейролизис.
Следует сразу оговориться, что у онкологических больных ЧЭНС, иглорефлексотерапия, невральные блокады могут с успехом применяться на ранних стадиях ХБС для усиления действия базовых анальгетиков. Эти меры имеют, как правило, временный эффект и достаточно быстро утрачивают свои анальгетические свойства. Основными методами терапии НБ является комплексная фармакотерапия и только в случае ее безрезультатности следует подключать инвазивные методики. Проводниковые блокады могут применяться разово для снятия прорывов острой боли, но длительное многократное применение этого метода опасно из-за возможной травмы периферических нервов, что само по себе может стать причиной неврологических расстройств.
При длительной терапии возможны побочные эффекты системного применения анестетиков (гипотензия, брадикардия и др.), кроме того, к ним достаточно быстро развивается толерантность.
У онкологических больных нейропатическая боль чаще всего имеет сочетанный характер и возникает, как компонент ноцицептивного (висцерального или соматического) болевого синдрома. Поэтому онкологические больные, как правило, получают наркотические и ненаркотические анальгетики, которые только частично ослабляют проявления нейропатии, поскольку не способны воздействовать на его причины. Таким образом, комплекс противоболевой терапии у этих пациентов в первую очередь должен состоять из средств блокирующих ноцицептивную боль, а при наличии нейропатического компонента в него необходимо включать специальные средства (табл.).
Средства лечения ноцицептивной и нейропатической боли
Одним из специальных средств лечения НБ являются трициклические антидепрессанты. Их механизм действия в плане устранения боли полностью не изучен, но есть сведения об их способности вызывать центральную блокаду захвата моноаминов, периферическую блокаду кальциевых каналов и адренорецепторов. Трициклические антидепрессанты, согласно мировым стандартам, еще недавно считались препаратами первой линии в терапии нейропатической боли. Однако, применение амитриптилина в эффективной для этой цели дозе — 75-100 мг/сут. для онкологических больных мало приемлемо по ряду причин. Амитриптилин подвергается биотрансформации в печени с образованием активных метаболитов, которые выводятся несколько дней почками, тогда как функция паренхиматозных органов у онкологических больных нередко нарушена, что ограничивает применение амитриптилина.
Побочные эффекты препарата связаны с блокадой м-холинорецепторов: сухость во рту, задержка мочеиспускания и кишечной перистальтики, усиленное потоотделение. Эти же симптомы наблюдаются при раковой интоксикации и лечении опиоидамии, они усугубляются при подключении амитриптилина, дополнительно ухудшая качество жизни больного. Кроме того, амитриптилин кардиотоксичен, противопоказан при глаукоме, гиперплазии предстательной железы, пилоростенозе и др. Поэтому применение амитриптилина у онкологических больных, как правило, возможно только в ограниченных дозах (10-50 мг в сутки).
В настоящее время созданы и начали применяться для терапии нейропатической боли новые селективные атидепрессанты не имеющие м-холинергических эффектов. Это селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСиН). Наиболее известные из них — дулоксетин (Симбалта) и венлафаксин (Велафакс, Эффектин). Дулоксетин был первым препаратом, одобренным Управлением по контролю за пищевыми продуктами и лекарственными препаратами США — FDA именно для лечения нейропатических болей, при диабете и как антидепрессант у взрослых. Поскольку дулоксетин достаточно селективен и не блокирует м-холинергические рецепторы, профиль переносимости у него значительно лучше, чем у амитриптилина.
Основными побочными эффектами могут быть головокружение, сонливость, тошнота, рвота, иногда сухость во рту и снижение аппетита. Опыт применения этого лекарственного средства у нас невелик (6 пациентов), но первое впечатление хорошее. Симбалта назначается по 60 мг 1-2 раза в сутки. Для уменьшения проявлений побочных эффектов целесообразно назначение приема препарата перед сном. Собственного опыта применения венлафаксина для терапии НБС пока нет.
Неопиоидный компонент аналгетического эффекта трамадола (блокада обратного захвата норадреналина и серотонина в нервных синапсах) обеспечивает активацию антиноцицептивных систем (серотонинэргической и адренергической) и подавление нейропатической симптоматики. Однако, терапия трамадолом эффективна только при умеренной боли, а при ее усилении следует назначать сильнодействующие опиоиды.
В России имеются основные опиоидные препараты в неинвазивной (безинъекционной) форме введения, для длительной терапии боли. К ним относятся отечественный опиоид просидол в защечных таблетках, морфина сульфат в таблетках продленного действия (МСТ-континус), бупренорфин в виде трансдермальной терапевтической системы Транстек (подъязычные таблетки пока отсутствуют) и фентанил — трасдермальная система Дюрогезик. Их преимущества и недостатки представлены в таблице:
Краткая характеристика имеющихся в России опиоидных анальгетиков в неинвазивных формах для терапии ХБС
Таблетки ретард 100, 150, 200 мг
Капли 100 мг в 1 мл
– Средний анальгетический потенциал и продолжительность действия (6 час).
– Пригоден только для терапии боли умеренной интенсивности.
Таблетки ретард 60, 90, 120 мг
– Пригоден для терапии умеренной боли.
– Неприемлем при дисфагии.
буккальные таблетки – 20 мг
– Предназначен для терапии умеренной боли умеренной.
– Непродолжительный анальгетический эффект (4-6 час).
– Противопоказан при печеночной недостаточности (выделяется преимущественно с желчью).
Сублингвальные таблетки 0,2 мг
– Предел дозы 16 табл./сут.
35, 52.5, 70 мкг/кг
– Не следует применять при гипертермии, гипергидрозе.
– Предел дозы 2 пластыря по 70 мкг/ч.
– Возможен контактный дерматит.
– Длительный подбор эффективной дозы.
10, 30, 60, 100 мг
– Неприемлем при дисфагии
ТТС фентанила Дюрогезик
– Не следует применять при гипертермии, гипергидрозе.
– Возможен контактный дерматит.
– Длительный подбор эффективной дозы.
Местные анестетики, такие как лидокаин в виде пластырей и 5% крема, могут применяются для лечения нейропатической боли. ТТС лидокаина — версатис представляет собой пластины 10×14 см, которые можно апплицировать на неповрежденную кожу в области проекции боли (например, в зоне аллодинии) на 12 часов в сутки, в последующие 12 часов необходим перерыв для восстановления нормального состояния кожи. Одновременно допускается применение не более 3 пластин препарата.
Крем с лидокаином 5% — Эмла может кратковременно применяться только для анестезии кожи или слизистых, так-как при обильном и длительном наложении может привести к неконтролируемому всасыванию лидокаина с последующими побочными эффектами. Недостатком этих препаратов является их кратковременный эффект и возможность применения при локальных болевых расстройствах. Системное введение лидокаина способно временно ослабить симптомы НБС, но при длительном применении может вызывать серьезные побочные эффекты (синусовая брадикардия, поперечная блокада сердца, коллапс, судороги, возбуждение или угнетение ЦНС и др.). Местные анестетики могут быть использованы как временная мера при резком обострении НБС.
Специфическим и антинейропатическим действием обладают антагонисты NMDA рецепторов. Представителем этой группы является кетамин. В России терапия ХБС кетамином даже в онкологической практике крайне ограничена. Кетамин разрешен для применения только в условиях отделений анестезиологии и реанимации. К группе непрямых блокаторов NMDA-рецепторов относится флупиртин — Катадолон. Применение этого препарата, по мнению ряда исследователей, может предотвратить хронизацию боли, и в дальнейшем уменьшить проявления нейропатии. Катадолон назначается первоначально в дозе 200 мг на ночь, с дальнейшим приемом по 100 мг трижды в сутки. При недостаточной эффективности возможно увеличение его суточной дозы до 600 мг.
Препараты из группы антиконвульсантов признаны наиболее патогенетически обоснованным средством лечения НБ. Длительное время основным препаратом для терапии нейропатической боли был антиконвульсант старого поколения — карбамазепин. Механизм его действия связан с угнетением спонтанной эктопической активности поврежденных нервных волокон, посредством блокады вольтаж-зависимых натриевых каналов в периферических нейронах.
Аналогичными свойствами обладают дифенин, вальпроаты. Все эти препараты имеют опасные для онкологического пациента побочные эффекты: высокий риск развития лейкопении и тромбоцитопении, кардио- и гепатотоксичность, интерстициальный нефрит, эндокринные расстройства. Проведение лучевой или химиотерапии на фоне приема этих токсичных для онкологических больных препаратов сопряжено с высоким риском развития вышеперечисленных осложнений.
Среди антиконвульсантов наиболее эффективными, современными препаратами для лечения нейропатической боли являются габапентин (нейронтин, тебантин) и прегабалин (лирика), которые приводятся в качестве препаратов первой линии для терапии нейропатической боли в Европейских рекомендациях по терапии нейропатической боли 2006 г. [Attal N., Cruccu G., Yaanpaa M., et al. EFNS guidelines on pharmacological treatment of neuropathic pain. Eur J Neurol, 2006; 13 (11): 1153-69]. Их преимущества по сравнению с антиконвульсантами предыдущего поколения в более высокой эффективности при меньших побочных эффектах. Эффективность лирики и нейронтина подтверждена международными рандомизированными исследованиями, в том числе при лечении нейропатической боли у онкологических пациентов, принимающих опиаты (морфин).
Нейронтин (габапентин) известен как противоэпилептический препарат с 1993 г., а для терапии НБ в неврологии начал применяться с 1997 г. По своей структуре нейронтин аналогичен гамма-аминомаслянной кислоте (ГАМК или GABA — gamma-aminobutiric acid), тормозному медиатору ЦНС. Действие препарата направлено на разные уровни нейрональной передачи. Нейронтин способствует увеличению синтеза и высвобождения ГАМК, одновременно тормозя синтез и транспорт глутамата, а также подавляет кальциевые потоки, стабилизируя постсинаптическую мембрану. Такое разноплановое воздействие одного препарата на различные звенья механизма формирования нейропатии позволяет отнести его к специальным антинейропатическим средствам. Не подвергается метаболизму в печени, выводится почками. Клиренс габапентина из плазмы снижается у пожилых людей и больных с нарушенной функцией почек. Фармакокинетика не меняется при повторном применении.
Лечение габапентином начинают с 300 мг один раз в сутки на ночь, увеличивая дозу в течение 3 дней до 900 мг/сут., которую назначают в три равных приема. После этого дозу, при необходимости, можно повышать на 300 мг в сутки до максимально рекомендуемой — 1800 мг/сут. (предельно допустимая доза — 3600 мг/сут.). Основные побочные эффекты (сонливость, головокружение, атаксии, тошнота и/или рвота) дозозависимы. При сочетании с высокими дозами опиоидных анальгетиков возможны миоклонии, этих случаях следует снизить дозу антиконвульсанта.
Лирика (прегабалин) является еще более мощным антиконвульсантом последнего поколения, с механизмом действия, аналогичным нейрорнтину (габапентину). Полученные in vivo результаты специальных исследований достоверно показывают, что степень связывания лирики (прегабалина) со специфическим белком на поверхности кальциевых каналов нейронов (α2-дельта субъединицей кальциевого канала) в 10 раз сильнее, чем у нейронтина. Отличительной чертой Лирики является более высокая биодоступность — 90% (у габапентина 60%), с линейными параметрами фармакокинетики, что дает клинически значимое противоболевое действие уже к 3-им суткам от начала терапии. Таким образом, длительность подбора терапевтической дозы лирики в 2-3 раза меньше, чем у нейронтина. Препарат не метаболизируется в организме, при нарушении функции печени коррекции дозы не требуется. Следует учитывать, что плазменный клиренс лирики (прегабалина) снижается при нарушении функции почек и у пациентов старшей возрастной группы.
Препарат зарегистрирован в России в капсулах по 25, 50, 75, 150, 200 и 300 мг. Для терапии нейропатической боли, как правило, используют дозировки 75, 150 и 300 мг. Начинать терапию необходимо с дозы 75 мг дважды в сутки. Через 3 суток дозу следует повысить до 300 мг (по 150 мг 2 раза в сутки), а при необходимости возможно дальнейшее повышение дозы до 600 мг в сутки через 7 дней от начала терапии. Отличительной чертой лирики является его мощное антинейропатическое действие и эффективность у пациентов с длительным анамнезом нейропатической боли (более года) и при безуспешной фармакотерапии другими антиконвульсантами в том числе нейронтином (габапентином).
Наиболее частые побочные эффекты лирики — сонливость, головокружение, атаксия, сухость во рту, как правило, уменьшаются или полностью нивелируются после стабилизации дозы (через 2-7 дней). Эти нежелательные явления регистровались на начальном этапе у 5,6-21,7% больных получавших лирику и только 2,3-3,1% из них отказались от его дальнейшего приема, что говорит о высокой эффективности препарата и слабой степени проявления побочных свойств. Пациентам со сниженной функцией почек препарат назначают из расчета клиренса мочевины по схеме, представленной в инструкции.
Помогите докторам узнать о мигрени больше. Ваше мнение и ощущения очень важны, чтобы мы могли лучше помогать вам справляться с мигренью!
Медицинский блог "Медзаписки" - информация про болезни, их лечение, диагностику, профилактику. Информация для врачей и пациентов.
Страницы
- Главная
- Книги по медицине
- Консультация юриста
- Карта сайта
31 мая 2013 г.
Перечисленные ниже дополительные лекарственные средства могут либо расширять диапазон действия анальгетиков, либо иметь самостоятельное анальгетическое действие.
Трициклические антидепрессанты (амитриптилин, имипрамин) часто используются для лечения нейропатической боли. Они имеют относительные противопоказания у пациентов с ИБС и риском желудочковых аритмий. Амитриптилин оказывает анальгетическое действие, но плохо переносится из-за выраженного холинолитического эффекта.
Антигистаминные препараты (димедрол) помимо основного оказывают аналгезирующее, противорвотное и умеренно успокаивающее действие. Обычная доза 10—20 мг перорально или в/м каждые 4—6 ч (0,5 — 1 мг/кг для детей).
Бензодиазепины (сибазон, диазепам, реланиум) эффективны для лечения внезапной тревоги и мышечных судорог. Они показаны некоторым онкологическим больным, имеющим противопоказания к приему антидепрессантов, а также для лечения терминальной одышки. За исключением боли, связанной с мышечными судорогами, эти средства не являются эффективными анальгетиками, а их успокаивающее действие и способность угнетения дыхания усиливаются при совместном применении с опиоидами. Поэтому у тревожных пациентов с болью подбор дозы опиоида должен предшествовать лечению бен- зодиазепинами.
Кофеин в разовой дозе около 65 мг достаточно успешно усиливает анальгетический эффект НПВС. Оптимальная суточная доза кофеина не установлена, но 65—200 мг/день обычно хорошо переносятся большинством пациентов.
Кортикостероиды оказывают специфическое и неспецифическое действие при лечении хронической онкологической боли. Они могут лизировать некоторые опухоли (например, лимфому) и купировать боль, уменьшая отек в области сдавления опухолью мягких тканей, нервов или спинного мозга. Лечение кортикостероидами (дексаметазон 16 мг/сут или его эквивалент) может быть эффективно при боли, вызванной поражением плечевого или пояснично-крестцового сплетений у онкологических больных при отсутствии эффекта от больших доз опиоидов. У онкологических больных в терминальной стадии болезни кортикостероиды могут повышать настроение и аппетит; побочные эффекты не должны беспокоить врача в этой ситуации. Как известно, длительное использование стероидов вызывает увеличение массы тела, синдром Кушинга, проксимальную миопатию и психозы (редко), повышает риск кровотечения из ЖКТ, особенно при комбинации с НПВС. Синдром отмены кортикостероидов может усиливать боль.
Антиконвулъсанты (карбамазепин, баклофен) могут снимать приступы острой тикоподобной боли при таких периферических неврологических синдромах, как тройничная, постгерпетическая, языкоглоточная невралгии, возникающих на фоне поражения нерва опухолью или специального противоопухолевого лечения. Подобно трициклическим антидепрессантам, при диабетической невропатии и постгерпетической невралгии эффективен габапентин в дозе 2,4—3,6 г/сут.
Агонисты а2-адренорецепторов (клонидин, клофелин) используются при лечении опиоидрезистентной нейропатической боли по 0,075—0,01 мг внутрь 2—3 раза в сутки.
Висфосфонаты (бондронат, памидронат, клодронат) показаны для уменьшения риска патологических переломов при костных метастазах рака молочной и предстательной железы, легких и мие- домной болезни. Включение бисфосфонатов в комплекс методов лечения онкологических больных с костными метастазами приводит к уменьшению активности остеолитического процесса и стабилизации анальгетического эффекта. Бондронат применяется по следующей схеме: 6 мг/сут внутривенно капельно в течение 3-х дней с последующим приемом 50 мг/сут перорально в течение 3 месяцев. Также можно рекомендовать 60—90 мг памидроната каждые 3—4 недели или 1500 мг клодроната (бонефос) каждые две недели.
Николаев А.В., Войцицкий В.Е.
г.Новосибирск, Россия
Резюме: выбор рационального метода болеутоления складывается из множества факторов, которые требуют индивидуального подхода и принятия решения на основании данных тщательного обследования больного, оценки возможной эффективности, противопоказаний, целесообразности и риска планируемого лечения. Нами проведено обезболивание 22 инкурабельных онкологических больных с использованием клофелина, трамала (или морфина) и амитриптилина. Эффект обезболивания достигнут в 87% случаев. Длительность болеутоления 30 – 60 дней. Нам представляется перспективным использование данного способа обезболивания в амбулаторной практике онколога.
Часто у онкологических больных, заболевание являющееся причиной болевого синдрома, не поддается специфическому лечению. Поэтому на первый план выходит симптоматическое лечение болевого синдрома. Это требует использования системных аналгетиков, психологического воздействия, нейрохирургических манипуляций или блокады нервных стволов и пр. Болевой синдром малой или умеренной интенсивности при не продолжительной терапии обычно вполне адекватно устраняется не наркотическими аналгетиками и их комбинацией с адъювантами, в то время как для купирования сильной и нестерпимой боли используются мощные опиаты и опиоиды, способные адекватно ликвидировать болевое ощущение.
К сожалению, болевой синдром, осложняющий онкологическое заболевание, является трудной клинической задачей и его устранение не всегда укладывается в рамки схемы разработанной ВОЗ для терапии больных с болевым синдромом. Врач не знакомый с комплексом проблем у онкологического больного, может быть склонен к тому, чтобы объяснять все жалобы на боль его болезнью. Поскольку онкологическое заболевание в нашем обществе расценивается как заболевание с неизбежным летальным исходом, всегда сопровождающееся сильным и длительным болевым синдромом, неонкологические причины боли часто просматриваются. Поэтому при лечение болевого синдрома необходимо помнить, что боль не обязательно связана со злокачественным процессом. Согласно Foley этиологически болевой синдром у онкологического больного может быть классифицирован на три основные категории:
боль обусловлена непосредственным распространением опухоли;
боль связана с противоопухолевым лечением;
боль не связана с опухолевым процессом или противоопухолевым лечением.
По данным зарубежной и отечественной литературы, в среднем, среди всех онкологических больных, находящихся на стационарном лечение, болевой синдром, связанный с непосредственным распространением опухолевого процесса, регистрируется приблизительно у 75% больных. Около 20% жалоб на боли обусловлены противоопухолевым лечением и около 5% - не связаны с опухолевым процессом (14).
Несмотря на плохой прогноз, связанный с рецидивом злокачественной опухоли или распространенным опухолевым процессом, оценка и максимальная помощь при лечение болевого синдрома очень важны, и комплекс клинических проблем заслуживает разумного подхода с учетом общего физического состояния пациента, психических и моральных ресурсов. В каждом случае выбор наиболее рационального способа лечения может быть произведен только после доказательного изучения следующих параметров:
механизм ее возникновения;
природа и причины заболевания;
физическое и психическое состояние пациентов;
пригодность и практическая доступность различных методов ликвидации болевого синдрома.
Следует подчеркнуть, что ощущение беспомощности или явное отсутствие участия к больному, которое наблюдается у части врачей, быстро и точно ощущается большинством пациентов, и может быть причиной возникновения у больного страха смерти или ощущения безнадежности и отверженности. Способность выслушать больного, обсудить с ним его проблемы, завоевать его доверие и его родственников является показателем квалификации хорошего врача, который лечит больного с болевым синдромом. Попытки лечить боль без учета связанных с нею эмоциональных переживаний приведут к неудаче в ликвидации болевого ощущения, к увлечению наркотиками или вынудят пациента искать более дорогого, оказывающего менее эффективную помощь и даже опасного знахаря (14).
Известно, что 80% пациентов страдающих от раковых болей, получают удовлетворительное обезболивание при использование 3-х ступенчатой схемы, рекомендованной экспертами ВОЗ 20 лет назад. Данная схема проста и может быть назначена врачами общей практики. Однако, 20% пациенов нуждаются в индивидуальном подходе (M. Ortiz, Испания), мультидисциплинарной оценке состояния и применении специальных методик аналгезии. Инвазивные методики широко применяются в клиниках лечения раковой боли. Основными показаниями к их применению являются: неэффективнсть или непереносимость опиоидов, выраженные побочные эффекты при энтеральном и парентеральном использование.
Однако, ведущую роль в терапии болевого синдрома играют опиаты, нестероидные противовоспалительные препараты, адъюванты. Чаще всего используют энтеральный и парентеральный способы введения лекарственных средств, что иногда затруднительно для больного. Ввнутримышечный и внутривенный пути введения требуют вмешательства медицинского персонала, это становится особенно актуально в амбулаторных и домашних условиях, поэтому появляются дополнительные трудности у больного и его окружения. Опасно проводить лечение тяжелых онкологических больных большими дозами наркотических аналгетиков в амбулаторных и домашних условиях. Это может привести к преждевременной смерти больного от нарастающей депрессии ЦНС.
Пытаясь решить проблему обезболивания инкурабельных онкологических больных с опухолями легкого, почек, предстательной железы, поджелудочной железы, вторичных изменениями в костях таза мы применяли трамал и клофелин, амитриптилин. В ситуациях, когда эффект болеутоления не достигался или был менее 4 часов мы использовали сочетание морфина, клофелина, амитриптилина. Препараты принимались внутрь не зависимо от приема пищи. В каждом конкретном случае подбиралась оптимальная доза аналгетика, альфа2 агониста и антидепрессанта. Кратность приема препаратов определялась индивидуально, в среднем 2 – 3 раза в сутки. Следует заметить, что препараты для болеутоления принимали строго в определенное время, несмотря на отсутствие боли, так как замечено, что для профилактики боли требуется меньшие дозы лекарств, чем для ее устранения. В случаях, когда прием пациентами таблетированных форм препарата был затруднителен, препараты вводились парэнтерально. В среднем для каждого пациента доза трамала составляла 400мг/сутки или 30мг морфина, клофелина 300мкг/сутки, амитриптилина – 50мг. При однократном приеме аналгетика и альфа 2 агониста на фоне амитриптилина без болевой период составил 8 ± 0, 5 часа. Длительность периода болеутоления 30 - 60 дней. Обезболивание трамалом и клофелином, морфином и клофелином с амитриптилином было применено у 22 (n=22) инкурабельных онкологических больных в возрасте от 35 до 67 лет. Адекватность болеутоления оценивали используя визуально аналоговую шкалу, проводили контроль гемодинамики (АД, ПУЛЬС, ЧСС), ЧДД. Другие методы контроля обезболивающего действия препаратов не проводились из гуманных целей по причине дополнительной диагностической нагрузки на пациента. Эффективное обезболивание достигалось в 87 % случаев. При невозможности достаточно эффективно устранить болевой синдром энтеральным и парэнтеральным применением аналгетиков и альфа2 агонистов мы использовали пролонгированную эпидуральную анестезию с применением даларгина, клофелина, лидокаина. При низком эффекте болеутоления использовали морфин для длительной эпидуральной анестезии. Сочетание даларгина, клофелина и/или морфина для длительного эпидурального использования позволяет значительно снизить дозу каждого из градиентов, не влияя на период болеутоления и не снижая качество жизни больного. Однако значительно уменьшается проявление нежелательных паранаркотических эффектов. При эпидуральном введение даларгина, клофелина и/или морфина удавалось устранять боль в 100 % случаев при условии индивидуального подбора дозы.
За период наблюдения нами отмечено, что при приеме внутрь трамала и клофелина, морфина и клофелина на фоне амитриптилина возможно довольно эффективное и продолжительное обезболивание у инкурабельных онкологических больных. Сочетание аналгетика и альфа2 агониста позволяет снизить дозу аналгетика и значительно повысить порог болевой чувствительности. Седативный эффект был выражен слабо, особенно после 2–х суток приема препаратов, но имел положительное значение. Пациенты были контактны и оценивали эффект обезболивания как хороший и отличный. Ожидаемой нами резкой и значительной депрессии гемодинамики не наблюдалось. При энтеральном приеме препаратов выявлено не продолжительное (15 – 20 минут) снижение АД на 5 – 7 %. Опасных осложнений для жизни пациента не отмечено.
Наши наблюдения, проведенные на базе Государственного областного онкологического диспансера г.Новосибирска позволили нам сделать вывод о перспективности купирования болевого синдрома различной степени интенсивности при использование аналгетиков, альфа2 агонистов и антидепрессантов ни только при парэнтеральном, но и энтеральном использовании.
На наш взгляд, используя клофелин, трамал или морфин на фоне амитриптилина у онкологических больных, даже в амбулаторных условиях можно устранять болевой синдром различной интенсивности.
На сегодняшний день врач в своей профессиональной деятельности все чаще встречается с необходимостью лечить онкологического больного с болевым синдромом. Несмотря на печальный прогноз заболевания, проблема боли заслуживает тщательного рассмотрения и разработки плана ликвидации болевого синдрома, чтобы предотвратить разрушающее действие боли на физическое, психическое и моральное состояние пациента и как можно дольше сохранить его социальную значимость.
Бредихин А.Ю., Приходько В.В., Долгов А.М. Сравнительная оценка действия опиоидов и бензодиазепинов на психоэмоциональный статус и болевой порог в предоперационном периоде. Актуальные проблемы спинально - эпидуральной анестезии. Екатеринбург, 1996.
Двойрин В.В. Статистика злокачественных новообразований в России, 1990 г. Вестник ОНЦ АМН России, 1992, №4. –с. 3 – 14.
Исакова М.Е., Павлова З.В., Лактионов К.П. Лечение болевого синдрома у онкологических больных М., 1994.
Николаев А.В., Лепешкин Г.П., и др. Купирование хронического болевого синдрома у онкологических больных методом пролонгированной эпидуральной анестезии. Актуальные вопросы онкологии, г. Кемерово, 1997, с. 134 – 135.
Николаев А.В., Полехин А.Е., Кузнецов Д.И., Войцицкий В.Е. Пролонгированное эпидуральное обезболивание даларгином при вторичных изменениях в костях таза у онкологических больных. Актуальные вопросы современной медицины. 8-я научно-практическая конференция врачей, г. Новосибирск, 1998, с. 35.
Николаев А.В., Ровина А.К., Войцицкий В.Е., Пушкарев С.В. Пролонгированная эпидуральная анестезия у онкобольных. Паллиативная медицина и реабилитация № 2 – 3, 1998, г. Москва, - 164.
Николаев А.В., Полехин А.Е., Войцицкий В. Е. Эпидуральное использование даларгина, клофелина и бупивакаина для купирования болей у больных в финальных стадиях онкологического процесса. Паллиативная медицина и реабилитация № 2, 1999, г. Москва, с. – 16.
Николаев А.В., Слепушкин В.Д., Войцицкий В.Е. Пролонгированная эпидуральная аутоаналгезия даларгином у больных в финальных стадиях онкологического процесса. Актуальные вопросы интенсивной терапии, №4, 1999 г., с. 20 – 22., г. Иркутск.
Николаев А.В., Слепушкин В.Д. Отечественный препарат даларгин и его использование в онкологии. Ж. Будьте Здоровы. г.Новосибирск, 2000, с. 14 – 16.
Николаев А.В., Ровина А.К., Войцицкий В.Е., Пушкарев С.В. Пролонгированная эпидуральная анестезия у онкобольных. Паллиативная медицина и реабилитация № 2 – 3, 1998, г. Москва, - 164.
Слепушкин В.Д. Нейропептиды в анестезиологии и реаниматологии. // Анест. и реанимат. – 1997, - № 6. – с. 59 – 61.
Слепушкин В.Д. Использование даларгина в анестезиологии и интенсивной терапии. Вестник интенсивной терапии №1, 1996, - с. 7 – 8.
Трапезников Н.Н., Аксель Е.М., Бармина Н.М. Заболеваемость и смертность от злокачественных новообразований населения России в 1996 г. Русский медицинский журнал, Том 6, № 10, 1998, с. 616 – 620.
Дж. У. Ярбо, Р.С. Борнстейн. Срочная медицинская помощь в онкологии. М-1985.
Читайте также:

