Активность раковых клеток 3
За последние несколько лет рак стал вторым по количеству летальных исходов диагнозом, уступая лишь сердечно-сосудистым заболеваниям. Эта онкологическая болезнь относится к типу патологий, которые поражают органы человека – желудок, кишечник, пищевод, печень, легкие, гортань, молочные железы, репродуктивную и костную систему. Различают 4 стадии ракового заболевания. Врачи определяют степень развития рака по размеру опухоли, области распространения первичного новообразования, наличию поражения лимфатических узлов и процессу метастазирования в организме пациента. Несмотря на уровень развития современной медицины, эта патология нередко достигает третьей стадии, при которой прогноз выживаемости зависит от многих показателей, включая и эмоциональное состояние самого пациента.
Содержание
Причины заболевания
Достоверные причины возникновения раковой опухоли не известны до сих пор. Существуют лишь теории, по которым факторами, влияющими на развитие опухоли, считаются:
- генетическая предрасположенность;
- несбалансированное питание и влияние канцерогенов, находящихся в продуктах питания;
- злоупотребление алкоголем и курением;
- бактериальные и вирусные инфекции в организме;
- влияние научно-технического прогресса на здоровье человека (ядерное топливо, мобильные телефоны, микроволновые печи и т. п.).
Во многих случаях рак доходит до 3 степени из-за несвоевременного диагностирования заболевания и позднего обращения пациентов к врачу.
Симптомы 3 стадии рака
Заболевание начинается с возникновения в организме человека атипичных клеток, которые со временем размножаются и проникают в соседние ткани и органы. Для 3 стадии рака характерно проникновение пораженных клеток в лимфатические узлы. На этом этапе развития заболевания наблюдаются следующие общие характерные симптомы:
- чувство постоянной усталости, слабости, повышенная сонливость;
- ломота в суставах;
- повышенное потоотделение во время сна;
- ухудшение аппетита;
- снижение массы тела;
- повышение температуры;
- головная боль (иногда возможна потеря сознания).
В зависимости от пораженного органа к вышеперечисленным симптомам могут добавиться сложности с мочеиспусканием, расстройство органов ЖКТ, затрудненное глотание, припухлость конечностей и лица, кровянистые выделения, увеличенные в размере и болезненные лимфоузлы. Пациент на этом этапе заболевания не может не заметить значительного ухудшения здоровья, поэтому, как правило, обращается за помощью к врачу. Продолжительность жизни на данной стадии ракового заболевания зависит от степени поражения организма.
Методы лечения
На третьей стадии заболевания происходит быстрое деление и распространение раковых клеток, диагностируется, так называемое, повышенное метастазирование. Процесс лечения достаточно сложный, и возможно появление серьезных осложнений. Для этой стадии используются следующие методы:
- хирургическое вмешательство;
- эндоскопия;
- лучевая терапия;
- химиотерапия;
- гормонотерапия;
- биологическая терапия.
Хирургическое вмешательство. Этот метод наиболее действенный для предотвращения дальнейшего развития рака. Несмотря на запущенную стадию заболевания, многие опухоли все равно являются операбельными. Для третьей стадии рака характерно наличие метастазов, которые невозможно полностью удалить. Поэтому обязательно назначаются в комплексе с проведением операции дополнительные методы лечения, такие как лучевая, химиотерапия и гормонотерапия.

Лучевая терапия. Данный вид эффективен при лечении опухолей, расположенных в глубоких слоях кожи. Это воздействие применяется в совокупности с хирургическим вмешательством и проводится до и после него. С ее помощью предотвращается проникновение раковых клеток в соседние здоровые ткани. Если хирургическое удаление опухоли по каким-либо показаниям невозможно, то с помощью лучевой терапии замедляется рост и размножение пораженных клеток.
Химиотерапия. Этот метод лечения основан на введении в кровь пациента специальных химических препаратов цитостатиков. Они уменьшают рост клеток и оказывают разрушающее воздействие на новообразование. Химиотерапия выступает вспомогательным методом к операционному лечению и проводится до или после него. Однако этот метод лечения агрессивно воздействует на организм, так как разрушает не только раковые, но и здоровые клетки, поэтому между курсами необходимо время отдыха на восстановление организма. Основные отрицательные эффекты химиотерапии: выпадение волос, нарушение сердечного ритма, расстройство пищеварения.
Рак 3 степени различных органов
Имеющиеся симптомы и осложнения от рака 3 стадии ухудшают качество жизни пациентов и снижают ее продолжительность. Существует понятие пятилетней выживаемости, по которому делаются дальнейшие прогнозы по эффективности проводимого лечения и возможности выздоровления пациента. Разберемся подробнее, что такое третья стадия рака и что это значит для разных органов человека.
Рак молочной железы
Для третьей стадии этого заболевания характерно наличие опухоли в самой железе и распространение атипичных клеток в близлежащих подмышечных и окологрудных лимфатических узлах. Как правило, для лечения этого вида рака применяется оперативное вмешательство (мастэктомия) с последующим проведением лучевой терапии. Помимо этого, может назначаться комплекс с химиотерапией, таргетной терапией и гормонотерапией. Эта стадия заболевания делится еще на три подстадии.
Стадия IIIА. Имеет в свою очередь один из трех сценариев течения:
- опухоль до 2 см в диаметре, зараженные клетки проникли не более, чем в 9 лимфатических узлов;
- опухоль имеет размер более 5 см, в лимфоузлах небольшие скопления атипичных клеток;
- опухоль в диаметре больше 5 см и наблюдаются новые очаги болезни в окологрудных и подмышечных лимфоузлах.
Стадия IIIВ. Для нее характерно наличие новообразования любого размера, прорастание его в грудную клетку и близлежащие кожные покровы, распространение не более, чем на девять лимфатических узлов.
Стадия IIIC. Для нее должны соблюдаться следующие условия:
- опухоль имеет любой размер, прорастает в стенки грудной клетки и кожу, при этом образуются язвы;
- новообразование имеет метастазы в подключичных, подмышечных и окологрудных лимфоузлах.
Рак печени
Для этого органа характерно быстрое развитие болезни (за 3-4 месяца новообразование разрастается с первой до четвертой стадии), однако при 3 стадии не наблюдается поражения лимфатических узлов. Различают три подстадии рака печени:
- IIIA (наличие нескольких новообразований, причем одно из них имеет размер более 5 см);
- IIIB (прорастание опухоли в печеночную и воротную вену);
- IIIC (состояние, при котором опухоль уже проросла в соседние органы, кроме желчного пузыря).
Сложность лечения рака печени заключается в отсутствии возможности проведения операции. Это может быть вызвано различными причинами (слишком большой размер опухоли, неудобное расположение новообразования, наличие нескольких очагов, расположенных по всему органу). Поэтому основные методы лечения при онкологии этого органа – химиотерапия, лучевая терапия, радиочастотная аблация (воздействие на опухоль токами высокой частоты), таргетная терапия. Зачастую под воздействием этих методов новообразование в печени уменьшается до операбельного размера.
Колоректальный рак
При третьей стадии рака кишечника опухоль прорастает в сами стенки кишки и распространяется на близлежащие лимфатические узлы. Основные симптомы:
- дискомфорт в брюшной полости;
- метеоризм;
- задержка стула или диарея;
- наличие крови в кале;
- тошнота и рвота;
- отсутствие аппетита и потеря веса.
Для данной стадии выделяют три подстадии:
- IIIA (опухоль находится в мышечном слое кишки и проросла в 1-3 лимфоузла);
- IIIB (новообразование распространилось на соседние органы и проросло на глубину всей толщины стенки кишки, также новообразование есть в соседних 1-3 лимфоузлах;
- IIIC (раковое образование проросло через всю толщину стенки кишечника и распространилось в более, чем четырех лимфоузлах).
Распространенным способом лечения заболевания является операция с удалением части пораженного кишечника и последующее проведение химиотерапии или лучевой терапии для подавления остаточных атипичных клеток. При отсутствии возможности проведения хирургического вмешательства назначается комплексное лечение с чередованием лучевой и химиотерапии.
Рак желудка
При данном расположении опухоли и третьей стадии развития онкологического заболевания процент выживаемости увеличивается за счет проведения химиотерапии и хирургического удаления опухоли. После операции в 15 % случаев восстанавливается нормальная проходимость пищи по пищевому тракту.
Рак легкого
При 3 степени рака легкого наблюдается значительная по размерам опухоль, при этом могут также быть затронуты близлежащие узлы. Новообразование может распространиться и в диафрагму, трахею, перикард, сердце, пищевод, позвоночник. Помимо имеющейся опухоли новые образования могут появиться и в других долях легкого. При приемлемом размере раковой опухоли проводится операция по удалению части пораженного органа или всего легкого. Хирургический метод комбинируется с химиотерапией и лучевой терапией. При неоперабельной форме, когда раковые клетки глубоко проросли в ткани легкого и распространились в лимфоузлах, назначаются только лучевая и химиотерапия.
Рак простаты
Данное заболевание чаще диагностируется у мужчин в возрасте после 60 лет. Для третьей стадии характерно наличие новообразования в предстательной железе и распространенные патологические клетки в близлежащих тканях и органах, в частности в мочевом пузыре, кишечнике и семенных пузырьках. Из-за пожилого возраста операция бывает противопоказана, поэтому лечение назначается в зависимости от скорости развития под постоянным наблюдением врача. В более, чем 80 % случаев онкологическая патология простаты излечима.
Рак матки
При поражении этим заболеванием только шейки прогноз более благоприятный и пятилетняя выживаемость пациенток имеет показатель до 35 %. При раковом заболевании тканей самой матки процесс развития болезни стремительный, и атипичные клетки проникают в органы малого таза, поражая их и образуя свищи. При третьей стадии заболевания матки эффективен комбинированный способ лечения, при котором проводится лучевая терапия и операционное вмешательство.

Прогноз выживаемости
Эффективные результаты лечения и прогноз, сколько осталось жить пациенту, в первую очередь зависят от расположения опухоли и степени метастазирования. Полноценное выздоровление наблюдается лишь у одной трети пациентов даже при применении комплексного лечения. В зависимости от места локализации опухоли третьей стадии пятилетняя выживаемость пациентов имеет разные прогнозы для:
- легкого – 12–25 %;
- молочной железы – 50–70 %;
- печени – 11–15 %;
- поджелудочной железы – 18–20 %;
- желудка – 15–35 %;
- матки – 6–15 %;
- колоректального рака – 35-90 %.
У некоторой части пациентов наблюдается полная ремиссия. Если же онкологическое заболевание не удается лечить, то с помощью различных методов можно избавиться от неприятных и болезненных симптомов и продлить жизнь пациента.
Рекомендации
Результат лечения во многом зависит не только от метода выбранного лечения, но и от настроя самого пациента на выздоровление. Продлить жизнь поможет соблюдение следующих правил:
- постоянное посещение онколога;
- укрепление иммунной системы;
- соблюдение здорового образа жизни;
- своевременное лечение всех сопутствующих заболеваний.
Заключительная часть пересказа эссе Брайана Нго о возможной роли витамина C в борьбе со злокачественными опухолями. Сам Брайан подчеркивает, что это высокие дозы витамина С не следует рассматривать как универсальный метод лечения рака, но тем не менее это явление может быть интересно для дальнейшего изучения. Оригинальная статья была опубликована в журнале Nature Reviews Cancer как идея о перспективных направлениях.

Таргетинг эпигенетических регуляторов
Эпигенетическое репрограммирование при раке включает гиперметилирование ДНК, которое часто происходит в промоторных областях островков CpG и, как известно, подавляет супрессоры опухолей.
В большинстве случаев гиперметилирование ДНК при раке можно объяснить повышенной активностью ДНК-метилтрансфераз и потерей активности транслокационных белков (TET, ten-eleven translocation proteins). Транслокационные белки (TET1, TET2 и TET3) деметилируют ДНК и принадлежат к семейству ферментов αКГ-зависимых диоксигеназ.
Используя кислород и αКГ, они катализируют реакции окисления, сначала превращая 5-метилцитозин в 5-гидроксиметилцитозин (Часть 2, рисунок 2). TET2 часто мутирует или соматически утрачивается при миелоидных и лимфоидных злокачественных новообразованиях.
Интересно, что мутации TET2 взаимоисключают мутации, усиливающие активность изоцитратдегидрогеназы 1 (ИЦДГ1) и ИЦДГ2 при миелолейкозе. ИЦДГ1 и ИЦДГ2 превращают изоцитрат в αКГ в цитозоле и митохондриях соответственно.
Но мутация в ИЦДГ1 и/или ИЦДГ2 вызывает изменение ферментативной активности и накопление 2-гидроксиглутарата, который ингибирует функцию αКГ-зависимых ферментов, таких как TET2, что приводит к потере 5-гидроксиметилцитозина, метилированию ДНК и изменению экспрессии генов, которые способствуют развитию рака.
Витамин С как кофактор может активировать транслокационные белки TET. Молекула аскорбиновой кислоты может отдать электрон Fe3+ для синтеза Fe2+, который в свою очередь необходим для активности ТЕТ (Часть 2, рисунок 2). Большая часть мутаций TET2 при остром миелолейкозе — это гетерозиготные мутации, и каждая изоформа TET функционально избыточна. Применение аскорбата может усиливать активность остаточных белков ТЕТ и таким образом предотвращать метилирование ДНК.
Например, ежедневная внутрибрюшинная инъекция высоких доз аскорбиновой кислоты (4г/кг-1) в индуцированной делецией TET2 модели лейкемии на мышах способствовала восстановлению TET2 путем деметилирования ДНК и экспрессии генов, необходимых для дифференцировки миелоидных клеток.
Кроме того, аскорбат in vitro способствовал деметилированию ДНК в генах-усилителях и промоторах генов, связанных с миелоидной дифференцировкой, а также экспрессии нескольких ключевых гемопоэтических генов в клетках мышиного костного мозга, экспрессирующих мутантный ИЦДГ1. При определенных типах лимфом, где TET часто мутируют, лечение аскорбатом in vitro повышает активность TET, приводя к деметилированию ДНК, повышенной экспрессии генов-супрессоров опухоли и повышенной чувствительности к химиотерапевтическим препаратам.
Следует отметить, что во всех исследованиях было исключено влияние окислительного стресса в ответ на высокие дозы аскорбата путем добавления каталазы (которая превращает H2O2 в воду) в культуральную среду, мониторинга изменений клеточных уровней АФК и/или использования 2-фосфат l-аскорбиновой кислоты — стабильного производного витамина С, которое не окисляется в условиях эксперимента.
Также лечение мышей аскорбатом способствовало повышению уровня 5-гидроксиметилцитозина в клетках меланомы и рака мочевого пузыря. Предполагается, что лечение аскорбатом также может быть эффективным при солидном раке с низким уровнем 5-гидроксиметилцитозина.
Еще одно исследование также предполагает, что пероральный прием аскорбата может играть профилактическую роль в развитии лейкоза. Используя несколько различных генно-инженерных моделей мышей, включая мышей Gulo -/-, в организме которых не синтезируется витамин C, и TET2 -/-, было показано, что дефицит аскорбата нарушает регуляцию функции ГСК (гемопоэтические стволовые клетки), что ведет к возникновению лейкоза.
Таргетинг HIF1 сигналинга
Опухоли могут сдавливать окружающие кровеносные сосуды. Чтобы приспособиться к гипоксии, опухолевые клетки активируют фактор транскрипции HIF1 (hypoxia-inducible factor 1 — индуцируемый гипоксией фактор 1), что приводит к активации широкого спектра генов. HIF1, важная мишень в терапии рака, представляет собой гетеродимерный транскрипционный фактор, состоящий из двух субъединиц: O2-регулируемого HIF1α и конститутивно экспрессированного HIF1β.
Ключевой механизм, посредством которого O2 регулирует активность HIF1α, заключается в использовании белков пролин-гидроксилазного домена (PHD1, PHD2 и PHD3) и аспарагин-гидроксилазы (фактор, ингибирующий HIF (FIH)), известных под общим названием HIF-гидроксилазы. В нормоксических условиях PHDs гидроксилируют пролиновые остатки на HIF1α. Пролилгидроксилированный HIF1α затем связывается с белком-супрессором опухолей VHL (von Hippel-Lindau gene — ген болезни Гиппеля-Линдау), который рекрутирует лигазу E3-убиквитин, нацеленную на HIF1α для протеасомной деградации (рисунок 3). С другой стороны, FIHs гидроксилируют остаток аспарагина на HIF1α, который блокирует ассоциацию HIF1α с коактиватором белка p300, что приводит к ингибированию транскрипционной активности HIF1 (рисунок 3). Подобно TET, обе HIF-гидроксилазы принадлежат к Fe2+-содержащим αKГ-зависимым диоксигеназам, которые используют O2 и αKГ в качестве субстратов. Из-за их относительно более низкой аффинности к O2 (константа Михаэлиса (Km) = 230–250 мкМ) по сравнению с другими, αKГ-зависимые диоксигеназы s76 в гипоксических условиях PHD и FIH неактивны, что приводит к стабилизации и активации HIF1.
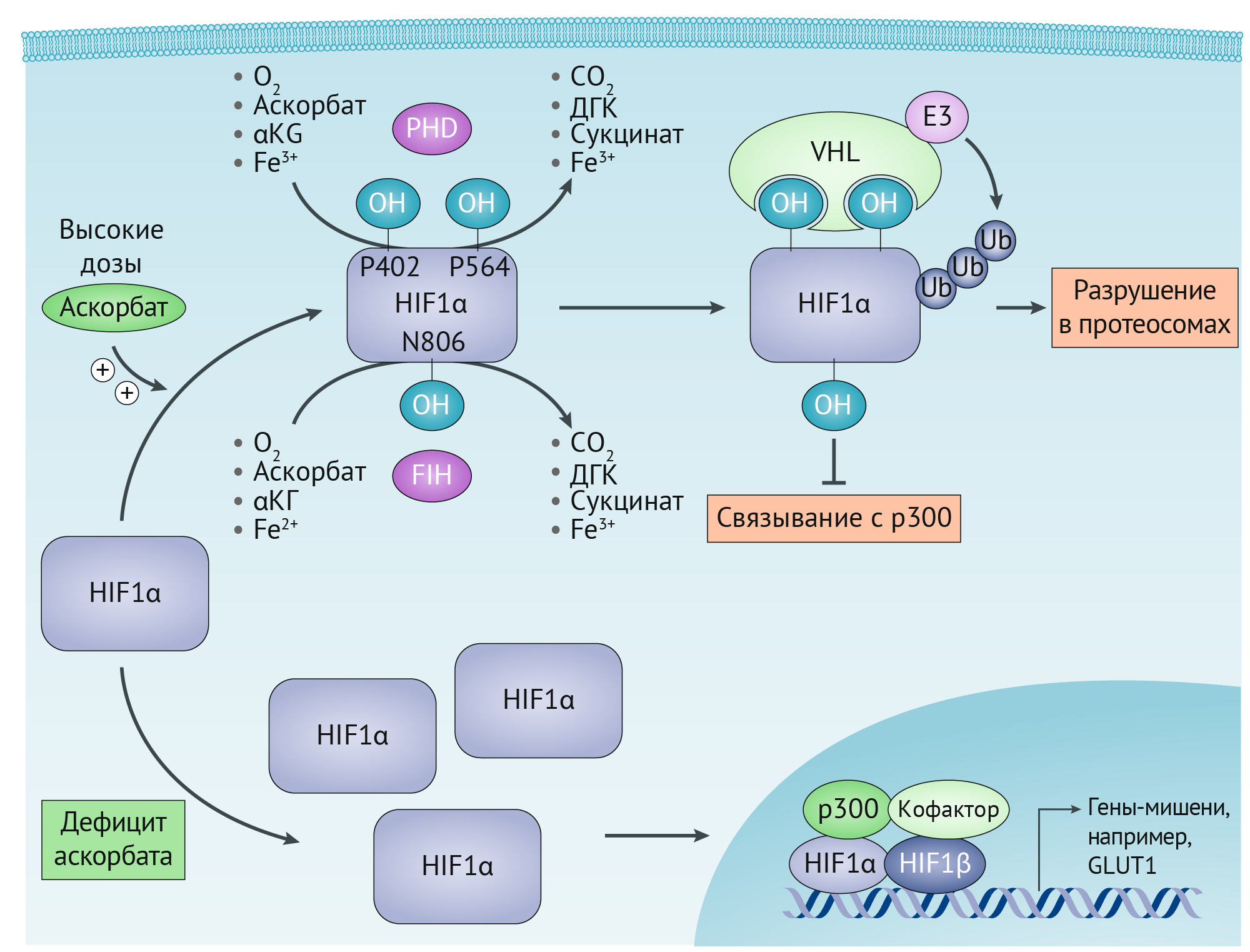
Рис 3 | Аскорбат и регуляция HIF1α
Подобно ТEТ, HIF гидроксилазы нуждаются в аскорбате в качестве кофактора для рециркуляции Fe2+. Следовательно, клетки с дефицитом аскорбата могут иметь повышенную функцию HIF1α, что потенциально способствует прогрессированию опухоли. Это подразумевает, что применение аскорбата может повышать активность HIF-гидроксилазы, таким образом ингибируя активность HIF1α и подавляя рост опухоли.
Уровень аскорбата обратно пропорционален уровню экспрессии HIF1α при поражениях щитовидной железы, и исследование in vitro показало, что лечение аскорбатом индуцировало дозозависимое снижение экспрессии HIF1α и ГЛЮТ1 в раковых клетках щитовидной железы.
В исследованиях на мышах Gulo -/- карцинома легкого, имплантированная мышам Gulo -/-, росла медленно, когда мышей лечили высокими дозами аскорбата в питьевой воде (3,3 г на литр) или ежедневными внутрибрюшинными инъекциями (1 г/кг—1), по сравнению с мышами Gulo -/-, получавшими низкую дозу аскорбата в питьевой воде (0,33 г на литр). Опухоли, подвергшиеся воздействию высоких доз аскорбата, также имели пониженные уровни экспрессии HIF1α, VEGF (vascular endothelial growth factor — фактор роста эндотелия сосудов, ФРЭС) и пониженную плотность микрососудов.
Кроме того, ретроспективные исследования на людях также подтверждают связь между витамином С, активностью HIF1 и онкогенезом. С использованием образцов опухолей пациентов и контрольных образцов рака эндометрия, почечно-клеточного и колоректального рака (КРР) было продемонстрировано, что опухоли с дефицитом аскорбата обладали наибольшей активностью HIF1.
Также было показано, что пациенты с КРР с высоким уровнем аскорбата в клетках опухоли демонстрировали лучшую выживаемость и более благоприятный исход заболевания.
Пока все исследования свидетельствуют о корреляции, но не о причинно-следственной связи. Стабилизация HIF1α даже в нормоксических условиях может происходить, например, при почечно-клеточном раке, где делеция опухолевого супрессора VHL предотвращает деградацию HIF1α при нормоксии. Клетки почечно-клеточного рака с дефицитом VHL погибают при воздействии витамина С в условиях нормоксии.
Более высокие уровни ГЛЮТ1 в нормоксических VHL-дефицитных клетках, чем в клетках с нормальным уровнем VHL, способствовали увеличению поглощения ДГК (дегидроаскорбиновая кислота), полученного из аскорбата, что приводило к увеличению количества АФК и гибели клеток.
В дополнение к мутациям VHL стабильность и активность HIF1α также могут быть повышены путем мутаций двух ферментов-супрессоров опухолей в цикле трикарбоновых кислот: сукцинатдегидрогеназы (СДГ) и фумаратдегидрогеназы (фумарат ДГ). Мутации, приводящие к потере функции СДГ и фумарат ДГ, способствуют накоплению сукцината и фумарата соответственно. Повышенные уровни сукцината и фумарата могут ингибировать активность HIF-гидроксилазы, и таким образом индуцировать нормоксическую активность HIF1α in vitro.
Витамин С как средство против рака
Высокие дозы витамина С не следует рассматривать как универсальный метод лечения рака.
Способ введения витамина С может влиять на его максимальную концентрацию в плазме у пациентов. В настоящее время считается, что миллимолярная концентрация аскорбата, необходимая для индукции цитотоксичности в раковых клетках, может быть достигнута только при внутривенном введении. Например, клиническое исследование I фазы показало, что концентрации аскорбата могут достигать 25–30 мМ при внутривенной инфузии 100 г витамина С. В этом исследовании концентрации в плазме около 10 мМ поддерживались в течение 4 часов, что, на основании доклинических исследований, достаточно для замедления роста раковых клеток. Исследования показали, что внутривенное введение высоких доз аскорбата хорошо переносится пациентами, улучшает качество их жизни и демонстрирует синергетический терапевтический эффект с лучевой и стандартной химиотерапией, а также снижает побочные эффекты последних.
Но многие из этих исследований не были предназначены для крупномасштабных РКИ — эффективность терапии высокими дозами аскорбата еще предстоит определить. Определено три различных механизма, с помощью которых высокие дозы аскорбата могут ингибировать рост опухолей, возможно, эти механизмы могут не работать изолированно друг от друга. Например, субпопуляции мутантных клеток колоректального рака KRAS или BRAF, которые не были полностью уничтожены с помощью прооксидантного механизма in vivo (возможно, из-за их удаленности от кровеносных сосудов, плохой перфузии или устойчивости к АФК) все еще могут подвергаться воздействию аскорбатной терапии посредством ингибирования передачи сигналов HIF1 и/или активации ферментов TET.
На основании текущих доклинических исследований аскорбат может быть более эффективным у онкологических пациентов с мутациями в KRAS, BRAF, TET2, ИЦДГ1 и/или ИЦДГ2, VHL, SH или FDH.
Комбинированная терапия
Клинический потенциал аскорбата в качестве противоопухолевой терапии может заключаться в использовании совместно с другими видами лечения рака.
Например, недавнее исследование показало, что витамин С усиливает действие ингибитора ДНК-метилтрансферазы 5-аза-CdR (децитабина), способствуя деметилированию эндогенных ретровирусов человека и усиливая экспрессию интерферон-стимулируемых генов, приводящих к гибели раковых клеток.
Выдвигаются предложения использовать высокие дозы витамина С, который, как известно, улучшает функцию иммунных клеток (отвечающих как за врожденный, так и за приобретенный иммунитет). Опухоли существуют в сложной иммунной среде, которая включает нейтрофилы, макрофаги и лимфоциты. Хотя мало что известно о том, как аскорбат используется различными клетками, составляющими микроокружение опухоли, исследования показали, что фагоциты и лимфоциты имеют концентрации аскорбата в 10–100 раз выше, чем в плазме. Более того, появляются новые сведения о влиянии аскорбата на воспалительный ответ и функцию иммунных клеток. Возможно, аскорбат даст синергетический эффект в сочетании с современной иммунотерапией.
Заключение
Недавние открытия разнообразных биологических функций аскорбата и их значение в терапии рака породили интересные и многообещающие гипотезы относительно использования аскорбата в лечении рака. Чтобы полностью выяснить биологические функции аскорбата и его отношение к развитию опухолей, исследователи должны будут использовать модели in vivo. Значительное количество исследований на людях последовательно показывает, что лечение аскорбатом улучшает качество жизни пациентов с раком, а в комбинированной терапии аскорбат защищает здоровые ткани от токсических эффектов, вызванных химиотерапией.
Текущие результаты доклинических и ранних клинических испытаний I/II фазы позволяют предположить, что утверждения Линуса Полинга относительно терапевтического потенциала витамина С при раке могут быть не такими уж возмутительными
- Чем раковые клетки отличаются от нормальных?
- Каковы причины появления раковых клеток?
- Какие бывают типы генов рака?
- Основные характеристики и строение раковых клеток
- Как выглядят раковые клетки под микроскопом?
- Как развиваются раковые клетки, какие этапы проходят в своем развитии?
- Ликвидация раковых клеток: что помогает их уничтожить?

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).

Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.
Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадьювантной терапией.
Другие методы лечения:
В Европейской клинике применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
Читайте также:

