Аденоматоидная опухоль что это
Аденоматоидная опухоль (мезотелиома). Аденоматоидная опухоль придатка яичка имеет вид небольших пузырьков или плоских бляшек серо-белого цвета При микроскопическом исследовании характерны эпителиоподобные клетки в фиброзной строме и пучки гладких мышц. Количество тех или иных элементов определяет очень вариабельную гистологическую картину. Эпителиоподобные клетки кубической или уплощенной формы образуют тяжи, трубки или полости с сосочковымн выростами в фиброзной строме, иногда становятся похожими на эндотелий, что придает им сходство с сосудистой опухолью. В ангиоматоидных участках преобладают клетки веретенообразной формы. Иногда такие клетки образуют переплетающиеся между собой тяжи, тогда сходство с эпителием утрачивается. В участках разрастания гладких мышц опухоль похожа на лейомиому. Присутствие в опухоли гладких мышц трактуется по-разному одни авторы считают их предшествующими, другие относят к опухолевым компонентам.
В фиброзной строме встречаются то более, то менее выраженная лимфоид-ная инфильтрация, очаги некроза. Опухоли обычно четко отграничены, но олнсано и распространение их на ткань яичка. Течение доброкачественное Происхождение опухолей не установлено, возможна их мезотелиальная природа. Различие во взглядах на происхождение этих опухолей породило большое количество синонимов аденофиброма, аденоматондная мезотелиома, аденоматоидная лейомиома, лимфангиома и т д.
Аденоматондная опухоль маточных труб может располагаться как в трубе, так и в области дна матки. Обычно достигает 1—2 см в диаметре. Иногда бывает в виде множественных узелков. Микроскопически состоит из многочисленных мелких трубочек, выстланных уплощенным или низким кубическим эпителием. Содержимое трубочек дает положительную ШИК-реакцию; в его состав входят некоторые гликозоамнноглнкаиы. Строма скудная. Опухоль часто нарушает мышечный слой и складки слизистой оболочки, но никогда не приводит к некрозу их и не дает метастазов. В трубах встречаются участки аденомиоза (аденометриоза).
Миксома (врожденная миксома, фибром иксом а, эмбриональная фиброма) — редко встречающееся округлое эластичное образование до 10—12 см в диаметре, иногда представленное несколькими рядом лежащими или слившимися узлами. На разрезе узлы полупрозрачные, слизистые, часто с множественными кистами. Отграничение узлов от окружающих тканей ие всегда четкое. Миксомы наблюдают в любом возрасте, без различия пола. По данным одних авторов, они чаще локализуются в межмышечиой клетчатке, в области фасций и апоневрозов, главным образом на конечностях. Другие авторы указывают на область пупка, стенку мочевого пузыря, нервные стволы. По-видимому, различие объясняется недостаточно четкой верификацией опухолей, расцененных как миксомы.
В 1948 г. А.Р. Stout определил миксому как доброкачественную мезенхимальную опухоль, состоящую из редких, свободно расположенных звездчатых и веретенообразных клеток в очень рыхлой миксоматозиой строме с ретикулиновыми и коллагеиовыми волокнами. В противоположность миксоидной липосаркоме миксома имеет бедную сосудистую сеть. Основное вещество богато мукополисахарндами, чувствительными к обработке гиалуронидазой. Иногда строма может быть более плотной вследствие вторичного фиброза, но большинство клеток при этом сохраняет свой звездчатый вид, что помогает отличать истинную миксому от других опухолей с мнксоматозными изменениями.
Миксомы обладают прогрессирующим ростом, что отличает их от локализованной микседемы. Отсутствие кистозных полостей отличает миксому от ганглиона (синовиальной кисты). Они редко бывают очень крупных размеров, могут обнаруживаться всюду, но наиболее часто располагаются внутримышечно.
Очень часто миксому смешивают с другими опухолями с мнксоматозными изменениями нейрофибромами, липосаркомами, рабдомиосаркомами, мезенхимомами или фиброзными опухолями.
В то же время иногда можно наблюдать множественное поражение, кто рое часто ассоциируется с фиброзной дисплазией костей. Эти случаи необходимо дифференцировать от нейрофиброматоза с миксоматозными изменениями.
Гистогенез миксомы связывают со слизеобразующей тканью, рассматриваемой как результат превращения мезенхимы, предшествующий ее дифференцировке в различные виды соединительной ткани. В дефинитивном состоя нии слизистая ткань, согласно этим представлениям, существует в вартоно вом студне. Остатки же этой ткани в пост эмбриональном периоде в виде хористий могут быть во всех органах мезенхимного происхождения. Эти остатки якобы и дают начало миксоме. Из классических описаний чиксочы очевидно, что основой ее выделения как особой опухоли являлось наличие слизеподобной основной субстанции, что и придает опухоли своеобразный внешний вид и микроскопическую структуру. Уже Р Вирхов выделял истинные и ложные миксомы, считая, что первые возникают из слизеобразующей ткани, а вторые представляют собой различные соединительные опухоли (фибромы, липомы и др.), подвергшиеся слизистой дегенерации. В дальнейшем эти представления были детализированы и уточнены. Из группы миксом постепенно выделялись процессы, которые причислялись к ним по чисто формальным признакам. Так, был выделен ряд иеопухолевых процессов (гангли он. слизистые полипы носа, гак называемые миксомы эндокарда и др ) и многие опухоли, как оказалось, гистогенетически связанные с другими производными мезенхимы: миксоидная липосаркома, эмбриональная липома, эмбриональная рабдомиосаркома и некоторые другие. Таким образом, круг опухолей, включаемых в представление о миксомах, постепенно суживался.
В последние годы получены данные, которые заставили внять под сомнение само существование миксомы как особой гистогенетической категории опухолей. В настоящее время гистогенез этой опухоли остается дискутабельным D. H. McKenzie (1970) относит миксому не к бластомам, а к реактивным воспалительным процессам неясного генеза, близким к фасциитам и к локализованной микседеме, представляющей собой узловатое слизистое образование, возникающее иногда в мягких тканях после лечения гипертиреоза.
Еще Borst (1902) сомневался в правомерности выделения слизистой ткани, которая тогда рассматривалась как результат развития мезенхимы, предшествующего ее дифференцировке. За последние годы установлено, что мезенхима на стадии слизистой ткани уже имеет все признаки последующей конечной диффереицировкн в фиброзную, жировую, хрящевую и другие ткани. Вартонов студень представляет собой своеобразную разновидность соединительной ткани, возникающей из внеэмбриобластнческой мезенхимы амннотической ножки. Эти данные свидетельствуют о том, что представление о мнксоме как гистогенетически особой опухоли в теоретическом плане лишено оснований.
Эпителиальные опухоли овариального типа. Tumours of ovarian epithelial type
В яичке и паратестикулярных тканях могут возникать опухоли, напоминающие поверхностные опухоли яичника.
Теории их гистогенеза достаточно противоречивы.
Источниками формирования паратестикулярных опухолей могут быть мюллерова метаплазия влагалищной оболочки яичка, мюллеровы остатки в паратестикулярных тканях, аппендикс яичка.
Тестикулярные опухоли могут формироваться из мезотелиальных включений или монодермальных тератом. Обычно в процесс вовлечены придаток яичка или само яичко. Номенклатура и критерии идентичны овариальным опухолям.
Полный спектр гистологических типов:
• серозная;
• муцинозная;
• эндометриоидная;
• светлоклеточная;
• переходноклеточная.
В яичке могут быть серозные или муцинозные пограничные опухоли, например муцинозная цистаденома, доброкачественная или злокачественная опухоль Бреннера, серозная карцинома, эндометриоидная аденокарцинома. Макроскопическое и микроскопическое строение этих опухолей такое же, как в яичнике.
Опухоли и опухолеподобные поражения сети яичка
Аденокарцинома сети яичка встречается очень редко. Макроскопически опухоль представлена белыми или желтыми очагами с нечеткими границами в области ворот яичка, вовлекающими паратестикулярные структуры. Могут быть кистозные изменения.
Микроскопически опухоль состоит из папиллярного, солидного и железистого компонентов. Часто бывает внутрипротоковый компонент. заполняющий просвет канальцев. Можно проследить разные стадии дисплазии эпителия до карциномы in situ и инвазивного рака.
Опухолевые клетки с круглыми или овальными ядрами, скудной цитоплазмой могут формировать сосочки. Опухоль экспрессирует цитокератины, эпителиальный мембранный антиген (ЕМА), реже — раково эмбриональный антиген (СЕА). Meтастазирует чаще лимфогенно. Дифференциальная диагностика проводится с опухолью из яичникового эпителия низкой степени злокачественности, мезотелиомой, раком простаты.
Диагностические критерии карциномы сети яичка:
• отсутствие гистологически сходной опухоли вне мошонки;
• локализация опухоли в воротах яичка;
• морфологическое строение не соответствует ни одному другому типу тестикулярной или паратестикулярной опухоли;
• иммуногистохимический (ИГХ)-профиль исключает мезотелиому или серозную аденокарциному.
Встречается крайне редко, описаны единичные случаи. Обычно аденоматоидная гиперплазия бывает вторичной, нередко сочетается с тестикулярной атрофией (включая крипторхизм), хронической печеночной недостаточностью, двусторонней почечной дисплазией.
Макроскопически представлена солидным и/или кистозным образованием. При микроскопии выявляются тубулопапиллярные пролифераты мономорфных клеток, раздвигающие сеть яичка.
Синоним: доброкачественная непапиллярная мезотелиома.
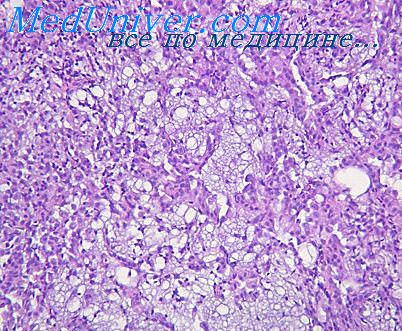
В подавляющем большинстве случаев опухоль паратестикулярная, однако может быть и в ткани яичка. Выделяют сосудистый, перстневидноклеточный, лейдигомоподобный варианты. Большинство опухолей представлено железистоподобными структурами с выстилкой из однорядного уплощенного или кубического эпителия, напоминающего эндотелий сосудов (рис. 4.40-4.42).

Рис. 4.40. Аденоматоидиая опухоль. Железистоподобные структуры с выстилкой из уплощенного эпителия. Окраска гематоксилином и эозином. х200

Рис. 4.41. Аденоматоидиая опухоль. Тубулярные структуры с выстилкой из уплощенного эпителия. Окраска гематоксилином и эозином. х100

Рис. 4.42. Аденоматоидмая опухоль. Железистоподобные структуры с выстилкой из уплощенного эпителия. Окраска гематоксилином и эозином. х100
В ряде случаев могут выявляться хорошо сформированные сосочки. Иногда структуры опухоли расположены в строме между канальцами и могут ошибочно быть приняты за инвазивный рост. Перстневидноклеточный вариант может имитировать метастаз рака из желудочно-кишечного тракта (ЖКТ).
Иммуногистохимические исследования
В последние годы появляются новые данные об ИГХ-диагностике опухолей яичка. Наиболее полная панель антител для ИГХ-исследования включает в себя следующие маркеры: плацентарная щелочная фосфатаза (PLAP), CD30, D2-40, CD117, общий цитокератин (Раn-СК), глипкан-3 (GPC3), NANOG, ОСТ-3/4, LIN-28, SOX-2.
Наиболее характерным маркером этих опухолей представляется PLAP — фермент, локализующийся в цитоплазме клеток и экспрессирующийся, начиная с закладки герминативных клеток (рис 4.43). Однако следует заметить, что слабую экспрессию PLAP иногда наблюдают и в негерминогенных опухолях.

Рис. 4.43. Типичная семинома. Выраженная экспрессия PLAP о опухолевых клетках Иммуногистохимическое исследование с антителами к PLAP. х200
Маркер D2-40 представляет собой высоко гликосиалинизированный мономерный сиалогликопротеид, используется как маркер мезотелиальных клеток. Он характерен для 95% семином, но экспрессируется и в эмбриональных карциномах, что не позволяет использовать его для дифференциальной диагностики этих герминогенных опухолей.
CD117 — протоонкоген, играющий важную роль в гемопоэзе, сперматогенезе и меланогенезе. Различные опухоли часто имеют низкий уровень экспрессии этого белка. Сильное мембранное окрашивание отмечается в гастроинтестинальных стромальных опухолях, семиномах (рис. 4.44) и хроническом миелолейкозе, что связано с мутациями в гене KIT. Положительными по экспрессии CD117 бывают практически 100% семином, а в смешанных опухолях он окрашивает компонент семиномы.

Рис. 4.44. Типичная семинома. Выраженная мембранная экспрессия CD117 в опухолевых клетках. Иммуногистохимичеекое исследование с антителами к CD117. х400
Однако при проведении дифференциальной диагностики необходимо учитывать, что только 40% случаев слерматоцитарной семиномы, встречающейся в яичках у пожилых мужчин, положительны по реакции с антителами к CD117. Эти опухоли также отрицательны и по реакциям с другими маркерами герминативных клеток PLAP, Pan-CK, CD30.
Важным маркером считается CD30 — активационный антиген лимфоцитов и макрофагов, экспрессия которого характерна и для эмбрионального рака. Этот антиген локализуется на мембране клеток и в цитоплазме в зоне комплекса Гольджи. Экспрессия CD30 наблюдается в эмбриональном раке и лишь в 3% семином.
Глипкан-3 (GPC3) — белок семейства гепарансульфат протеогликанов, играющий важную роль в клеточном росте, дифференцировке и миграции, он экспрессируется в печеночноклеточной карциноме, опухоли желточного мешка (100%), хориокарциноме (100%), а в семиноме и эмбриональной карциноме экспрессия этого белка отсутствует.
Высокоспецифичными маркерами герминогенных опухолей яичка служат транскрипционные факторы эмбриональных стволовых клеток, такие как NANOG, ОСТ-3/4, LIN-28, SOX-2, локализованные в ядрах клеток. Эти транскрипционные факторы появляются на ранних этапах эмбрионального развития в стволовых и герминативных клетках. У взрослых мРНК фактора транскрипции ОСТ-4 экспрессируется в премордиальных герминативных клетках яичников и яичек.
В первичных семиномах и метастазах семиномы и эмбрионального рака эти маркеры положительны в 100% случаев. ОСТ-4 считается лучшим маркером семиномы и эмбрионального рака по сравнению с более широко применяемыми CD117, PLAP, Pan-CK. Высоко консервативный транскрипционный фактор SOX-2, играющий ключевую роль в дифференцировке стволовых клеток нейроглии, экспрессируется в большинстве нейроэпителиальных опухолей и может быть полезен при диагностике незрелой тератомы.
В семиномах и опухолях желточного мешка этот маркер всегда отрицательный. NANOG — транскрипционный фактор, характерный для всех полипотентных стволовых клеток; подобно ОСТ-4. он экспрессируется в ядрах клеток семиномы/герминомы и эмбриональной карциномы. Хориокарцинома отрицательна по этому маркеру.
Суммируя данные по описанным маркерам, можно рекомендовать следующее их применение в дифференциальной диагностике:
Для диагностики эмбрионального рака используется следующая панель антител: NANOG, ОСТ-3/4, SOX-2, CD30, Раn-СК, PLAP. Маркеры NANOG, ОСТ-3/4, SOX-2, CD30 положительны в 85% случаев, Раn-СК и PLAP — более чем в 85%, примерно 33% опухолей имеют положительную реакцию с антителами к а-фетопротеину (AFP).
Опухоль желточного мешка положительна с антителами к Раn-СК (диффузная реакция), GPC3 и PLAP. Значительная часть опухолей желточного мешка имеет положительную реакцию с AFP. Опухоли желточного мешка с гепатоидной дифференцировкой положительны с НерРаr-1.
Данные по экспрессии ИГХ-маркеров в герминогенных опухолях яичка приведены в табл. 4.2.
Таблица 42. Положительные реакции герминогенных опухолей яичка с различными антителами, %

Генетические исследования
Около 95% тестикулярных опухолей составляют герминогенные новообразования.
Предрасположенность клеток герминогенных опухолей к полиплоидизации может быть связана с их происхождением из первичных половых клеток. Эти клетки особенно склонны к полиплоидизации, поскольку они обладают высокой митотической активностью и тенденцией к образованию межхромосомных мостов.
Отличительной чертой всех герминогенных опухолей яичка служит увеличение количества копий короткого плеча хромосомы 12, наблюдаемое в большинстве случаев в виде изохромосомы i(12p). Она обнаруживается в 85% этих опухолей. Увеличение количества копий 12р происходит также о результате амплификации, тандемной дупликации, в редких случаях — инсерции.
По-видимому, избыточность генетического материала 12р играет важную роль в развитии герминогенных опухолей яичка, в частности, для полипотентности опухолевых клеток. В данном районе присутствует более 400 генов, часть из которых (CCND2, FU22028, GLUT3, GAPDH, REA) гиперэкспрессируется практически во всех герминогенных опухолях.
Более того, амплификация определенной области короткого плеча хромосомы 12 обнаружена при внутриканапьцевой герминативноклеточной неоплазии неклассифицируемого типа, которая считается предшественником герминогенных опухолей, а также в семиномных метастазах.
Изохромосома i(12p) служит молекулярным маркером, характерным для всех герминогенных опухолей яичка, который позволяет проводить дифференциальную диагностику с опухолями срединной линии (midline tumors) неопределенного гистогенеза. Помимо общих нарушений существует ряд генетических изменений, связанных с различными подтипами герминогенных опухолей яичка.
Так, перестройки хромосомных районов 1р32-р36 и 7q11.2 специфичны для тератом, в опухолях желточного мешка обнаружены перестройки локуса 1р22. Амплификация участка 12р11-12.2 встречается преимущественно в семиномах, 17q11-q21 — в несеминомах. Активирующие мутации гена KIT обнаруживают в семиномах с частотой 13-30%.
Показано, что гомозиготные делеции гена DCC связаны с прогрессией заболевания. Известно также, что с опухолевой прогрессией коррелируют структурные и/или функциональные потери экспрессии генов-супрессоров опухолевого роста RB1, NME, WT1, АРС и Р16. Аберрации таких генов, как c-MYC, N МУС и К-RAS, в герминогенных опухолях яичка встречаются редко.
Для этих опухолей также показано аномальное метилирование генов PRSS21, MGMT и RASSF1A. Мутации гена ТР53 — редкое событие для герминогенных опухолей, однако несколько исследований свидетельствуют о наличии мутаций ТР53 в опухолях, резистентных к химиотерапии.
Чрезвычайно высокая чувствительность герминогенных опухолей яичка к химиотерапии, включающей цисплатин, по-видимому, есть результат того, что исходные герминативные клетки полипотентны и весьма восприимчивы к апоптотическим стимулам, включающим повреждение ДНК.
Считается, что клетка герминогенной опухоли приобретает полипотентность вследствие амплификации хромосомного участка 12р. Несмотря то что для герминогенных опухолей яичка характерен дикий тип белка р53, полагают, что в семиномах также происходит нарушение сигнального р53 зависимого пути.
Идентификация генов, ответственных за функциональную инактивацию р53, позволит определить мишени для разработки таргетных препаратов лечения гермино генных опухолей яичка. Резистентность к цисплатину связана со значительной амплификацией локусов 1q31-32, 2р23-24, 7q21, 7q31, 9q22, 9q32-34, 15q23-24 и 20q11.2-12.
Герминогенные опухоли яичка у детей и взрослых существенно отличаются. В то время как опухоли у взрослых анеуплоидны. педиатрические случаи пра ктически всегда диплоидны, в частности, это характерно для тератом.
Изохромосома i(12p) и амплификация 12р нетипичны для опухолей у детей, причем наличие данных изменений зависит от возраста: они обнаружены только у пациентов старше 9 лет С другой стороны, для опухолей детского возраста характерны делеции хромосомных районов 1р, в частности 1р36, 6q, а также структурные аберрации на хромосомах 2 и 3.
Семейные случаи герминогенных опухолей яичка. Герминогенные опухоли яичка в основном считаются спорадическим заболеванием, но известны и семейные формы с частотой встречаемости около 2%. Наследственные опухоли развиваются в более раннем возрасте и часто имеют билатеральную локализацию.
Для родственников пациента с наследственной формой рака яичка риск герминогенных опухолей в 6-10 раз выше, чем в среднем в популяции. На настоящий момент гены, ответственные за развитие герминогенных опухолей яичка, неизвестны; попытки установить хромосомные локусы, связанные с заболеванием, также пока не увенчались успехом.
Такие новообразования состоят из сочетания элементов эндометриальной стромы и гладкомышечных клеток. Они могут быть одиночными и множественными, их консистенция обычно мягче, чем у лейомиомы. Эндометриольный стромольный компонент состоит из мелких клеток и многочисленных мелких артериол. Гладкомышечный компонент имеет вид мелких узлов с зоной гиалиноза в центре. Для постановки диагноза смешанной опухоли один из компонентов должен занимать не менее 30 % всего объема опухоли. Если эндометриальный стромальный компонент опухоли может иметь признаки клеточной атипии и нести в себе злокачественные потенции, то гладкомышечный компонент всегда доброкачественный. Прогноз заболевания зависит от степени зрелости стромального компонента, но чаще всего он благоприятный.
Аденоматоидная опухоль является производной мезотелия, обычно она фигурирует как случайная находка при гистерэктомии. Эта форма может сочетаться со сходными изменениями в фаллопиевых трубах. Макроскопически опухоль обычно имеет вид одиночного узла с четкими границами. Прогноз благоприятный. Под микроскопом ее ткань состоит из множества мелких щелевидных пространств в миометрии, сообщающихся между собой. Щели выстланы одним слоем кубических или уплощенных клеток. Ядра клеток без признаков атипии, митозы отсутствуют. Пространства могут быть кистозно расширены, в таких случаях возможен ошибочный диагноз лимфангиомы.
Кроме вышеописанных новообразований, в матке могут развиваться различные доброкачественные и злокачественные мезенхимальные опухоли. Их подразделяют на гомологичные и гетерологичные. Гомологичные новообразования построены из тканей, встречающихся в матке, гетерологичные — из тканей, в норме в матке не встречающихся. Доброкачественные опухоли включают в себя: липому, гемангиому, лимфангиому, рабдомиому, миксому, а злокачественные — рабдомиосаркому, злокачественную фиброзную гистиоцитому, ангиосаркому, липосаркому, остеосаркому и др. Нет необходимости описывать все эти формы из-за их сходства с аналогами других локализаций.
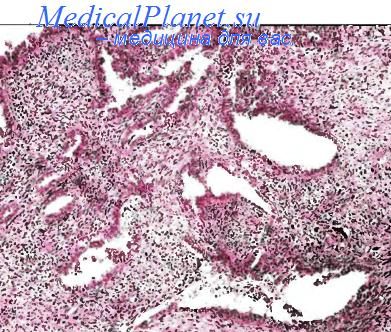
Аденосаркома матки
Согласно определению, новообразования этой группы включают в себя тесно связанные друг с другом эпителиальный и мезенхимальный компоненты. В зависимости от строения мезенхимального компонента эти опухоли могут быть гомо- и гетерологичными. Как доброкачественные, так и злокачественные варианты растут обычно в виде одиночного полиповидного узла, выступающего в полость матки. Размеры узла могут значительно варьировать. Ведущее клиническое проявление — маточные кровотечения.
Аденофиброма содержит широкие сосочки, выстланные эпителием, соответствующим пролиферативному или неактивному эндометрию. Строма представлена как фибробластами, так и стромальными клетками эндометрия. Клеточной атипии нет. Фигуры митоза единичны или отсутствуют. Опухоль доброкачественная, однако при неполном ее удалении возможны рецидивы.
Аденомиома представлена эндометриальными железами, расположенными в строме, состоящей почти исключительно из гладкомышечных клеток. Оба компонента опухоли доброкачественные. При атипичной полиповидной аденомиоме обнаруживаются нарушение архитектоники и атипия эпителиоцитов, что иногда сопровождается плоскоклеточной метаплазией выстилки желез.
Аденосаркома — сочетание доброкачественного эпителиального компонента и саркоматозной стромы. Первый из них представлен мелкими кистозно-расширенными или сдавленными железами, выстланными эндометрием пролиферативного типа. Строма гиперцеллюлярная, состоит из веретенообразных или округлых клеток, которые расположены, в основном, вокруг желез. По степени клеточной атипии стромальный компонент обычно соответствует саркоме низкой степепени злокачественности. Митотическая активность колеблется от 2 до 20 фигур митоза в полях зрения при большом увеличении микроскопа. Часто встречаются очаги фиброза, гиалиноза кровоизлияний и некроза.
Карциносаркома — смешанная опухоль, в которой оба компонента злокачественные. Железистый компонент обычно дифференцирован в эндометриоидном направлении и может быть представлен любым вариантом эндометриоилнои аденокарциномы. Саркоматозный компонент бывает гомо- и гетерологичным. Как правило, он обладает высокой степенью злокачественности.
Карцинофиброма — наиболее редкий вариант смешанной эпителиально-мезенхимальной опухоли, представленный карциномой эндометрия в сочетании с доброкачественным мезенхимальным компонентом, чаще — фиброматозным.

-
5 минут на чтение

Доброкачественные новообразования придатка яичка у мужчин встречаются в возрасте 20-50 лет и составляют 1-1,5% от всех онкологических заболеваний.
- Что такое
- Классификация
- Причины
- Симптомы
- Диагностические процедуры
- Осмотр онколога
- Инструментальные методы
- Лабораторные исследования
- Лечение
- Лечение доброкачественного образования
- Лечение злокачественной опухоли
- Вероятные осложнения
- Прогноз
- Профилактика
Опухоли придатка делятся на первичные и приобретенные (при переходе метастазов от близлежащих тканей). Первичные злокачественные уплотнения придатка даже при незначительных размерах (2-3 см) дают метастазы на яичко и соседние органы.
Что такое
Диаметр новообразования колеблется от 5 до 6 см. Место локализации – хвостовой отдел придатка, реже средняя часть. На разрезе опухоль состоит из нескольких узлов.
Классификация
Различают доброкачественные и злокачественные образования. По гистологическому строению они делятся на эпителиальные, неэпителиальные и тератоидные.

- Онкоурология
![]()
Наталья Геннадьевна Буцык- 10 декабря 2019 г.
На основании гистологической квалификации к ним относятся:
- Аденома.
- Мезателиома (опухоль мезотелия).
- Рак.
- Эмбриональная рабдомиосаркома.
- Новообразование Бренера (светлоклеточные опухоли).
- Опухоль мягких тканей.
- Аденоматоидные опухоли (аденокарцинома, фибросаркома).
- Другие виды разрастания тканей (лейомиосаркомы, фибромы, липомы).
Аденоматоидные новообразования – доброкачественные опухоли придатков на их долю приходится 80% заболеваний. Злокачественные образования – рак и саркома.
Причины
Причины возникновения опухоли придатка до сих пор не установлены. Однако определен перечень факторов, повышающий риск развития образований. К ним относятся:
- хронические болезни эндокринной системы;
- нарушения метаболизма;
- наследственность;
- травмы половых органов;
- радиация;
- вредные привычки (алкоголь, курение, наркотики);
- СПИД;
- наличие в анамнезе новообразований.
Крипторхизм (неопущение яичка в мошонку) – это патология, которая стоит на первом месте в группе риска онкологических заболеваний у мужчин.
Воздействие одного или нескольких факторов способствует разрастанию атипичных клеток.
Симптомы
Доброкачественная опухоль придатка протекает бессимптомно.
Первый признак заболевания – это появление безболезненного образования. Определяется при пальпации самостоятельно и служит поводом для посещения врача.
Клинические проявления злокачественной опухоли придатка характеризуются дискомфортом, болью и отечностью в области гениталий. При осмотре половых органов заметна деформация и увеличение пораженного яичка, отечность мошонки.
Все начинается с облигатного предрака. Аденоматоз – предопухолевые изменения в эпителиальных тканях, которые с очень высокой вероятностью станут карциномой.
Аденоматозные изменения в тканях
Естественная история опухоли
У любой раковой опухоли всегда есть история развития (путь от одной самой первой раковой клетки до печального завершения заболевания). Всего одна-единственная атипически измененная клетка может стать основой для формирования злокачественного новообразования. Временной фактор разнообразен – порой проходят годы-десятилетия до двукратного увеличения размеров карциномы, но иногда период удвоения злокачественного очага занимает несколько месяцев.
И всегда началом истории развития злокачественной опухоли являются предраковые изменения, какими бы словами они не назывались.
Аденоматоз
Типичный вариант предопухолевых изменений в активных железисто-эпителиальных тканях различных органов – аденоматоз. Заболевание необходимо воспринимать, как крайне опасную для жизни ситуацию. Да, это еще не рак, время позволяет, но период перехода в карциному может быть коротким.
Аденоматозные изменения непредсказуемы: сегодня еще не страшно, а завтра уже поздно.
К наиболее часто встречающимся вариантам заболеваний относятся:
- Аденоматозная гиперплазия эндометрия;
- Фиброаденома молочной железы;
- Аденоматозный полип (в желудке, в матке, в кишечнике).
Порой невозможно отличить облигатный предрак от карциномы in situ – разница не выражена, а исход лечения зависит от скорости принятия решения. Вроде, в первом случае еще есть время для выбора тактики терапии, а при втором – все надо делать максимально быстро. И что самое главное – необходимо воспринимать предрак, как реальную угрозу жизни.
Что делать, если обнаружена предопухоль
Врач проблему может заподозрить, но для подтверждения диагноза нужна биопсия. Типичные предраковые изменения обнаруживаются при гистологическом исследовании. Подтвержденный аденоматоз (вне зависимости от месторасположения) – это всегда очень и очень серьезно. С полученным от врача гистологическим заключением и биопсийным препаратом надо отправиться к врачу-онкологу для консультации: если специалист подтвердит предрак, то необходимо предвосхитить прогрессирование раковой опухоли (не надо ждать, когда аденоматоз станет карциномой). Оптимальный вариант лечения – хирургическая операция, объем которой всегда подбирается индивидуально. Большое значение имеет вариант предракового состояния – аденоматозная гиперплазия эндометрия, аденоматозный полип в желудке или в матке.
Аденоматоз – это первый шаг на долгом или коротком пути к раку. Если удалось выявить болезнь на этом этапе, то надо радоваться: плохо, что предрак возник, но хорошо, что получилось обнаружить проблему до появления прогрессирующей карциномы.
Читайте также:


