1 4 диметилбензол с хлором
Арены - ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда - бензол - C6H6. Общая формула их гомологического ряда - CnH2n-6.
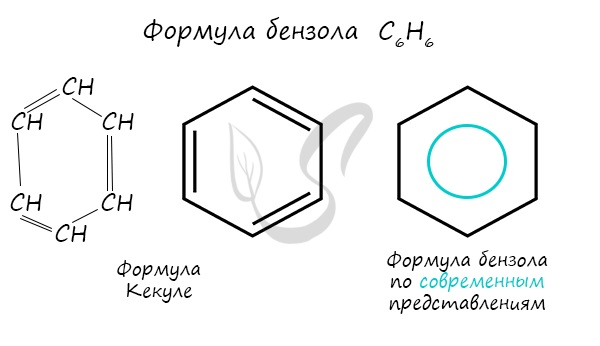
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с двумя тройными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям, двойные связи в молекуле постоянно перемещают, поэтому правильнее рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол - 120°.
Названия аренов формируются путем добавления названий заместителей к главной цепи - бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
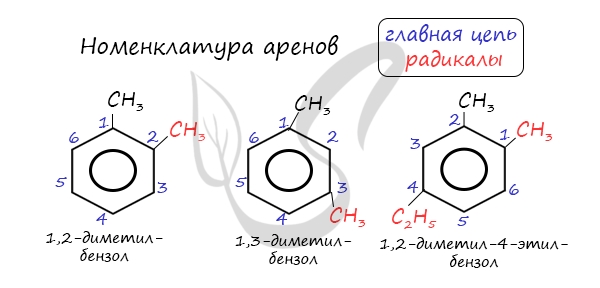
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
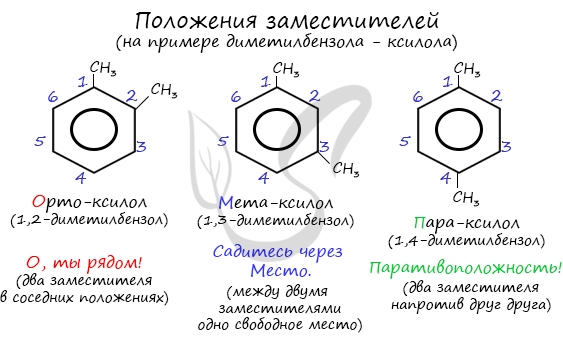
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания ;)
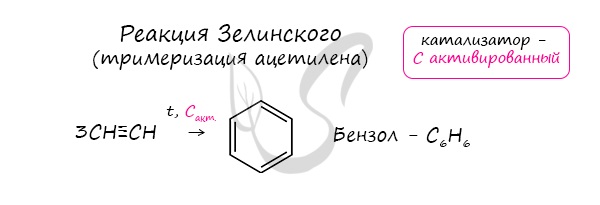
Арены получают несколькими способами:
-
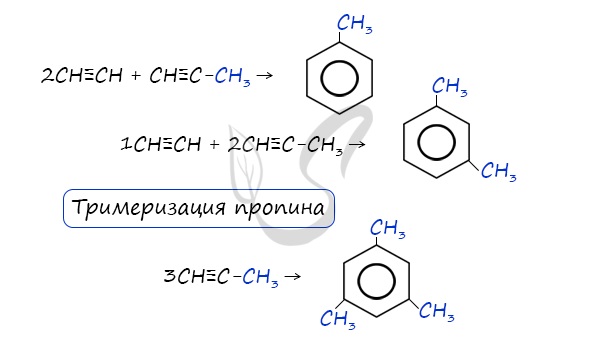
Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород - бензол.
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
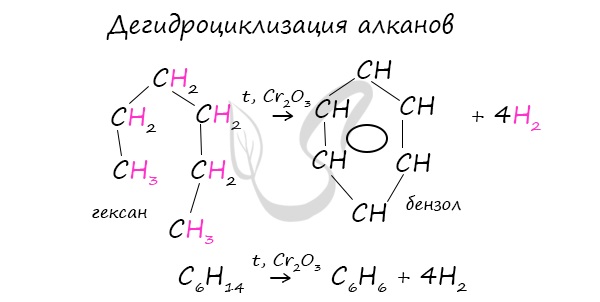
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора - Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
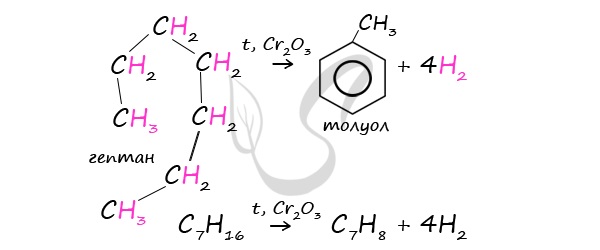
При дегидроциклизации гептана получается толуол.
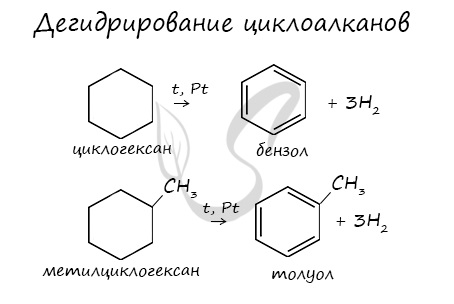
В результате дегидрирования уже "готовых" циклов - циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
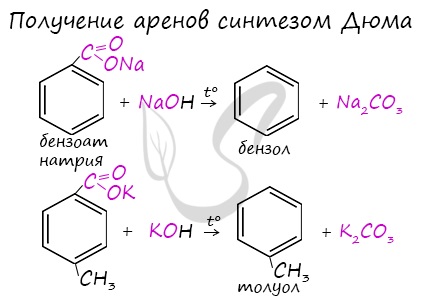
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Арены - ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
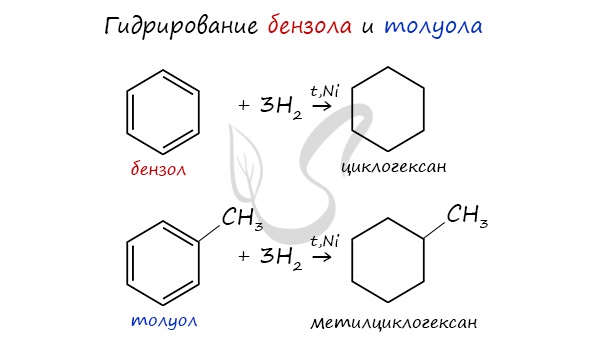
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
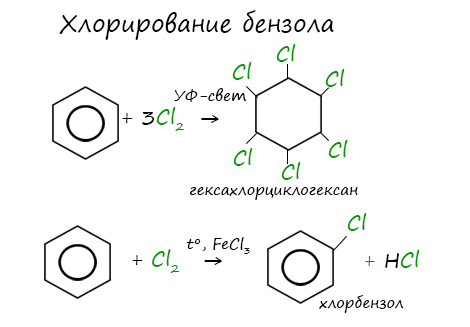
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
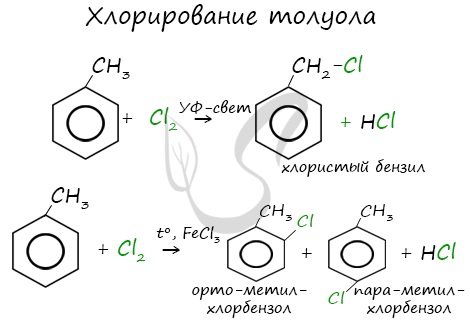
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH 2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
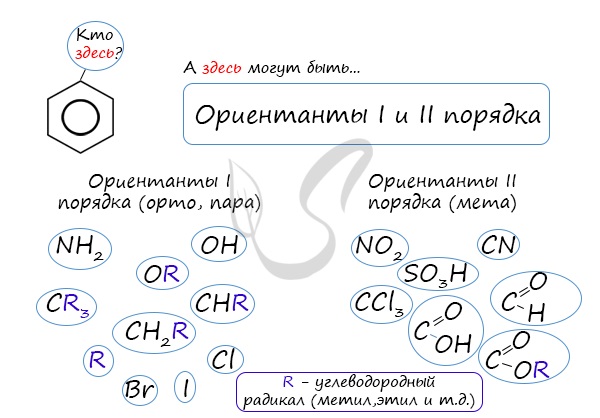
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
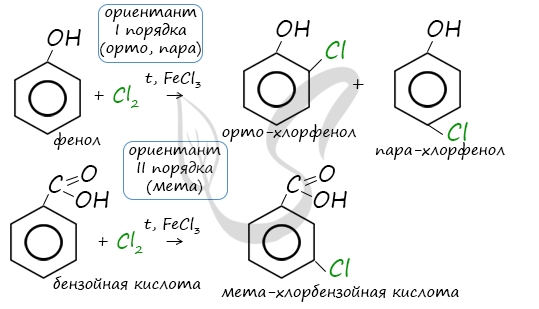
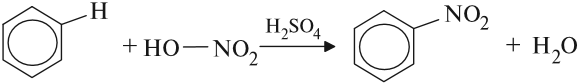
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
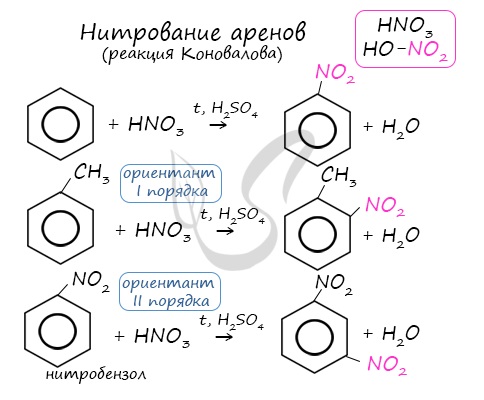
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
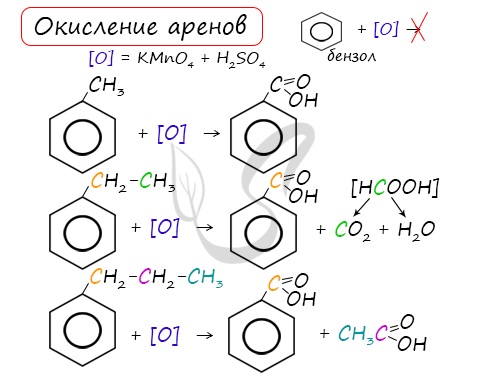
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
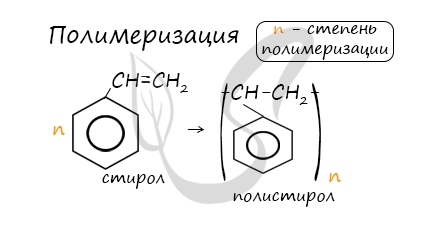
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Ароматические соединения
Ароматические соединения (арены) – циклические соединения содержащие, как правило 5- и 6-членные циклы, имеющие замкнутую систему сопряженных связей. Боковые цепи не обязаны содержать сопряженные связи.
Ароматичность молекулы характеризует ее повышенную устойчивость, которая обусловлена делокализацией π-электронов в циклической системе.
1. Атомы углерода в состоянии sp 2 -гибридизации создают замкнутую систему.
2. Атомы углерода образуют единую плоскость.
3. Цикл из сопряженных связей включает в себя 4n + 2 π-электронов (где n – целое число). Этот принцип называется правилом Хюккеля.
В зависимости от n можно выделить следующие простейшие ароматические системы:
• Системами с 2 π-электронам являются производные катиона циклопропенилия и дикатионциклобутадиена.
• Системы с 10 π-электронами – это в первую очередь нафталин. Кроме того, широко встречается в природе конденсированные бензольные кольца. Другой представитель – азулен. Это изомер нафталина, содержащий в себе 5- и 7-членные кольца. Азулен часто встречается в эфирных маслах, но распространенность гораздо меньше, чем у бензола и нафталина. 
Сюда же относятся индол, хинолин, изохинолин, хиназолин, хиноксалин, другие системы, основанные на бензольном кольце, конденсированном с другим кольцом, в котором находится гетероатом. Широко распространены в природе.
• Системы с 14 π-электронами: антрацен, фенантрен – конденсированные бензольные кольца обоих кольцах. Широко распространены в природе. 
Для ароматических соединений часто используют тривиальные названия (толуол, ксилол, кумол и т. п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень):
| С6H5–CH3 | С6H5–C2H5 | С6H5–C3H7 |
| Метилбензол (толуол) | Этилбензол | Пропиленбензол |
Если радикалов более одного, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерация организовывается таким образом, чтобы заместители имели наименьшую сумму номеров положений. Например:
 |
| 1,2-Диметилбензол 1,3-Диметилбензол 1,4-Диметилбензол |
Для дизамещенных бензолов R–C6H4–R распространен способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками:
- орто- (о-) – заместители у соседних атомов углерода кольца, т.е. 1,2-положениях к опорному;
- мета- (м-) – заместители через один атом углерода (в 1,3-положениях к опорному);
- пара- (п-) – заместители на противоположных сторонах кольца (в 1,4-положениях к опорному).
| 1,2-Диметилбензол 1,3-Диметилбензол 1,4-Диметилбензол |
 |
- положения заместителей для ди-, три- и тетра-замещенных бензолов (например, о-, м- и п-ксилолы);
- углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода:
![]()
н-Пропилбензол Изопропилбензол (кумол) - изомерия заместителей R, начиная с R=С2Н5. Например, молекулярной формуле С8Н10 соответствуют 4 изомера:
Химические свойства ароматических соединений сильно отличаются от свойств других классов соединений из-за делокализации шести π-электронов в циклической системе, которые понижают энергию молекулы. В результате в молекуле повышается устойчивость. Арены практически не вступают в реакции присоединения или окисления, приводящие к нарушению ароматичности. Для них наиболее распространены реакции с сохранением ароматической системы, т. е. замещения атомов водорода в составе цикла.
Так как в бензольном кольце за счет системы сопряженных связей с обеих сторон от плоскости кольца наблюдается повышенная электронная плотность, то бензольное кольцо является нуклеофилом и склонно взаимодействовать с электрофильным реагентом. Поэтому для ароматических соединений наиболее типичны реакции электрофильного замещения.
Замена атома водорода в бензольном кольце на какой-либо из галогенов наблюдается, как правило, в присутствии катализаторов AlCl3, AlBr3, FeCl3 (кислот Льюиса):
| C6H6 + Cl2 |  | C6H5Cl | + HCl. |
| Хлорбензол |
Бензол хорошо взаимодействует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
| C6H6 + HNO3 |  | C6H5NO2 | + H2O. |
| Нитробензол |
Алкильная группа замещает атом водорода в бензольном кольце при взаимодействии с алкилгалогенидами (реакция Фриделя–Крафтса) или алкенов с катализатором, например AlCl3 (кислота Льюиса):
| C6H6 + CH3Cl |  | C6H5CH3 | + HCl. |
| Толуол (метилбензол) |
Гомологи бензола, содержащие боковые цепи, активнее вступают в реакции замещения.
Например, при нитровании толуола С6Н5CH3 может происходить замещение не одного, а одновременно трех атомов водорода с образованием 2,4,6-тринитротолуола:
 | ||
| Толуол | 2,4,6-Тринитротолуол (тротил, тол) | |
В этом случае хорошо иллюстрируется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях.

Причиной именно такой ориентации при электрофильном замещении является взаимное влияние атомов в молекуле. В незамещенном бензоле С6Н6 электроны в кольце распределены равномерно, а в замещенных ароматических соединениях под влиянием заместителя происходит перераспределение электронов и образуются области повышенной и пониженной электронной плотности, что оказывает влияние направления реакций электрофильного замещения. Таким образом, атака нового заместителя определяется природой уже имеющегося заместителя.
Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т. е. оказывают ориентирующее действие.
По своему направляющему действию все заместители делятся на две группы: ориентанты первого рода и ориентанты второго рода.
Орто-пара-ориентанты направляют замещение преимущественно в орто- и пара-положения.
К ним относятся электроннодонорные группы (электронные эффекты групп указаны в скобках):
+M-эффект в этих группах сильнее, чем –I-эффект.
Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто- и пара-положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов.

Ориентанты 1-го рода повышают в бензольном кольце электронную плотность, это приводит к повышению его активности в реакциях электрофильного замещения (по сравнению с бензолом).
Галогены занимают особое место среди ориентантов 1-го рода, проявляющие электронно-акцепторные свойства: –F (+M бензол > нитробензол.
Но нужно учитывать, что под влиянием бензольного кольца группа СH3 в толуоле становится активнее в реакциях окисления и радикального замещения по сравнению, например, с метаном СH4.
Поэтому толуол (в отличие от метана) окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании):

В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.


Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т. п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений [5, 6].
Гомологи бензола, в отличие от самого бензола, окисляются легко. При обработке перманганатом калия будут окисляться только боковые цепи:
| C6H5–CH3 + 3[O] | → | C6H5–COOH | + H2O. |
| Толуол | Бензойная кислота |
Наращивание боковой насыщенной цепи (этилбензол, пропилбензол и т. д.) также дает на выходе бензойную кислоту, так как разрыв связи происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.

Алкильные группы в алкилбензолах окисляются легче, чем алканы. Это объясняется влиянием бензольного кольца на атомы в боковой цепи.
Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах:
Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
Уголь и нефть – основной источник ароматических углеводородов.
При коксовании каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения.
а) дегидроциклизация (дегидрирование и циклизация) насыщенных УВ, состоящих, как минимум из 6 атомов углерода в основной цепи. Реакция проходит при нагревании в присутствии катализатора:

б) дегидрирование циклоалканов, состоящих из шести атомов:

Алкилирование бензола галогеналканами или алкенами в присутствии безводного хлорида алюминия:

Тримеризация алкинов над активированным углем (реакция Зелинского):

Бензол С6Н6 – основа для получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола, стирола и т. д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Толуол С6Н5–СН3 используется для производства лекарственных и взрывчатых веществ (тротил, тол), а также красителей.
Ксилолы С6Н4(СН3)2 в виде смеси изомеров (орто-, мета- и пара-) применяется как растворитель.
Изопропилбензол (кумол) С6Н4–СН(СН3)2 – основа для получения фенола и ацетона.
Винилбензол (стирол) C6H5–CН=СН2 используется для получения полистирола – важного для промышленности полимера.

Бензпире́н или бензапире́н – химическое соединение, относящееся к первому классу опасности. Источником его образования является сгорание углеводородного жидкого, твёрдого и (реже) газообразного топлива. Концентрируется преимущественно в почве, меньше – в воде. Из почвы мигрирует в ткани растений и продолжает своё движение дальше в пищевой цепочке.
Понятие о циклических углеводородах. Циклоалканы
Циклические углеводороды — это вещества, в молекулах которых имеется замкнутая цепь атомов углерода.
Циклоалканы (циклопарафины) — это углеводороды замкнутого (циклического) строения, в молекулах которых атомы углерода соединены только простыми связями.
Общая формула циклоалканов СnH2n, поэтому эти углеводороды нельзя отнести к предельным углеводородам. Атомы углерода, образующие цикл, соединены между собой простыми σ-связями, как в алканах. В зависимости от величины цикла, т. е. числа сторон в этом углеродном многоугольнике, различают циклоалканы:
- трёхчленные (правильные треугольники);
- четырёхчленные (правильные четырёхугольники);
- пятичленные (правильные пятиугольники) и т. д.
По номенклатуре ИЮПАК названия циклопарафинов образуют, прибавляя приставку цикло- — к названию алкана.
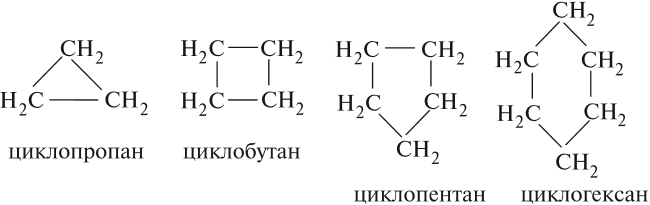
Первые два представителя — циклопропан и циклобутан (при н. у.) — газы, следующие три — жидкости, высшие — твёрдые вещества.
Циклопентан, циклогексан и их гомологи — наиболее устойчивые циклоалканы, поэтому они с трудом вступают в реакции гидрирования, галогенирования и т. д. Если реакция галогенирования происходит, то это реакция замещения, цикл при этом не разрушается:
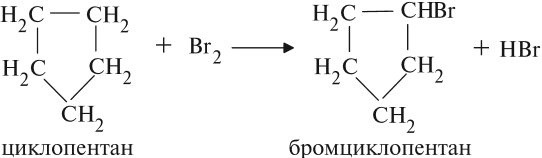
Трёхчленные и четырёхчленные циклы, имея менее устойчивый цикл, способны присоединять одну молекулу водорода, превращаясь в предельный углеводород:
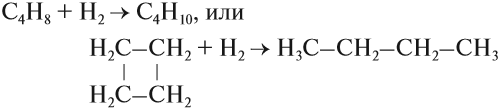
При этом происходит размыкание цикла. Галогенирование циклобутана идёт так же, как и его гидрирование:
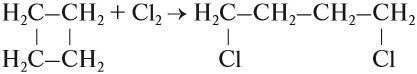
Обратите внимание. Атомы хлора становятся в 1,4-положение: по концам разорванной цепи. Это реакции присоединения. С бОльшим трудом вступают в реакции присоединения и устойчивые пяти— и шестичленные циклоалканы.
Поэтому циклопарафины нельзя отнести к насыщенным углеводородам.
Циклопарафины входят в состав нефти, составляя до 25– 75 % её. Поэтому их называют нафтенами.
Понятие об ароматических углеводородах
К ароматическим углеводородам относятся углеводороды, в молекулах которых содержится одно или несколько бензольных ядер (колец)*.
* Существуют и другие ароматические углеводороды и органические соединения. В данном пособии они не рассматриваются.
Бензольное ядро — это остаток типичного представителя ароматических углеводородов — бензола.

История открытия бензола. Строение молекулы
Бензол был открыт в начале прошлого века. Это было загадочное вещество. Многие учёные пытались разгадать его строение, объяснить его свойства, но не могли. Почему?
Дело в том, что было установлено: состав молекулы бензола выражается формулой
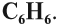
Задание 21.1. По составу молекулы определите, является ли это вещество предельным или непредельным углеводородом.
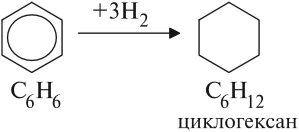
Если сравнить состав бензола с соответствующим алканом, легко видеть, что бензол — сильно ненасыщенное соединение. Для того чтобы превратиться в алкан, бензол должен присоединить 8 атомов (4 молекулы) водорода. Но оказалось, что бензол, присоединяя 3 молекулы водорода, превращается в вещество циклического строения:
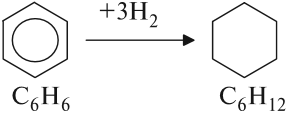
Значит, и бензол имеет циклическое строение!
Теперь возникает вопрос: какие связи соединяют атомы углерода в молекуле бензола? В 1865 году немецкий химик Кекуле* предложил такую модель молекулы бензола:

Эта модель объясняла многие свойства бензола, но не объясняла особенности химических свойств этого соединения. Ведь если углеводород имеет три двойные связи, то он должен давать качественные реакции на двойную (кратную) связь.
Вопрос. Какие вы знаете качественные реакции на кратную связь?
Но оказалось, что бензол эти качественные реакции не даёт, т. е.
- не обесцвечивает бромную воду (при нормальных условиях);
- не обесцвечивает раствор перманганата калия.
Значит, двойных связей в молекуле бензола НЕТ!
Дальнейшие исследования показали, что в молекуле бензола существует особая, очень прочная ароматическая связь. Рассмотрим её образование на примере бензола.
Как уже было сказано, бензол имеет циклическое строение, причём атомы углерода соединены в правильный шестиугольник при помощи простых σ-связей. Такие σ-связи соединяют атомы углерода и водорода:
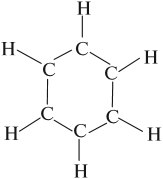
Вопрос. Сколько связей образовал каждый атом углерода? Сколько электронов участвует в образовании этих связей?
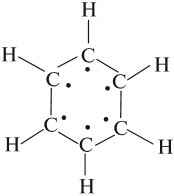
Задание. Соедините точки линией, не отрывая карандаш от бумаги. Что у Вас получилось? Окружность.
Ароматическая связь в молекулах обозначается кружочком:

Формулы (1) и (1а) отражают строение одного и того же вещества бензола, состава С6Н6. Записывая формулу бензола (1а), следует помнить, что:
- в вершинах этого правильного шестиугольника находится атом углерода;
- каждый атом углерода соединён с одним атомом водорода.

Гомологический ряд, номенклатура, изомерия
Для того чтобы вывести общую формулу гомологического ряда бензола, сравним, как всегда, состав алкана и бензола, у которых число атомов углерода одинаково:
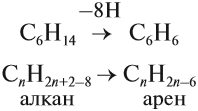
Гомологи бензола (арены) должны отвечать формуле СnН2n–6 и содержать одно бензольное кольцо (остаток бензола). Так как у бензола состав C6H6, то ближайший гомолог бензола имеет семь атомов углерода в молекуле:
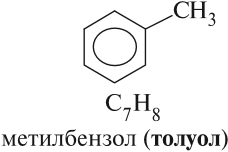
Поскольку все атомы углерода равноценны, — изомеров ароматического строения у толуола нет и обозначать цифрой положение метильной группы не имеет смысла.
Если n = 8, то составу С8Н10 отвечают несколько формул:
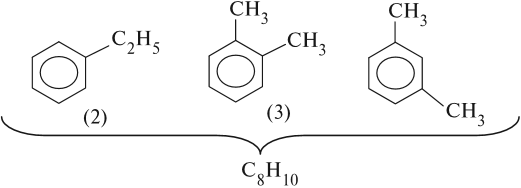
В местах соединения атомов углерода бензольного кольца и радикалов атомов водорода нет!
Вопрос. От чего будет зависеть изомерия таких ароматических соединений?
Очевидно, что для вещества (3) возможны ещё два изомера, которые отличаются взаимным расположением метильных групп. В этом случае положение метильной группы нужно показывать цифрой. Цифрой 1 нумеруют любую метильную группу и, двигаясь по кольцу в сторону ближайшей группы, расставляют остальные номера:
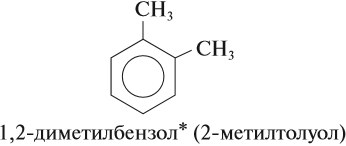
* Ароматические изомеры диметилбензола называются ксилол.
Задание 21.2. Составьте формулы остальных гомологов бензола с n = 8. Назовите полученные изомеры. Назовите также соединение (2).

Свойства бензола
Бензол — это бесцветная жидкость с характерным запахом. Приятный запах некоторых ароматических соединений (аромат) дал название целому классу соединений. Бензол легче воды и не смешивается с нею. Являясь неполярным соединением, бензол хорошо растворяет неполярные соединения: жиры и масла.
В молекуле бензола имеется очень прочная ароматическая связь. Поэтому в химических реакциях бензол стремится сохранить ароматическую связь. Для того чтобы понять, какие химические реакции более характерны для бензола, вспомним, как протекают реакции основных типов: замещения и присоединения.
Задание 21.3. Составьте уравнения реакций с бромом для этана и этилена. Укажите тип этих реакций.
Обратите внимание: реакции замещения происходят без изменения структуры молекулы (тип химической связи остался прежним):
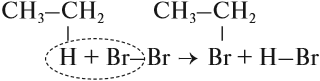
А в реакциях присоединения изменяется структура молекулы, изменяется тип химической связи:
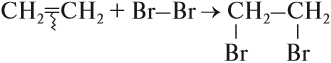
Вопрос. Какой тип химической реакции предпочтительнее для бензола: замещения или присоединения? Почему?
Поскольку в реакциях замещения тип химической связи не изменяется, то бензол и другие ароматические углеводороды преимущественно вступают в реакции замещения, так как в этих реакциях ароматическая связь (она наиболее прочная) не разрушается. Следует помнить, что при обычных условиях бензол в химические реакции не вступает.
Так, реакция бромирования бензола происходит в присутствии катализатора железа:
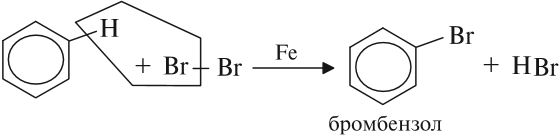
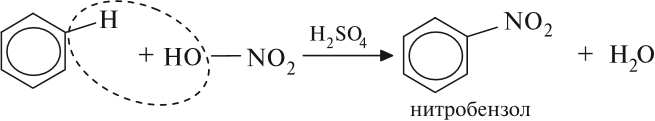
Реакция нитрования (с HNO3) происходит при нагревании в присутствии концентрированной серной кислоты:
В особых условиях возможно разрушение ароматической связи, и тогда бензол вступает в реакции присоединения:
На ярком солнечном свету происходит взаимодействие бензола с хлором или бромом:
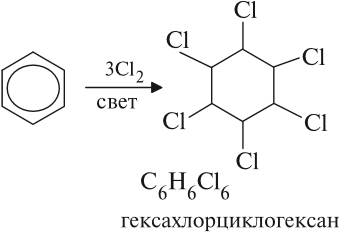
Бензол при обычных условиях не окисляется, например не обесцвечивает раствор перманганата калия. Окисление идет в особых условиях и сопровождается разрушением бензольного кольца. Бензол легко воспламеняется и горит коптящим пламенем. Пары бензола взрывоопасны. Бензол ядовит!
Задание 21.4. Составьте уравнение реакции горения бензола.

Свойства гомологов бензола
Свойства толуола и других гомологов бензола очень похожи на свойства самого бензола, но всё же имеют определённые особенности.
В теории Бутлерова сказано: атомы в молекуле взаимно влияют друг на друга. Поэтому появление в молекуле любой новой группы оказывает влияние на остальные атомы, т. е. изменяет свойства прежнего вещества.
Рассмотрим взаимное влияние атомов в молекуле на примере толуола.
Сравним две реакции: нитрование бензола и толуола. Исходные вещества отличаются друг от друга на группу СН3 (метил).
Отличается ли их поведение в этих реакциях? Да. Бензол вступает в реакцию медленнее, и в его молекуле может быть замещён любой атом водорода:
Толуол реагирует с азотной кислотой в 24 раза быстрее. В его молекуле могут быть замещены только те атомы водорода, которые связаны со вторым, четвёртым или шестым атомом углерода по отношению к CH3 группе:
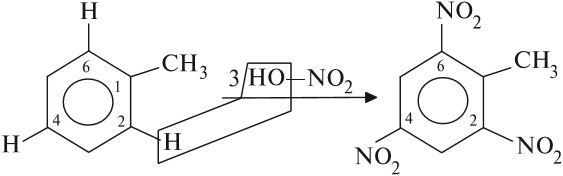
Вывод. Влияние СН3-группы, а также любых других углеводородных радикалов, заключается в том, что они (эти группы) облегчают реакции замещения и направляют их в 2, 4, 6-положения по отношению к себе.
Сравним три реакции окисления (знак [O] означает мягкое окисление в водном растворе окислителя):
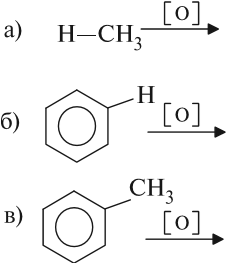
Первые две реакции при обычных условиях не происходят, т. е. бензол и метан не окисляются в растворах и не обесцвечивают розовый раствор перманганата калия (КМnО4). Толуол вступает в такую реакцию:
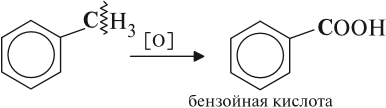
Таким образом, ни СН3-группа, ни бензол по отдельности не окисляются при нормальных условиях. Но влияние бензольного кольца на СН3-группу приводит к тому, что связи в ней становятся более полярными и разрушаются под действием перманганата калия. Такая реакция характерна и для других гомологов бензола:
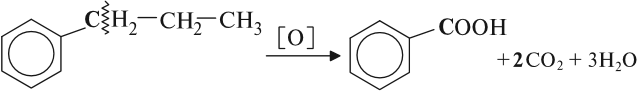
Под действием бензольного кольца становятся более полярными ближайшие к кольцу С–Н связи. Поэтому при окислении раствором перманганата калия любого гомолога бензола на месте боковой цепи образуется карбоксильная группа СООН.
Задание 21.5. Составьте уравнения реакций:

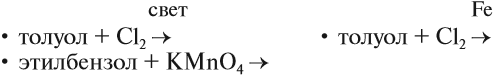
Укажите тип этих реакций.

Получение бензола и его гомологов
Бензол можно получить из ацетилена:
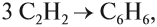
а также дегидроциклизацией алканов (дегидрирование — отщепление водорода, циклизация — образование замкнутого кольца из атомов углерода):
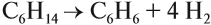
Бензол и другие ароматические углеводороды, как и алканы, можно получать из солей соответствующих кислот:
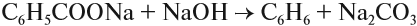
Гомологи бензола можно получить, как и алканы, из галогенпроизводных углеводородов:
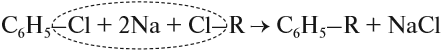

Выводы
Арены — это непредельные циклические углеводороды, содержащие прочную ароматическую связь. Для таких веществ характерны реакции замещения атома водорода. Возможны также реакции присоединения.
Читайте также:


