Ультразвуковая диагностика опухоли у детей


Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Ретинобластома - наиболее частая внутриглазная опухоль у детей младшего возраста, это быстро растущая опухоль эмбрионального типа, вариант исходящей из незрелой сетчатки нейробластомы. Раннее адекватное лечение существенно сказывается на прогнозе [2, 3]. При строго интраокулярной локализации опухоли выздоровление наступает более чем в 90 % случаев [4]. Однако диагностика часто запаздывает, так как педиатры, наблюдающие детей младшего возраста, недостаточно знакомы с проблемой и с запозданием направляют детей на радиологическое обследование и в специализированные центры. В связи с этим мы представляем результаты собственных наблюдений и критический анализ литературы.
По итогам работы поликлинического отделения РДКБ за 1999-2006 гг. среди 7311 детей, доставленных на прием к окулисту, было 8 детей с ретинобластомой. Во всех наблюдениях дети были в возрасте до 3 лет, ретинобластома имелась спорадическая, односторонняя. Наряду с офтальмологическим обследованием проводили радиологические диагностические вмешательства.
Ребенку с подозрением на ретинобластому после сбора анамнеза, общего клинического обследования, внешнего осмотра глаза, биомикроскопии с помощью щелевой лампы и непрямой офтальмоскопии необходимо выполнить дополнительные инструментальные исследования, прежде всего УЗИ, флюоресцентную ангиографию, рентгеновскую компьютерную томографию (РКТ) или магнитно-резонансную томографию (МРТ).
На первом месте по простоте использования и быстроте получения информации стоит УЗИ. Исследование позволяет достаточно быстро отдифференцировать ретинобластому от неопухолевых образований. Ретинобластома имеет характерные ультразвуковые признаки. При А-сканировании определяется высокоамплитудный эхосигнал с аттенуацией в нормальных тканях орбиты. По нашим данным, при В-сканировании с частотой излучения не менее 5-7 Мгц визуализируется округлое или неправильной формы внутриглазное образование с отложениями кальция. Образование исходит из задних отделов глаза, хорошо отграничено от стекловидного тела (рис. 1). Кровоток в опухоли не определяется. Эхографические исследования особенно показаны в динамике для оценки реакции опухоли на радиотерапию. Ультразвуковая картина опухоли весьма близка к так называемым псевдоопухолям сетчатки - гранулематозном изменении сетчатки, например, при токсокарозе. Безапелляционное заключение в совокупности с некритическим восприятием картины глазного дна по данным офтальмоскопии может привести к абсолютно не показанной энуклеации.

а) Небольшая ретинобластома. В ткани опухоли видны более плотные мелкие структуры (включения кальция).

б) Большая ретинобластома. Опухоль заполняет практически всю заднюю камеру глаза. Структура опухоли неоднородна, средней эхогенности. Регистрируются множественные ярко белые (высокая эхогенность) отложения кальция..
Флюоресцентная ангиография особенно информативна при множественных внутриглазных опухолях. В случаях мелких внутриретинальных опухолей в артериальную фазу становятся видны незначительно расширенные немногочисленные питающие артерии, умеренная гиперваскуляризация в венозную фазу и небольшое свечение узла Р на завершающем этапе. В средних и больших узлах Р определяются расширенные питающие артерии и дренирующие вены, а сама опухоль оказывается окруженной большим количеством капилляров.
После ультразвуковых исследований ребенка направляют на КТ или МРТ, которые, как и эхография, выявляют очаги кальцификации в ткани опухоли, типичные, но не патогномоничные для ретинобластомы. Кальцинаты в сетчатке наблюдаются при ретинальном ангиоматозе, астроцитоме, инвазии нематодами и других заболеваниях. Преимуществом КТ по сравнению с УЗИ является способность метода выявить экстраокулярную экспансию опухоли и сопутствующую пинеалобластому (трилатеральную ретинобластому). Не менее важно, что КТ, как и МРТ, оказывается полезным для исключения псевдоопухолей, т.е. гранулематозных изменений сетчатки [5].
МРТ может оказаться принципиально важным вспомогательным методом диагностики ретинобластомы. В Т1-взвешенном изображении ретинобластома гиперэхогенна по отношению к стекловидному телу, хотя и с трудом отличима от него. В Т2-взвешенном изображении опухоль гипоэхогенна. В Т2 режиме лучше визуализируются и очаги кальцификации, экссудации и геморрагии [6]. По нашему мнению, у детей младшего возраста качество МРТ-изображения может уступать КТ по специфичности из-за меньшей вероятности выявления внутриопухолевых кальцинатов. МРТ высокоинформативна для диагностики экссудативной или геморрагической отслойки сетчатки. В Т1 и Т2 режимах это проявляется субретинальным сигналом, соответствующим по плотности стекловидному телу.
Известно, что ретинобластома может быть как наследственным заболеванием, так и спорадически возникшей опухолью. В 94 % наблюдений опухоль является спорадической, в 6 - семейной. Во всех случаях семейной Р пациенты по аутосомно-доминантному типу передают повышенный риск ее развития своим потомкам. В то же время не менее 5 % больных с односторонней спорадической ретинобластомой могут быть носителями гена ретинобластомы и передавать его своим потомкам [7]. У 25 % пациентов с семейной ретинобластомой обнаруживают интерстициальную делецию длинного плеча 13-й хромосомы (13q14) с потерей хромосомного материала. Утерянное хромосомное вещество включает в себя ген, кодирующий ядерный фосфопротеин, являющийся супрессором репликаций ДНК. В итоге теряется контроль клеточного цикла. Ретинобластома развивается у 80-90 % носителей данного хромосомного дефекта [1]. Для этого варианта характерны задержка умственного развития, низкий рост и дисморфии лица [8]. Считается, что у остальных пациентов с семейным вариантом ретинобластомы имеются мелкие, не выявляемые мутации в этом же регионе 13.й хромосомы. Пенетрантность гена - 80-100 %. Неполная пенетрантность - ложная, обусловленная случаями не диагностированной ретиноцитомы, доброкачественная опухоль.
В 75 % наблюдений опухоль односторонняя и средний возраст пациента на момент выявления опухоли - 12 месяцев. В 25 (по другим данным - в 50 %) наблюдений ретинобластома поражает оба глаза. При двухсторонней локализации риск передачи гена опухоли потомству велик. Средний возраст пациентов при двухсторонней локализации опухоли на момент ее манифестации составляет 23 месяца. Однако опухоль может обнаруживаться у новорожденных и крайне редко - у взрослых. Цитологически возможен полный спектр от низкодифференцированных до высокодифференцированных клеток. Для низкодифференцированной опухоли типичны мелкие или средних размеров круглые нейробласты с большим гиперхромным ядром и небольшим объемом цитоплазмы. Гистологически для случаев зрелой ретинобластомы характерно обнаружение розеток Флекснер.Винтерштайнера и флореток, напоминающих цветочные букеты (flores). Розетки Флекснер-Винтерштайнера составлены из цилиндрических клеток, кругообразно расположенных вокруг светлого центра. Розетки высокоспецифичны для ретинобластомы, однако встречаются и при других внутриглазных опухолях, особенно при медуллоэпителиоме. Флоретты выглядят как нежные эозинофильные структуры, состоящие из опухолевых клеток, содержащих эозинофильные отростки, которые вследствие проникновения через фенестрированную мембрану приобретают грушевидную форму (рис. 2). Кроме ретинобластомы флоретты обнаруживаются и в ретиноцитомах, доброкачественных вариантах ретинобластомы. Возможен частичный или полный кальциноз опухоли как исход ее некроза.
Нефробластома, или опухоль Вилмса – опухоль почки, составляет 6% от всех злокачественных опухолей детского возраста. Опухоль названа по фамилии немецкого хирурга Макса Вильмса, впервые описавшего это заболевание в конце XVIII века.
Стандартом в лечении нефробластомы является комплексный подход: химиотерапия, туморнефроуретерэктомия и лучевая терапия. Прогноз заболевания при современных подходах к терапии благоприятный: выживаемость достигает 80%.
Распространенность нефробластом у детей
- Нефробластома – врожденная эмбриональная злокачественная опухоль почки.
- Заболеваемость составляет 1:100000 детей в возрасте до 14 лет.
- Опухоль выявляется преимущественно в возрасте 1-6 лет.
- Нет различий заболеваемости по полу.
- В 5% случаев наблюдаются двусторонние нефробластомы.

Точные причины возникновения опухоли Вильмса не установлены. Предполагается связь развития заболевания с мутацией в гене 1 опухоли Вильмса (WT 1), расположенного на 11 хромосоме. Этот ген важен для нормального развития почек и любые поломки в нем могут приводить к возникновению опухоли либо других аномалий развития почек. В 12-15% случаев опухоль Вильмса развивается у детей с врожденными аномалиями развития. Чаще всего имеют место аниридия (отсутствие радужной оболочки), синдром Беквита-Видемана (висцеропатия, макроглоссия, пупочная грыжа, грыжа белой линии живота, олигофрения, микроцефалия, гипогликемия, постнатальный гигантизм), урогенитальные аномалии, синдром WAIR (опухоль Вильмса, аниридия, мочеполовые аномалии, олигофрения), синдром Дениса-Драша (Опухоль Вильмса, нефропатия, аномалия гениталий, задержка роста, аномалии ушной раковины).
Классификация опухолей почек у детей
Существует гистологическое и клиническое стадирование опухоли Вильмса:
I) Гистологическое стадирование по Smidt/Harms проводится после удаления новообразования и предусматривает выделение 3х степеней злокачественности, влияющих на прогноз заболевания (низкой, средней и высокой) в зависимости от строения опухоли.
II) Клиническое стадирование
В настоящее время используют единую систему стадирования нефробластомы, которая является определяющей для лечения:
I стадия – опухоль локализуется в пределах почки, возможно полное удаление
II стадия – опухоль распространяется за пределы почки, возможно полное удаление, в т.ч.:
- прорастание капсулы почки, с распространением в околопочечную клетчатку и/или в ворота почки,
- поражение регионарных лимфатических узлов (стадия II N+),
- поражение внепочечных сосудов,
- поражение мочеточника
III стадия — опухоль распространяется за пределы почки, возможно неполное удаление, в т.ч.:
- в случае инцизионной или аспирационной биопсии,
- пред- или интраоперационный разрыв,
- метастазы по брюшине,
- поражение внутрибрюшных лимфоузлов, за исключением регионарных,
- опухолевый выпот в брюшную полость,
- нерадикальное удаление
IV стадия – наличие отдалённых метастазов
V стадия – двусторонняя нефробластома
Классификация нефробластомы по системе TNM в настоящее время сохраняет, в основном, историческое значение и в клинической практике не используется.
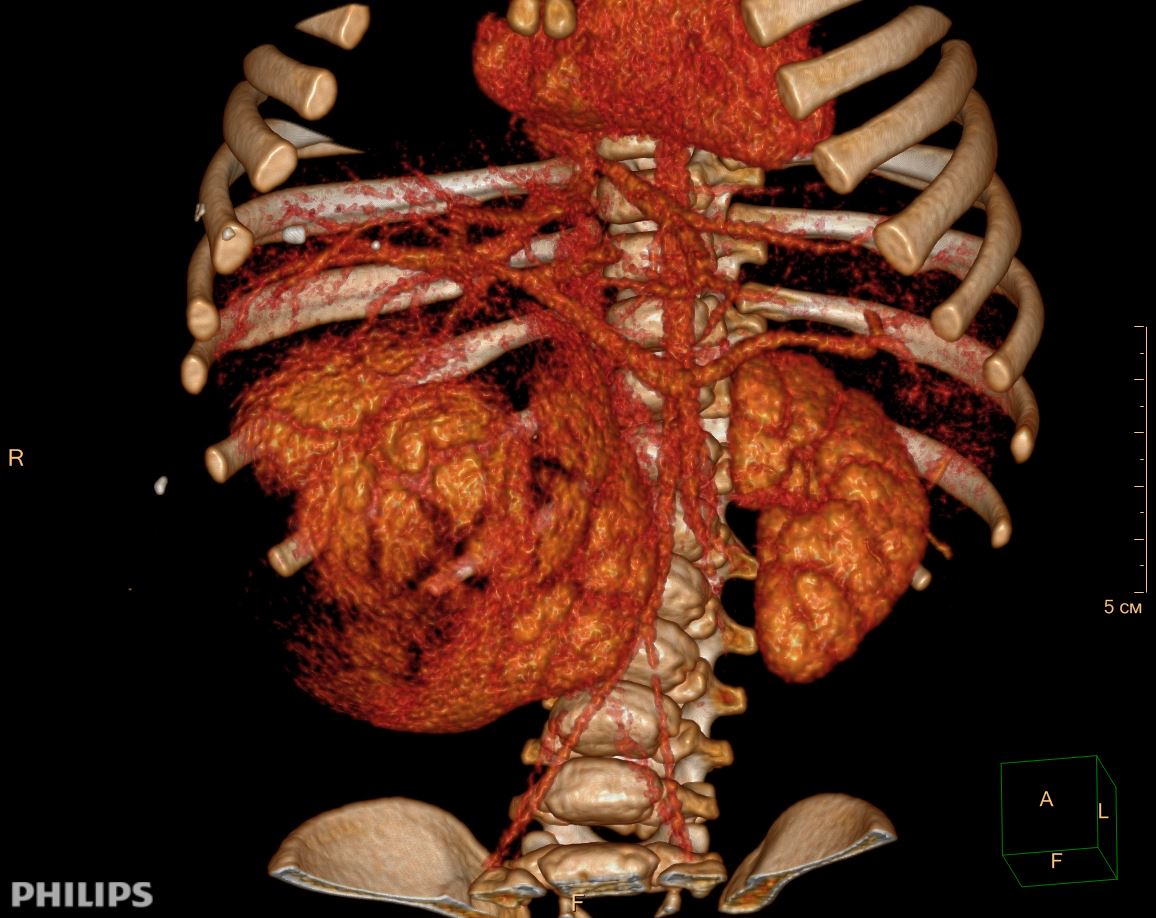
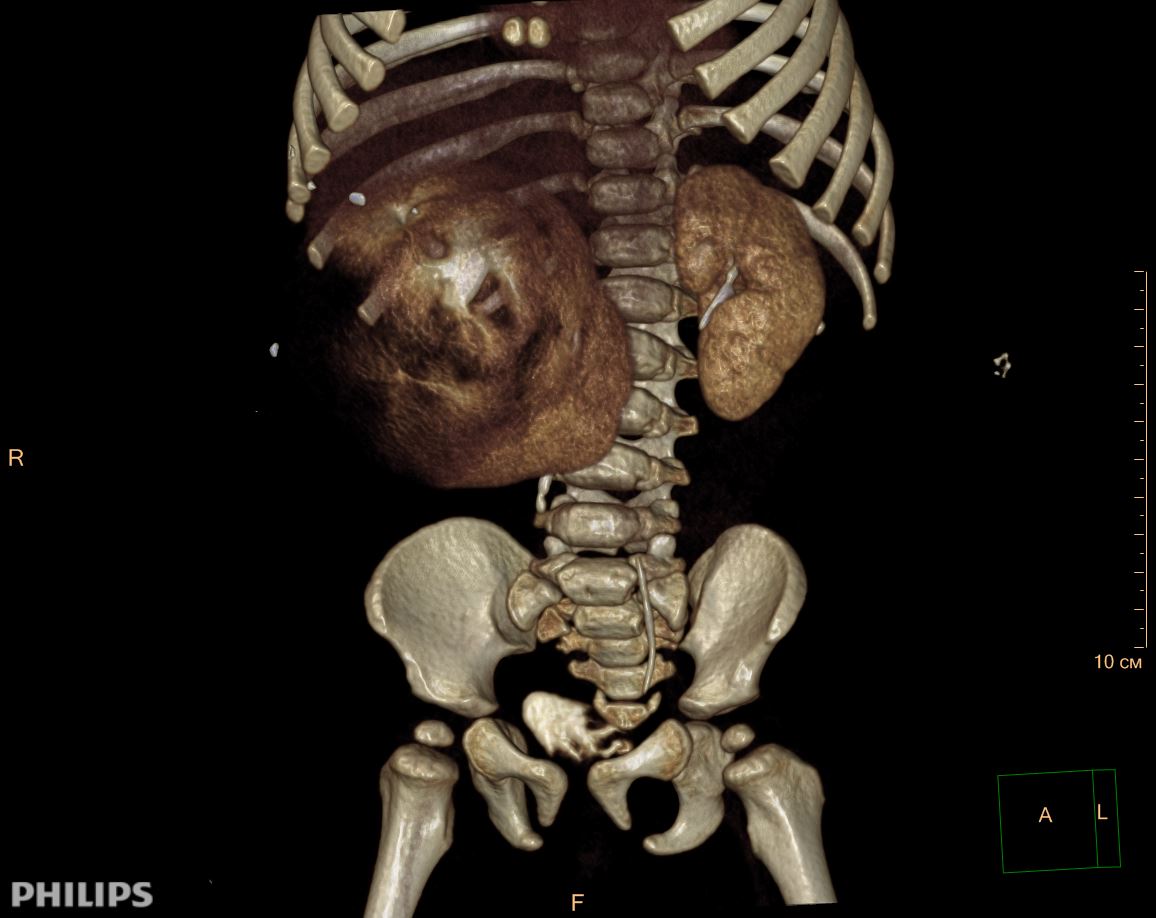
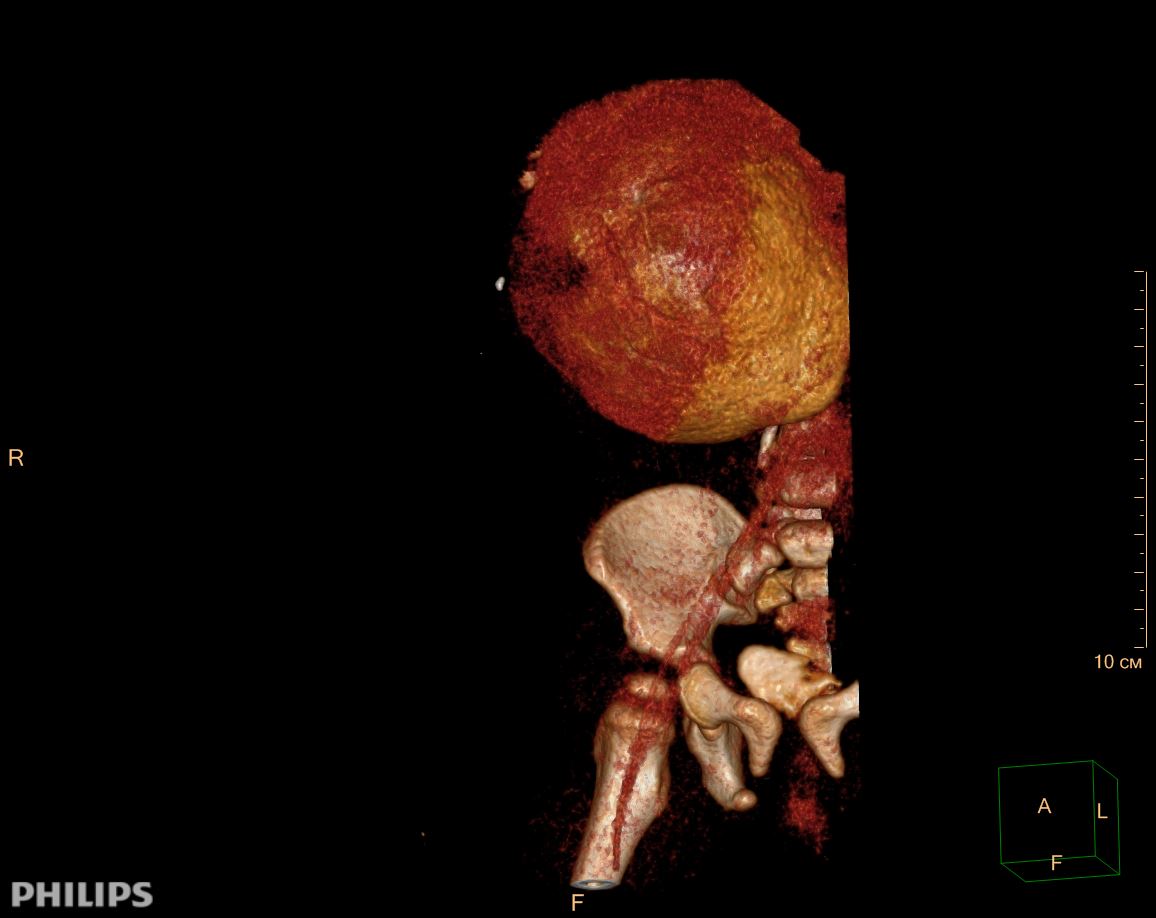
3D-реконструкции опухоли Вильмса пациентов детского отделения НМИЦ онкологии им. Н.Н. Петрова
Клинические симптомы опухоли почки у детей
Нефробластома может длительное время протекать бессимптомно. Первым признаком заболевания, который замечают родители, является увеличение размеров живота. Иногда ребенок жалуется на боли в животе. При микроскопическом исследовании мочи можно выявить микрогематурию.

Диагностика нефробластомы
Диагностические мероприятия при подозрении на опухоль Вильмса направлены, в первую очередь, на морфологическую верификацию диагноза и определение степени распространенности процесса в организме.
Основными инструментальными методами в диагностике опухоли почек у детей и подростков являются:
- УЗИ органов брюшной полости и забрюшинного пространства.
- Компьютерная томография органов брюшной полости и забрюшинного пространства с оральным и внутривенным контрастированием.
- Магнитно-резонансная томография брюшной полости и забрюшинного пространства без и с контрастным усилением (даёт дополнительную информацию о распространённости и связи опухоли с окружающими органами).
- Радиоизотопное исследование почек – реносцинтиграфия позволяет оценить как суммарную функцию почек, так и отдельно функцию каждой из них.
- Для исключения метастатического поражения легких проводятся рентгенография и компьютерная томография органов грудной клетки.
Лабораторные исследования являются рутинными и включают в себя: клинический анализ крови, общий анализ мочи, биохимический анализ крови.
Непременным условием для постановки диагноза является выполнение тонкоигольной аспирационной биопсии опухоли под УЗИ-навигацией с проведением цитологического исследования полученного материала.
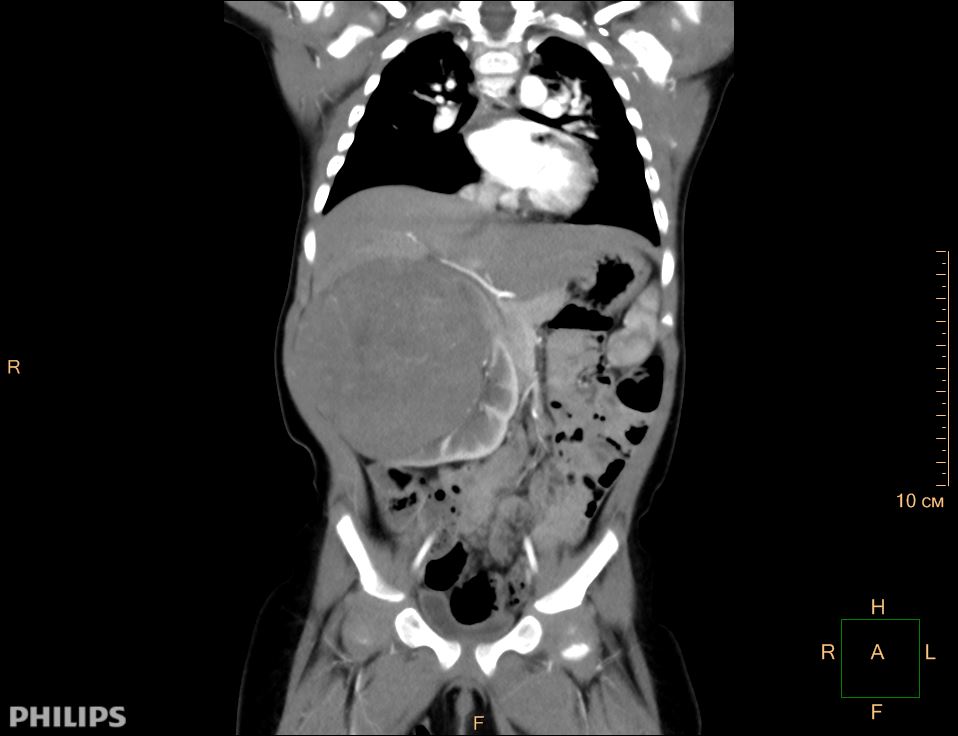
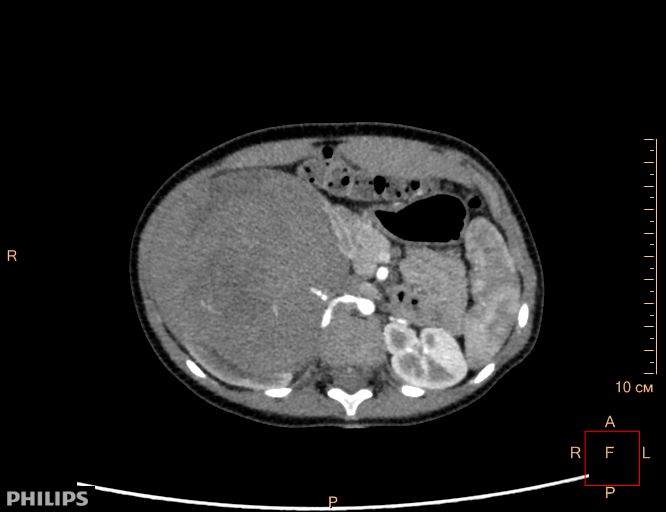
Опухоль Вильмса. Компьютерная томография
Общие принципы лечения опухолей почки у детей и подростков
Лечение нефробластомы у детей осуществляется по стандартным методикам, принятым в европейских странах, и включает в себя проведение неоадьювантного курса полихимиотерапии, операции – туморнефроуретерэктомии, послеоперационной химиотерапии и, по показаниям, лучевой терапии.
Предоперационный курс химиотерапии длится от 4-х до 6-ти (при IV стадии) недель. Задача терапии – максимальное уменьшение размеров опухоли с целью предотвращения ее интраоперационного разрыва и достижения максимальной резектабельности. Базовыми препаратами, используемыми в данном курсе, являются винкристин и дактиномицин.
Оперативный этап лечения опухоли почки заключается в радикальном одномоментном удалении всей ткани опухоли. Туморнефроуретерэктомию проводят из срединного доступа. Обязательной является ревизия печени, контралатеральной почки и регионарных лимфатических узлов.
Послеоперационная химиотерапия проводится после разделения больных на группы риска в соответствии с гистологической структурой опухоли и стадии заболевания.
Лучевая терапия проводится параллельно послеоперационной полихимиотерапии, начинается на 2-3 неделе после удаления опухоли. Длительность лучевой терапии составляет 7-10 дней. Объем облучения зависит от результатов операции.
Показаниями к послеоперационной локальной лучевой терапии с облучением ложа опухоли являются:
- Стандартный риск нефробластомы, III стадия.
- Высокий риск, стадия II и стадия III
- Стадия IV и V – в зависимости от локальной стадии.
Диспансерное наблюдение при нефробластомах
Наблюдение за излеченными пациентами осуществляется для выявления рецидива и отдаленных последствий лечения.

В течение первых двух лет после окончания терапии пациенты обследуются каждые три месяца. Далее, до достижения пятилетнего срока наблюдения – каждые 6 месяцев. В алгоритм обследования включаются: УЗИ органов брюшной полости, рентгенография органов грудной клетки при каждом визите. При необходимости дополнительно рекомендуются проведение исследования функции почки (анализ мочи, биохимическое исследование крови, ренография), углубленное исследование сердечно-сосудистой деятельности (ЭКГ, ЭХО-КГ), исследование слуха методом аудиометрии.
После пяти лет наблюдения пациенты обследуются не чаще одного раза в год.
Все дети, закончившие программное лечение, могут продолжить посещение организованных детских коллективов (школа, детский сад).

Авторская публикация:
КУЛЕВА СВЕТЛАНА АЛЕКСАНДРОВНА
заведующая отделением химиотерапии и комбинированного лечения злокачественных опухолей у детей, доктор медицинских наук
Ультразвуковое исследование (УЗИ) играет важную роль в диагностической визуализации опухолей почек у детей, потому что оно легко выполняется без седации и не имеет ионизирующего излучения. На полутоновых серошкальных изображениях можно легко отличить твердое поражение от кистозного. Цветовое допплерография и спектральный анализ используется для оценки целостности почечных сосудов.
После того как УЗИ почек у ребенка продемонстрировало подозрение на злокачественное новообразование, дополнительно выполняется КТ или МРТ для более четкого определения степени заболевания. Опухоль Вильмса - наиболее распространенная в педиатрии опухоль почек. Имеются четкие клинические и ультразвуковые критерии, которые помогают в дифференциации опухоли Вильмса с другими почечными образованиями у детей.
Нормальная сонографическая анатомия почек в педиатрии
Размеры почки и эхогенность паренхимы зависят возраста больного. Наиболее часто используемые измерения размеры – это длина от верхнего до нижнего полюса. На понимать, что размер длины почек, полученных у пациента в положении лежа на спине или в положении лежа на боку имеют тенденцию быть немного выше, чем полученный если ребенок лежит на животе.
Кортикальная эхогенность новорожденных и грудных детей имеет тенденцию быть выше, чем у детей старшего возраста и взрослых. Она обычно совпадает или превышает эхогенность прилегающей печени или селезенки, в то время как кора почки у пожилых лиц является гипоэхогенна по отношению к этим органам. Повышение кортикальной эхогенности у ребенка, как считается, обусловлено увеличением клеток и количества корковых клубочков, что приводит к более акустическому эффекту. У здоровых доношенных новорожденных почечная кортикальная эхогенность обычно не больше, чем в печени или селезенке. В отличие от почечной кортикальной эхогенности у недоношенных детей, которая часто гиперэхогенна чем эти органы.
Чем более недоношенный ребенок, тем больше вероятность, что почечная кора будет гиперэхогенная. В младенчестве снижение эхогенность почечной коры появляется уже после 1 года она, как правило, она становиться гипоэхогенной по отношению к соседним печени или селезенки. У младенцев менее 1 года в медуллярные пирамиды проявляются более заметной гиперэхогенностью, чем у детей старшего возраста и взрослых. Этот вид, как считается, возникает из-за большего медуллярного объема и меньшего объема коры почки у младенцев.
Наконец, почечный синус у новорожденных и грудных детей является менее эхогенным, чем у детей старшего возраста и взрослых, из-за относительной скудности жира в этом месте. Эхогенность почечного синуса увеличивается с возрастом и подходит по виду к взрослым уже в подростковом возрасте. Как правило, почечная лоханка при измерении составляет 10 мм или менее в диаметре, а переднезадней и не связан с дилатацией чашечно-лоханочной системы. Стенки собирательной системы в норме не видны. Ее утолщение предполагает наличие инфекции мочевыводящих путей, пузырно-мочеточниковый рефлюкс, или хроническую непроходимость.
Опухоль Вильмса составляет примерно 6% от всех детских новообразований и является наиболее частой педиатрической проблемой опухолей почек. Текущая 5-летняя выживаемость превышает 90%. Большинство проявлений опухоли Вильмса появляются в течение первых 5 лет жизни, со средним возрастом на момент постановки диагноза для мальчиков с односторонней болезнью 41,5 месяцев по сравнению с 46,9 месяцами для девочек. Для детей с двусторонней болезнью средний возраст на момент постановки диагноза составляет 29,5 месяцев для мальчиков и 32,6 месяцев для девочек. Опухоль Вильмса - это редкая опухоль на УЗИ у новорожденных с менее 0,16% случаев происходят в этой возрастной группе. Примерно 6% опухоли Вильмса являются двусторонними. Хотя большинство этих опухолей появляется у одного члена семьи, около 1% являются семейными. Режим наследования обычно аутосомно-доминантный с переменной пенетрантностью и экспрессивностью. Нарушений внепочечного встречаются примерно у 8% пациентов, у которых опухоль Вильмса, в том числе врожденных спорадическая аниридия, и дисбактериоз расстройств, таких как hemihypertrophy. Определенные генетические синдромы также ассоциированы с опухолью Вильмса, в том числе трисомия, синдром Беквита-Видемана, и WAGR (опухоль Вильмса, аниридия, мочеполовые аномалии, умственная отсталость) и DRASH (мужского псевдогермафродитизма и прогрессирующий гломерулонефрит) синдромы.
Опухоль Вильмса, как предполагается, развивается в результате аномального гистогенеза. Бластема почечной ткани считается предвестником опухоли Вильмса. Развития почек плода завершается на 36 недели гестации, и почки нормальных доношенных детей не должны содержать никаких остаточных очагов почечной бластемы.
Гистологически опухоль Вильмса содержит эпителиальные, стромальные и элементы бластемы. Гистология опухоли - самый важный прогностический фактор. Благоприятная гистология определяется в примерно 90% всех новообразований, состоящих из достаточно хорошо дифференцированной почечной ткани с эмбриональными или недоразвитыми клубочками и образованием канальцев, окруженных стромальными клетками шпинделя. Опухоль может иметь компоненты поперечно-полосатых мышц, волокнистой соединительной ткани, хряща, кости и жировой ткани. Неблагоприятная гистология возникает в около 10% опухолей, в особенности анапластических, включая изменчивость в размерах и форме ядер, укрупненными гиперхромными ядрами и большим количеством фигур митоза.
Опухоль Вильмса по данным УЗИ может возникнуть в любой части почки. Чаще всего ее рост бывает экзофитным, но обычно расширяется в почечной паренхиме, поэтому смещает и искажает чашечно-лоханочную систему. Она обычно твердая и имеет псевдокапсулу, что отделяет его от нормальной почечной паренхимы. Почечная капсула, как правило, остается неповрежденной и редко, опухоль прорывает капсулу и распространяется на внепочечного пространства. Районы центральной кровоизлияния и некроз может привести к кистозным внешний вид. Местные метастазы в регионарные лимфатические узлы часто. Иногда там может быть уротелиальная распространение. Образование может вторгнуться в почечную и нижнюю полую вену. Важно задокументрировать венозное расширение в предоперационном периоде, так как ее присутствие влияет на хирургический подход. Отдаленные метастазы чаще возникают в легкие и печень. Расширение почечной вены объясняется высокую частоту (от 12% до 20%) гематогенных метастазов в легкие на момент диагностики. Хотя многие метастазы в легкие выявляются при рентгенографии грудной клетки, КТ важно для проверки наличия или отсутствия метастазов небольших размеров. Пневмоторакс иногда осложняется метастазами при анапластической форме опухоли Вильмса.
При визуализации опухоли на ультразвуковом сканировании необходимо определить размер и местонахождение первичной опухоли, местное распространение и место отдаленных метастазов. Визуализация используется также для наблюдения людей, подверженных риску развития опухоли первичного или рецидивного образования. Спорадически опухоли обычно диагностируются путем наблюдения при вздутии живота и при пальпации брюшной полости.
Опухоли, связанные с передачей семейных и генетических синдромов, часто обнаруживаются при обследовании. Скрининг на опухоль Вильмса у пациентов, связанных с ним синдромов должны начинаться в диагностике синдрома с серийным УЗИ почек каждые 3 - 4 месяца в течение от 5 до 7 лет. Длительность обследования зависит от возраста презентации опухоли Вильмса в состоянии предрасполагающих. В возрасте от 5 до 7 лет, в зависимости от конкретного состояния под наблюдение в виде скрининга может быть прекращена, поскольку риск развития опухоли Вильмса значительно уменьшается.
УЗИ почек обычно первый метод визуализации, проводимый у ребенка, когда у него прощупывается образование в брюшной полости. Опухоли Вильмса обычно крупные, резко выступающие, с гиперэхогенной относительно нормальной почечной паренхимой. Гипоэхогенные зоны в пределах опухоли могут быть обусловлены кровоизлиянием, некрозом или расширением чашечек. Из-за высокой частоты распространения опухоли Вильмса в почечной вене, нижней полой вене (НПВ), а иногда в правом предсердии, тщательного надо анализировать и исключать опухолевый тромб с помощью цветового допплеровского картирования и спектрального анализа на УЗИ почек у детей с является обязательным. Венозное расширение диагностируется, когда идентифицируется гиперэхогенный внутрисосудистый фокус. Эта ситуация может помешать адекватной оценки на УЗИ венозных структур, особенно у беспокойных детей. Ультразвуковое исследование обычно бывает полезным для определения проходимости нижней полой вены. Опухоли Вильмса, как правило, большие, но точная ультразвуковая оценка НПВ может быть затруднена из-за возникающих активных перемещений и сжатия ее массивной опухолью.
Современное лечение опухоли Вильмса является хирургическая операция с адекватной химиотерапией. Противоположной почки исследуется для исключения синхронной двусторонней опухоли. Лучевая терапия может использоваться после операции. Большинство онкологов считают, что 2-летняя безрецидивная выживаемость после лечения свидетельствует о восстановлении.
Операции с дополнительной химиотерапией и облучением привело к 2-летней выживаемости более 90% у пациентов, которые имеют благоприятные возможности по данным гистологического контроля. Однако, смертность остается высоким у детей из-за неблагоприятных особенностей опухоли. Последующие обследования после лечения включает в себя серийное КТ грудной клетки и УЗИ брюшной полости и МРТ.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Цель исследования. Оценить возможность сонографии в диагностике опухолей малого таза у детей.
Результаты. На первом этапе диагностики установлено, что для злокачественных новообразований малого таза характерны неправильная форма, которая встречалась у 97 (88,2%; p 0,05) наблюдались кальцинированные включения, акустическая плотность опухолей у 75 детей (68,2%) р=0,001 была пониженной. При допплерографии у наибольшего количества пациентов (100 (90,9%)) регистрировался гиперинтенсивный внутриопухолевый кровоток преимущественно артериального типа с диапазоном максимальных артериальных скоростей (МАС) от 12,5 до 45 см/с, среднее значение МАС – 30±2,7 см/с. Специфичность метода составила 86,3% (р=0,001), чувствительность – 85,2% (р=0,011), точность – 87,5% (р=0,014). В ходе лечения, после каждого курса полихимиотерапии, осуществлялся ультразвуковой контроль, мы оценивали изменения в размерах, структуре и неоваскуляризации новообразований, что позволяло оценить эффективность противоопухолевого лечения.
Заключение. Комплексная сонография является важным методом в первичной диагностике злокачественных тазовых опухолей в детском возрасте и приоритетным методом на этапах мониторинга противоопухолевого лечения, позволяющим определить степень распространенности опухолевого процесса и избежать многократной лучевой нагрузки на растущий детский организм.
344037, Российская Федерация, г. Ростов-на-Дону, ул. 14-я линия, д. 63
д.м.н., профессор, заведующая отделением детской онкологии № 1
SPIN: 6923–7360, Author ID: 732882
344037, Российская Федерация, г. Ростов-на-Дону, ул. 14-я линия, д. 63
SPIN: 2856-7946, AuthorID: 734046
344037, Российская Федерация, г. Ростов-на-Дону, ул. 14-я линия, д. 63
344037, Российская Федерация, г. Ростов-на-Дону, ул. 14-я линия, д. 63
1. Мень Т. Х., Поляков В. Г., Алиев М. Д. Эпидемиология злокачественных новообразований у детей в России. Онкопедиатрия. 2014; 1(1): 7–12.
2. Желудкова О. Г., Поляков В. Г., Рыков М. Ю., Сусулева Н. А., Турабов И. А. Клинические проявления онкологических заболеваний у детей: практические рекомендации. Под ред. В. Г. Полякова, М. Ю. Рыкова. СПб.: Типография Михаила Фурсова, 2017; 52 с.
6. Детская онкология. Национальное руководство. Под ред. М. Д. Алиева, В. Г. Полякова, Г. Л. Менткевича, С. А. Маяковой. М.: Издательская группа РОНЦ, 2012; 681 c.
7. Нечушкина И. В., Нечушкина В. М., Бойченко Е. И., Сусулева Н. А., Рябов А. Б., Казанцев А. П. и др. Опыт лечения детей с герминогенными опухолями яичников: исторический обзор. РМЖ. Медицинское обозрение. 2019; 3(3): 20–21.
8. Максимова Н. А., Ильченко М. Г., Агаркова Е. И. Особенности ультразвукового исследования в диагностике рака мочевого пузыря. Евразийский онкологический журнал. 2014; 3(3): 721–722.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Лекция для врачей "УЗИ-диагностика опухолей мягких тканей". Лекцию для врачей поводит Зайцев Александр Николаевич врач-рентгенолог, врач ультразвуковой диагностики.
На лекции рассмотрены следующие вопросы:
- УЗИ в настоящее время - на первом месте в первичной диагностике опухолей мягких тканей:
- информативно
- наименее трудоёмко
- безопасно
- экономично
- в большинстве медицинских учреждений
- визуализирует структуры мягких тканей любой локализации
- хорошо различает солидные и жидкостные образования даже до 5 мм диаметром, плотные рубцовые изменения
- компрессия тканей датчиком позволяет в определённой степени оценить их плотность, более точно устанавливаемую с помощью эластографии
- в большинстве случаев имеет возможность определить
- размеры
- структуру
- васкуляризацию опухоли
- состояние магистральных сосудов
- доступны для исследования и регионарные лимфатические узлы
- стандартное УЗИ позволяет оценить в целом состояние окружающих тканей, в т.ч. прилежащих костных структур
- небольшие рецидивные узлы после удаления опухоли, практически не визуализируемые при рентгенологическом исследовании на фоне мышц и послеоперационных изменений, достаточно отчётливы при УЗИ
- при небольших размерах опухоли в большинстве случаев данные УЗИ (с учётом морфологического заключения) достаточны для планирования лечебной тактики, включая операцию
- эхографический контроль считается одним из наиболее эффективных при выполнении чрескожной биопсии: при этом, особенно с использованием эластографии - имеется возможность выбора наиболее плотного участка вне зон распада, некроза в структуре опухоли
- О характере опухоли при УЗИ можно судить по
- состоянию контуров
- эхогенности
- степени однородности структуры
- васкуляризации
- Главный признак, на основании которого предполагается опухоль при УЗИ - наличие в мышечном слое (большинство сарком развиваются в нём) узлового гипоэхогенного неоднородного образования (диагностика прежде всего по факту визуализации узлового образования, исключение — доброкачественные сосудистые опухоли)
- В ряде случаев по данным УЗИ можно судить о гистогенезе опухоли - в частности:
- при липомах:
- обычно однородны
- часто несколько более эхогенны, чем окружающий жир, или изоэхогенны
- при гемангиомах:
- неоднородно эхогенны из-за различных плотностей составляющих их тканей
- могут быть видны флеболиты, повышенный кровоток
- предположительно при невриномах:
- хорошо очерченные гипоэхогенные веретенообразные узлы по ходу нерва
- с легким дорсальным усилением
- может у полюсов образования прослеживаться нервный ствол-кисты (из неопухолевых изменений)
- лимфангиомы:
- гипоэхогенны и анэхогенны с дорсальным усилением
- хорошо очерченные гипоэхогенные веретенообразные узлы по ходу нерва
- при липомах:
- При УЗИ можно высказаться о наличии злокачественной опухоли мягких тканей:
- по факту визуализации узлового образования (прежде всего по этому признаку, как основному при дифференциации опухолевых и неопухолевых изменении мягких тканей в целом) с учётом его локализации гипоэхогенной и неоднородной структуре, нередко с наличием участков распада выраженной васкуляризации при цветовом допплеровском картировании. Морфологическую принадлежность опухоли (прежде всего — злокачественной опухоли) по УЗ-данным можно лишь предполагать
- При эхографии (внутри ультразвукового метода исследования) всегда целесообразен комплексный подход следует использовать разные датчики. в числе которых обязательны высокочастотные (не менее 5 MГц)


- Опухолевые и неопухолевые образования, которые легче всего дифференцировать по данным эхографии
- Липома, липосаркома (больше нелинейная неоднородность), старый рубец (с тенью) гемангиома (сосудистые структуры на гиперэхогенном фоне)

- Типичные с разной исчерченностью - правильная архитектоника

- В диагностике таких липом помогает сравнение симметричных участков мягких тканей

- Допплерографическая картина липом — скудная

- При визуализации сосудов в опухоли - наличие низкоамплитудных спектров

- При применении вазоактивных препаратов (нитромази) реагирование сосудистых спектров: сдвиги одного или нескольких показателей кровотока на 3% и более

- Реагирование кровотока в другом сосуде - в области сосудистой ножки опухоли

- При эластографии - низкие показатели жёсткости. На эластограммах диффузные липомы более чётко контурируются в сравнении с серошкальными ЭГ

- Липосаркомы - кроме частичной гиперэхогенности, в их ультразвуковой картине мы видим противоположность таковой изображению липом

- В высокодифференцированных липосаркомах - нелинейные гипоэхогенные участки, более плотные при эластографии

- Более высокие скорости кровотока более разнообразные сосудистые спектры

- При применении вазоактивных препаратов (нитромази) — обычно менее выраженное реагирование сосудистых спектров: сдвиги показателей кровотока отсутствуют либо менее 3% от исходной величины

- Доброкачественные сосудистые опухоли мягких тканей
- видны сосудистые структуры на гиперэхогенном фоне либо
- кистевидные структуры

- Рабдомиосаркомы большая частота встречаемости участков распада в опухоли

- Фибромы - очень высокая плотность, обуславливающая высокий коэффициент жёсткости при эластографии

- Нейриномы и нейрофибромы - возможны гиперэхогенный ободок, слоистость строения


- Нейросаркомы - вытянутость формы


- Аневризмы, ложная аневризмы - видим связь с сосудом, кровоток в образовании

- Разрыв мышцы-помогают функциональные пробы (сгибание и разгибание)

- Организовавшаяся гематома - уточняется по динамике её эхогенности (повышается), размеров (уменьшаются), появлению дорсальной тени

- Варикозное расширение вен - видим саму изменённую вену

- Эндометриоз - схожесть с фибромой, но: может содержать жидкостные включения и имеет низкий коэффициент жёсткости

Встречает мысли эхогенность,
Что в мире Троице сродни
Затем — структуры одномерность
И контур просим: помоги
И отраженья волшебство -
На жидкость, на обызвествленья
Укажут — словно Божество.
И отражающий сигнал -
Эластоконтур чётко дал.
И бледный нрав липосарком,
Да кист скупая эхобедность -
Разнообразят дифф. УЗ-ком.
Липосаркому от липомы
Сосуды, жёсткость отличат,
А ободок и длинность формы
Из нерва бяку обличат.
Хрящ обожает в чреве известь,
Которой также не чужды
Сосуд и кровь, что вдруг излилась
Без организменной нужды.
Саркомы — глубже залегают,
В поверхность лезет метастаз.
Есть исключения, я знаю
Лей-, дермо- выше всех — не раз
Пусть различать не так уж просто
Из мягких тканей злой купаж,
Сосудов тест поможет в росте
Разграничения без браш-.
Берите датчики и смело
Высокой, низкой частотой
Шумите там, где неумело
Припухлость встала на постой!
Коль что-то вдруг несимметрично
Иль наблюдения велит -
Поможет ПНУ как лаконичный
Не забывайте про другие
Лучей и клиники пути.
Хоть те - активны, дорогие,
От них совсем-то не уйти!
Хотя, во многом эхографство
Свой хлеб насущный сохранит -
Без плагиата, без лукавства,
Шумя на всех наук гранит
Книги по медицине с доставкой

Широко освещены вопросы нормальной ультразвуковой анатомии органов брюшной полости, поверхностных органов и структур, включая редкие области исследования: орган зрения, слюнные железы, мышцы. Варианты нормальных ультразвуковых изображений, полученных в режиме традиционной "серой шкалы", а также с применением ультразвуковой допплерографии (цветовое картирование и спектральный анализ кровотока).

Патология неопухолевого и опухолевого характера внутренних и поверхностно расположенных органов. Освещены особенности диагностики как в традиционном В-режиме, так и в режимах кодирования кровотока, Книга содержит свыше 800 сонограмм. В приложениях представлены основные стандартные протоколы ультразвукового исследования различных органов.

Цель исследования: улучшение лучевой диагностики опухолей и опухолевидных образований мягких тканей путем выполнения комплексного УЗИ. Детально описана УЗ-семиотика этих заболеваний при их визуализации в В-режиме. Показана диагностическая эффективность изучения степени кровоснабжения различных образований с помощью допплерографии.
Читайте также:

