Мрт для диагностики саркомы
а) Терминология:
1. Синонимы:
• Семейство опухолей типа саркомы Юинга (ESFT)
• Круглоклеточная опухоль кости
2. Определения:
• Агрессивные злокачественные опухоли детского возраста: саркома Юинга, опухоль Аскина и периферическая примитивная нейроэктодермальная опухоль (PNET)
б) Визуализация:
1. Общие характеристики саркомы Юинга позвоночника:
• Наиболее значимый диагностический признак:
о Инфильтративное литическое поражение тела позвонка или крестца
• Локализация:
о Позвоночник: 5% всех опухолей Юинга
о Поражение в первую очередь тела позвонка и только потом дуги позвонка
о Наиболее распространенная позвоночная локализация - крестец
о Могут поражаться смежные кости: позвонки, ребра или подвздошная кость
о Распространяется вдоль периферических нервов
о Может исходить из эпидуральных или паравертебральных мягких тканей
5. Радиоизотопные методы исследования:
• Костная сцинтиграфия:
о Положительный результат исследования во всех трех фазах сканирования
• ПЭТ:
о Усиление захвата ФДГ в области первичной опухоли, метастатических очагов
6. Рекомендации по визуализации:
• Наиболее оптимальный метод диагностики:
о МРТ позволяет наиболее точно оценить степень поражения костей и мягких тканей, тогда как по результатам КТ распространенность опухоль зачастую недооценивается
- Ввиду наличия перитуморозного отека размеры опухоли могут быть переоценены
• Протокол исследования:
о МРТ для оценки распространения опухоли:
- Сагиттальные Т1-ВИ
- Аксиальные и сагиттальные STIR, Т1-ВИ с КУ
о КТ информативна в отношении доказательства отсутствия опухолевого матрикса и дифференциального диагноза ее с остеогенной саркомой (ОГС)
в) Дифференциальная диагностика саркомы Юинга позвоночника:
1. PNET:
• Клинически/рентгенологически идентична саркоме Юинга
• Может исходить как из кости, так и из мягких тканей
• Более выраженная нейроэктодермальная дифференцировка опухолевых клеток
3. Лимфома и лейкемия:
• Рентгенологическая картина идентична саркоме Юинга
• Нечетко ограниченное литическое образование с признаками инфильтративного роста
• Чаще поражается тело, чем дуга позвонка
• Нередко имеют место множественные очаги
4. Метастазы нейробластомы:
• Надпочечниковая или вненадпочечниковая первичная локализация
• Встречается в детском возрасте
• Костные очаги характеризуются идентичной саркоме Юинга рентгенологической картиной
7. Множественная миелома:
• Характерна для лиц пожилого возраста
• Обычно множественное поражение позвонков
8. Хордома:
• Наиболее часто локализуется в крестце
• Исходит из срединной линии
• Экспансивное расширение и деструкция кости
9. Гигантоклеточная опухоль:
• Исходит из тела позвонка
• Узкая переходная зона
• Фокальная деструкция кортикального слоя
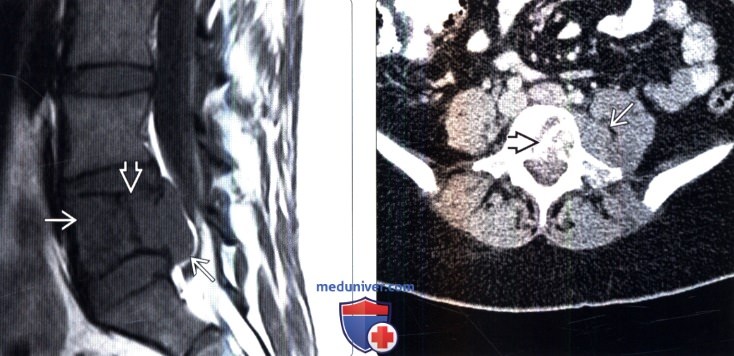
(Слева) Сагиттальный срез, Т1-ВИ: саркома Юинга, практически полностью поражающая тело L5 позвонка и распространяющаяся в эпидуральное пространство. Линия низкой интенсивности сигнала представляет собой не границу опухоли, а зону реактивного склероза. Опухоль в Т1 -режиме характеризуется относительно низкой интенсивностью сигнала по сравнению с красным костным мозгом и мышцами.
(Справа) Аксиальный КТ-срез, этот же пациент: более четко визуализируется зона реактивного остеосклероза в толще опухоли. Видны признаки распространения опухоли в паравертебральные ткани.
г) Патология:
1. Общие характеристики:
• Этиология:
о Мезенхимальные клетки с минимальными признаками дифференцировки в нейроэктодермальные клетки
• Генетика:
о Реципроктная транслокация между геном EWS в 22 хромосоме и ETS-подобными генами в 11 хромосоме - t(11 ;22)
2. Стадирование, степени и классификация саркомы Юинга позвоночника:
• Общепринятой схемы стратификации рисков для пациентов с саркомами Юинга не существует
3. Макроскопические и хирургические особенности:
• Опухоль серовато-белого цвета
• Нечеткие границы с окружающими тканями
• Очаги кровоизлияний, кистозной трансформации, некрозов
4. Микроскопия:
• Мелкие округлые клетки (в 2-3 раза превышающие размеры лимфоцитов), скудная цитоплазма
• Нечеткие границы клеток
• Округлые ядра, нередко имеют вдавления, высокий уровень митотической активности
• Солидные пласты клеток разделены фиброзными пучками на дольки неправильной формы
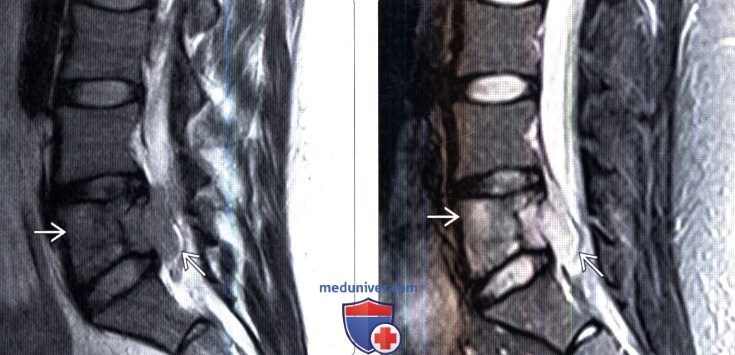
(Слева) На сагиттальном Т2-ВИ этого же пациента сигнал опухоли изоинтенсивен сигналу красного костного мозга.
(Справа) На сагиттальном STIR МР-И этого же пациента опухоль характеризуется гиперинтенсивным по сравнению с красным костным мозгом сигналом. В STIR-режиме саркома Юинга обычно видна более четко.
д) Клинические особенности:
1. Клиническая картина саркомы Юинга позвоночника:
• Наиболее распространенные симптомы/признаки:
о Локальный болевой синдром
о Лихорадка, лейкоцитоз, повышение СОЭ (картина напоминает остеомиелит)
о Неврологическая симптоматика может варьировать от радикулопатии до парезов и параличей
о Vertebra plana
2. Демография:
• Возраст:
о 90% всех сарком Юинга диагностируются в возрасте
Редактор: Искандер Милевски. Дата публикации: 26.8.2019
Существует множество методов обследования, при помощи которых выявляется в разной степени точности и достоверности патология определенных конкретных структур человеческого организма: определенного сустава или органа. Однако связочный аппарат, мускулатура, подкожножировая клетчатка, кожа, железы наружой секреции также подвергаются различным заболеваниям и патологическим процессам. Для визуализации подобных мягкотканных структур методом выбора является МРТ.
Кроме того МРТ исследование мягких тканей различных областей организма играет важную роль в случаях, когда жалобы и симптомы пациента сложно связать с конткретной анатомической структурой.
Рассмотрим примеры патологий, выявляемой при исследовании мягких тканей различных областей тела человека.
Гемангиома – частая мягкотканная опухоль, характеризующаяся пролиферацией нормальных или патологических сосудистых структур. Встречается капиллярного и кавернозного характера.
Клинически проявляется болевым синдромом, определяется как пальпируемое пульсирующее образование. Возможно увеличение при физической нагрузке.

Жен., 27 лет. Пальпируемое, пульсирующее образование передней поверхности бедра (в/3). Визуализируется подкожно расположенное мягкотканное образование сосудистого характера, с выраженно дольчатыми контурами. Гемангиома.
Саркома - гетерогеная группа злокачественных мезенхимальных опухолей. Мужчины поражаются в 1,5 раза чаще. Локализуется на туловище, конечностях, забрюшинно. Гистологически выделяют лейомио- , фибро-, липо-, рабдомиосаркомы, гемангио- , синовиальную саркому и др.
Характерно: образование псевдокапсулы; смещение окружающих тканей при большом размере опухоли; метастазирование в легкие, печень, поражение лимфоузлов.
Клинически проявляется местными симптомами (боль, отек) и общими онкологическими (потеря массы тела, слабость анемия).

Т2-cor T1-cor +контраст.
Муж., 79 лет. Больших размеров саркома мягких тканей передней поверхности бедра. При внутривенном контрастировани отмечается диффузно-неоднородное усиление, преимущественно по периферии за счет наличия центрального некроза.
Липома - наиболее частая опухоль мягких тканей из адипоцитов в фиброзной капсуле. Опухоль часто разделена соединительнотканными перегородками. Возрастная предрасположенность 30-50 лет. Женщины поражаются чаще. Характерен очень медленный рост, отсуствие болевого синдрома.

a) Т2-cor б) Т2-tra +жироподавление
Муж., 63 года. Определятся овальной формы внутримышечное образование (в vastus lateralis). При жироподавления просходит инверсия МР-сигнала на гипоинтенсивный. Липома.
Нередко при исследовании мягких тканей встречаются различного рода кистозные образования.

Кистозное объемное образование в подкожной жировой клетчатке передне-медиальной поверхности левой голени на уровне верхней трети.
Остеосаркома- наиболее частая первичная злокачественная опухоль кости; смешанная остеолитическая/бластическая опухоль, с агрессивным ростом, деструкцией кортикального слоя и злокачественными изменениями надкостницы. Подразделяется на классическую, телеангиэктатическую и поверхностную (надкостничную) формы. Пик частоты 10-25 и 60-80 лет. Чаще локализуется в метадиафизах длинных трубчатых костей. Клинически проявляется болевым синдромом.

Т1-cor. Классическая остеосаркома с распространением на эпифиз (белые стрелки) и обширным параоссальным компонентом (черная стрелка).
Т2 FS cor. Телеангиэктатическая остеосаркома. Кистозный компонент в опухоли. Минимальные изменения костного мозга, обширный параоссальный компонент, инфильтрация мягких тканей.
Т2-sag. Остеосаркома надкостницы (стрелка).
Хондросаркома - 2-ая по частоте злокачественная опухоль кости.
Пик частоты 30-50 лет. Мужчины поражаются в 2 раза чаще женщин.
Возникает первично или вторично при малигнизации доброкачественных опухолей (энхондроматоз, наследственные экзостозы).
Обычно центральное расположение возле метафизов длинных трубчатых костей, костей таза и ребер (реже эксцентричное, поднадкостничное и внекостное расположение).
Характерен внезапный приступ болей тупого характера.

Т1-tra T2-tra T1-cor+контраст
Жен., 23 года. Надкостничная хондросаркома бедра. При внутривеном контрастировани определяется периферическое, септальное, дольчатое усиление.
Саркома Юинга - вторая по частоте высокозлокачественная опухоль у детей, поражающая длинные трубчатые кости, кости таза и позвонки. Это агрессивно растущая мета-диафизарная опухоль с реакцией надкостницы и параоссальным компонентом. Характерно отсутствие образования опухолевого матрикса.
Пик частоты встречаемости 8-18 лет. Редко встречается до 5 и после 30 лет.
Клиника: подъем температуры, боль, припухлость.

Саркома Юинга левой беденной кости, Т1-cor. Определяется литическое опухолевое поражение проксимального метадиафиза, слоистый периостит и метастазы в среднем и дистальном отделах бедренной кости (при рентгенографии метастазы не диагностированы).
Патология задней группы мышц бедра в месте их прикрепления к седалищному бугру в результате хронического травматического повреждения. Сопровождается выраженным болевым синдромом.
Наиболее часто встречается у спортсменов.


Частичный отрыв сухожилий задних мышц бедра (хамстринг-синдром).
Нередко боли, возникающие в области ключиц и грудины, связаны с их асимметричным расположением и развивающимся в результате неравномерной нагрузки артрозом стернально-клавикулярных сочленений.


МР картина асимметричного расположения медиального отдела правой ключицы с относительным выстоянием книзу и кзади. Проявления артроза стернально-клавикулярных сочленений значительно выраженных справа, нерезко выраженных слева.
При исследовании мягких тканей шеи выявляются различного рода объемные образования: кистозные, солидные, липомы и др. Также нередко встречается патология гортани: от воспалительных изменений складочного аппарата до злокачественных новообразований.

Объемное образование парасагиттальных справа отделов мягкого неба.

МР-картина липомы латеральной поверхности шеи.

МР-картина больше соответствует наличию дополнительной асимметричной костной стуктуре и артрозу неосустава, образованному вероятно VII добавочным шейным и II грудным ребрами справа. Susp. менингоцеле на уровне С7 позвонка справа.

МР-данные нерезко выраженных инфильтративных изменений слизистой черпало-надгортанных складок, надскладочного отдела гортани. Больше данных за воспалительный характер изменений.
МРТ диагностика мягких тканей очень часто применяется для выявления патологии слюнных желез, их воспалительных изменений, кист, патологии протоков, объемных образований.

МР-картина солидно-кистозного объемного образования правой околоушной железы с инфильтративным характером роста соответствует проявлениям заболевания слюнной железы (СR, больше данных за цилиндрому) без признаков распространия объемного процесса за пределы железы.

МР-картина объемного образования левой околоушной железы с учетом характеристик МР сигнала и с учетом динамики накопления контраста типична для наличия кавернозных сосудистых элементов в структуре образования, что соответствует гемангиоме.
Что такое саркома мягких тканей и почему она развивается
- Соотношение мужчины: женщины - 3:2.
- Частота 1-2:100 000
- 40% пациентов имеют возраст более 40 лет
- Доброкачественные опухоли мягких тканей встречаются в 100 раз чаще, чем злокачественные
- Гетерогенная группа злокачественных опухолей мягких тканей
- Расположение: 40% - нижние конечности, 30% - туловище, в 15% случаев поражает голову, горло, шею; 15% — верхние конечности; редко - забрюшинное расположение Гистологическое исследование: лейомиосаркома, фибросаркома, липосаркома (миксоидная липосаркома), рабдомиосаркома мягких тканей (преимущественно дети), злокачественная фиброзная гистиоцитома (наиболее частая злокачественная опухоль мягких тканей у взрослых), нейрогенная саркома, мезотелиома, гемангиосаркома (очень редко), синовиальная саркома, ангиосаркома.
- Объемное поражение со смещением локальных структур
- Образование псевдокапсулы
- Саркомы мягких тканей высокого риска: диаметром более 5 см, глубокое проникновение в мышечные ткани, гистологическая стадия II-III.
Какой метод диагностики саркомы мягких тканей выбрать: МРТ, КТ, рентген, УЗИ
- Локальная стадия: МРТ
- Стадия отдаленных метастазов: КТ грудной клетки/брюшной полости.
- Объемное образование мягких тканей с гладкими, четкими границами, поражающее конечности.
- Выявление или исключение деструкций кости.
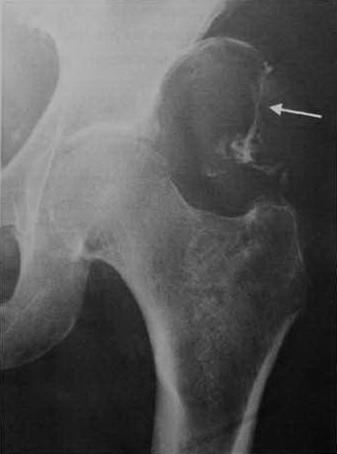
Мужчина 67 лет с синовиальной саркомой в левой ягодичной мышце. Рентгенологическое исследование демонстрирует типичные кальцинаты в опухоли.
Липосаркома :
- элементы жировой ткани в пределах опухоли
- Обычно имеет участки с изображением в виде оперения и интенсивность сигнала, эквивалентную жировой ткани на Т1-взвешенном изображении
- Высокодифференцированная липосаркома демонстрирует меньшее накопление контрастного вещества, чем недифференцированные опухоли
- Муцинозный компонент опухоли и участки некроза определяются гиперинтенсивными на Т2-взвешенном изображении.
Синовиальная саркома мягких тканей:
- расположение в области сустава
- Наличие перегородки и расслоение жидкости в связи с кровоизлиянием
- Обычно обнаруживаются кальцинаты (при рентгенологическом исследовании и КТ).

а, b Мужчина 36 лет с липосаркомой в сгибательной области левого бедра: а) Аксиальная Т1-взвешенная SЕ-последовательность. Гипоинтенсивная опухоль с типичным гиперинтенсивным компонентом перегородок является показателем ее липоидного происхождения; b) Определяется опухоль с выраженным контрастным усилением.
Клинические проявления
Типичные проявления или симптомы саркомы мягких тканей:
- Безболезненный отек
- В 20-30% случаев локальный или отраженный болевой синдром
- Общие признаки опухоли (потеря веса, слабость, анемия).
Методы лечения
- Лечение фибросаркомы мягких тканей, липосаркомы, синовиальной саркомы и других разновидностей опухоли зависит от стадии процесса и наличия патологических переломов
- Широкая резекция
- Предоперационнная и послеоперационная адъювантная химиотерапия, с/без регионарной гипертермии при саркомах высокой степени риска
- Послеоперационная лучевая терапия, особенно после резекции R1/R2.
Течение и прогноз
- Гематогенные метастазы: легкие (70%)
- Метастазы в печень при первичной опухоли брюшной полости и забрюшинного пространства
- Лимфатические метастазы встречаются редко
- Прогноз при лечении саркомы мягких тканей зависит от гистологической стадии, размеров опухоли, распространенности и расположения
- Опухоли низкой дифференцировки (I стадия) имеют частоту 5-летней выживаемости 75%; промежуточной стадии, дифференцированные опухоли - 56%; высокой градации (III стадии) - 26%
- Высокая частота местных рецидивов при злокачественной фиброзной гистиоцитоме (до 45%). Прогноз при липосаркоме на стойкое выздоровление составлят 30-40%.
Что хотел бы знать лечащий врач
- Инвазия сосудов, нервов, костей
- Расположение опухоли: поверхностное или глубокое в области мышечных пространств
- Размеры и распространение опухоли
- Отдаленные метастазы
Какие заболевания имеют симптомы, схожие с саркомой мягких тканей
Липома
- Дифференциальная диагностика с липосаркомой
- Т1-взвешенное изображение демонстрирует только жировую ткань с гиперинтенсивным сигналом
- Отсутствие гиперинтенсивных включений на изображениях с подавлением МР-сигнала от жировой ткани
- Отсутствие накопления контрастного вещества
Гематома
- Отсутствие солидного компонента
- Контрастное усиление только периферической области
Внекостные опухоли кости
- Например, саркома Юинга; дифференциальная диагностика невозможна
Оссифицирующий миозит
- Анамнез пациента: травма
- Через 7-10 дней: припухлость мягких тканей
- Через 2-6 нед. - кальцинаты
- Через 6-8 нед. - окостенение
Советы и ошибки
Ошибочная интерпретация саркомы мягких тканей как доброкачественного поражения или гематомы.
Саркомы мягких тканей представлены четырьмя десятками злокачественных новообразований, развивающихся из 12 видов соединительной ткани. В группу включены несколько вариантов липосаркомы, фибросаркомы, лейомиосаркомы, рабдомиосаркомы, ангиосаркомы, ГИСО, РЕСомы, гломусная и опухоли неясной дифференцировки, недавно добавлены злокачественные опухоли нервного ствола и неклассифицируемые саркомы. Все эти процессы имеют характерные особенности, но схожи подходы к диагностике и лечению.

Отчего и почему возникают мягкотканные саркомы?
Причина развития сарком мягких тканей неизвестна, но есть доказательства неблаготворного канцерогенного действия давно — несколько десятилетий назад проводившегося облучения и длительного глубокого иммунодефицита. На жизненном пути 99% заболевших саркомой не наблюдалось ни того, ни другого фактора.
Поражают чуть меньше двух человек из каждых 100 тысяч россиян. Некоторые типы новообразований имеют невыраженные гендерные предпочтения, но чёткой статистики по встречаемости у мужчин и женщин не существует.
Что важно для прогноза течения саркомы мягких тканей?
Стадия заболевания определяется размером опухолевого узла и предусмотрено только два варианта — менее или более 5 см. Важно расположение опухоли относительно поверхностной фасции — соединительнотканной оболочки на мышечном массиве, как показателя интенсивности внедрения в окружающие структуры, тоже два варианта: над и под фасцией.
Для подбора оптимальной терапии необходимо знать степень злокачественности, которую выводят по сумме баллов, присуждаемых за определённый гистологический признак. Рассматриваются выявляемые при микроскопии кусочка саркомной ткани такие гистологические критерии:
- дифференцировка — степень отличия от нормальной мезенхимальной (соединительной) ткани; всего 3 степени, которым присуждается от 1 до 3 баллов;
- митозы — процесс деления клетки; их число градуируется тоже по 3 позициям, минимально число до 9 и максимально — больше 19 митозов;
- некроз — мёртвые клетки в массиве опухолевой ткани, до 50% и более.
Высокая степень агрессивности G3 отмечается при 6-8 баллах, низкая G1 — сумма до 3 баллов и в их интервале средняя G2.
Оставьте свой номер телефона
Как обнаруживают саркому?
Диагностика поверхностных образований несложная, но высокотехнологичная — рентгеноскопия и УЗИ, МРТ области поражения для выявления границ злокачественного процесса и степени внедрения в соседние структуры, особенно крупные нервные стволы и сосуды.
Обязательна биопсия саркомы мягких тканей более 5 см для предоперационного микроскопического исследования. Предпочтение отдано биопсии толстой иглой, позволяющей взятие столбика ткани, если не удаётся — прибегают к иссечению по краю опухолевого узла. Небольшие опухоли, планируемые на радикальное удаление без подключения предоперационного облучения или химиотерапии, изучают под микроскопом уже после операции.
Как лечат мягкотканные саркомы?
Веяние современности — радикальные, но сохраняющие орган операции, тем не менее, в части случаев невозможно избежать большой калечащей операции с удалением вовлечённых в злокачественный процесс костных структур, больших мышечных массивов и резекции крупных сосудов.
При высокой степени агрессивности или большом протяжении новообразования хирургический этап дополняется предварительным облучением и химиотерапией. Несмотря на длительность лечения, облучение перед операцией весьма полезно:
- меняет взаимоотношение саркомы со здоровыми мягкими тканями;
- уменьшает и отграничивает первичную опухоль;
- снижает биологическую активность и жизнеспособность клеток;
- купирует воспалительный компонент;
- улучшает технические условия для операции.
После операции лучевая терапия уменьшает вероятность рецидива в зоне рубца. Но самая эффективная и наисовременнейшая методика — облучение во время операции или интраоперационное. Оно решает те же задачи, что и послеоперационное облучение, но с меньшей травмой тканей. Инновационная методика лечения мягкотканной саркомы
При саркомах высокой злокачественности и сомнительно операбельных или вовсе не подлежащих оперативному лечению проводится инновационная терапия с сочетанием дистанционного облучения, локальной гипертермии и химиотерапии, получившая название терморадиохимиотерапия.
Стратегия такая:
- перемежаясь или параллельно с курсами химиотерапии все будние дни с перерывами на выходные 5 недель проводится лучевая терапия;
- дважды на неделе перед сеансом облучения по часу делают гипертермию 41-45˚С;
- по завершении цикла и перерыва для отдыха на 4 недели либо выполняется операция, либо повторный цикл терморадиохимиотерапии при невыраженном эффекте.

Оставьте свой номер телефона
Какая химиотерапия работает при саркоме?
К химиотерапии саркомы мягких тканей не особо чувствительны, но при изначально неоперабельных новообразованиях результат несомненно лучше при сочетании противоопухолевых цитостатиков с гипертермией и облучением.
При больших опухолях конечности, когда в перспективе обозначена калечащая операция, используется инновационный подход с локальной гипертермией и системной внутривенной химиотерапией или введением в питающий опухоль сосуд цитостатика мелфалана последовательно с фактором некроза опухоли.
После радикальной операции при некоторых морфологических видах тоже проводится профилактическая химиотерапия, считается, что она уменьшает вероятность рецидива в рубце и частоту метастазов в лёгкие и другие органы.
При метастатической стадии заболевания химиотерапия — единственный вариант помощи. При хорошем самочувствии пациента предпочтительно применение комбинации нескольких цитостатиков. Максимально высокие результаты демонстрирует сочетание доксорубицина с ифосфамидом. Ангиосаркомы хорошо отзываются на таксаны, а липосаркомы с лейомиосаркомами, фибросаркомы и ГИСТ — на таргетные препараты.
Особая сложность — лечение метастатических и неоперабельных форм заболевания, когда на фоне лекарственного воздействия появляется возможность для оперативного удаления метастатических очагов и высокодозной химиотерапии с трансплантацией собственных клеток крови. Клинические исследования доказали весомое увеличение продолжительности жизни пациентов, часто сложности вызываются не столько терапевтическими причинами, сколь процессом организации паллиативной помощи.
В нашей клинике пациенту предложат всё, что поможет ему жить лучше и дольше, а процесс организации — забота персонала.
Трофименко И.А. 1,2 , Берген Т.А. 3 , Исакова Н.Б. 4 , Бакланова Н.С. 5 , Красильников С.Э. 6
1) Кафедра рентгенологии и радиологии Военно-медицинской академии им. С.М. Кирова, кафедра радиологии и рентгенологии с курсом УЗ-диагностики, Санкт-Петербург, Россия;
2) Городская больница № 40, отделение лучевой диагностики, Сестрорецк, Россия;
3) Дорожная клиническая больница на ст. Новосибирск-главный ОАО "РЖД", рентгеновское отделение №1,
4) Новосибирский областной онкологический диспансер, патоморфологическое отделение,
5) Новосибирский областной онкологический диспансер, отделение лучевой диагностики,
6) Новосибирский областной онкологический диспансер, отделение гинекологии, Новосибирск, Россия
Приводится клиническое наблюдение пациентки Х., на примере которого рассматривается дифференциальная диагностика саркомы и миомы матки со сложными формами дегенерации методами ультразвуковой диагностики и магнитно-резонансной томографии.
Обсуждение. При затруднении интерпретации сонографической картины в дифференциальной диагностике саркомы и миомы матки рекомендуется проведение МРТ малого таза. При магнитно-резонансной томографии с применением только лишь морфологических последовательностей дифференцировать доброкачественные и злокачественные опухоли миометрия возможно, только опираясь на вторичные признаки (инвазия в прилежащие структуры, регионарная лимфаденопатия, наличие метастазов). Контрастное усиление также не позволяет убедительно различить эти образования, так как и саркомы, и лейомиомы неоднородно накапливают контрастный препарат. Наибольшие затруднения вызывает дифференциальная диагностика крупных узлов, а также сарком и лейомиом клеточного типа или с миксоматозной дегенерацией.
Заключение. При дифференциальной диагностике саркомы и миомы матки целесообразно проведение МРТ малого таза с методикой ДВИ в протоколе, поскольку, по данным литературы, измеряемый коэффициент диффузии в лейомиомах в среднем составляет 1,3-1,7×10 -3 мм 2 /с, а в злокачественных новообразованиях этот показатель редко превышает 1,1×10 -3 мм 2 /с.
Ключевые слова: саркомы матки, миома матки, ультразвуковая диагностика, магнитно-резонансная томография, МРТ, диффузно-взвешенное изображение.
Лейомиома представляет собой наиболее распространенное из объемных образований матки, составляя 12-25% от всех гинекологических заболеваний [1]. Пик встречаемости лейомиом приходится на поздний репродуктивный и пременопаузальный возраст, когда опухоли этого типа присутствуют у 77% женщин [1, 2].
До 65% лейомиом матки со временем претерпевают так называемые вторичные или дегенеративные изменения, что делает эту группу доброкачественных опухолей чрезвычайно разнородной с точки зрения морфологии и, соответственно, ультразвуковой и магнитно-резонансной семиотики. К таким изменениям относится гиалиновая дегенерация, составляющая до 63% вторичных изменений лейомиом, мукоидная или миксоматозная дегенерация (19%), кальциноз (8%), кистозная дегенерация с предшествующей фазой отека стромы опухоли (4%), красная или геморрагическая дегенерация (3%), а также жировое перерождение (3%) [3]. Для гиалиновой дегенерации лейомиом при МРТ характерен типичный сигнал стромы узла на Т2-ВИ, более низкий, чем для миометрия, и изоинтенсивный поперечно-полосатым мышцам [3]. При УЗИ участки гиалиноза обычно эхонегативны и могут напоминать мелкодисперсную несмещаемую взвесь. Контуры таких лейомиом четкие, но часто неровные, фиброзные изменения стромы узла сопровождаются повышением его эхогенности [4].
Кальциноз лейомиом сопровождается появлением в их строме гипоинтенсивных включений во всех типах взвешенности при МРТ; при УЗИ кальцинаты демонстрируют характерную гипоэхогенность с эффектом дистального затенения, часто участки обызвествления создают своеобразную картину гиперэхогенного ободка узла [3, 4].
Кистозная форма дегенерации лейомиом при УЗИ проявляется наличием в строме узла гипо- или анэхогенных полостей, лишенных кровотока; при МРТ кистозные включения характеризуются гиперинтенсивным сигналом на Т2-ВИ и гипоинтенсивным на Т1-ВИ с высокими показателями измеряемого коэффициента диффузии [3, 5]. При геморрагической дегенерации строма лейомиомы на МР-изображениях характеризуется повышенным сигналом в Т1-взвешенности [3].
Наиболее сложными по структуре, МР- и эхо-характеристикам являются лейомиомы с миксоматозной дегенерацией. При сонографии лейомиомы такого типа характеризуются анэхогенными включениями вне клиники нарушения питания узла, появлением зон сниженной эхогенности в узле без признаков акустического усиления, а также участками повышенной эхогенности в узле 4. При МРТ лейомиомы данного типа демонстрируют негомогенную структуру, вариабельную интенсивность сигнала на Т1-ВИ, при этом они гипер- или изоинтенсивны миометрию на Т2-ВИ [3, 6].
Такое разнообразие семиотики определяет сложности дифференциальной диагностики дегенеративно измененных лейомиом с другими узловыми образованиями тела матки, в частности, с саркомами.
Саркоматозные опухоли тела матки встречаются достаточно редко, на долю лейомиосарком приходится лишь 1% злокачественных опухолей данного органа [1]. Саркомы обычно проявляются болевым синдромом и метроррагиями, однако могут протекать бессимптомно. Они склонны к быстрому росту, 5-летняя выживаемость составляет 50-65% [6]. Наиболее распространенными подтипами сарком тела матки являются лейомиосаркомы и эндометриальные стромальные саркомы [1].
Пациентка Х., 66 лет, обратилась к гинекологу по поводу периодических болей внизу живота тянущего характера, появившихся около полугода назад. Из анамнеза: менопауза в течение 18 лет, 4 беременности, 2 родов; помимо аппендэктомии около 30 лет назад оперативных вмешательств не было, из соматической патологии – артериальная гипертензия II ст., степень риска III.
При гинекологическом обследовании отмечается увеличение размеров тела матки до 6-7 недель беременности за счет плотного узлового образования, безболезненного при пальпации, с ограниченной подвижностью; шейка матки и придатки без особенностей. По результатам морфологического исследования материалов раздельного диагностического выскабливания полости матки и цервикального канала атипических клеток выявлено не было.
УЗИ на аппарате HITACHI Preirus из транасабдоминального и трансвагинального доступов с использованием датчиков различной частоты: конвексного датчика с постоянной частотой 5 МГц, объемного 3D датчика с частотой 2-7 МГц, внутриполостного датчика с постоянной частотой 3-10 МГц (для визуализации образований малого таза размерами до 50 мм) и линейного датчика с постоянной частотой 3-9 МГц для исследования поверхностных структур. Исследование проводили в режиме серошкального сканирования (В-режим) и цветового допплеровского картирования (ЦДК).
Сонографическая картина образования характеризовалась бугристым контуром, в структуре были анэхогенные аваскулярные участки, кровоток определялся хаотично по всех поверхности, в т.ч. в центральных отделах узла, показатель индекса резистентности (IR) был в пределах 0,5-0,45 мм/сек (рис. 1), на основании чего был предложен диагноз саркома матки.
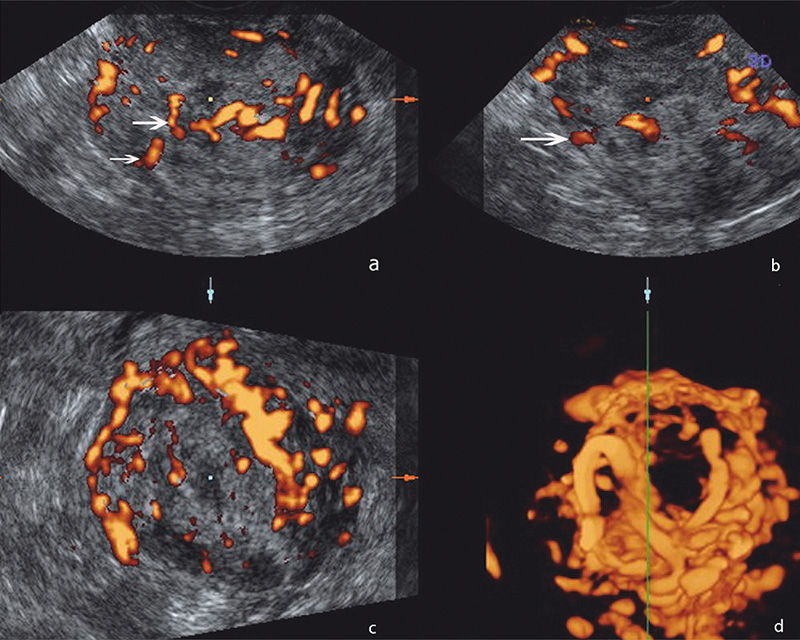
Рисунок 1. Эхограммы с энергетической допплерографией органов малого таза у больной Х.: а, б, в) образование миометрия с бугристым нечетким контуром, неоднородной структуры за счет гипоэхогенных участков в структуре, хаотичным кровотоком по всей поверхности (стрелки), показатель индекса резистентности (IR) 0,5-0,45 мм/сек; г) 3D-реконструкция, извитой ход сосудов, васкуляризация по типу клубка.
Выполнена МРТ малого таза на системе с напряженностью поля 1,5Т с применением поверхностной 6-канальной катушки. Протокол исследования включал 3 серии Т2-ВИ spin echo в сагиттальной плоскости, по короткой и длинной оси тела матки, Т1-ВИ в аксиальной плоскости с подавлением сигнала от жировой ткани и без такового, ДВИ с b-факторами 50, 500, 800 с/мм 2 в аксиальной плоскости с автоматическим построением карт измеряемого коэффициента диффузии (ИКД). Толщина среза составила 3-4 мм. От контрастного усиления пациентка отказалась.
На МР-изображениях справа по передней стенке определялось интрамурально-субсерозное образование размером до 4 см, имеющее четкие дольчатые контуры с предполагаемым наличием псевдокапсулы (рис. 2); опухоль не распространялась на шейку матки и не демонстрировала связи с цервикальным каналом и полостью матки. Структура опухоли представлялась гетерогенной за счет кистозных включений и множественных расширенных сосудов, визуализируемых в виде характерных линейных участков пустоты потока; строма образования демонстрировала преимущественно гипоинтенсивный сигнал на Т2-ВИ, изоинтенсивный на Т1-ВИ с высоким показателем ИКД , на основании чего образование было охарактеризовано как лейомиома со сложной дегенерацией стромы. Обращало на себя внимание диффузное расширение сосудистых сплетений в миометрии передней стенки тела матки вокруг опухоли, а также в параметриях с высоким сигналом на Т2-ВИ spin echo, отражающим относительно низкие скоростные показатели кровотока, что было интерпретировано как возможное наличие сопутствующей сосудистой мальформации. В остальном в зоне исследования изменений выявлено не было.
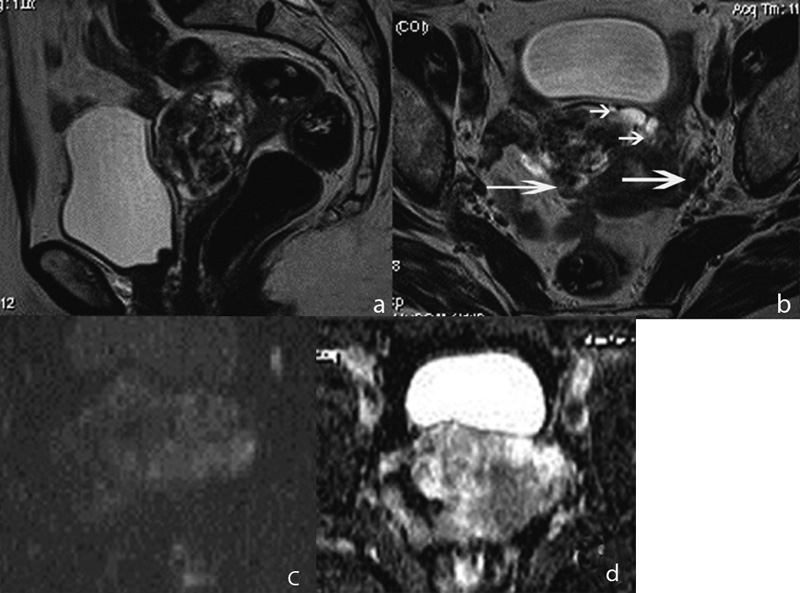
Рисунок 2. МР-томограммы органов малого таза пациентки Х. Т2-ВИ в сагиттальной (а) и косо-аксиальной (б) плоскости;
ДВИ с b-фактором 800 с/мм 2 (в) и карта ИКД (г) в аксиальной плоскости. Опухоль характеризуется негомогенной структурой
с преимущественно низким сигналом на Т2-ВИ, имеет псевдокапсулу. Отмечается расширение сосудов в миометрии вокруг опухоли
(короткие стрелки), а также в параметриях (длинные стрелки). Показатель ИКД 1,57×10 -3 мм 2 /с.
Через 2 месяца после УЗИ и МРТ пациентке выполнено хирургическое лечение в объеме экстирпации матки с придатками (рис. 3). По результатам морфологического исследования материалов операции опухоль сформирована из клеток веретенообразной формы, собранных в переплетающихся в различных направлениях пучки (рис. 4.). Клетки опухоли вытянуты по полюсам с веретенообразным центрорасположенным ядром, структура хроматина мелкоглыбчатая. Отмечался пикноз отдельных ядер, вакуолизация цитоплазмы, некоторый ядерный клеточный полиморфизм. Митозы в поле зрения. Каждая клетка была погружена в волокнистую строму. Строма опухоли с явлениями отека, отмечается присутствие тучных клеток, а также эозинофильных лейкоцитов, зрелых лимфоцитов, локализующихся преимущественно периваскулярно. Сосуды щелевидные. Таким образом, был выставлен окончательный диагноз: миома с выраженными дегенеративно-дистрофическими изменениями.

Рисунок 3. Макропрепарат: удаленная матка с придатками. Полость матки вскрыта, в просвете −
экзофитная крупнодольчатая опухоль на широком основании с признаками нарушения питания, кровоизлияниями, отеком.
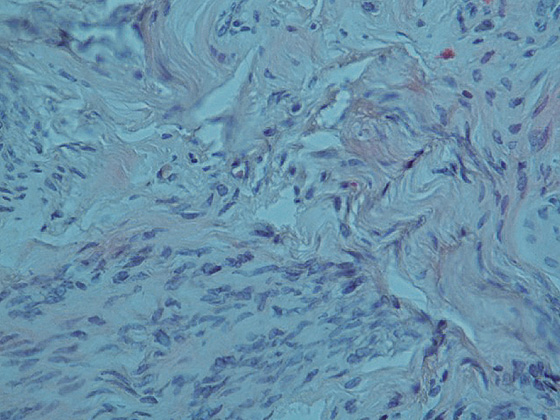
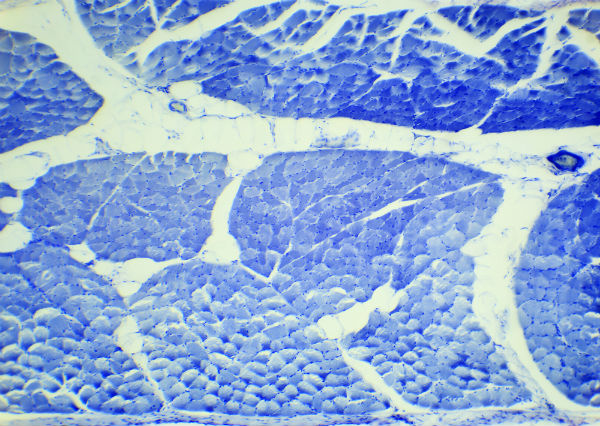
Рисунок 4. Микропрепарат миомы тела матки с дистрофическими изменениями (увеличение 10×40, окраска гематоксилином и эозином).
Опухоль состоит из веретеновидных, с центрально расположенными ядрами клеток, собранных в переплетающиеся пучки,
строма опухоли отечна, сосуды щелевидные, присутствуют эозинофилы и лимфоциты.
При сонографическом исследовании основными признаками, позволяющими дифференцировать саркоматозные опухоли от лейомиом со сложной дегенерацией узла, являются показатели кровотока [5, 7]. В частности, для злокачественных опухолей более характерен центральный тип васкуляризации, тогда как доброкачественные образования миометрия чаще демонстрируют периферический тип кровоснабжения. Большое значение имеют и количественные показатели кровотока: злокачественные опухоли характеризуются более низкими значениями индекса резистентности и более высокими значениями скоростных показателей кровотока [7]. По данным А. Kurjak и соавт., использование порогового значения индекса резистентности (IR) 0,40 позволяет дифференцировать миому и саркому матки с чувствительностью 90,91%, специфичностью 99,82% и прогностической ценностью отрицательного результата 99,96% [8]. Однако не все исследователи разделяют эту точку зрения, считая, что низкие значения IR часто наблюдаются при допплерографии доброкачественных лейомиом [5]. Другим важным дифференциально-диагностическим критерием является максимальная артериальная скорость (МАС). Разные авторы предлагают значения пороговых критериев МАС от 41 до 45 см/с [7]. Но следует отметить, что в пролиферирующих лейомиомах размером более 5 см нередко наблюдаются очень высокие значения МАС, что не позволяет использовать данный критерий как патогномоничный в дифференциации лейомиом и сарком миометрия [4, 9].
При МРТ с применением только морфологических последовательностей (Т1- и Т2-взвешенных изображений) дифференцировать доброкачественные и злокачественные опухоли миометрия возможно, опираясь лишь на вторичные признаки (инвазия в прилежащие структуры, регионарная лимфаденопатия, наличие метастазов). Контрастное усиление также не позволяет убедительно различить эти образования, так как и саркомы, и лейомиомы неоднородно накапливают контрастный препарат [3, 6]. Наибольшие затруднения вызывает дифференциальная диагностика крупных узлов, характеризующихся гиперинтенсивным сигналом на Т2-ВИ (саркома и лейомиома клеточного типа или с миксоматозной дегенерацией). В этих случаях одним из основных опорных пунктов дифференциального диагноза является методика МР-диффузии, т.к. измеряемый коэффициент диффузии в лейомиомах в среднем составляет 1,3-1,7×10 -3 мм 2 /с, тогда как в злокачественных саркомах этот показатель редко превышает 1,1×10 -3 мм 2 /с [6,10].
В данном клиническом наблюдении образование миометрия характеризовалось низким сигналом в Т2 взвешенности от подавляющего объема своего матрикса, что типично для гиалинизированных лейомиом; в саркомах могут встречаться включения низкого сигнала на Т2-ВИ, соответствующие кровоизлияниям, обызвествлениям или гиалиновому некрозу, однако больший объем опухолевого матрикса, как правило, демонстрирует гипер- или изоинтенсивный сигнал. При количественном анализе МР-диффузии в представленном клиническом наблюдении участки стромы опухоли с повышенным сигналом в Т2-взвешенности демонстрировали ИКД 1,57±0,11×10 -3 мм 2 /с, что подтверждало доброкачественную природу образования.
Вероятной причиной затруднений в интерпретации сонографической картины в представленном наблюдении послужило наличие сложной дегенерации миоматозного узла и, как следствие, регистрация кровотока в центральных участках образования. УЗ-интерпретацию затрудняло также расширение интрамуральных сосудов в миометрии, окружающем образование, что, вероятно, оказывало влияние на скоростные показатели кровотока и снижение индекса резистентности.
Представленное клиническое наблюдение иллюстрирует, насколько сложным может быть дифференциальная диагностика лейомиом с вторичными дегенеративными изменениями и сарком тела матки. Опухоли сложной структуры в сочетании с сопутствующими сосудистыми изменениями миометрия могут затруднять УЗ-диагностику, имитируя злокачественный рост. В таких случаях для установления диагноза и, соответственно, адекватного выбора тактики лечения рекомендуется проведение МРТ.
- Бохман Я.В. Руководство по онкогинекологии. М: Медицина, 1989; 464.
- Зайратьянц О.В., Сидорова И.С., Леваков С.А. и др. Особенности морфогенеза и ангиогенеза лейомиомы матки. Архив патологии 2005; 67(3): 29-31.
- Труфанов Г.Е., Панов В.О. Руководство по лучевой диагностике в гинекологии. СПб: ЭЛБИ, 2008; 592.
- Демидов В.Н., Зыкин Б.И. Ультразвуковая диагностика в гинекологии. М.: Медицина, 1990; 221.
- Sladkevicius P, Valentin L, Marsal K. Transvaginal Doppler examination of uteri with myomas. J Clin Ultrasound 1996; 24(3): 135-140.
- Tamai K, Koyama T, Saga T, et al. The utility of diffusion-weighted MR imaging for differentiating uterine sarcomas from benign leiomyomas. Eur Radiol 2008; 18: 723-730.
- Hata K, Hata T, Maruyama R, Hirai M. Uterine sarcoma: can it be differentiated from uterine leiomyoma with Doppler ultrasonography? A preliminary report. Ultrasound Obstet Gynecol 1997; 9(2): 101-104.
- Kurjak A, Kupesic S. An atlas of transvaginal color Doppler. 2nd ed. New Jork-London: The Parthenon publishing group, 2000; 205.
- Зыкин Б.И., Медведев М.В. Допплерография в гинекологии. 1-е издание. М.: РАВУЗДПГ. Реальное время, 2000; 152.
- Namimoto T, Yamashita Ya, Awai K, et al. Combined use of T2-weighted and diffusion-weighted 3-T MR imaging for differentiating uterine sarcomas from benign leiomyomas. Eur Radiol 2009; 19: 2756-2764.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Читайте также:





