Лаборатория экспериментальной диагностики и биотерапии опухолей
- История
- Услуги
- Подразделения
- Как попасть на лечение в онкоцентр
- Контакты и схема проезда
- Отзывы
Национальный медицинский исследовательский центр онкологии им. Н. Н. Блохина — самостоятельная медицинская научная организация, имеющая статус государственного учреждения. Центр находится в непосредственном подчинении Министерства Здравоохранения России. Одно из крупнейших в мире учреждений профиля. В его состав входят пять институтов: НИИ клинической онкологии, НИИ детской онкологии и гематологии, НИИ клинической и экспериментальной радиологии, НИИ экспериментальной диагностики и терапии опухолей и НИИ канцерогенеза.

- адрес: 115478, Москва, Каширское шоссе, 23
- единая справочная служба – тел. 8 (499) 324-24-24
В 1952 году институт возглавил Николай Николаевич Блохин. В кратчайшие сроки он сумел собрать в одном центре лучших представителей науки, практических врачей, хирургов, рентгенологов, радиологов, терапевтов и организаторов здравоохранения, талантливую молодежь и создать ведущую научно-практическую школу страны, ставшую одной из наиболее авторитетных в мире. Сегодня Центр носит имя своего основателя и первого директора.
В дальнейшем учреждение было реорганизовано во Всесоюзный онкологический научный центр Академии медицинских наук СССР (ВОНЦ АМН СССР).
В 1988 году директором ВОНЦ АМН СССР был назначен академик РАМН, профессор Николай Николаевич Трапезников, длительно работавший заместителем директора по научной работе.
С 2001 года по 2017 центр возглавлял академик РАН, профессор, главный онколог России Михаил Иванович Давыдов.
На сегодняшний день, НМИЦ онкологии им. Н. Н. Блохина стал крупнейшей онкологической клиникой России и Европы, а также одной из самых крупных онкологических клиник в мире. В Центре представлены все существующие виды онкологической помощи.
Центр осуществляет следующие основные виды деятельности:
- оказание высококвалифицированной медицинской помощи больным со злокачественными новообразованиями и предопухолевой патологией;
- проведение научных исследований в области изучения биологии опухолевой клетки, механизмов канцерогенеза и опухолевой прогрессии (молекулярные, вирусологические, химико-физические, генетические, клеточные, иммунологические аспекты);
- экспериментальная и клиническая разработка новых технологий в области хирургического лечения злокачественных опухолей;
- разработка новых средств и методов диагностики, лекарственной, лучевой и комбинированной терапии, а также активной профилактики опухолей;
- разработка вопросов диагностики, лечения и профилактики в области детской онкологии;
- изучение эпидемиологии злокачественных опухолей, совершенствование методов онкологической статистики;
- внедрение новых приборов и технологий в лечебно-диагностический процесс и для профилактики злокачественных новообразований;
- подготовка научных и медицинских кадров через ординатуру, аспирантуру, докторантуру и в системе дополнительного профессионального образования.
- Отдел общей онкологии
- Отделение хирургическое N2 диагностики опухолей
- Отделение хирургическое N3 проктологическое
- Отделение хирургическое N11 опухолей верхних дыхательно-пищеварительных путей
- Отделение хирургическое N4 опухолей головы и шеи
- Торако-абдоминальный отдел
- Отделение хирургическое N5 опухолей молочных желез
- Отделение хирургическое N7 опухолей печени и поджелудочной железы
- Урологическое отделение
- Отделение комбинированных и лучевых методов лечения онкогинекологических заболеваний
- Отделение хирургическое N10 биотерапии опухолей
- Отделение амбулаторной химиотерапии (дневной стационар)
- Отделение клинической фармакологии и химиотерапии
- Отделение химиотерапии
- Отдел гематологии и трансплантации костного мозга
- Отделение химиотерапии и комбинированного лечения злокачественных опухолей
- Отделение эндоскопическое
- Отделение реабилитации
- Отделение научно-консультативное амбулаторных методов диагностики и лечения
- Приемное отделение
- Хирургический отдел
- Отделение анестезиологии-реанимации (отдела анестезиологии и реаниматологии)
- Отделение реанимации и интенсивной терапии N2 детоксикации
- Банк криоконсервированных биоматериалов
- Отдел патологоанатомической анатомии опухолей человека
- Централизованный клинико-лабораторный отдел
- Аптека
- Лаборатория клинической онкогенетики
- Отдел анестезиологии и реаниматологии
- Отделение радиохирургии
- Отделение реанимации и интенсивной терапии N3 трансплантации костного мозга и интенсивной химиотерапии
- Юридический отдел
- Группа опухолевых заболеваний орбиты и глаза
- Радиологическое отделение
- Операционный блок
- Отделение научно-консультативное (поликлиника)
- Отдел общей онкологии
- Отделение анестезиологии и реанимации
- Отделение химиотерапии
- Аппарат управления
- Организационно-методический отдел с канцер-регистром и медицинским архивом
- Дирекция НИИ канцерогенеза
- Ученый совет
- История института
- Отдел эпидемиологии и профилактики опухолей
- Отдел экспериментальной биологии опухолей
- Лаборатория биологии стромальных клеток опухолей
- Лаборатория механизмов канцерогенеза
- Лаборатория цитогенетики
- Лаборатория генетики опухолевых клеток
- Лаборатория вирусного канцерогенеза
- Лаборатория онкогеномики
- Лаборатория регуляции клеточных и вирусных онкогенов
- Лаборатория молекулярной биологии вирусов
- Лаборатория механизмов регуляции иммунитета
- Лаборатория механизмов гибели опухолевых клеток
- Отдел химического канцерогенеза
- Отдел иммунохимии
- Аппарат управления
- Ученый совет
- Лаборатория химического синтеза
- Лаборатория разработки лекарственных форм
- Лаборатория фармакологии и токсикологии
- Лаборатория иммунофармакологии
- Лаборатория биомаркеров и механизмов опухолевого ангиогенеза
- Лаборатория экспериментальной химиотерапии
- Лаборатория рекомбинантных опухолевых антигенов
- Лаборатория экспериментальной диагностики и биотерапии опухолей
- Лаборатория комбинированной терапии опухолей
- Лаборатория химико-фармацевтического анализа
- Лаборатория медицинской биотехнологии
- Лаборатория клеточного иммунитета
- Группа молекулярных маркеров опухолей
- Лаборатория биомедицинских исследований
- Лаборатория трансгенных препаратов
На базе онкологического центра Блохина проводится лечение онкологии у детей и взрослых. В услуги входят инструментальные исследования: радиоизотопные исследования, рентгенографические методы, магнитно-резонансная томография, компьютерная томография, ультразвуковое исследование, позитронно-эмиссионная томография, исследование костного мозга, люмбальная пункция, пункция опухолевого узла с биопсией, эдоскопические методы (лапароскопия, цистоскопия и др.).
Предлагаются лабораторные исследования: общий анализ мочи, кровь на онкомаркеры, скорость оседания эритроцитов, общий анализ крови. Проводится лечение следующими способами: лучевая терапия, криотерапия, биохимический анализ крови, полихимиотерапия, радиочастотная аблация, лазеротерапия, эмболизация.
Платные прием и обследование в НМИЦ онкологии им. Н.Н. Блохина проводятся:
- пациентам, не имеющим Российского гражданства,
- гражданам РФ, не имеющим действующего полиса обязательного медицинского страхования;
- гражданам РФ, не имеющих направления на консультацию формы 057-у (выдается лечебным учреждением по месту жительства);
- при отсутствии медицинских документов, свидетельствующих об онкологическом заболевании;
- пациентам с неопухолевыми заболеваниями или доброкачественными опухолями.
Кроме того, в связи с возможным расхождением в интерпретации диагноза и распространенности заболевания специалисты нередко рекомендуют пересматривать и консультировать рентгеновские снимки и данные морфологического обследования. Однако это является дополнительной медицинской услугой и выполняется платно.
Оплата может производиться как по наличному расчету, так и по страховому полису ДМС, согласно заключенному договору и прейскуранту.
Любые вопросы по платным медицинским услугам Вы можете направлять на электронный адрес : Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра. .
На консультативно-диагностическую и стационарную медицинскую помощь в Онкоцентре в рамках Программы государственных гарантий бесплатного оказания гражданам медицинской помощи имеют право граждане, застрахованные в РФ по системе обязательного медицинского страхования.
Перечень необходимых документов для первичной консультации больного в Онкоцентре:
1. Направление для оказания медицинской помощи за счет средств ОМС (форма 057/у-04) из медицинской организации, в которой пациент проходит диагностику и лечение в рамках оказания первичной медико-санитарной помощи и (или) специализированной медицинской помощи.
Направление должно быть заверено личной подписью лечащего врача, личной подписью руководителя медицинской организации (уполномоченного лица), печатью лечащего врача, печатью направляющей медицинской организации, и содержать следующие сведения:
- Фамилия, имя, отчество пациента, дата его рождения, адрес регистрации по месту жительства (пребывания);
- Номер действующего полиса обязательного медицинского страхования и название страховой медицинской организации;
- Страховое свидетельство обязательного пенсионного страхования (СНИЛС);
- Код диагноза основного заболевания по Международной классификации болезней–10 (МКБ-10);
- Наименование медицинской организации, в которую направляется пациент для оказания медицинской помощи за счет средств ОМС;
- Фамилия, имя, отчество и должность лечащего врача, контактный телефон, электронный адрес.
3. Оригиналы и копии следующих документов пациента:
- Документ, удостоверяющий личность пациента (паспорт - для взрослых, свидетельство о рождении - для детей);
- Действующий полис обязательного медицинского страхования пациента;
- Страховое пенсионное свидетельство (СНИЛС).
- Листок нетрудоспособности (при наличии)
Если вам отказывают в направлении (форма 057/у-04) в Онкоцентр, вы можете обратиться к администрации своего регионального лечебного учреждения с заявлением.
После первичной консультации больной осматривается ведущими сотрудниками профильного отделения, материалы рассматриваются консилиумом онкологов в составе хирурга, химиотерапевта и радиотерапевта. Результаты консилиума оформляются документально в виде консультативного заключения о принятом решении госпитализировать больного для лечения или рекомендации лечения в медицинской организации по месту жительства.
". Благодарю вас за чуткость и терпение! Выражаю глубочайшую благодарность всему коллективу РОНЦ им. Блохина за высококвалифицированное обследование, за созданные условия и удобства, за отсутствие угнетающей обстановки. Спасибо вам, добрые и заботливые люди. . "
Онкологический центр им. Блохина - адрес, официальный сайт и основные телефоны
Адрес: 115478, Москва, Каширское шоссе, 23
Официальный сайт: ronc.ru
Электронная почта: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Карта-схема - как добраться.
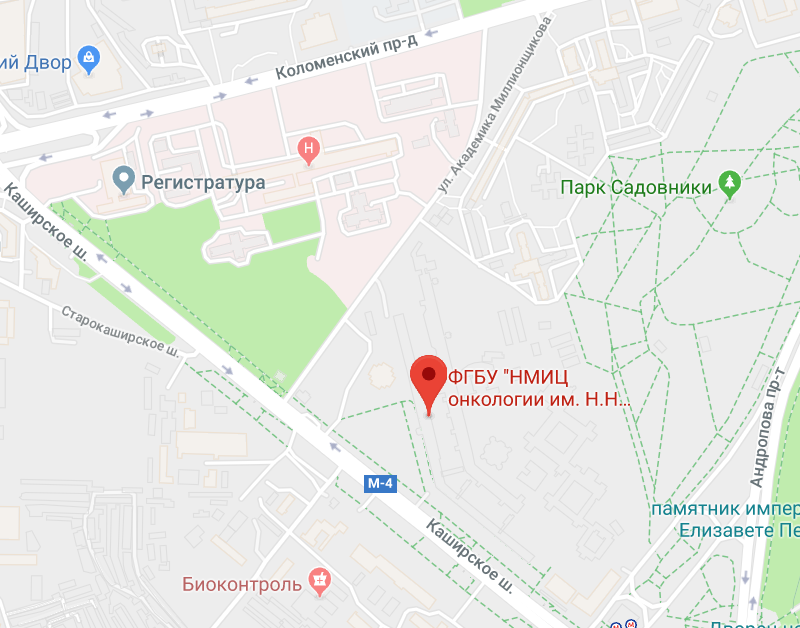
Как добраться общественным транспортом
Единая справочная служба – тел. 8 (499) 324-24-24 время работы телефона единой справочной службы с 8.30 до 17.15
Справочная служба поликлиники для взрослых - тел. 8 (499) 324-10-94
Справочная служба Детского института – тел. 8 (499) 323-56-22
Предварительная запись к эндокринологу и дерматологу тел. 8 (499) 324-35-64
В центре ведется разработка новых подходов и методов в области молекулярной диагностики и биотерапии, проводят исследования в области молекулярной иммунологии и онкологии.
В центре проводятся исследования мембранных и растворимых форм иммунозначимых молекул. Изучается их роль в здоровом организме и при развитии патологических процессов. Также в центре был разработан биочип для определения экспрессии раково-тестикулярных генов в периферической крови человека.
- Лаборатория молекулярной биологии и генной инженерии.
- Лаборатория экспериментальной иммунологии.
- Лаборатория молекулярной иммунологии.
- Лаборатория медицинской биотехнологии.
Цели и задачи
- Изучение молекулярных механизмов иммунного ответа.
- Изучение молекулярных механизмов канцерогенеза.
- Исследование особенностей экспрессии генов человека.
- Исследование влияние генетического полиморфизма на работу генома при различных заболеваниях.
- Изучение молекулярно-биологических изменений, возникающих при различных онкологических заболеваниях, аутоиммунных болезнях, заболеваниях сердечно-сосудистой системы и болезнях легких.
Центр предоставляет базу практики для аспирантов и студентов университета, обучающихся по программам подготовки бакалавров и магистров.
Основные направления исследований
- Исследование роли мембранных и растворимых форм дифференцировочных молекул и молекул главного комплекса гистосовместимости в патогенезе иммуно-опосредованных заболеваний.
- Исследование молекулярно-биологических особенностей опухолевого роста.
- Изучение роли однонуклеотидных полиморфизмов в предрасположенности к заболеваниям.
- Разработка тест-систем для определения молекулярно-биологических маркеров, имеющих прогностическую ценность в диагностике злокачественных новообразований.
- Разработка биологических чипов для диагностики злокачественных новообразований.
- Получение рекомбинантных терапевтических антител против MUC
- Создание рекомбинантных белов, применяемых для биотерапии опухолей, аутоиммунных и других заболеваний.
Экспериментальные возможности
- Очистка и амплификация нуклеиновых кислот (обратная транскрипция, ПЦР, гибридизация).
- Анализ экспрессии генов в биологических образцах (детекция мРНК и ее альтернативных форм, сравнительный полуколичественный анализ уровней мРНК, технология биологических микрочипов).
- Анализ нуклеотидных последовательностей, расчет праймеров и гибридизационных зондов, а также разработка наборов для специфической амплификации и детекции нуклеотидных последовательностей с помощью ПЦР, ОТ-ПЦР, ПЦР в реальном времени.
- Электрофорез белков в полиакриламидном геле, иммуноблоттинг.
- Генотипирование биологических объектов с помощью ПЦР и определение первичной структуры ДНК (секвенирование).
- Молекулярное клонирование, экспрессия рекомбинантных белков в E. Coli и дрожжах Pichia Pastoris.
- Очистка белков методами ионообменной и аффинной хроматографии.
- Качественное и количественное определение антигенов иммуноферментным методом.
- ДНК-баркодинг.
- Microarray: оптимизация множественной ПЦР, разработка, изготовление и испытание олигонуклеотидных микрочипов.





ЭПИГЕНЕТИЧЕСКАЯ (ГЕНЕТИЧЕСКАЯ) РЕГУЛЯЦИЯ, ОНКОЛОГИЧЕСКИЙ КОНТЕКСТ И ГИПОТЕТИЧЕСКИЕ МЕХАНИЗМЫ ЭКСПРЕССИИ ГЕНОВ/ГЕНОМА. ОБЩИЕ ПРИНЦИПЫ. ДЕЙЧМАН А.М Лаборатория экспериментальной диагностики и биотерапии опухолей НИИ ЭДИТО, РОНЦ им. Н.Н. Блохина РАМН.
ДЕЙЧМАН А.М Лаборатория экспериментальной диагностики и биотерапии опухолей НИИ ЭДИТО, РОНЦ
- Related
- More by user
ЭПИГЕНЕТИЧЕСКАЯ (ГЕНЕТИЧЕСКАЯ) РЕГУЛЯЦИЯ, ОНКОЛОГИЧЕСКИЙ КОНТЕКСТ И ГИПОТЕТИЧЕСКИЕ МЕХАНИЗМЫ ЭКСПРЕССИИ ГЕНОВ/ГЕНОМА. ОБЩИЕ ПРИНЦИПЫ ДЕЙЧМАН А.М Лаборатория экспериментальной диагностики ибиотерапии опухолей НИИ ЭДИТО, РОНЦ им. Н.Н. Блохина РАМН
БФВ: Эпигенетика: область знаний о совокупности свойств организма, которые непосредственно не закодированы в геноме, но могут и, по определению, должны передаваться по наследству. • Сходное: Эпигенетика изучает стойкие изменения, влияющие на геном особи в течение развития и старе-ния, но не обязательно передающиеся следующим поколениям. • Andrew Feinberg(Professor of Medicine and director of the Center for Epigenetics in Common Human Disease at Johns Hopkins): “Cells affected by epigenetic changes look normal under a microscope at low levels of resolution, but if you look carefully at the genome, you find there are subtle changes (тонкие изменения)."; и: “(Отслеживая эти изменения, врачи могли бы лечить людей, прежде чем опухоли разовьются, – во многом так же, как кардиологи назначают для снижения уровня холестерина препараты, чтобы помочь предотвратить сердечные заболевания.)”
Парамутации, Эпимутации растений / животных (у цветковых и млекопитающих; легко ревертируют к норме). Считают: за этими явлениями стоит некий общий и доволь-но широко распространенный механизм, однако он, несмо-тря на большой интерес к проблеме, не расшифрован. • Эухроматин (малая часть генома). Гетерохроматин(
20% сайтов, в CpG-островках) ге-нома. Метилирование и транскрипция связаны обрат-ной зависимостью (совершенно необходим трансак-тивирующий белковый фактор).
Эпигенетический эквивалент генетической мутации: • Пример: Эпимутации(состояли в de novoгипер-метилированиипромоторной областиMLH1-гена у пациентов с HNPCC-раком, в различных клетках). Оказалось, что слабо наследуемые эпимутации, вызывали такой же клинический HNPCC-эффект (фенотип), как и сами мута-ции. Группа повышенного риска (гипермети-лирование + микросателлитная нестабиль-ность). (Эпимутации≈Парамутации). • Заметка: При лейкозах животных тотальное ДНК-мети-лирование (в L-клетках (фибробл?)) понижено, а в не-кодирующих межгенных палиндромных областях генома метилирование было повышенным.
ГИПОТЕТИЧЕСКИЕ МЕХАНИЗМЫ ЭКСПРЕССИИ ГЕНОВ / ГЕНОМА. ТЕЗИСНО (почти все опубликова-но, рисунки/схемы см. ниже): • Предложен новый гипотетический механизмвоспроизведения олигонуклеотидных после-довательностей длиной в (15-30)n- нуклеоти -дов. Как и малые РНК они используются в соответствии клеточной программой (роста / развития / дифференцировки; при патологии, в частн. онкологии, все меняется). • Это механизм вариабельной Поэпитопной Обратной Трансляции (вПОТ-механизм), протекающий в митохондриях (растения: + хлоропласты). Локализован на внутренних мембранах органелл. • Другое название олигонуклеотидов – Нуклеиновый Эквивалент (НЭ) эпитопа (длиной в 5-10 аминокислот).
Рис 1. Схематическое изображение роли miRNAs в регуляции инвазии и миграции опухолевых клеток (В целом, miRNAs также играют различные роли при канцерогенезе и включаются в процессы миграции, инвазии, метастазирования, пролиферации и клеточного цикла)
10. вПОТ-механизмнапряженноработает в Мт / клетке (чувствителен к факторам внутр/внешн сре-ды). Единичные / амплифицир - вариантыНЭ. Подобие с повтор-послед-ми. Рибоперекл-ли метаболизма (сах /железа, как у бакт.); РНК-аптамерныеструктуры. Отдельные / кластеры рибонукл-в в: 1. мтДНК животных (особ. в отстающей нити); 2. ядДНК эукариот / прокариот. Участие коротких РНК (ДНК) врепарации ядерной ДНК (дрожжи). Митохондрии: число, асинхронность, изменчивость, старение (радикалы, АФК); связь с ядерной ДНК: энергетика / биохимия /регуляция; + у в.растений в ядерной ДНК: есть динамические сайты для мтДНК и хпДНК (> 3000 kb). мтДНК: . анал-сайты для ядДНК. 11. Эпитопыизбыточных/поврежденных собственных (клеточ / внеклет) и чужеродных белков. Протеасомы(лизосомы,фаголизосомы при имм. - ответе). 12. Замкнутая обратная связь регуляции экспрессии генов / генома с участием митохондрий, ядра, цитоплазмы (. по собств / чуж белкам . по нуклеотидным последователь-ностям). Сочетание регуляторной, эпигенетической и генетической компонент.
15.(3) Генетическая компонента, в целом: стабильность и изменчивость, поддерживается как самим НЭ (поступающим в геном в составе векторов), так и перемещением НЭ-содержащих векторов. (см. далее). вПОТ (Мт)→НЭ→ВНП (ретро- / транспозон с НЭ):1. яд-ДНК (повторы +/→ интроны +/→ экзоны); 2. обратным сплайсингом в РНК (интроны / экзоны: мРНК, рРНК, тРНК); и далее обратной транскрипцией в ДНК-участки). вПОТ (Мт)→ НЭ → РНП (НЭ): цитоплазма (трансляция) + ядро (структура хроматина: транскрипция, транскрипционный сайленсинг, рекомбинация, др.). Многое из этого касается и эпигенетической компоненты. Интересно, что, подобно СН3-ДНК, увеличение активности спец-х микро-РНК (miRs-103/107; при раке молочной железы) сопрово - ждается общим падениемглобальной экспрессии микро-РНК (за счет ингибирования экспресс Dicer-нуклеазы) в эпителиальных формах, с последующим усил-ем миграции и метастатич. - диссе - минациимезенхимальнымиклеточнымиформами рака при EMT.
Рис 2. Роль miRNAs в метастазировании.(a) EMTрегулируетсяmiRNAs(рак простаты). miR-200, miR-205 усил-т мезенхим-ю направл-ть при экспресс-транскрипц-факторов ZEB-1/2, аmiR-101– блокирует экспрессию E-кадхерина(через таргетинг EZH2, Zeste Homolog 2). miR-155усиливает: 1. активность Rho-фактора и2. TGF-Smad-путь; все вместе это предрасполагает к метастазированию.(b) Усиление метастазирования (при раке молочной железы) с помощ.- miR-10b– первой из идентифицированных; связана с Twist1, MMPs, активатором урокиназы плазминогена(uPA), и различными интегринами. Запуск про-метастатическихmiR-373иmiR-520cусил-л метастазирование (при модулировании CD44) в кости и легких; а miR-21при этом угнетает экспрессию TPM1, PDCD4. Другие miRs:miR-335, miR-206 и miR-31идентифицированы как антиметастатические и тарге-тируют RhoA-/Fzd3-/RDX-факторыиинтегрины.Усиление экспрессии miR-146 и miR-98/let-7 вело, соответственно, к таковой же для супрессирующих метастази-рование факторов BRMS-1 и RKIP.
5) Возможная сопряженность с редактированием РНК(необходимость в напр. - матрице при A→I у животных, и U-вставочно-делеционном gRNAs-редактировании утрипаносом), др. (слайд 24) 6) Возможнаясовместная изменяемость геномов клетки и вируса(в частности ретровирусов). 7) Генетическая компонента приЛекарственной Устойчивости. 8) АГ-специфические участкив АТ и рецепторах В-/Т-клеток (слайд 23). 9) Другое(феногенотипическое равновесие: преобразование соотношений АТ↔GC-пар, пуринов↔пиримидинов; отбор более востребованных белк.-версий (слайд 24), др.). Отдельно: 10) Формирование генетического кода(разнообразия в его рамках; слайд 23,26). Биосфера, единая генетически и экологически (ГЧОС-система). 11)Динамическая синхроннаяконсервативность – скрытый вид вариабельности (слайды 23, 24). 12)Специфический иммунный ответ (слайд 23) → врожденный. 13) И т.д.
Заведующий лабораторией
Ларин Сергей Сергеевич, кандидат биологических наук
Основные направления деятельности лаборатории
- Изучение молекулярных механизмов ускользания опухолевых клеток от иммунного надзора. Скрининг опухолевых клеток на предмет экспрессии ими лигандов ингибиторных рецепторов лимфоцитов. Разработка критериев отбора пациентов для получения иммунотерапевтических препаратов.
- Разработка технологии высокочувствительной детекции индивидуальных лейкозных клеток в периферической крови пациентов. Анализ реаранжировки генов легких и тяжелых цепей иммуноглобулинов и Т-клеточного рецептора в моноклональных и поликлональных популяциях.
- Изучение возможности использования молекулы Pdcd4 (Programmed cell death 4) в качестве потенциального прогностического и диагностического маркера, а также мишени для терапии при лимфомах и лейкозах. Проведение скрининга пациентов, анализ корреляции уровня экспрессии Pdcd4 и клинически значимых показателей, сопоставление с эффективностью лечения и прогнозом.
- Разработка новых методик генной терапии и биотерапии болезни Гоше (совместно с Румянцевым С.А.).
Достижения (значимые книги, монографии, руководства, статьи)
- А. В. Посвятенко, К. В. Куликова, Н. В. Гнучев, Г. П. Георгиев, А. В. Кибардин, С. С. Ларин. Функциональные свойства новой изоформы лиганда WNT11, экспрессирующейся в клетках линии карциномы кишечника человека HT29. // Молекулярная биология. № 1, 2012 г. Принята к печати 05.07.2011 г.
- K. Kulikova, A. Kibardin, N. Gnuchev, G. Georgiev, S. Larin. Dual Function of Wnts in Human Cutaneous Melanoma. In the book “Melanoma/Book 1”, ISBN 978-953-307-293-7.
- К. В. Куликова, А. В. Посвятенко, Н. В. Гнучев, Г. П. Георгиев, А. В. Кибардин, С. С. Ларин. Внутриядерная локализация бета-катенина не может считаться достаточным условием для активности канонического сигнального пути Wnt в клеточных линиях меланомы человека. Молекулярная биология, 2011, 45 (5), С. 884–891.
- E. Ilina, S. Khodyreva, A. Berezhnoy, S. Larin, O. Lavrik. Tracking Ku Antigen levels in Cell Extracts with DNA Containing Abasic Sites. Mutat Res., 2010, 685, P. 90–96
- А. Е. Бережной, А. Д. Чернышева, И. Р. Закеева, А. Б. Данилова, А. О. Данилов, В. М. Моисеенко, D. Geraghty, Н. В. Гнучев, Г. П. Георгиев, А. В. Кибардин, C. C. Ларин. Индукция экспрессии молекулы HLA-E на поверхности опухолевых клеток интерфероном-гамма приводит к защите опухолевых клеток от цитотоксического действия лимфоцитов. Вопр. онкологии, 2009, в т. 55, № 2, стр. 224–229.
- I. Mikhaylova, D. Kovalevsky, L. Morozova, V. Golubeva, E. Cheremushkin, M. Lukashina, E. Voronina, O. Burova, I. Utyashev, S. Kiselev, L. Demidov, Beabealashvilli RSh, Baryshnikov AY. Cancer/testis genes expression in human melanoma cell lines. Melanoma Res. 2008 Oct;1 8(5): 303–13.
- А. Е. Бережной, А. А. Вайнсон, Н. Н. Касаткина, О. А. Хохлова, А. С. Островская, Е. В. Володина, А. Ю. Барышников, Г. П. Георгиев, С. С. Ларин. Высокие дозы гамма-облучения усиливают экспрессию трансгена, находящегося под контролем раннего цитомегаловирусного промотера, в стабильно трансфицированных опухолевых клетках // Молекулярная биология. 2008. Т. 42. № 3, с. 1–9.
- А. Е. Бережной, Н. В. Гнучев, Г. П. Георгиев, А. М. Козлов, С. С. Ларин. Молекулярные механизмы взаимодействия опухоли и иммунной системы. Вопр. онкологии, 2008, т. 54, № 6, стр. 669–683
- E. Kuznetsova, T. Kekeeva, S. Larin, V. Zemlyakova, A. Khomyakova, O. Babenko, M. Nemtsova, D. Zaletayev, V. Strelnikov. (2007) Methylation of the BIN1 gene promoter CpG island associated with breast and prostate cancer. J. Carcinog. 2007, May 4; 6–9.
- Е. Б. Кузнецова, Т. В. Кекеева, С. С. Ларин, В. В. Землякова, О. В. Бабенко, М. В. Немцова, Д. В. Залетаев, В. В. Стрельников. Новые маркеры метилирования и экспрессии генов при раке молочной железы. Молекулярная биология, 2007, 41: 624–633.
- И. Р. Закеева, А. Е. Бережной, Н. В. Гнучев, Г. П. Георгиев, С. С. Ларин. Ингибиторные рецепторы лимфоцитов и их роль в противоопухолевом иммунитете. Вопр. онкол. 2007; 53(2): 140–9.
- A. Kibardin, O. Ossipova, S. Sokol. Metastasis-associated kinase modulates Wnt signaling to regulate brain patterning and morphogenesis. Development. 2006, Aug; 133 (15): 2845–54.
- A. Kibardin, T. Karpova, T. Sapenko, J. Vazquez-Boland, S. Kiselev, S. Ermolaeva. Mammalian peptidoglycan recognition protein TagL inhibits Listeria monocytogenes invasion into epithelial cells. FEMS Immunol. Med. Microbiol. 2006, Mar; 46 (2): 284–90.
- И. Н. Михайлова, М. И. Лукашина, А. Ю. Барышников, Л. Ф. Морозова, О. С. Бурова, Т. Н. Палкина, А. М. Козлов, В. А. Голубева, Е. А. Черемушкин, М. Б. Дорошенко, Л. В. Демидов, С. Л. Киселев, С. С. Ларин, Г. П. Георгиев. Клеточные линии меланомы – основа для создания противоопухолевых вакцин. Вестник Российской АМН. 2005; (7): 37–40
- V. Moiseyenko, A. Danilov, I. Baldueva, A. Danilova, N. Tyukavina, S. Larin, S. Kiselev, R. Orlova, V. Anisimov, A. Semenova, L. Shchekina, G. Gafton, V. Kochnev, A. Barchuk, S. Kanaev, K. Hanson, G. Georgiev. Phase I/II trial of gene therapy with autologous tumor cells modified with tag7/PGRP-S gene in patients with disseminated solid tumors: miscellaneous tumors. Ann. Oncol. 2005, Jan; 16(1): 162–168.
- S. Larin, G. Georgiev, S. Kiselev. (2004) Gene transfer approaches in cancer immunotherapy. Gene. Ther. 2004, Oct. 11, Suppl. 1: S18–25. Review.
- S. Larin, E. Korobko, O. Kustikova, O. Borodulina, N. Raikhlin, I. Brisgalov, G. Georgiev, S. Kiselev. (2004) Immunotherapy with autologous tumor cells engineered to secrete Tag7/PGRP, innate immunity recognition molecule. J. Gene. Med. 6(7): pp. 798–808.
- В. М. Моисеенко, А. О. Данилов, И. А. Балдуева, А. Б. Данилова, Н. В. Тюкавина, С. С. Ларин, С. Л. Киселев, Р. В. Орлова, А. И. Семенова, Е. А. Туркевич, Л. А. Щелкина, В. В. Анисимов, Г. И. Гафтон, В. А. Кочнев, А. С. Барчук, С. В. Канаев, К. Р. Хансон, Г. П. Георгиев. (2004) I-II фаза клинической оценки эффективности генотерапии на основе аутологичных опухолевых клеток, модифицированных геном tag7 у больных диссеминированными солидными опухолями. Вопр. онкол. 50(3): pp. 293–303
- А. О. Данилов, С. С. Ларин, А. Б. Данилова, В. М. Моисеенко, И, А. Балдуева, С. Л. Киселев, Е. А. Туркевич, А. С. Барчук, В. В. Анисимов, Г. И. Гафтон, В. А. Кочнев, К. Р. Хансон. (2004) Усовершенствование метода приготовления аутологичных модифицированных противоопухолевых вакцин для активной специфической иммунотерапии больных диссеминированными солидными опухолями. Вопр. онкол. 50(2): pp. 219–227
- A. Kibardin, I. Mirkina, E. Baranova, I. Zakeyeva, G. Georgiev, S. Kiselev. The differentially spliced mouse tagL gene, homolog of tag7/PGRP gene family inmammals and Drosophila, can recognize Gram-positive and Gram-negative bacterial cell wall independently of T phage lysozyme homology domain. J . Mol. Biol. 2003, Feb. 14; 326(2): 467–74.
- S. Larin, N. Gorlina, I> Kozlov, A. Cheredeev, N. Zorin, R. Zorina. (2002) Binding of alpha2-macroglobulin to collagen type I: modification of collagen matrix by alpha2-macroglobulin induces the enhancement of macrophage migration. Russ. J. Immunol. 7: pp. 34–40
- С. Л. Киселев, С. С. Ларин, Н. В. Гнучев, Г. П. Георгиев. (2000) Ген tag7 и генотерапия рака. Генетика. 2000, т. 36, № 11, с. 1431–1435.
Читайте также:

