Использование моноклональных антител в ранней диагностике рака

Рак становится второй ведущей причиной смерти в мире. Эффективная стратегия для ранней диагностики заболевания является ключевым фактором для снижения смертности и заболеваемости. Разработка эффективных моноклональных антител (Мка) – основа для обнаружения антигенов и небольших молекул, высвобождающихся из раковых клеток, которые способствуют повышению современной диагностики рака в медицине [1,2].
Несмотря на то, что технология Mка все еще находится на стадии разработки, последние достижения в области подготовки рекомбинантных методов антигена и инженерии антител резко расширили применение этой технологии в диагностике рака. По сравнению с другими методами, анализы, основанные на Мка могут обеспечивать пространственное, временное, точное и количественное измерение для диагностики заболевания [3]. Изучение онкологической иммунологии обеспечило диагностические и терапевтические приборы с помощью сывороточных аутоантител, биомаркеров и экзогенных моноклональных антител [2,3].
К сожалению, иммунная система не всегда способна распознать или уничтожить опухоль. Клетки новообразований к тому же имеют целый список способов маскировки. Применение Мка делает раковые клетки видимыми для иммунных клеток, которые убивают переродившиеся клетки. Иногда использование Мка может предотвратить появление онкологического заболевания, заранее научив организм бороться с определенным типом рака [4].
Культивируют полученные гибридомы в питательной среде, затем отбирают клоны, дающие положительный ответ к заданному антигену ( рис.2).
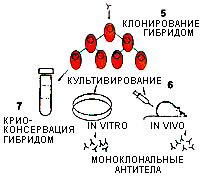
Отобранные клоны нарабатывают in vitro и in vivo. Часть клеток замораживают в жидком азоте и так хранят, пока они не потребуются, а часть используют для терапевтических и диагностических целей ( рис.3).
Мышиные антитела плохо подходят для использования в клинической практике, так как они вызывают иммунный ответ в организме, поэтому используют химерные Мка мыши, в которых собственный Fc-фрагмент заменен на Fc-фрагмент человеческого антитела, что существенно снижает их иммуногенность в организме человека [4].
Следующие данные подтверждают, что сигнал от антимышиных IgG обусловлен антителами в опухоли, а не наличием иммунных клеток в ткани (рис.4, 5)
Рис.4. Рак молочной железы мыши
Показано, что флуоресцентная маркировка мышиного IgG в неопластической молочной ткани статистически выше, чем в молочной ткани здоровой мыши [5].
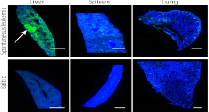
Рис.5. Рак печени, селезенки, легких
Показано, что в тканях этих органов, обработанных антимышиным IgG, больше антител в опухолевой ткани, чем в тканях здоровой мыши.
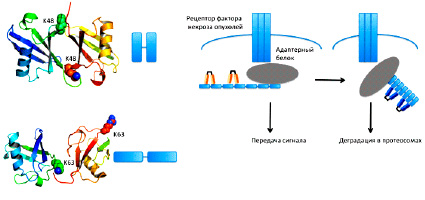
Рис.6. Роль К63 и К48-связанных полимеров убиквитина в передаче сигнала от рецептора фактора некроза опухолей
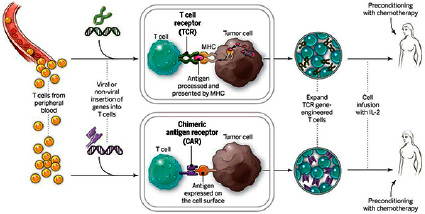
Рис.7. CAR Т-клеток и TCR Т-клетки предназначены для получения специальных рецепторов на их поверхности. Затем они нарабатываются в лаборатории и возвращаются пациенту
Недавно появился новый подход, так называемый адаптивный перенос клеток (ACT), использующий иммунные клетки пациентов для лечения рака (рис. 7) [9].
Существует потребность в разработке эффективных методов лечения, совмещающих использование Мка со стандартной химиотерапией. Все лейкозные клетки экспрессируют несколько поверхностных антигенов, поддающихся терапии, включая CD20, CD22 и CD19. Мка избирательно взаимодействуют с поверхностными антигенами и минимизируют токсичность . При добавлении к первой химиотерапии ритуксимаба, антитела, направленного против CD20, эффективность лечения больных лейкемией значительно возрастает [10].
В настоящее время потребность в большом количестве Мка привела к значительным объемам их производства, а также к улучшению подходов их разработки [11].
Таким образом, моноклональные антитела могут распознавать эпитопы, присутствующие на поверхности клеток, отражающие самые ранние биохимические изменения, предшествующие неопластическому процессу, что является перспективным для диагностики онкологических заболеваний.
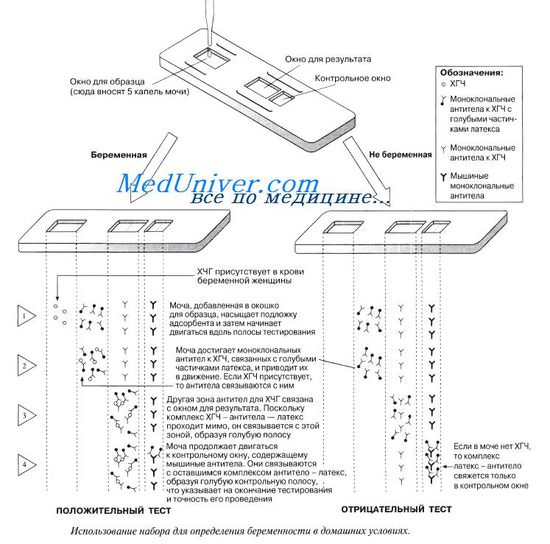
ДИАГНОСТИКА БОЛЕЗНЕЙ. Одной из самых распространенных болезней, передаваемых половым путем, является хламидиоз. Возбудитель болезни — небольшая грамотрицательная бактерия Chlamydia — необычна тем, что является внутриклеточным паразитом. Симптомы заражения очень слабо выражены, поэтому иногда его трудно отличить от гонореи, другого распространенного заболевания, передающегося половым путем. Обе инфекции могут вызывать у женщин воспалительный процесс в области таза, если они распространяются через матку в фаллопиевы трубы. Болезнь выражается в болях и дискомфорте и может привести к бесплодию. Пока не было моноклональных антител, диагностировать хламидиоз было очень трудно. С использованием моноклональных антител диагностика обеих болезней стала более быстрой и надежной. Результаты можно получить в течение 15—20 мин, что существенно быстрее, чем лабораторный анализ в больницах, занимающий несколько дней.
Другой пример использования моноклональных антител — набор для диагностики стрептококковых инфекций горла. С помошью такого набора участковые врачи могут быстро диагностировать заболевание и назначить лечение. Раньше результатов анализа в лабораториях приходилось ждать несколько дней.
В настоящее время получены моноклональные антитела, способные отличать вирус герпеса 1-го типа, который вызывает простудные поражения кожи на губах, от близкородственного вируса герпеса 2-го типа, вызывающего гени-тальные инфекции. Около 10—12% генитальных инфекций вызываются тем не менее вирусом герпеса 1-го типа. Поскольку способы лечения инфекций, вызываемых разными типами вирусов, существенно различаются, важно уметь отличать один вирус от другого. В этом случае тестирование также занимает около 15—20 мин.
Один из волнующих аспектов диагностики с помощью моноклональных антител — это исследования, проводимые с целью выявления злокачественных заболеваний на более ранних стадиях. Лейкозы и лимфомы обусловлены злокачественным поражением лимфоцитов, и часто их трудно отличить друг от друга. В настоящее время появилась возможность ранней и точной диагностики обоих заболеваний, позволяюшая распознавать разные антигены этих клеток. Лечение рака на ранних стадиях существенно повышает шансы больного на выживание.
Главная проблема трансплантации органов состоит в том, что иммунная система организма распознает новый орган как чужеродный и атакует его. Один из путей решения этой проблемы — попытаться подавить иммунную систему пациента. Созданы антитела, которые очень эффективно предотвращают отторжение пересаженных почек. Такое антитело взаимодействует с антигеном, обнаруженным во всех Т-клетках. Т-клетки — это разновидность лимфоцитов, которые в норме атакуют инфицированные вирусом или злокачественные клетки. Эти же клетки участвуют в отторжении пересаженных органов (гл. 14). Монокло-нальные антитела более эффективны, чем обычные лекарства, используемые для подавления иммунной системы. Они подавляют только Т-клетки, а не всю иммунную систему, как это делают медикаменты и, таким образом, у больного сохраняется способность противостоять болезни.
Чтобы уменьшить риск отторжения, перед пересадкой органа нужно найти максимально совместимого донора. Это означает, что антигены донора должны, насколько это возможно, соответствовать антигенам реципиента. Чем больше различаются антигены, тем выше риск отторжения. Для более точного выявления типов антигенов, присутствующих у донора, используют моноклональные антитела.


Моноклональные антитела — это новейшее достижение медицины, которое применяется при лечении тяжелых заболеваний. Среди них злокачественные новообразования, аутоиммунные, системные, заболевания сердечно-сосудистой системы, некоторые инфекции и многое другое. Помимо этого, моноклональные антитела широко используются в диагностике, например, в иммуногистохимии, иммуноферментном анализе, проточной цитофлуориметрии и др. Таким образом, данная технология используется во многих отраслях современной медицины.
- Способы получения моноклональных антител
- Механизм действия моноклоналных антител
- Препараты с моноклональными антителами
- Проблемы при использовании моноклональных антител
Человечество уже давно открыло для себя действие антител — особых молекул, которые вырабатываются клетками иммунной системы для распознавания чужеродных агентов — антигенов и их уничтожения. Антитела обладают специфичностью. Это значит, что они узнают только свой антиген, причем не просто антиген, а отдельный его фрагмент — детерминантную группу. В одном антигене может быть несколько таких детерминантных групп, и к ним будут образовываться разные антитела. Более того, к одной детерминанте может образовываться сразу несколько видов антител, которые могут отличаться по структуре, степени родства и прочности связывания. Таким образом, при введении антигена в организм образуется большое количество разных видов антител, направленных исключительно на один вид антигена. Это позволяет обеспечить адекватную иммунную защиту.
Антитела образуются специальными антителообразующими клетками. Причем каждый их вид образуется отдельной группой генетически однородных клеток — клонов. Чем больше необходимо видов антител, тем больше образуется клонов. Соответственно, антитела, которые вырабатываются одним клоном клеток называются моноклональными антителами.
Раньше для производства антител применялась иммунизация животных, после которой отбиралась их плазма и использовалась для приготовления отдельных препаратов — иммунных сывороток для борьбы с различными токсинами (дифтерия, столбняк), вирусами, ядами и др. Но бывают ситуации, когда нужно конкретное антитело, направленное на конкретную детерминанту антигена. Здесь уже обычной иммунизацией не обойтись. Требуются более прицельные технологии.
Способы получения моноклональных антител
Получение моноклональных антител — это сложный многоступенчатый процесс, который проходит следующие этапы:
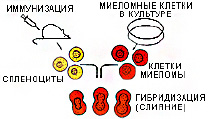
- Иммунизация животных. Обычно используются мыши или крысы. Это нужно для того чтобы увеличить количество лимфобластов — клеток, продуцирующих нужные антитела и перевести эти клетки в активное состояние. После выделения из организма эти клетки не могут долго существовать в лабораторных условиях, они погибнут даже на питательных средах с содержанием ростовых факторов. Чтобы это предотвратить, их скрещивают со злокачественными миеломными клетками.
- Подготовка миеломных клеток. Параллельно с иммунизацией животных проводят подготовку опухолевых миеломных клеток. Они, во-первых, обладают способностью синтезировать моноклональные антитела, а во-вторых, обладают неограниченным жизненным потенциалом (они бессмертны и способны к бесконечному воспроизведению). Для того чтобы миеломные клетки не погибли вне организма, их культивируют на специальных средах с использованием факторов роста.
- Гибридизация (слияние) лимфобластов и миеломных клеток для образования гибридомы. Для этого клетки обрабатывают различными антителами, чтобы изменить строение их мембран и спровоцировать образование цитоплазматических контактов. При этом образуются разные типы клеток, имеющих двойной набор хромосом (дикарионы). Это могут быть дикарионы, образованные только лимфоцитами, или только миеломными клетками. Но для производства моноклональных антител нужны именно дикарионы, образованные лимфоцитом и миеломной клеткой — гибридные клетки.
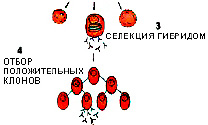
- Отбор гибридных клеток. Для этого используют специальные растворы, которые позволяют выжить только лимфобластным и гибридомным дикарионам. Первые в скором времени погибают, т. к. не обладают возможностью безграничного деления, а гибридомные клетки остаются жизнеспособными.
- Реклонирование гибридомных клонов.
- Определение и отбор гибридом, продуцирующих моноклональные антитела. Обычно для этого используется иммуноферментный анализ.
- Массовое наращивание антител.
- Очистка полученных антител. Степень очистки будет определяться областью применения препарата. Если это диагностика, достаточно 70-95% степени чистоты. Если препарат предполагается использовать для иммунотерапии, требуется более высокая степень чистоты. Для очистки используется аффинная и ионообменная хроматография.
- Удаление оставшихся примесей и обеззараживание полученного препарата от вирусов и бактерий.
В настоящее время идет тенденция отказа в использовании антител животных для лечебных целей. Во-первых, они являются чужеродными агентами для организма и могут спровоцировать аллергические реакции, вплоть до анафилаксии, что напрямую угрожает жизни пациентов. Во-вторых, иммунная система человека, распознавая такие антитела как чужеродные, будет пытаться их инактивировать, что снизит эффективность противоопухолевого лечения. Получить человеческие моноклональные антитела вышеописанным методом не представляется возможным, ввиду следующих проблем:
- Иммунизация человека различными антигенами неэтична.
- Даже если получить иммунизированные лимфоциты человека, будут проблемы на этапе их слияния с клетками миеломы мыши — полученные гибридомы будут нестабильны.
- Клеточные линии миеломы человека, которые можно было бы эффективно использовать в рамках биотехнологий для получения антител, пока получить не удалось.
В этой связи необходимо было искать новые технологии получения антител. Решением проблемы стали гибридные, гуманизированные и одноцепочечные антитела, производство которых подразумевало применение гибридомной технологии, кратко описанной выше, и технологии рекомбинантной ДНК.
Механизм действия моноклоналных антител
Моноклональные антитела широко используются в лечении заболеваний, у которых в патогенезе замешан иммунный компонент. С их помощью лечат псориаз, аутоиммунные заболевания, ревматоидный артрит, рассеянный склероз. Большие перспективы эти технологии получили и в онкологии в рамках таргетной терапии. При этом, их эффект основан на различных механизмах, которые рассмотрены ниже.

В качестве примера изменения клеточных сигналов можно привести рецепторы факторов роста. Некоторые злокачественные клетки имеют на своей поверхности большое количество рецепторов к факторам роста, активирующим каскад реакций, направленный на усиление размножения клетки. Чем больше таких рецепторов, тем активнее протекает этот процесс. Если блокировать рецептор с помощью моноклонального антитела, он не сможет связаться с лигандом (фактором роста), и соответственно каскад этих реакций не будет запущен. Клетка не будет так активно размножаться и в конце концов погибнет.
Этот механизм реализуется следующим образом. Антитело связывается с антигеном, находящимся на поверхности злокачественной клетки, что приводит к активации многоэтапной системы комплемента (механизма иммунного ответа). Конечным этапом этих реакций является образование особого белка С 9, который перфорирует клеточную мембрану раковой клетки, что в конечном итоге приводит к ее гибели.
Препараты с моноклональными антителами
Препараты на основе моноклональных антител уже два десятилетия входят в протоколы противоопухолевого лечения некоторых злокачественных новообразований. В 2008 году ВОЗ были приняты рекомендации относительно непатентованных названий таких препаратов:
- Их название должно заканчиваться на маб, от английского monoclonal antibody.
- Для указания источника получения моноклонального антитела должны использоваться следующие подосновы:
- -аксо — гибридное антитело.
- -о — мышиное антитело.
- -кси — химерное антитело.
- -у — человеческое антитело.
В настоящее время используется два вида противоопухолевых моноклональных антител:
- Неконъюгированные антитела — они оказывают непосредственное действие на процессы, которые приводят к гибели злокачественной клетки.
- Конъюгированные антитела — они связаны (конъюгированы) с токсинами или изотопами. Токсины и изотопы обладают уничтожающим действием на злокачественные клетки, а антитело обеспечивает их прицельную доставку к клеткам-мишеням.
Эти препараты используются чаще всего. Их целью является определенный рецептор на поверхности злокачественной клетки.
К этому типу препаратов относится ритуксимаб — первое моноклональное антитело, которое было одобрено для применения в клинической практике. Его используют для лечения CD20+ В-клеточных лимфом. Рецептор CD20 есть на В-лимфоцитах, как здоровых, так и опухолевых, но он отсутствует на других тканях и клетках, в том числе на стволовых. Поэтому при воздействии ритуксимаба хоть и погибает популяция В-лимфоцитов, но потом она восстанавливается за счет нетронутых стволовых клеток. Причем восстанавливаются именно здоровые клетки.
Неконъюгированные антитела могут помечать злокачественные клетки и делать их видимыми для иммунной системы. Таким способом работает алемтузумаб, который связывается с CD52+ лимфоцитами и привлекает к ним внимание иммунитета.
Также к неконъюгированным моноклональным антителам относятся ингибиторы рецепторов факторов роста. Факторы роста — это специальные молекулы, которые запускают деление клетки. Для того чтобы запустить этот процесс, фактор должен связаться со специальным рецептором, расположенным на мембране клетки, что приведет к каскаду соответствующих реакций. Такие рецепторы есть и у здоровых клеток, и у злокачественных, но у злокачественных их может быть очень много, что позволяет таким клеткам делиться быстрее. Блокирование рецепторов с помощью антител приводит к нарушению этого процесса деления и клетки уже не могут бесконтрольно размножаться. К таким препаратам относится трастузумаб, цетуксимаб и др.
К неконъюгированным антителам относятся и ингибиторы ангиогенеза — образования кровеносных сосудов. Ангиогенез очень важен для злокачественных опухолей, чтобы получать большее количество кислорода и питательных элементов, поэтому опухоли инциируют его образование с помощью специальных химических сигналов. Моноклональные антитела либо блокируют передачу этих сигналов, либо разрушают уже созданную внутри опухоли сосудистую сеть. Это приводит к нарушению ее питания и остановке роста. К группе этих препаратов относится рамуцирумаб, бевацизумаб и др.
Конъюгированные моноклональные антитела связывают с цитотоксическими или радиотоксическими веществами, что позволяет прицельно воздействовать разрушающим агентом на злокачественные клетки. В качестве примера такого препарата можно привести ибритумомаб (Зевалин), в котором моноклональное антитело против CD20 (как мы помним, это маркер В-лимфоцитов) соединено с радиоактивным изотопом — иттрием-90. Препарат применяется для лечения В-клеточных лимфом. В качестве другого препарата можно привести Кадсилу — препарат, в котором антитело трастузумаб конъюгировано с ингибитором микротрубочек DM1, оказывающим цитотоксический эффект. Применяют его для лечения рака молочной железы.
Проблемы при использовании моноклональных антител
Несмотря на, казалось бы, огромные перспективы в лечении онкологических больных, применение моноклональных антител не является панацеей и тоже имеет ряд проблем:
- Препараты на основе моноклональных антител биологически и биохимически нестабильны. Особенно это касается конъюгированных антител. Это требует особых условий производства, хранения и транспортировки.
- Антитела плохо проникают внутрь опухоли.
- Они могут вызывать иммунный ответ против себя, что блокирует их действие. У 75% пациентов, которым вводились мышиные антитела, наблюдалось образование нейтрализующих антител, что снижало эффективность лечения.
- Препараты на основе моноклональных антител оказывают токсическое действие. Конечно, оно не такое выраженное как у цитостатиков, но в ряде случаев токсичность настолько высокая, что требует отмены препарата.
- Наиболее важным моментом является высокая специфичность моноклональных антител и высокая гетерогенность опухолевых клеток. Не все раковые клетки имеют молекулы мишени, на которые направлено действие препарата. Соответственно, они ускользают от его действия и остаются нетронутыми. Постепенно масса этих клеток накапливается и опухоль становится резистентной к данному методу лечения.
Чтобы улучшить результаты лечения, разрабатываются новые виды моноклональных антител. Одним из вариантов являются биспецифические антитела, которые направлены сразу на две молекулярные мишени, например, блинатумомаб — препарат, направленный сразу на две клеточные мишени В-лимфоцита — CD 19 и CD22. Он повышает узнаваемость злокачественных клеток даже после их трансформации в другие виды лейкоза.
В любом случае моноклональные антитела — это новое и высокоперспективное направление в современной онкологии. Разработка современных, более совершенных технологий помогает решать имеющиеся проблемы и делает лечение пациентов эффективнее и безопаснее.
Читайте также:

