Гипердиагностика рака молочной железы

На протяжении нескольких лет ресурс GreenMedInfo сообщает о чрезмерной диагностике рака. Гипердиагностика рака — это одна из самых серьёзных и опасных проблем современной медицины. Преждевременно диагностированный рак не представляет никакой угрозы. Но ненужная химиотерапия и облучение, не предлагая никакой помощи, создают значительную угрозу получения стресса, дискомфорта, болезни и даже, возможно, становятся причиной настоящих раковых заболеваний.
Предпосылка
Как стало ясно из предыдущих материалов, большинство исследований показывают, что раннее выявление рака не снижает риск смерти от рака, для чего оно и проводится (1). Но это действительно подвергает риску получения вреда, причиняемого скринингом, ложноположительными результатами и гипердиагностикой.
Пожалуй, самая серьёзная история гипердиагностики у рака щитовидной железы. Для женщин риск гипердиагностики рака щитовидной железы колеблется от 50% до 70-80% в США, Франции, Италии и Австралии. Мужчинам следует опасаться этого не меньше при том, что гипердиагностика достигает показателей в 45% в США и до 70% в некоторых других странах (2).
Рак молочной железы — это почти такая же страшная проблема. Систематический обзор исследований показал, что риск гипердиагностики рака молочной железы составляет невероятные 52% (3). Более поздние исследования не показывают никаких улучшений. На самом деле, картина становится всё хуже. Исследование 2014 года, опубликованное в Журнале Американской Медицинской ассоциации, показало, что десять и более лет регулярных маммограмм приводят к ложноположительному результату более чем у 60% женщин (4).
Мужчины сталкиваются с аналогичными проблемами при раке предстательной железы. Хотя скрининг ПСА на рак простаты не даёт никаких преимуществ, поскольку он не снижает уровень смертности, он приводит к ложноположительным результатам у 12-13% мужчин, которые проходят обследование три-четыре раза (5).
Новое доказательство
Для женщин новое исследование выявило риск гипердиагностики рака щитовидной железы в том же диапазоне, что и предыдущие исследования. 73% случаев рака щитовидной железы были на самом деле гипердиагностированы.
Более ранние исследования показали, что проблема рака щитовидной железы возникает из-за двойной проблемы гипердиагностики и поспешность определения проблемы. Один из самых распространенных видов рака щитовидной железы оказывается был вовсе не раком. Инкапсулированный фолликулярный вариант папиллярного рака щитовидной железы составляет около одного из каждых 6,5 человек, у которых ежегодно диагностируется рак щитовидной железы в США, но эта распространенная форма рака щитовидной железы в настоящее время, как известно, вообще не является раком. Таким образом, все эти люди получили ненужное и вредное облучение из-за гипердиагностики из-за поспешного определения (6).
Для рака молочной железы новое исследование показало, что частота гипердиагностики составляет 22%. Шокирующие 58% всех случаев рака почки на самом деле оказались гипердиагностированы. Частота гипердиагностики меланом почти так же плоха и составила почти 54%. В целом, 18% постановки всех диагнозов рака у женщин были плодом чрезмерной диагностики.
Для мужчин цифры столь же тревожны. Рак щитовидной железы, опять же, возглавляет список с 73%-ной частотой гипердиагностики. 42% всех диагнозов рака предстательной железы на самом деле являются гипердиагностикой. Число случаев рака почек также составляет 42%. А гипердиагностика меланом встречается в 58% случаев. В целом для мужчин 24% всех диагнозов рака являются гипердиагностикой.
Гипердиагностика рака у людей, которые никогда не испытали бы симптомов или вреда, которая приводит к лечению, действительно вызывающему симптомы и причиняющему вред, является одной из самых серьёзных проблем в медицине сегодня.
- Saquib N, Saquib J, Ioannidis JP. Does screening for disease save lives in asymptomatic adults? Systematic review of meta-analyses and randomized trials. Int J Epidemiol 2015;44:264-77.
- Vaccarella S, Franceschi S, Bray F, et al. Worldwide Thyroid-Cancer Epidemic? The Increasing Impact of Overdiagnosis. NEJM 2016;375:614-7.
- Jørgensen KJ, Gøtzsche PC. Overdiagnosis in publicly organised mammography screening programmes: systematic review of incidence trends. BMJ 2009;339:b2587.
- Pace LE, Keating NL. A systematic assessment of benefits and risks to guide breast cancer screening decisions. JAMA 2014;311:1327-35.
- Chou R, Croswell JM, Dana T, et al. Screening for prostate cancer: a review of the evidence for the US Preventive Services Task Force. Ann Intern Med 2011;155:762-71.
- Yuri E. Nikiforov, Raja R. Seethala, Giovanni Tallini, et al. A Paradigm Shift to Reduce Overtreatment of Indolent Tumors. JAMA Oncol 2016;2(8):1023-1029.
- Псевдомолекулы, сваренные в подвале. Расследование МедАльтернатива.инфо
- Маммография приводит к ошибочному диагнозу и причиняет вред
- Скрининг рака никогда не спасал жизни – вывод исследования Британского Медицинского Журнала (BMJ)
- Глобальная афера в индустрии лечения рака
- Почему скрининг и традиционные рецептурные препараты для лечения щитовидной железы зачастую оказываются неэффективными
- Окаменевшие до смерти: вновь доказано, что кальциевые добавки убивают
Внимание! Предоставленная информация не является официально признанным методом лечения и несёт общеобразовательный и ознакомительный характер. Мнения, выраженные здесь, могут не совпадать с точкой зрения авторов или сотрудников МедАльтернатива.инфо. Данная информация не может подменить собой советы и назначение врачей. Авторы МедАльтернатива.инфо не отвечают за возможные негативные последствия употребления каких-либо препаратов или применения процедур, описанных в статье/видео. Вопрос о возможности применения описанных средств или методов к своим индивидуальным проблемам читатели/зрители должны решить сами после консультации с лечащим врачом.

- Как возникает рак молочной железы?
- Типы рака молочной железы
- Причины и факторы риска
- Симптомы рака молочной железы
- Самостоятельная диагностика рака груди
- Диагностика
- Стадии рака молочной железы
- Лечение рака молочной железы
- Прогноз при раке молочной железы
Как возникает рак молочной железы?
Рак груди развивается так же, как и любая другая злокачественная опухоль в организме. Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги — метастазы.
Мутации, которые приводят к РМЖ, бывают наследственными и приобретенными .
Распространенными наследственными генетическими причинами рака молочной железы становятся мутации в генах BRCA1 и BRCA2. Носительницы мутации BRCA1 имеют риск заболеть раком молочной железы 55–65%, а носительницы BRCA2 — 45%. Такие генетические дефекты передаются по наследству от родителей детям, они становятся причиной рака молочной железы примерно в 15% случаев.
Намного чаще опухоль возникает из-за приобретенных мутаций: они возникают в клетках молочной железы и не передаются по наследству. Например, в 20% случаев увеличено количество копий гена, кодирующего HER2 — белок-рецептор, который находится на поверхности клеток и стимулирует их размножение.
Типы рака молочной железы
Злокачественные опухоли груди делятся на два типа: протоковые и железистые. Протоковый рак молочной железы встречается чаще. Он может быть внутриэпителиальным (in situ) и инвазивным. У внутриклеточного протокового рака молочной железы более благоприятный прогноз, он редко дает метастазы и излечивается в 98% случаев. Инвазивный же вариант опухоли склонен к бесконтрольному росту и генерализации процесса.
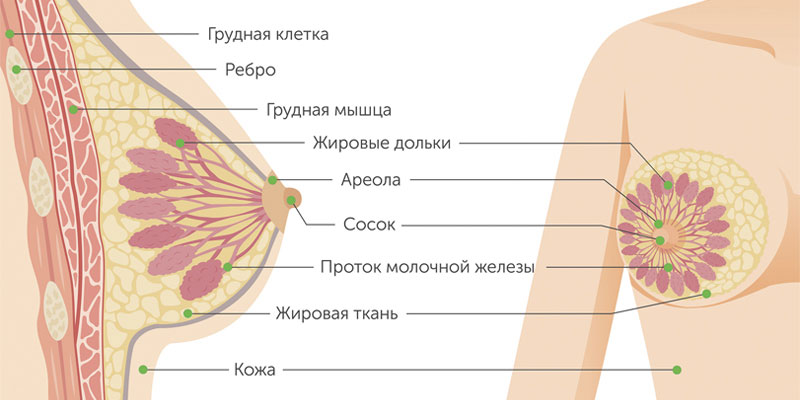
Железистый рак молочной железы может быть дольковым (инвазивная лобулярная карцинома) или произрастать из других клеток железистой ткани. Для долькового рака нередко характерен мультицентричный рост. Скорость увеличения в размерах и сроки метастазирования форм узлового рака груди зависят от степени дифференцировки опухоли.
Причины и факторы риска
К сожалению, полной информации о причинах возникновения рака молочной железы у ученых пока нет. Существует список факторов риска, влияющих на вероятность появления опухоли, однако у некоторых болезнь диагностируют при отсутствии этих факторов, другие же остаются здоровыми при наличии сразу многих из них. Тем не менее, ученые все же связывают развитие рака груди с определенными обстоятельствами, наиболее часто предваряющими его появление. К ним относятся:
- Возраст. Большинство случаев РМЖ приходятся на женщин в возрасте 55 лет и старше.
- Наследственность. Если РМЖ диагностирован у кого-то из близких родственников, риск повышается вдвое.
- Рак молочной железы в анамнезе.
- Повышенная плотность ткани молочной железы по результатам маммографии.
- Некоторые доброкачественные новообразования в молочной железе.
- Раннее начало менструаций — до 12 лет.
- Поздняя менопауза — после 55 лет.
- Отсутствие детей или поздние (после 35 лет) первые роды.
- Воздействие радиации, например, в ходе лучевой терапии, проводимой для лечения другого типа рака.
- Курение и злоупотребление алкоголем. Если женщина ежедневно потребляет 28–42 г этилового спирта, ее риски повышаются на 20%.
- Лишний вес и низкая физическая активность.
- Использование гормональных препаратов: оральные контрацептивы, заместительная гормональная терапия в постменопаузе.
- Травмы молочных желез.
- Сахарный диабет.
- Работа по графику с ночными сменами.
Симптомы рака молочной железы
На ранних стадиях рак молочной железы, как правило, никак клинически не проявляется. Чаще всего опухоль обнаруживается самими больными или выявляется случайно при проведении профилактических исследований.
Пациентки обычно жалуются на наличие пальпируемого образования, выделения из соска. Боль является редким симптомом рака грудной железы, однако болевой синдром может выйти на первый план на этапе генерализации процесса, в особенности при распространении метастазов в кости.
Довольно часто выявляются такие признаки рака груди, как появление асимметрии вследствие изменения размеров пораженной железы. Уменьшение, смещение кверху, деформация и сморщивание молочной железы может наблюдаться при скиррозной (фиброзной) форме опухоли. Напротив, увеличивается грудь на стороне поражения при быстром росте образования или из-за отека, который формируется по причине нарушенного оттока лимфы.
При распространении новообразования в подкожную клетчатку могут наблюдаться изменения кожи. При этом выявляются следующие симптомы рака молочной железы:
Иногда, при распространении опухоли на поверхность кожи могут наблюдаться такие признаки рака груди, как покраснение и изъязвление. Наличие этих симптомов говорит о запущенности процесса.
Изменения соска тоже могут определяться, но только на поздних стадиях. При этом имеют место такие симптомы рака грудной железы, как:
- Симптом Форга — на стороне поражения сосок находится выше, чем на здоровой стороне.
- Симптом Краузе — сосок утолщен, складки ареолы заметно выражены.
Такой признак рака молочной железы, как патологические выделения, является довольно редким, но в ряде случаев может быть единственным симптомом, который выявляется при осмотре. Часто выделения носят кровянистый характер, реже встречаются серозные и гнойные.
Также были выделены особые формы рака груди, которые проявляются типичной симптоматикой. К ним относятся:
- Отечно-инфильтративная форма, для которой характерно увеличение и отечность железы, мраморный цвет кожи, выраженная гиперемия.
- Маститоподобная. Данный вид рака груди проявляется уплотнением пораженной груди, повышением температуры тела.
- Рожистоподобная форма, при которой на коже выявляются очаги (иногда появляются изъязвления), которые внешне напоминают рожистое воспаление.
- Панцирная форма характеризуется наличием множественных узлов, за счет которых происходит сморщивание и деформация железы.
- Рак Педжета — поражает сосок и ареолу. При данной разновидности наблюдают утолщение соска, изменение кожи в виде покраснения и уплотнения, образование корок и чешуек.
Иногда люди, интересуясь по каким признакам можно распознать наличие опухоли молочной железы, по ошибке ищут симптомы рака грудины. Данное название является неверным, так как грудина является центральной плоской костью грудной клетки и даже при метастазировании злокачественного образования груди практически никогда не поражается.
Самостоятельная диагностика рака груди
Самостоятельно проверять грудь на наличие узелков или каких-либо других изменений стоит раз в месяц после менструации. Домашнюю диагностику удобнее всего проводить, принимая ванну или находясь под душем. О любых изменениях, которые удалось обнаружить, стоит как можно быстрее рассказать врачу.
Порядок проведения самообследования молочных желез:
- Разденьтесь выше пояса и встаньте перед зеркалом.
- Поднимите руки вверх и заведите их за голову. Внимательно осмотрите грудь. Повернитесь правым, левым боком.
- Ощупайте молочные железы в положении стоя сложенными указательным, средним и безымянным пальцем. Начинайте с верхней наружной части груди и двигайтесь по часовой стрелке.
- Сожмите сосок двумя пальцами. Проверьте, выделяется ли из него что-нибудь.
- Снова ощупайте молочные железы — теперь в положении лежа.
70% случаев рака молочной железы выявляются пациентами самостоятельно в результате самообследования груди.
Диагностика
Диагностика рака молочной железы начинается с беседы. На этом этапе для врача важно оценить жалобы женщины и выяснить, встречались ли случаи рака молочной железы в её семье, если да — насколько часто. Это помогает заподозрить наследственную форму рака, связанную с мутациями в генах BRCA1, BRCA2, NBS1, CHECK, TP53.
Далее врач осматривает, ощупывает молочные железы, проверяет, нет ли в них узлов и уплотнений, не увеличены ли лимфатические узлы в подмышечной, надключичной и подключичной областях.
После осмотра врач может направить женщину на маммографию — рентгенографию молочной железы. Показаниями к этому исследованию являются: уплотнения в молочной железе, изменения со стороны кожи, выделение крови из соска, а также любые другие симптомы, которые могут указывать на злокачественную опухоль. Также для диагностики рака молочной железы назначают ультразвуковое исследование. Маммография и УЗИ являются взаимодополняющими методами, каждый из них имеет свои преимущества:
Маммография
УЗИ молочных желез
Позволяет обнаружить патологические изменения за 1,5–2 года до появления симптомов.
При кровянистых выделениях из соска можно провести дуктографию — рентгенографию с контрастированием молочных протоков. Это помогает получить дополнительную полезную информацию.
Высокая чувствительность — точная диагностика до 90% случаев рака.
Возможность обнаружить микрокальцинаты до 0,5 мм.
Безопасность — нет воздействия на организм рентгеновскими лучами.
Хорошо подходит при высокой плотности ткани молочной железы, у молодых женщин (до 35–45 лет).
Позволяет отличать кисты (полости с жидкостью) от плотных опухолей.
Позволяет оценить состояние регионарных лимфатических узлов.
Хорошо подходит для контроля положения иглы во время биопсии.
Магнитно-резонансная томография — высокоинформативный метод диагностики злокачественных опухолей молочной железы. Ее применяют при лобулярном раке, когда неинформативны маммография и УЗИ, а также для оценки размеров и расположения опухоли, что помогает определиться с тактикой хирургического лечения. МРТ может применяться для скрининга у женщин-носительниц аномальных генов, связанных с повышенным риском рака молочной железы, при отягощенном семейном анамнезе.
О роли биопсии в диагностике рака молочной железы рассказывает врач Европейской клиники Портной С.М.:

В лаборатории проводят цитологическое и гистологическое исследование, то есть оценивают строение отдельных клеток и ткани. В настоящее время доступны молекулярно-генетические исследования: они помогают выявить мутации, за счет которых произошло злокачественное перерождение, и подобрать оптимальную противоопухолевую терапию.
Биопсия позволяет выяснить, является ли опухоль злокачественной, а также определить ее тип и стадию. Кроме того, исследование биопсийного материала дает ответ на вопрос, является ли опухоль гормонозависимой , что также влияет на схему лечения.
После того как рак диагностирован, важно определить его стадию и понять, насколько сильно он распространился в организме. Для этого применяют следующие исследования:

Стадии рака молочной железы
Стадирование при раке молочной железы опирается на общепринятую систему TNM. Буква T в этой аббревиатуре обозначает размер первичной опухоли:
Буквой N обозначают наличие метастазов в регионарных лимфатических узлах. N0 — очаги в лимфатических узлах отсутствуют. N1, N2 и N3 — поражение разного количества лимфатических узлов.
Буква M обозначает наличие отдаленных метастазов. Рядом с ней может быть указана одна из двух цифр: M0 — нет отдаленных метастазов, M1 — отдаленные метастазы имеются.
В зависимости от значений T, N и M, выделяют пять основных стадий рака молочной железы (внутри некоторых из них есть подстадии):
- Стадия 0: рак на месте.
- Стадия I: опухоль в молочной железе диаметром до 2 см.
- Стадия II: опухоль в молочной железе диаметром до 5 см и более, могут быть метастазы в подмышечных лимфоузлах на стороне поражения.
- Стадия III: опухоль в молочной железе до 5 см и более, может прорастать в грудную стенку или в кожу, имеются очаги в регионарных лимфатических узлах.
- Стадия IV: опухоль может быть любых размеров, не имеет значения, поражены ли регионарные лимфоузлы. Если обнаруживают отдаленные метастазы, всегда диагностируют рак четвертой стадии.
Лечение рака молочной железы
Стратегия лечения рака молочной железы должна подбираться индивидуально для каждой пациентки с учетом таких факторов, как тип опухоли, стадия, чувствительность новообразования к гормональной терапии. Берется во внимание и общее состояние больной. Если опухоль обнаружена на ранних стадиях и выбрана правильная тактика ведения пациентки, то шанс полностью вылечить рак груди является весьма высоким.
Выберите врача-онколога и запишитесь на приём:

Пластический хирург, онколог-маммолог, доктор медицинских наук
Проблема гипердиагностики в онкологии не нова. Еще в 30—40-е гг. XX в. патологоанатомы обращали внимание на существование так называемых латентных опухолей щитовидной и предстательной желез, которые обнаруживались при вскрытии больных, умерших не от онкологического заболевания. Сейчас эта проблема приобрела новое значение в связи с развитием высокочувствительных диагностических технологий, с помощью которых стало возможным выявлять такие образования уже при жизни человека
Гипердиагностика и последующее чрезмерное или вовсе ненужное лечение и связанные с ним риски – наиболее опасное последствие внедрения массового обследования населения или так называемой диспансеризации, которая набирает обороты в России. В западных странах программы скрининга для раннего выявления рака критически пересматривают и от некоторых из них просто отказываются.
Заболеваемость, выживаемость и смертность
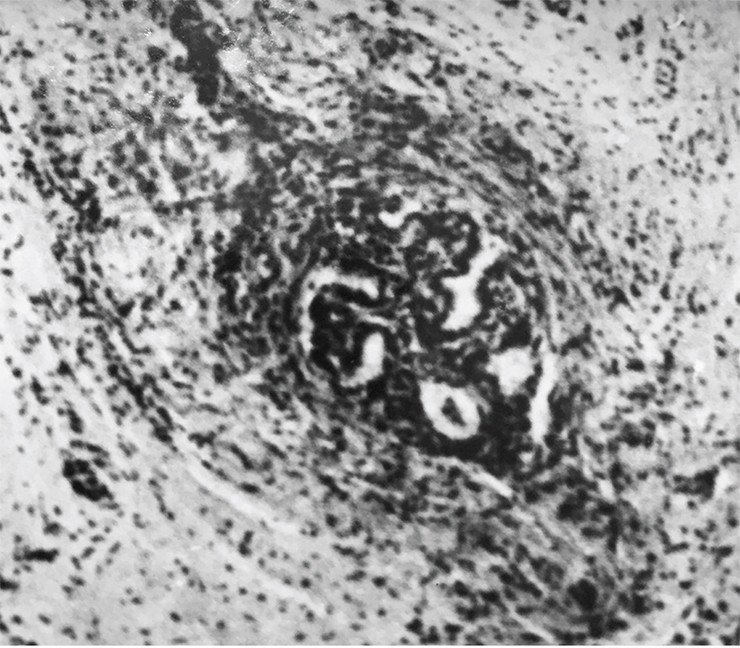
Папиллярная микрокарцинома щитовидной железы давно привлекла внимание патологов и клиницистов. Длительное наблюдение пациентов с диагнозом папиллярной микрокарциномы показало, что их продолжительность жизни не отличается от ожидаемой продолжительности жизни практически здоровых людей того же пола и возраста (Заридзе, 1973).
На основе данных, полученных при вскрытиях, можно предсказать частоту латентных раков в популяции и сравнить этот показатель с риском смерти от злокачественной опухоли того или иного органа. Латентный рак предстательной железы встречается очень часто: по данным разных авторов, он обнаруживается в 30—70 % случаев вскрытий мужчин старше 60 лет, умерших от неонкологических болезней (Breslow et al., 1977; Stamatiou et al., 2006). При этом популяционный риск умереть от рака простаты у мужчин в возрасте за шестьдесят всего 4 %.
Латентные раки щитовидной железы встречаются на вскрытии еще чаще, в 35—90 % случаев, а риск смерти от этой формы рака – всего 0,1 %. Клинически незначимый рак молочной железы может быть случайной находкой в 10—39 % случаев (Welch, Black, 2010), но риск смерти от этого заболевания не превышает 4 %. Таким образом, вероятность гипердиагностики этих заболеваний велика и по подсчетам составляет для рака простаты – около 90 %, рака щитовидной железы – 99 %, и рака молочной железы – 41—90 % (Harach et al., 1985; Welch, Black, 2010).
Судить о факте гипердиагностики крайне трудно в случае конкретного человека, но относительно легко – на уровне популяции: для этого надо сравнить статистические данные заболеваемости и смертности. Быстрый рост заболеваемости (или, точнее, выявляемости) той или иной формы рака в результате внедрения новых высокочувствительных методов диагностики при стабильной или уменьшающейся смертности указывает на возможность гипердиагностики. Например, в США рост заболеваемости раком щитовидной железы, почки, предстательной железы, молочной железы и меланомой кожи не только не сопровождался ростом смертности, но смертность от некоторых перечисленных форм рака даже снизилась (Welch, Black, 2010).
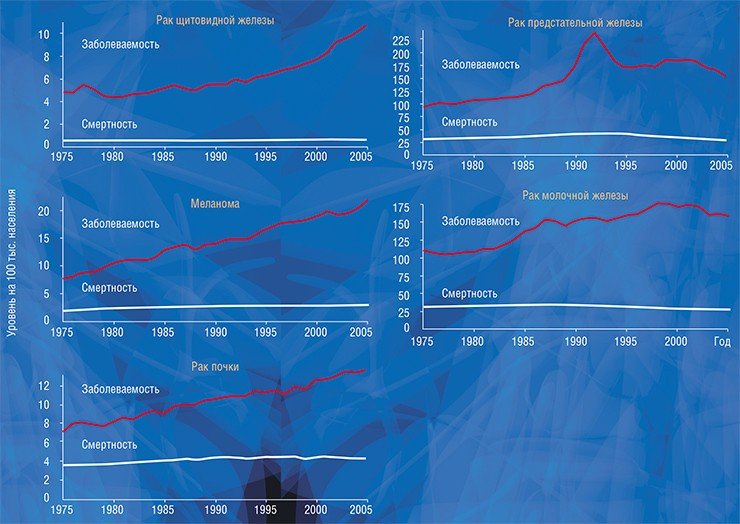
Американские авторы объясняют рост заболеваемости раком молочной железы гипердиагностикой, вызванной широким распространением маммографического скрининга, а предстательной железы – тестированием на простатический специфический антиген (ПСА). Анализ на ПСА, белковый маркер патологии предстательной железы, а не только рака, с 2014 г. не рекомендован к использованию в скрининговых программах из-за низкой специфичности и в результате гипердиагностики (Ibid). В то же время некоторое снижение смертности oт этих форм рака, по мнению тех же авторов, обусловлено не только прогрессом в лечении, но и ранней диагностикой клинически значимых опухолей.
Внутрипротоковый рак молочной железы in situ, до того как в 1980 г. получил распространение маммографический скрининг, встречался очень редко, составляя не более 2 % всех случаев рака молочной железы (Rosner et al., 1980). Но после внедрения скрининга выявляемость этой патологии резко выросла, составив к 2002 г. около 20 % случаев, диагностируемых на преинвазивной (ранней) стадии (Ernster et al., 2002), а применение магнитно-резонансной томографии увеличило эту цифру до 30 % (Kuhl et al., 2007).
Рост заболеваемости раком щитовидной железы или, точнее, выявляемости клинически незначимых латентных образований – следствие широкого распространения ультразвукового исследования (УЗИ) органов шеи. Изучив динамику заболеваемости в развитых странах, исследователи из Международного агентства по изучению рака (МАИР) пришли к заключению, что в течение последних двух десятилетий количество случаев гипердиагностики рака щитовидной железы в двенадцати развитых странах достигло почти полумиллиона случаев: 470 тыс. мужчин и 9 тыс. женщин (Vaccarella at al., 2016). Рост заболеваемости раком почки тоже в большой степени объясняется распространением УЗИ – в этом случае органов брюшной полости. Так называемая онкологическая настороженность дерматологов и широкое применение диагностической процедуры дерматоскопии позволяет выявлять клинически незначимые меланомы кожи, динамика роста выявляемости которых в США отражает динамику роста частоты дерматоскопий.
В США выживаемость при раке молочной железы достигает 90 %, а при раке простаты – 100 %. Ожидаемая продолжительность жизни пациентов с папиллярной микрокарциномой щитовидной железы не отличается от ожидаемой продолжительности жизни людей того же пола и возраста. Эти очень высокие показатели выживаемости в значительной степени являются результатом гипердиагностики
И во всех этих случаях нет оснований говорить о том, что изменилось влияние известных факторов риска рака, за счет которых может расти заболеваемость, хотя нельзя полностью исключить истинный рост заболеваемости, например, раком почки за счет распространения в популяции таких факторов риска, как избыточный вес и недостаток физической активности.
В России и в Америке – одна картина
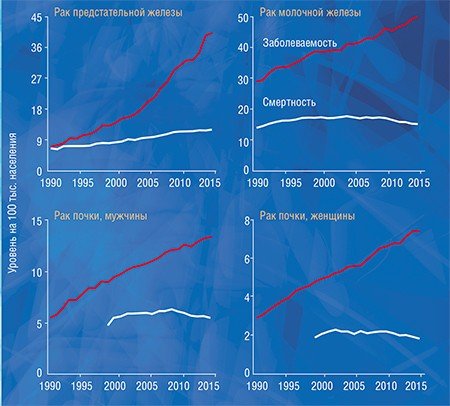
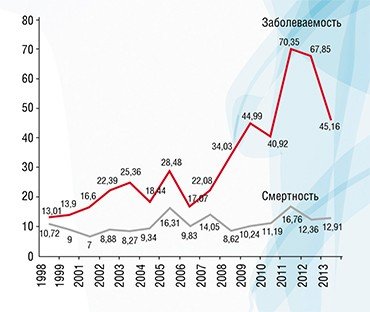
Чтобы понять, как влияет гипердиагностика на уровень заболеваемости раком в нашей стране, мы, используя данные статистики заболеваемости и смертности от рака, которые предоставили коллеги из МНИО им. П. А. Герцена, провели исследование, аналогичное американскому. Мы сравнили динамику заболеваемости меланомой, раком почки, предстательной, молочной и щитовидной желез с динамикой смертности от этих болезней и получили похожие результаты: резкий рост заболеваемости и незначительный рост смертности с дальнейшей стабилизацией или некоторым снижением.
Существует колоссальная разница между показателями заболеваемости раком предстательной и щитовидной железы в разных регионах России, а разница по смертности при этом далеко не так ярко выражена. Мы выяснили, что у пациентов с раком предстательной и щитовидной желез заболеваемость достоверно коррелирует с выживаемостью, т. е. в регионах с высокой заболеваемостью наблюдается высокая выживаемость. Это говорит о том, что заболеваемость растет за счет роста выявляемости клинически незначимых образований, а высокий показатель выживаемости указывает на то, что продолжительность жизни этих пациентов была бы такой же и без лечения.
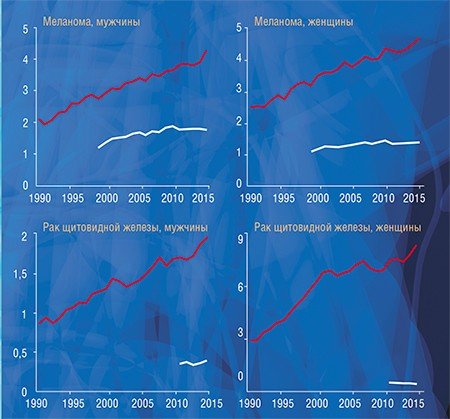
Как и в Америке, в России значительный рост заболеваемости раком за последние два десятилетия нельзя объяснить только ростом влияния известных или гипотетических факторов риска, а многократное увеличение разрыва между заболеваемостью и смертностью не может быть только следствием прогресса в лечении онкологических заболеваний. В эти годы и в нашей стране происходило широкое внедрение в практику высокочувствительных диагностических методов: ПСА, маммографии, УЗИ, компьютерной и магнитно-резонансной томографии, способных выявить латентные клинически незначимые новообразования.
Методом выбора ведения пациентов с бессимптомными, клинически незначимыми, латентными новообразованиями должен стать отказ от агрессивной терапии. Такая тактика позволит избежать ненужного, чрезмерного вмешательства, что, в свою очередь, предотвратит ухудшение качества жизни пациентов (сколько изуродовали мужчин на основании ПСА-тестирования!), а также приведет к сокращению расходов на лечение.
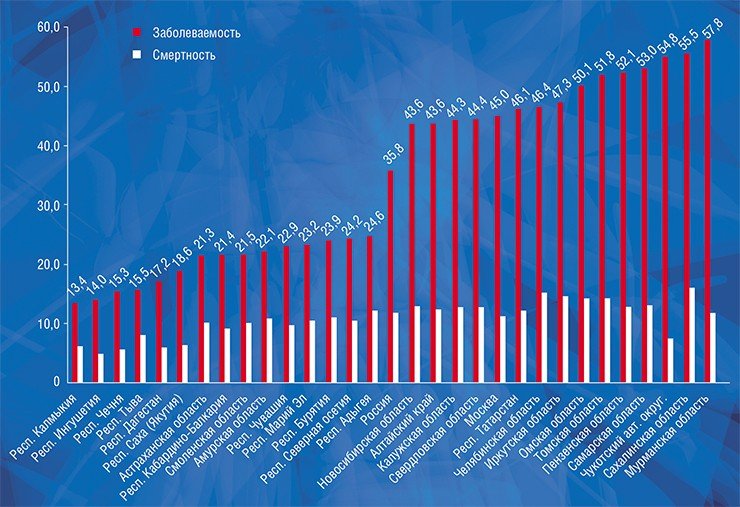
Показано, что в регионах, загрязненных радионуклидами в результате аварии на Чернобыльской АЭС, в рост заболеваемости раком щитовидной железы внес свой вклад скрининг УЗИ. До 40 % случаев рака щитовидной железы в этих регионах можно отнести к гипердиагностике (Ivanov et al., 2012)
К сожалению, у нас пока нет точных критериев, биомаркеров для определения прогноза, позволяющих отличить клинически незначимые образования от тех, которые прогрессируют. Необходимо проведение комплексных исследований, включая молекулярные, клинические, эпидемиологические. Крайне необходимо создание регистра пациентов с клинически незначимыми образованиями, с последующим длительным наблюдением за ними.
Такие исследования уже ведутся. Есть программа под названием Grand Challenge CRUK, которая финансируется британским онкологическим исследовательским фондом Cancer Research UK. Цель работы группы ученых из Великобритании, Нидерландов и США – выявить биологические маркеры прогрессии внутрипротокового рака молочной железы. Изучаются образцы тканей, взятые во время операции у женщин с этим диагнозом, собирается клиническая информация о пациентках, наблюдается развитие заболевания и дается его прогноз.
Пока нет четких критериев, нет ответа на вопрос, когда лечить необходимо, а когда нужно просто наблюдать. Но врачи должны знать об этой проблеме и одной из своих профессиональных задач ставить предотвращение практики чрезмерного агрессивного лечения, способного навредить пациенту.
Заридзе Д. Г., Пропп Р. М. О маленьком раке щитовидной железы // Архив патологии. 1973. Т. XXXV, № 12. С. 24—27
Breslow N., Chan C.W., Dhom G. et al. Latent carcinoma of prostate at autopsy in seven areas. The International Agency for Research on Cancer, Lyons, France // Int. J. Cancer. 1977. V. 15. N. 20. P. 680—688.
Ernster V. L., Ballard-Barbash R., Barlow W. E. et al. Detection of ductal carcinoma in situ in women undergoing screening mammography // J. Natl. Cancer. Inst. 2002. V. 16. P. 94. P. 1546—1554.
Ivanov V. K., Kashcheev V. V., Chekin S. Y. et al. Radiation-epidemiological studies of thyroid cancer incidence in Russia after the Chernobyl accident (estimation of radiation risks, 1991-2008 follow-up period) // Radiat Prot Dosimetry. 2012. V. 151. P. 489—499.
Kuhl C. K. Current status of breast MR imaging // Part. Clinical applications. Radiology. 2007. V. 244. N. 3. P. 672—691. Review.
Rosner D., Weiss L., Norman M. Ultrasonography in the diagnosis of breast disease // J. Surg. Oncol. 1980. V. 14. P. 83—96.
Stamatiou K., Alevizos A., Perimeni D. et al. Frequency of impalpable prostate adenocarcinoma and precancerous conditions in Greek male population: an autopsy study // Prostate Cancer Prostatic Dis. 2006. V. 9. P. 45—49.
Vaccarella S., Franceschi S., Bray F. et al. Worldwide Thyroid-Cancer Epidemic? The Increasing Impact of Overdiagnosis // N. Engl. J. Med. 2016. V. 18.N. 375. P. 614—617.
Welch H. G., Black W. C. Overdiagnosis in cancer // J. Natl. Cancer Inst. 2010. V. 102. N. 5. P. 605—613.
Читайте также:

