Диф диагностика различных видов новообразований костной ткани
Важно понимать, что в дифференциальной диагностике опухолей костей рентгенография является модальностью выбора. КТ и МРТ полезны только в отдельных случаях.
Ключевыми моментами при анализе изображений с потенциальной опухолью кости являются:
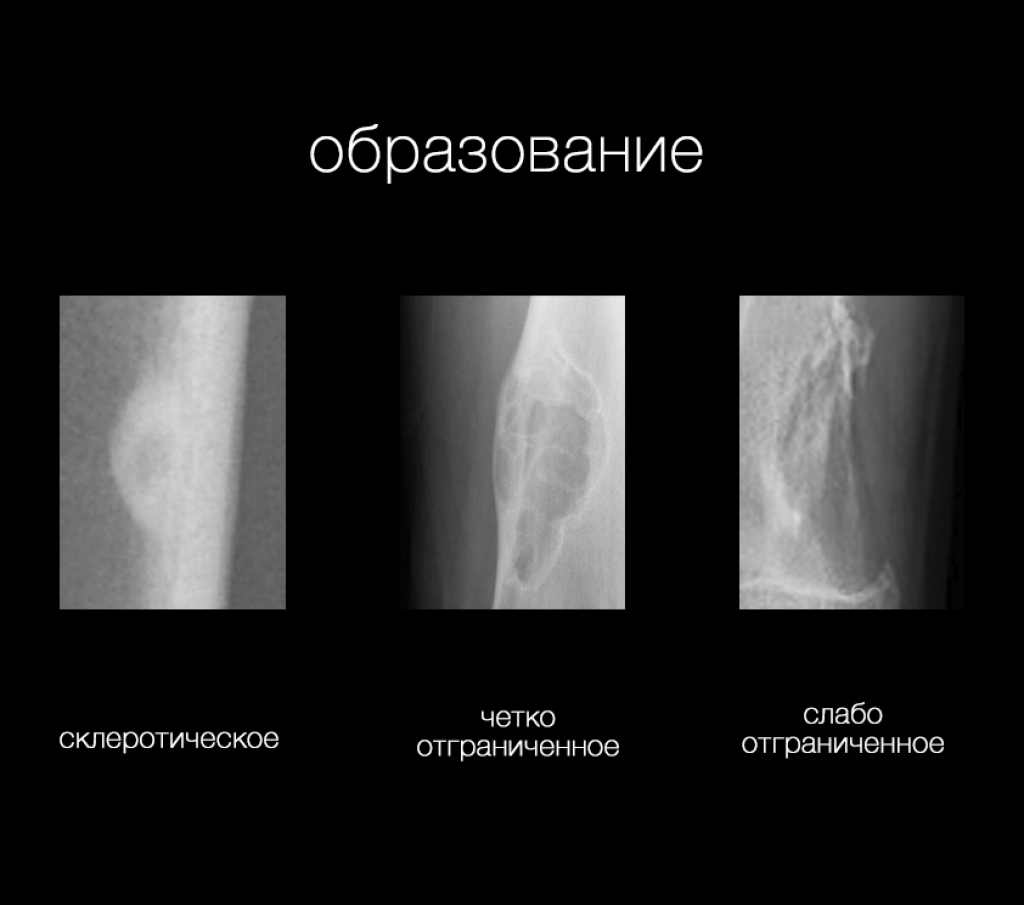
- морфология образования на рентгеновском снимке
- склеротическое образование
- остеолитическое образование
- четко отграниченное
- слабо отграниченное
- возраст пациента
Одним из надежных индикаторов в разграничении доброкачественных и злокачественных образований и определении характера морфологии для остеолитических образований является переходная зона между образованием и прилежащей неизмененной костной тканью.
После определения характера поражения (склеротический или остеолитический [четко или слабо отграниченный]), необходимо ответить на вопрос: каков возраст пациента? Поскольку возраст является следующим ключевым моментом.
Далее необходимо отметить локализацию, наличие периостальной реакции, деструкции кортикального слоя, наличия кальцификации матрикса образования, и т. д.
Для разграничения остеолитических образований на слабо и четко отграниченные необходимо оценивать зону перехода между образованием и неизмененной костной тканью. Зона перехода является надежным индикатором в разграничении доброкачественных и злокачественных образований. Зона перехода оценивается только для остеолитических образований так как к склеротических образований переходная зона как правило узкая.
Узкая зона перехода дает четкие и резкие границы, она указывает на медленный рост образования. Склеротические контуры характерны для низкой активности.
Для пациентов старше 30 лет, а особенно старше 40 лет, в зависимости от других рентгенологических признаков в первую очередь в дифференциальном диагнозе необходимо рассматривать метастатическое поражение или плазмацитому (множественную миелому), как наиболее частые опухоли для данной возрастной группы. Метастазы в кости у пациентов младше 40 лет без известной первичной опухоли встречаются крайне редко. Однако при известной первичной опухоли (например нейробластоме, рабдомиосаркоме или ретинобластоме) метастазы включаются в дифференциальный диагноз даже у молодых пациентов.
Нечеткие границы и широкая зона перехода указывают на агрессивный рост и являются характерной чертой злокачественных опухолей костей. Однако при дифференциальном диагнозе необходимо помнит о двух опухолеподобных образованиях с аналогичными морфологическими чертами: эозинофильной гранулеме и инфекционной деструкции.
В зависимости от возраста и локализации опухоли и опухолеподобные образования костей в соответствии с соглашением ESSR от 2017 года можно разделить следующим образом [2]:
- младше 20 лет
- диафиз
- эозинофильная гранулема
- саркома Юинга
- лимфома
- остеоид-остеома
- фиброзная дисплазия
- адамантинома
- метафиз
- простая костная киста
- неоссифицирующая фиброма
- хондромиксоидная фиброма
- остеосаркома
- остеохондрома
- энхондрома
- аневризмальная костная киста
- эпифиз
- хондробластома
- инфекционная деструкция
- диафиз
- от 20 до 40 лет
- диафиз
- эозинофильная гранулема
- саркома Юинга
- лимфома
- остеоид-остеома
- фиброзная дисплазия
- адамантинома
- метафиз
- неоссифицирующая фиброма
- остеомиелит
- энхондрома
- остеохондрома
- эпифиз
- остеосаркома
- гигантоклеточная опухоль
- диафиз
- старше 40 лет
- диафиз
- метастазы
- миелома
- фиброзная дисплазия
- метафиз
- метастазы
- миелома
- лимфома
- остеохондрома
- эпифиз
- хондросаркома
- болезнь Педжета
- субхондральные кисты
- диафиз
Опухоли локализующиеся центрально в длинных трубчатых костях: простая костная киста, эозинофильная гранулема, фиброзная дисплазия, аневризмальная костная киста, энхондрома.
Остеоид-остеомы локализуются в кортикальном слое и должны дифференцироваться с остеомиелитом.
При остеохондроме кортикальный слой должен распространяться на "ножку". Остеосаркома может возникать из периоста.
О периостальных реакциях читайте в отдельной публикации.
Кортикальная деструкция или деструкция кортикальной пластинки является довольно частой находкой и не позволяет достоверно дифференцироваться доброкачественные и злокачественные образования.
Полная деструкция может встречаться как при высокозлокачественных опухолях, так и при локально агрессивных процессах таких как эозинофильная гранулема и остеомиелит. Более однородная деструкция кортикальной пластинки может указывать на доброкачественность или низкую степень злокачественности. Изъеденность эндоста кортикального слоя встречается при фиброзной дисплазии и хондросаркоме низкой степени злокачественности.
Вздутие является одним из видов кортикальной деструкции. При вздутии разрушение кортикального эндоста и формирование костной ткани снаружи опухоли происходят с одинаковой скоростью и приводят к расширению. "Неокортекс" может быть гладким или неровным, локальная неровность встречается при более агрессивных образованиях (напр. гигантоклеточная опухоль).
В группе злокачественных мелкоклетночных опухолей, включающих саркому Юинга, костную лимфому и мелкоклеточную остеосаркому, кортикальный слой при рентгенографии может выглядеть практически не измененным, поскольку опухоль распространяется инвазивно через Гаверсовы каналы. Данные опухоли как правило характеризуются наличием крупного мягкотканного компонента без видимой деструкции кости.
Наличие кальцинатов или минерализации может быть важным ключевым моментом в дифференциальной диагностике. Выделяют два типа минерализации матрикса: хондроидный матрикс в хрящевых опухолях (например энхондрома или хондросаркома) и остеоидный матрикс в костеобразующих опухолях (напр остеоид остеома и остеосаркома).
Кальцификаты в хондроидном матриксе описывают как "кольца и арки", "попкорн" или локальную исчерченность.
Минерализация в опухолях может принимать трабекулярный или облаковидный паттерны при доброкачественных костеобразующих опухолях или аморфный паттерн при слабо отграниченных образованиях (напр. при остеосаркоме). Необходимо помнить, что склероз может быть реактивным (напр. при саркоме Юинга или лимфоме).
Henk Jan van der Woude and Robin Smithuis, Bone tumor - Systematic approach and Differential diagnosis, radiologyassistant.nl
Lalam et al. ESSR Consensus Document for Detection, Characterization, and Referral Pathway for Tumors and Tumor like Lesions of Bone DOI: 10.1055/s-0037-1606130
Целый ряд состояний может имитировать клиническую или рентгенологическую картину опухоли, а также осложнять интерпретацию гистопатологического исследования. Такие состояния легко вводят в заблуждение.
а) Мягкотканая гематома. Большая, свернувшаяся поднадкостничная или мягкотканная гематома может выглядеть как болезненная припухлость на руке или нижней конечности. Иногда при рентгенографии определяется нечеткая поверхность подлежащей кости. Ключевые моменты — анамнез и резкое начало симптомов.
в) Усталостный перелом. При ошибочной диагностике усталостных переломов был допущен ряд фатальных ошибок. Пациент, как правило, молодой человек, боль локализована рядом с крупным суставом. На рентгенограмме видны неясные участки кортикальной деструкции и вышележащее периостальное костное новообразование.
Если выполнена биопсия, в костной мозоли могут быть выявлены гистологические особенности, сходные с остеосаркомой. Своевременное выявление ошибки и взаимодействие хирурга, рентгенолога и патогистолога позволит предотвратить серьезные последствия.
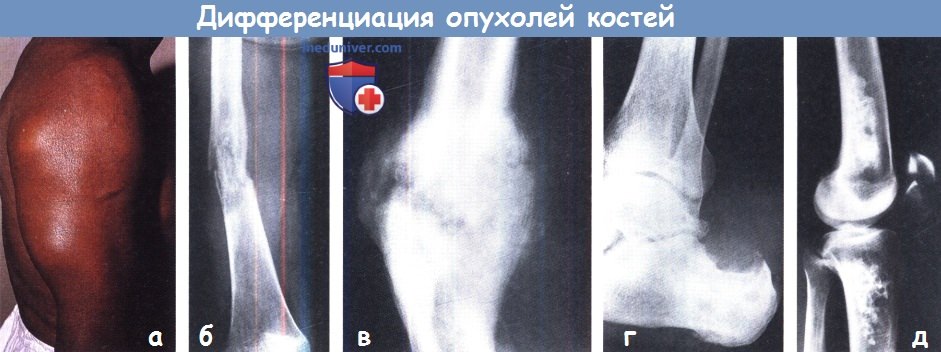
Опухоли — дифференциальный диагноз:
(а) Огромная припухлость оказалась свернувшейся гематомой.
(б) Инфекция кости с патологическим переломом.
(в) Разросшаяся костная мозоль при несросшемся переломе,
(г) Огромная эрозия пяточной кости подагрическим тофусом.
(д) Инфаркты кости.
г) Травматические отрывы сухожилий. Дети и подростки, особенно занимающиеся активными видами спорта, подвержены травматическому отрыву на участках прикрепления сухожилий вокруг тазобедренного и коленного суставов (Donnelly et al.).
Наиболее известный пример — это некроз бугристости большеберцовой кости при болезни Осгуда-Шлаттера, но повреждения в других, не типичных локализациях (гребнь подвздошной кости, бугристость седалищной кости, малый вертел бедра, точки прикрепления сухожилия подколенной мышцы, точек прикрепления большой и длинной приводящих мышц бедра и дистальный апофиз плечевой кости) не всегда учитываются и могут привести к ошибке.
д) Инфекционные поражения костей. Остеомиелит обычно вызывает боль и отек рядом с одним из крупных суставов. Как и при первичных опухолях костей, пациенты обычно — дети и молодые люди. На рентгенограмме могут определяться очаги деструкции в метафизе с периостальной реакцией. Системные проявления, особенно если пациент лечился антибиотиками, могут быть сглажены.
Если очаг обнаружен, биоптат из него должна быть направлена на гистологическое и бактериологическое исследования.
е) Подагра. Иногда большие подагрические отложения вызывают болезненные отеки у одного из концов кости, а на рентгенограмме определяется большая нечетко отграниченная полость. Если иметь в виду данное заболевание при диагностике, диагноз может быть легко подтвержден, а при необходимости выполнена прицельная биопсия.
ж) Другие поражения костей. Неопухолевые поражения костей, такие как фиброзные кортикальные дефекты, инфаркты костного мозга и костные секвестры иногда ошибочно принимаются за опухоли.
Аннотация научной статьи по клинической медицине, автор научной работы — Каплунов С.В.
В статье представлены клинико-рентгенологические особенности костных злокачественных опухолей и их дифференциальная диагностика с доброкачественными опухолями и неопухолевыми заболеваниями костей в детском возрасте.
Похожие темы научных работ по клинической медицине , автор научной работы — Каплунов С.В.
CLINICAL AND RADIOLOGICAL SPECIFICS OF DIFFERENTIAL DIAGNOSTICS OF OSSEOUS NEOPLASMATA IN CHILDREN
The article presents the clinical and radiological features of malignant bone tumors and their differential diagnosis with benign tumors and inflammatory diseases of the bones in childhood.
Волгоградский областной клинический онкологический диспансер № 1
КЛИНИКО-РЕНТГЕНОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ КОСТНЫХ НОВООБРАЗОВАНИЙ В ДЕТСКОМ ВОЗРАСТЕ
В статье представлены клинико-рентгенологические особенности костных злокачественных опухолей и их дифференциальная диагностика с доброкачественными опухолями и неопухолевыми заболеваниями костей в детском возрасте.
Ключевые слова: саркомы костей у детей, дифференциальная диагностика.
CLINICAL AND RADIOLOGICAL SPECIFICS OF DIFFERENTIAL DIAGNOSTICS OF OSSEOUS NEOPLASMATA IN CHILDREN
The article presents the clinical and radiological features of malignant bone tumors and their differential diagnosis with benign tumors and inflammatory diseases of the bones in childhood.
Key words: bone sarcomas in children, differential diagnosis.
Дифференциальная диагностика образований костей в детском возрасте является одной из актуальных тем детской онкологии, детской хирургии и ортопедии. Важнейшим для клинициста является определение характера образования—доброкачественное или злокачественное. Залогом успешной терапии костных сарком является раннее распознавание злокачественного процесса. Ошибки в диагностике костных новообразований достигают 60 % [1, 2]. Почти 70 % больным до обращения к онкологу выставлялись диагнозы не онкологического характера [3]. В связи с неправильной трактовкой, прежде всего, Ro-данных пациенты длительное время наблюдаются и получают неадекватное неправильное лечение, включая назначение абсолютно противопоказанной при онкопатологии физиотерапии, провоцирующей активизацию опухолевого процесса. Сложность дифференциальной диагностики доброкачественных и злокачественных опухолей костей у детей обусловлено большим разнообразием как самой костной онкопатологии, так и множеством опу-холеподобных заболеваний костей у детей. Особенно актуально дифференциальное разграничение костных поражений у детей на этапе первичной диагностики, когда рентгенолог, педиатр, детский хирург, ортопед-травматолог, столкнувшись с подозрительным на злокачественное новообразование кости, должны незамедлительно направить такого ребенка на дообследование у специалиста детского онколога или онкоортопеда. По утверждению некоторых авторов, внедрение новых методов лучевой диагностики с высокой разрешающей способностью [компьютерная (КТ) и магниторезонансная томография
(МРТ)] не привело к значительному улучшению первичной диагностики костных новообразований, но существенно повлияло на точность установления распространенности процесса [2]. Поэтому стандартная рентгенография продолжает оставаться наиболее доступным методом и играет ведущую роль в распознавании опухолей скелета.
Обобщение результатов рентгенологического обследования детей онкологического отделения, для акцентирования внимания на основных рентгенологических симптомах, позволяющих осуществить первичную и дифференциальную диагностику костных новообразований.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Наиболее частые рентгенологические проявления костных сарком, которые должны настораживать специалистов первичного звена в плане злокачественности костного образования:
ния за пределы кортикального слоя кости. В наших наблюдениях данный симптом помимо костных сарком (остеогенная саркома и саркома Юинга) отмечен в двух случая туберкулезных (БЦЖ) оститов, где прорыв туберкулезных масс за пределы кости сочетался с формированием козырька Кодмана (рис. 1, 2).
В дифференциальной диагностике туберкулез-ных/БЦЖ оститов и костных сарком можно отметить несколько критериев. Возраст: дети с БЦЖ-остита-ми были 1—2 лет жизни, а дети с саркомами костей были в возрасте от 6 до 16 лет. Распространение очага: для туберкулезных оститов характерно распространение очага из метафиза тонким ходом через ростковую пластинку в эпифиз с формированием остеолитических очагов в виде «песочных ча-
Рис. 1. Девочка, 2 года. Туберкулезный остит нижней трети бедренной кости — боковая проекция В дистальном метафизе бедренной кости имеется большой очаг литического характера с разрушением кортикального слоя по задней поверхности (выход патологического процесса за пределы кости), козырек Кодмана (отмечен стрелкой)
Рис. 2. Девочка, 2 года. Туберкулезный остит нижней трети бедренной кости — прямая проекция. В дистальном метафизе бедренной кости литический очаг с четкими контурами и формированием козырька Кодмана (отмечен стрелкой)
Рис. 3. Мальчик, 1,5 года.
Туберкулезный остит верхней трети большеберцовой кости.
Длительностьзаболевания 6 мес. Эпиметафизарный очаг в виде песочных часов (1).
Слоистая периостальная реакция (2)
Что касается остеогенной саркомы, то ростковый хрящ для нее является препятствием и на эпифиз остеогенная саркома не переходит. Однако при остеосаркоме могут появляться мелкие остеобластические очаги отсева опухоли в пределах той же кости (выше или ниже основного очага остеосаркомы), в том числе и в ее эпифи-зарном отделе — skip-метастазы — прыгающие и трансартикулярные метастазы (рис. 4). Саркома Юинга крайне редко может располагаться в эпифизарном отделе костей. Характер очага деструкции — четкие контуры и литический характер свойственен костным туберкулезным очагам. Для костных сарком характерны нечеткие границы очагов деструкции с различным сочетанием и выраженностью остеобластических и остеолитических процессов (рис. 5) как в самой пораженной кости, так и в прилежащих мягких тканях, куда распространяется саркома.
Рис. 5. Пациент, 17 лет. Остеогенная саркома верхней трети большеберцовой кости.
Очаг деструкции содержит участки остеосклероза и остеоразрежения, периостальный козырек Codman (отмечен стрелкой)
холь еще не сформировала заметный внекостный мягкотканный компонент. Еще труднее эта задача становится, если клиника саркомы Юинга напоминает клинику остеомиелита, процесс локализуется в плоских костях, а в анализах периферической крови отмечается лейкоцитоз и ускорение скорости оседания эритроцитов (СОЭ). Классическая клиническая картина, описанная Ewing, — интермиттирующее (волнообразное, циклическое) течение, когда эпизоды появления (или усиления) болей, повышения температуры тела и появления (увеличения)припухлости чередуются с исчезновением (уменьшением) данных симптомов, — встречается нечасто (рис. 6, 7).
Рис. 6. Девочка, 14 лет. Саркома Юинга лопатки, и нтерм итти рующее течен ие. Слоистый и игольчатый периостит
Рис. 7. Мальчик, 8 лет. Саркома Юинга средней трети малоберцовой кости. Козырьки Кодмана (1) и бахромчато-игольчатый тип периостальной реакции (2)
Но если первый эпизод такой клинической картины расценивается врачом как остеомиелит, а исчезно-
вение симптомов связывают с назначением антибиотиков — это еще более усугубляет диагностическую ошибку. Если в динамике (на фоне антибиотикотера-пии) на Ro-снимке в подобных случаях продолжает сохраняться (или нарастать) мелкоочаговая деструкция и слоистый периостит и не появляется склерозирование костной структуры в зоне деструкции, то эта ситуация требует обязательной биопсии (рис. 8).
Рис. 8. Девочка, 14 лет. Хронический гематогенный остеомиелит средней и нижней трети бедренной кости. Линейная периостальная реакция (1) и множественная мелкоочаговая деструкция в метафизе (2)
3. Разрыв (деструкция) кортикального слоя кости. Помимо костных сарком данный симптом наблюдался нами прежде всего при гигантоклеточных опухолях (ГКО), но в отличие от сарком при ГКО отмечаются более четкие и ровные (зачастую полициклические) контуры очага литической деструкции, а разрыв кортикального слоя отмечается на ограниченном участке (рис. 9). Гигантоклеточная опухоль кости (остеобластокластома)— самый яркий пример в костной онкологии, свидетельствующий об относительности морфологического деления всех опухолей на доброкачественные и злокачественные [3]. Это опухоли с так называемой пограничной злокачественностью. ГКО способны к рецидивирова-нию и (в очень редких случаях) к метастазированию.
Рис. 9. Девочка, 13 лет. Гигантоклеточная опухоль нижней трети бедренной кости. Очаг деструкции литического характера с полициклическим четким контуром и разрушением кортикального слоя по задней поверхности с выходом опухолевых масс в мягкие ткани (отмечено стрелкой)
4. Внекостный компонент новообразования в мягких тканях. Для злокачественных опухолей костей характерен так называемый мягкотканный компонент —часть костной саркомы, распространяющаяся на прилежащие к кости мягкие ткани (рис. 10).
Рис. 10. Девочка, 14 лет. Остеогенная саркома
верхней трети малоберцовой кости — мелкоочаговая деструкция и формирование остеоидных опухолевых масс в мягких тканях (отмечено стрелкой)
режиме Ro-исследования) мягкотканный компонент отмечался при саркоме Юинга (рис. 11), гемангиоме кости, ГКО, гистиоцитозе (рис. 12), аневризмальной костной кисте и туберкулезном поражении кости.
компонента на КТ-снимке (рис. 14) не позволяло с уверенностью исключить саркому Юинга без морфологических данных. Окончательный диагноз был поставлен после экзартикуляции ребра и проведения гистологического исследования.
Рис. 11. Мальчик, 6 лет. Саркома Юинга нижней трети бедренной кости. Линейная слоистая периостальная реакция (1), огромный мягкотканный компонент опухоли (2) и выраженная деструкция дистального метафиза бедренной кости по передней поверхности (3)
Рис. 12. Мальчик 11 мес. Гистиоцитоз из клеток Лангерганса (локальная форма) — поражение тела грудины
В одном случае гемангиома ребра (рис. 13) имела весьма характерную рентгенологическую картину — вздутие кости с ячеисто-трабекулярной (лучистой структурой), но наличие мягкотканного
Рис. 13. Девочка, 14 лет. Гемангиома 7-го ребра справа. ^-исследование. Ячеисто-трабекулярная (лучистая) структура очага деструкции
Рис. 14. Девочка, 14 лет. Гемангиома 7-го ребра справа.
КТ-исследование. Вздутие заднего отрезка ребра и наличие мягкотканного компонента (отмечен стрелкой)
Рис. 15. Девочка, 16 лет.
Аневризмальная костная киста верхней трети бедренной кости. ^-исследование.
Рис. 16. Девочка, 16 лет. Аневризмальная костная киста верхней трети бедренной кости.
КТ- исследование с ангиографией. Развитая сосудистая сеть новообразования — от четырех ветвей глубокой артерии бедра
Дифференциальная диагностика поражений костей в детском возрасте сложна и неоднозначна. Несмотря на огромное количество специальной литературы, до сих пор возникают затруднения при диагностике нозологических форм, в связи с чем дети поступают на лечение в поздних стадиях заболевания. Связано это с отсутствием патогномоничных клинических и рентгенологических проявлений на ранних стадиях развития опухоли, разнообразием клинических, рентгенологических и морфологических проявлений, существованием атипичных форм. Классические проявления заболевания—боль, припухлость, нарушение функции органа — свойственны не только опухолевому процессу, но и многим заболеваниям опорно-двигательного аппарата неопухолевой этиологии. Только с учетом клинических, рентгенологических и морфологических данных, то есть после проведения комплексного обследования пациента с костной патологией, можно с уверенностью говорить о характере патологического процесса. Данное обследование возможно только в условиях специализированного стационара.
Хочется напомнить, что Ro-исследование должно стоять первым в ряду методов обследования пациента с костным новообразованием.
1. Алиев Д. А, Алиев А. Ю. // Хирургия. — 1987. — № 10. — С. 117—119.
2. Веснин А. Г., Семенов И. И. Атлас лучевой диагностики опухолей опорно-двигательного аппарата: Часть 1: Опухоли скелета. — СПб.: Невский Диалект, 2002. — С. 6.
3. Волков М. В. Болезни костей у детей. — М.: Медицина, 1985. — С. 283.
4. Дурнов Л. А. Руководство по детской онкологии. — М.: Миклош, 2003. — С. 405.
М. К. МИХАИЛОВ, Г. И. ВОЛОДИНА, Е. К. ЛАРЮКОВА
Учебное пособие подготовлено кафедрами рентгенологии (зав. кафедрой — проф. М. К. Михайлов) и рентгенологии-радиологии (зав кафедрой — проф. Г. И. Володина) Казанского государственного института усовершенствования врачей.
Опухоли костей.
По клиническому течению, первичные опухоли костей делятся на доброкачественные и злокачественные. Эти свойства не отделимы от биологических свойств опухоли, и определяются в основном степенью ее зрелости.
Диагностика опухолей костей основывается на клинико-рентгенологических данных, и представляет подчас, определенные трудности. Задача рентгенолога состоит в том, чтобы в каждом случае опухоли кости определить морфологическую характеристику новообразования. Однако не всегда возможно верифицировать заключение только на основании клинико-рентгенологических данных. В подобных случаях приходится прибегать к пункционной биопсии опухоли и последующему морфологическому исследованию.
Немаловажное значение для правильной диагностики опухолей костей играет знание их классификаций. Общеизвестные классификации опухолей костей (Юинг, 1939; Lichtenstein, 1951—1965; И. Г. Лагунова, 1957; Coley, 1960; М. В. Волков, 1968; Т. П. Виноградова, 1973) не свободны от недостатков.
Нам представляется целесообразной классификация, в которой находят отражение все основные формы опухолей, номенклатура которых основана на гистогенетических и гистологических признаках. В этом отношении классификация первичных опухолей костей, предложенная Т. П. Виноградовой, облегчает дифференциальную диагностику новообразований.
При изложении лекционного курса и в своей практической работе, мы преимущественно пользуемся данной классификацией, изменив несколько порядок расположения групп опухолей и не вносим в классификацию доброкачественных опухолей костей костно-хрящевые экзостозы, хондроматоз костей и пограничные с опухолями процессы.
Злокачественая опухоль Юинга отнесена к неостеогенным опухолям из ретикуло-эндотелиальной ткани.
Вполне оправдано существование параллельных классификаций, включающих, основные формы опухолей, наиболее часто встречающихся в практике.
Доброкачественные опухоли костей.
№
Название опухоли
Построена
Остеобластокластома
Остеоидная остеома
Остеома
Из собственно костной ткани.
Хондрома
Хондробластома
Хондромиксоидная фиброма
Из хрящевой ткани
Остеохондрома
Из костной и хрящевой ткани
Миксома, липома, фиброма
Из разновидностей соединительной ткани
Хордома
Из хордальной ткани
Ангиома
Из сосудистой ткани
Эозинофильная гранулема
Из ретикулярной ткани, эозинофилов
Доброкачественные опухоли из собственно костной ткани.
Наибольшие затруднения бывают в рентгенологической дифференциальной диагностике остеобластокластом с остеогенной саркомой, костной кистой и аиевризматической кистой.
Важны в дифференциальной диагностике такие клинико-рентгенологические показатели, как возраст больного, анамнез заболевания, локализация очага поражения.
Остеобластокластома (литическая фаза)
Остеогенная остеокластическая саркома
Костная киста
Возраст
Локализация
Форма кости
Выраженное асимметричное вздутие
Незначительное расширение в поперечнике
Контуры очага деструкции
Состояние костно-мозгового канала
Закрыт замыкательной пластинкой
На границе с опухолью открыт
Кортикальный слой
Истончен, волнистый, прерывается
Склероз
Периостальная реакция
Выражена, преимущественно по типу „периостального козырька"
Состояние эпифиза
Эпифизарная пластинка истончена, волниста
В начальных стадиях участок эпифиза остается интактным
Соседний диафизарный отдел кости
Остобластокластома
Фиброзная дисплазия
Возраст
Преимущественно 20— 30 лет
Детский и юношеский
Локализация
Распространенность процесса
Солитарное и полиоссальное
Деформация
Искривление, укорочение, незначительное расширение
Характер деструкции
Однородная, с костными перемычками
Симптом „матового стекла"
Кортикальный слой
Бугристый, волнистый, может прерываться
Наружный контур ровный; внутренний — волнистый, не прерывается
Склероз
Участки склероза в зоне костномозгового канала, в кортикальном слое
При оссифицирующем миозите отмечается болезненность, отсутствие связи образования с собственно костью, неправильная пятнистая, волокнистая структура оссифицированной мышцы.
Поднадкостничная гематома представляет тень веретенообразной формы, длинник которой сливается с длинной осью кости. Кроме того, она отличается от остеомы отсутствием структурного рисунка кости.
У детей за остеому ошибочно принимают поднадкостничный венозный синус черепа — sinus pericranium, что является вариантом развития.
Прогноз при остеоме благоприятный. Остеома не озлокачествляется, но требует радикального оперативного лечения во избежание возможных рецидивов опухоли.
Опухоли опорно-двигательной системы, в частности новообразования костей, один из важных и трудных в диагностическом и лечебном плане разделов клинической онкологии. Чаще всего опухоли костей поражают детей и лиц молодого возраста, то есть самый социально значимый контингент населения.
Внедрение новых технологий в медицине позволяет выполнять радикальные органосохраняющие и функционально-щадящие хирургические вмешательства с удалением больших объемов измененных тканей в случае их малигнизация и последующим эндопротезированием, пластикой дефектов тканей и их замещением имплантатами. Успехи активно развивающейся реконструктивно-пластической хирургии стимулируют интерес к точности оценки доброкачественности/злокачественности опухоли на дооперационном этапе.
Диагностика опухолей и опухолеподобных заболеваний костного скелета имеет свои особенности. Следует подчеркнуть, что эти особенности принципиально отличаются от методов диагностики опухолей других локализаций.
В современной онкологии для дифференциальной диагностики опухолей костей применяется широкий спектр лучевых методов исследования. [Епифанова С.В. Роль магнитно-резонансной и компьютерной томографии в предоперационной оценке распространенности опухолей опорно-двигательной системы: автореф. дис. … канд. мед. наук. - М., 2013]. Каждый из диагностических лучевых методов выполняет свою роль в алгоритме обследования, обладая различной степенью информативности, обусловленной преимуществами и недостатками объективного и субъективного характера, и в большинстве случаев констатирует наличие, локализацию, объемы патологии и с низкой точностью ее тип - доброкачественная или злокачественная.
В настоящее время основным способом диагностики типа опухоли на дооперационном этапе остается биопсия новообразования с последующим гистоморфологическим исследованием, при осуществлении которого забранный материал фиксируют в течение суток в 10%-ом нейтральном формалине, затем для обезжиривания проводят через ряд спиртов и хлороформов и заливают в парафин. Из полученных парафиновых блоков изготавливают срезы толщиной 5-7 мк, окрашивают их гематоксилином и эозином по методу Ван-Гизона, Ниссля, Шпильмеера. Окрашенные стекла анализирует опытный патологоанатом.
В свою очередь, биопсия имеет ряд недостатков: во-первых, она является операцией, что достаточно травматично для пациента; во-вторых, обработка одного образца материала проводится в течение 7-10 рабочих дней.
В связи с вышесказанным, на сегодняшний день существует потребность в разработке малоинвазивных способов дифференциальной диагностики новообразований костной ткани. Авторы всех нижеперечисленных способов диагностики новообразований костной системы, основанных на оценке лабораторных параметров, не заявляли их как диагностические методики, проводимые на дооперационном этапе, но по специфике их выполнения, по нашему мнению, могут быть применимы и в этом качестве. В связи с этим и отсутствием в литературе описания способов проведения дооперационной дифференциальной диагностики новообразований костной системы малоинвазивными методами считаем близкими аналогами к заявляемому изобретению указанные ниже методики.
Одним из возможных подходов к дифференциальной диагностике костных опухолевых новообразований могли бы стать серологические маркеры. По данным анализа отечественных и зарубежных литературных источников на роль специфичных маркеров костной резорбции и остеообразования претендуют одна из изоформ тартратрезистентной кислой фосфатазы (TRAP-5b) и костная фракция щелочной фосфатазы (КФЩФ). Показано, что TRAP-5b в процессе резорбции кости секретируется остеокластами в кровь, отражает их активность в реальном времени и, как следствие, скорость разрушения костной ткани. КФЩФ является специфичным маркером остеобластов, за счет которых происходит синтез новой костной ткани [Державин В.А. Диагностический алгоритм использования серологических маркеров остеосинтеза и остеолизиса у больных первичными местнораспространенными и диссеменированными опухолями костей. Автореф. дис. … канд. мед. наук. - М., 2010].
Однако определение сывороточной концентрации маркеров метаболизма костной ткани, таких как тартратрезистентная кислая фосфатаза и костная фракция щелочной фосфатазы, имеет ограниченное значение вследствие своей низкой специфичности у больных с первичными местнораспространенными и диссеминированными опухолями костей вследствие возможности продукции данных маркеров в растущей кости, а также при наличии переломов костей и замедленной их консолидации.
Известно также, что в механизмах роста, апоптоза, пролиферативной активности и ангиогенеза при опухолях костей участвует ряд цитокинов - низкомолекулярных пептидов, секретируемых клетками воспаления, иммунного ответа и самой опухоли. Клетки злокачественных опухолей и их микроокружение могут сами секретировать некоторые цитокины, в том числе IL-6, и экспрессировать соответствующие рецепторы. При этом чрезмерная продукция IL-6 может благоприятствовать росту опухоли и усилению ее васкуляризации, что способствует распространению регионарных и отдаленных метастазов. В связи с этим имеются сведения о том, что в сыворотке крови больных с опухолями костей, в частности остеосаркомой и хондросаркомой, наблюдается повышение уровня IL-6, причем секреция последнего возрастает при диссеминации опухолевого процесса [Тарасова Т.А. Интерлейкин-6 и его рецептор в сыворотке крови больных опухолями и опухолеподобными поражениями костей. Автореф. дис. … канд. мед. наук. - М., 2010].
Однако изолированное определение концентрации IL-6 не позволяет достоверно осуществлять дифференциальную диагностику доброкачественных и злокачественных опухолей, а также степени прогрессии злокачественных опухолей ввиду влияния различных неспецифических факторов на содержание данного интерлейкина в сыворотке крови. Согласно литературным данным повышение концентрации IL-6 может быть связано с неспецифическими и специфическими локальными и генерализованными инфекционно-воспалительными процессами, аутоиммунными заболеваниями, травматической болезнью, аллергическими реакциями.
Известно также, что у больных со злокачественными опухолями костей наблюдается значительное повышение уровня фактора некроза опухоли TNF-α, определенного методом иммуноферментного анализа в периферической крови, чем у группы контроля (значения показателя в норме) [Xiao Т. et al. Determination and significance of patients with malignant bone tumors. Hunan Yi Ke Da Xue Bao. 1998. 23(6): 596-598].
Однако исследования были проведены на клетках крови (моноцитах) больных опухолями, которые были индуцированы липополисахаридом, что позволяет считать полученные доказательства участия TNF-α в патогенезе опухолей костей косвенными. Это связано с тем, что в условиях отсутствия опухолевого процесса липополисахарид сам по себе может стимулировать выброс TNF-α.
Однако в данном способе учитывается только один компонент, который отражает лишь частично взгляд на взаимодействие между отдельными цитокинами и иммунокомпетентными клетками, что приводит к понижению объективности и чувствительности способа диагностики.
Однако предлагаемый способ не учитывает степень повреждения внеклеточного матрикса костной ткани, обусловленного локальной прогрессией злокачественной опухоли.
Задачей заявляемого изобретения является повышение специфичности и информативности диагностики новообразований костной ткани с возможностью определения характера опухоли малоинвазивным методом на дооперационном этапе для оптимизации тактики ведения пациента с обеспечением внесения корректировок в технологию проведения хирургического вмешательства и распределения его в специализированное лечебное учреждением с учетом уровня сложности выполнения планируемых манипуляций.
Сущность заявляемого изобретения заключается в том, что в способе дооперационной дифференциальной диагностики новообразований костной ткани, включающем взятие венозной крови, подготовку образцов проб сыворотки крови, исследование полученных образцов методом иммуноферментного анализа ИФА на планшетах с определением количественного значения уровня неоптерина NP, фактора некроза опухоли TNF-α, интерлейкина-6 IL-6, при исследовании образцов сыворотки крови дополнительно определяют количественные значения уровней фактора роста эндотелия сосудов VEGF, матриксных металлопротеиназ ММР-2 и ММР-9, тканевого ингибитора матриксной металлопротеиназы-1 TIMP-1, анализируют полученные данные, рассчитывают с их учетом коэффициент К по формуле:
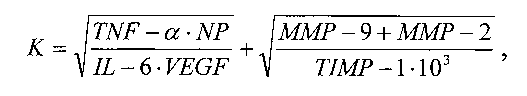
и при значении К≤15,8 диагностируют доброкачественный процесс, при значении К>15,8 - злокачественный процесс.
Технический результат заявляемого изобретения заключается в решении поставленной ранее задачи.
Использование при дооперационной диагностике комплекса иммунологических маркеров, регулирующих клеточную пролиферацию - NP, TNF-α, IL-6 и неоваскулогенез - VEGF в норме и в процессе канцерогенеза путем совместного влияния на митотическую активность и состояния сосудистого эндотелия, позволяет повысить специфичность и чувствительность заявляемого способа оценки характера новообразований. Данные процессы являются основополагающими при клеточном росте, однако они являются неспецифическими, в связи с чем определение состояния внеклеточного матрикса посредством исследования уровней матриксных металлопротеиназ и их тканевых ингибиторов позволяет сделать предлагаемую методику еще более специфичной и чувствительной в процессе дифференциальной диагностики новообразований костной ткани. Кроме того, исследование состояния маркеров межклеточного матрикса в этом случае свидетельствует не только о наличии злокачественного образования, но и о его прогрессии в пределах той или иной кости, что повышает информативность заявляемой методики.
Данный способ малоинвазивен. Для его выполнения необходимо взятие биоматериала в виде венозной крови, забор которой обязателен в амбулаторно-поликлинических условиях, а значит, не требуется осуществления дополнительных манипуляций, в частности проколов мягких тканей.
Возможность определения характера новообразования костной ткани на дооперационном этапе в амбулаторно-поликлинических условиях способствует оптимизации процесса распределения пациентов по лечебным учреждениям для последующего проведения хирургического вмешательства с учетом степени сложности проводимой манипуляции. Это позволит снять нагрузку со специализированных диспансеров онкологического профиля, тем самым, повысив качество проводимого лечения сложных случаев. Данный технический результат позволяет также внести корректировки в методику проведения хирургического вмешательства, в частности в объемы резекции костной ткани, повысив эффективность проводимого лечения.
Способ дооперационной дифференциальной диагностики новообразований костной ткани осуществляют следующим образом. Критериями отбора пациентов для осуществления данного способа являются рекомендации по выполнению радикального хирургического лечения по удалению новообразований костной ткани, выявленных при осуществлении лучевых исследований - рентгенографии, магнитно-резонансной и компьютерной томографии. Под новообразованиями костной ткани понимают опухолевые или опухолевидные образования костей различной локализации (первичных, вторичных), либо образования, сопровождающие вторичные изменения костной ткани - зоны деструкции, патологические переломы и др.
В амбулаторно-поликлинических условиях пациентам с подозрением на наличие вышеуказанных новообразований костной ткани осуществляют клиническое обследование с помощью стандартных методов, т.е. с оценкой жалоб и соматического статуса, детальным сбором анамнеза с выявлением факторов, влияющих на иммунный статус, проведением лучевых исследований, в большинстве случаев, обзорной рентгенографии исследуемой части скелета не менее чем в двух взаимоперпендикулярных проекциях, а при необходимости результаты рентгенологического исследования дополняют прицельными снимками и томограммами.
После клинического обследования у больных с подтвержденным наличием новообразований костной ткани производят взятие образца венозной крови в пробирку объемом 5 мл. С помощью центрифугирования готовят образцы проб сыворотки крови. Исследуют полученные образцы сыворотки крови методом твердофазного иммуноферментного анализа ИФА на планшетах. При этом определяют в сыворотке крови количественные значения уровней неоптерина NP, фактора некроза опухоли TNF-α, интерлейкина-6 IL-6, фактора роста эндотелия сосудов VEGF, матриксных металлопротеиназ ММР-2 и ММР-9, тканевого ингибитора матриксной металлопротеиназы-1 TIMP-1. Для этого измеряют с помощью планшетного спектрофотометра оптическую плотность раствора в лунках при длине волны 450 нм и рассчитывают количественные значения уровней вышеперечисленных параметров. Анализируют полученные данные и рассчитывают с их учетом коэффициент К по формуле:
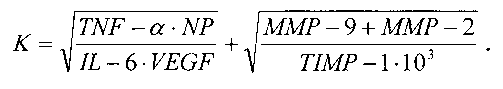
При значении К≤15,8 диагностируют доброкачественный процесс, при значении К>15,8 - злокачественный процесс.
По полученным результатам пациента направляют на хирургическое лечение в специализированное лечебное учреждение с учетом уровня сложности планируемой манипуляции и рекомендациями хирургу по выбору тактики ведения операций, в частности при злокачественном процессе - пересмотр объема резецируемой костной ткани.
Пациент П., 28 лет, обратился в поликлиническое отделение СарНИИТО с жалобами на боль при ходьбе и припухлость на уровне средней трети голени. Указанные жалобы отмечает в течение последних нескольких месяцев. После проведенного клинико-лучевого обследования выявлено наличие опухолевидного образования диафиза большеберцовой кости. С целью дооперационной дифференциальной диагностики, направленной на определение характера обнаруженного новообразования, на основании комплекса предлагаемых лабораторных параметров был рассчитан коэффициент К, значение которого составило 12,4. Полученное значение свидетельствовало о доброкачественности имеющегося у пациента новообразования. Пациент был направлен на дальнейшее хирургическое лечение в отделение ортопедии СарНИИТО, где было выполнено радикальное удаление опухолевидного новообразования большеберцовой кости в пределах здоровых тканей с замещением костного дефекта остеопластическим материалом. По результатам гистоморфологического исследования операционного материала была диагностирована остеобластокластома без признаков малигнизации.
Пациент Г., 37 лет, обратился в поликлиническое отделение СарНИИТО с жалобами на болезненность при осевой нагрузки в верхней трети правого бедра, усиливающуюся при его отведении, наличие припухлости и незначительной деформации в этой зоне. Указанные жалобы отмечает в течение последних нескольких месяцев. После проведенного клинико-лучевого обследования выявлено наличие опухолевидного образования в верхней трети правой бедренной кости. С целью дооперационной дифференциальной диагностики, направленной на определение характера обнаруженного новообразования, на основании комплекса предлагаемых лабораторных параметров был рассчитан коэффициент К, значение которого составило 17,2. Полученное значение свидетельствовало о злокачественности имеющегося у пациента новообразования. Пациент был направлен на дальнейшее хирургическое лечение в специализированный стационар онкологического профиля, где было выполнено радикальное удаление опухолевидного новообразования бедренной кости с замещением костного дефекта остеопластическим материалом. По результатам гистоморфологического исследования операционного материала была диагностирована остеосаркома.
Способ дооперационной дифференциальной диагностики новообразований костной ткани, включающий взятие венозной крови, подготовку образцов проб сыворотки крови, исследование полученных образцов методом иммуноферментного анализа ИФА на планшетах с определением количественного значения уровня неоптерина NP, фактора некроза опухоли TNF-α, интерлейкина-6 IL-6, отличающийся тем, что при исследовании образцов сыворотки крови дополнительно определяют количественные значения уровней фактора роста эндотелия сосудов VEGF, матриксных металлопротеиназ MMP-2 и MMP-9, тканевого ингибитора матриксной металлопротеиназы-1 TIMP-1, анализируют полученные данные, рассчитывают с их учетом коэффициент K по формуле: и при значении K≤15,8 диагностируют доброкачественный процесс, при значении K>15,8 - злокачественный процесс. 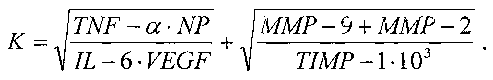
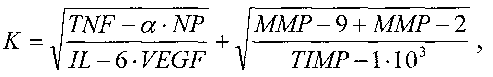
Читайте также:

