Цитологическая диагностика опухолей и предопухолевых процессов петрова
Что такое цитологическое исследование
Цитологическое исследование — одно из самых востребованных в онкологии. С его помощью врач оценивает состояние клеточных элементов и делает заключение о злокачественной или доброкачественной природе новообразования. Изучаются особенности строения клеток, клеточный состав органов, тканей, жидкостей организма человека. Цитологическое исследование применяется при диагностике предраковых заболеваний и злокачественных новообразований различных органов: шейки и тела матки, молочной железы, щитовидной железы, легких, кожи, мягких тканей и костей, желудочно-кишечного тракта, лимфатических узлов и др. Для цитологического исследования берут мазки свода влагалища и шейки матки, мокроту, мочу, экссудаты из полостей и т.д.
Когда назначается цитологическое исследование?
В большинстве случаев врачи – терапевты, гинекологи, онкологи и другие специалисты — прибегают к цитологической диагностике при подозрении на опухолевое заболевание.
Цитологический метод применяется для исследования новообразований в различных органах – кожа, молочная железа, лёгкие, средостение, печень, почки, забрюшинные образования, щитовидная железа, предстательная железа, яичко, яичники, лимфатические узлы, миндалины, слюнные железы, мягкие ткани, кости и др.
Наибольшее распространение цитологические исследования получили в области гинекологии. Это доступный и быстрый метод скрининга, доказавший свою эффективность в диагностике предраковых заболеваний и раннего рака шейка матки.
Нередки случаи, когда цитологическое исследование помогало обнаружить рак желудка, легкого, мочевого пузыря и др. на самых ранних стадиях, когда рентгенологические и эндоскопические исследования не выявили изменений.
В период лечения опухолевого заболевания необходимо постоянно контролировать эффективность проводимой терапии. Для этого необходимы быстрые и эффективные методы диагностики. Цитологическое исследование в этих случаях позволяет оперативно получить ответы на большинство возникающих у врачей вопросов по поводу течения болезни. Цитологическое исследование широко используется также и после окончания специализированного (хирургического, химиотерапевтического или лучевого) лечения для контроля течения заболевания и раннего выявления возможного рецидива или прогрессирования опухоли (исследование лимфатических узлов, плеврального экссудата и т.д.).

Основные области применения цитологических исследований в онкологии:
- Скрининг, профилактические осмотры
- Диагностика – установление и уточнение диагноза
- Контроль результатов во время и после проведения терапии
В чем отличие цитологии от гистологического исследования?
Отличие цитологического исследования от гистологического, в первую очередь, заключается в том, что изучаются именно клетки, а не срезы тканей. Для гистологического исследования требуется либо операционный материал, либо забор материала методом трепан-биопсии. Для цитологического же исследования достаточно мазка со слизистой оболочки, соскоба с поверхности опухоли или материала, полученного тонкой иглой.
Подготовка гистологического препарата требует больше усилий и времени, нежели подготовка для цитологического анализа.
Как выполняется цитологическое исследование?
Для анализа используют различный биоматериал.
- соскобы с поверхности эрозий, ран, язв;
- соскобы с шейки матки и цервикального канала, аспираты из полости матки;
- секреты желез, экскреты, мокрота, транссудаты, экссудаты, промывные воды и т.д.
- Исследование мочи на атипические клетки
Пункционный материал:
- пунктаты, полученные тонкой иглой (тонкоигольная биопсия)
- отпечатки материала трепан-биопсий из опухолей и различных новообразований
Операционный материал:
- мазки-отпечатки и соскобы с удаленной ткани, жидкость, смывы и др. материал, полученный при проведении хирургических вмешательств.
Эндоскопический материал:
- материал, полученный при проведении эндоскопического исследования
Цитологическое исследование — наиболее щадящий метод диагностики. Обычно забор материала для анализа протекает безболезненно, в амбулаторных условиях, без травматического воздействия на органы и ткани.
Взятый для анализа клеточный материал в цитологической лаборатории переносят на предметные стекла, окрашивают и исследуют под микроскопом.
Цитоморфолог использует в своей работе совокупность признаков атипии клетки, критически оценивая их наличие и степень выраженности. Результат анализа напрямую зависит от профессионализма специалиста, проводящего исследование: как в части подготовки материала, так и в части его исследования под микроскопом.
На поверхности опухолевых клеток есть особые белки – антигены. Причем, каждая опухоль экспрессирует свой собственный набор антигенов. При необходимости с помощью специальных реактивов для иммуноцитохимического исследования врач-цитолог может не только установить наличие злокачественно трансформированных клеток в исследуемом образце, но и определить гистотип опухоли, ее органную принадлежность, факторы прогноза и чувствительность к лечению.


Достоинства цитологического метода:
- абсолютная безвредность для пациента
- безболезненность
- возможность применения многократных цитологических исследований
- быстрота
- диагностика злокачественных опухолей любой локализации и в любой стадии процесса.
Обычно для проведения исследования требуется несколько часов. Интраоперационное цитологическое исследование может быть выполнено в течение 10 минут.
За счет его безвредности, цитологический метод незаменим для оценки динамики морфологических изменений в клетках опухоли во время лечения, для определения терапевтического эффекта проводимого лечения. Для таких пациентов он имеет несомненные преимущества перед другими, более инвазивными методами исследования.
Методы цитологических исследований постоянно совершенствуются. Развитие эндоскопической техники позволяет целенаправленно получать материал для исследования из внутренних органов, ранее недоступных для морфологического анализа без оперативного вмешательства.
Таким образом, цитологическое исследование, благодаря сочетанию высокой информативности, безвредности для пациента и скорости проведения, при отсутствии травматизации тканей, имеет огромное значение в онкологии.


Авторская публикация:
Михетько Андрей Александрович
заведующий лабораторией цитологии НМИЦ онкологии им.Н.Н. Петрова,
врач клинической лабораторной диагностики (цитолог) высшей квалификационной категории, кандидат медицинских наук.
Еще фото
Автор (ы): Н.В. Литвинов, к.в.н., ветеринарный врач-цитолог, член ESVCP, эксперт органа по сертификации качества Метрологической академии РФ, научный руководитель Ветеринарного центра клинической цитологии и компьютерной цитометрии CYTOVET, г. Санкт-Петербург
Журнал: №3-4 - 2011
Ключевые слова: жидкостная цитология (ЖЦ), цитологическое исследование, преаналитический этап, цитоцентрифугирование, клеточное обогащение, фильтрация (ThinPrep), стайнер
Цитологический метод исследования – один из важных инструментов, с помощью которого осуществляется диагностика многих патологических процессов. Данный метод имеет бесспорные преимущества перед более инвазивными методиками прижизненной морфологии.
Технически для приготовления информативного препарата требуется минимальное количество материала. Аспирационные и пункционные методы биопсии малотравматичны и практически безболезненны, доступна любая локализация в организме животного.
Цитологическая диагностика стала неотъемлемой частью клинического обследования животных в практике ветеринарного врача. Но следует отметить, что успех цитологической диагностики, помимо квалификации цитолога, во многом зависит оттого, каким образом был получен материал, как он был обработан, и насколько точно было составлено сопроводительное направление с описанием места локализации исследуемого патологического участка и другие моменты преаналитического этапа до поступления в цитологическую лабораторию.
Преаналитический этап является одним из основных этапов, где происходит (зачастую неконтролируемое) снижение контроля качества в лабораторной и цитологической диагностике.
Основная форма контроля преаналитического этапа – периодические внешние и внутренние проверки, внедрение инструкций, наставлений и проведение тренингов на рабочих местах, снижающие ошибки персонала.
Для создания условий по стандартизации преаналитического этапа и обеспечения качества цитологического исследования внедрены современные методы получения материала, пробоподготовка и доставка.
Жидкостноя цитология (ЖЦ) – liquid based cytology (LBC) – новый стандарт для приготовления монослойных цитологических препаратов.
Большинство ошибок, совершаемых при взятии или переносе патологического материала для приготовления мазков, является основной причиной ложных результатов диагностики больного животного, снижающей статус и качество работы цитологической лаборатории, дискредитации врача морфолога. Нередко врачами осуществляется некомпетентное пунктирование и аспирирование из новообразования с последующим неравномерным распределением материала на стекле. Слишком толстый мазок является причиной получения неполноценного материала. Слизь и кровь, присутствующие во взятом материале, мешают перенести на мазок клетки, также материал невозможно равномерно перемешать. При переносе материала на стекло традиционным способом клетки могут не попасть в препарат. Подсушивание и потеря прилипших к инструменту клеток значительно уменьшает диагностическую информативность микропрепаратов.
Обилие преаналитических ошибок у такого рода специалистов, становится основным барьером в собственной диагностической работе и невозможностью оценить преимущества цитологического исследования.
Описанные методы ЖЦ позволяют исключить эти негативные факторы в существующих недостатках преаналитического этапа.
Основные этапы
А. Долабораторный преаналитический этап
Получение материала классическими способами (аспирация, пункция, эксфолиат, отпечаток и др.) с применением современного инструментария (цитощетки cervix-brush, cytobrash, урогенитальные щетки, современные цитологические троакары и биопсийные иглы стандарта sterile eo и др.).
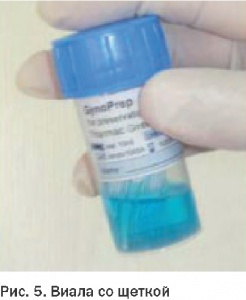
1.Транспортная среда – консервант (PreservCyt, Novaprep – solution preservative). Собранный клеточный материал, помещенный в виалу с консервантом (PBS, коммерческие спирто-эфирно-формалиновые смеси и др.), препятствует повреждению клеток, позволяет отфильтровать слизь и избежать бактериального загрязнения, давая возможность в оптимальных условиях доставить пробу в лабораторию. Позволяет сделать несколько цитологических препаратов из одной пробы.
Важно отметить, что материал можно хранить от недели до нескольких месяцев, т.к. в консерванте он устойчив к колебаниям температуры (не замораживать!). В некоторых консервирующих средах клеточный материал пригоден для дополнительных лабораторных исследований (генетически-молекулярных, ИЦХ, ЦХ и др.).
Б. Лабораторный преаналитический этап
Способы получения монослойных цитологических препаратов при переносе клеток из фиксирующего раствора на стекло с использованием методов центрифугирования, осаждения и/или фильтрации.
1. Варианты реализации методики жидкостной цитологии с помощью цитоцентрифуг (Cyto-Tek, CytoSpin, DiffSpin и др.). Цитоцентрифугирование, на сегодняшний день, уже относится к ручному способу приготовления мазков.
Здесь следует отметить преимущества этой методики – простоту в освоении и внедрении, возможность изготовления нескольких стекол из одного образца, удобное обслуживание и малозатратность при небольшом потоке исследований.
Выделены и недостатки данной методики: требуются наработки и навыки от лабораторного сотрудника в приготовлении мазка в зависимости от вида клеточного материала. Это полностью ручной способ с низкой производительностью. В большинстве случаев необходимо разведение образца при высокой клеточности материала (центрифугирование в обычной центрифуге, разведение осадка в 1000 мкл фиксатора), а это требует использования дополнительного оборудования (вортекс, нефелометр), отсутствуют стадии очищения образца, центрифугирование может приводить к разрушению клеточных комплексов, мультинаслаиванию.
• Первоначально требует стандартизованного перемешивания виал с материалом (вортекс);
• Приготовление супернатанта (дополнительный аппарат по наслоению + двойное центрифугирование);
• Приготовление монослойного мазка происходит из супернатанта и в некоторых комплектах оборудования производится стандартизированная окраска препарата (опционально);
• Все стадии процесса можно наблюдать и прервать/вмешаться в любой момент;
• Наличие аппарата автоматизированного предпросмотра (аппарат не позволяетсканировать, сохранять изображения, осуществлять обмен и телеконференции).
В процессе приготовления супернатанта происходит удаление части диагностического материала(кровь, воспалительные элементы, это удобно при исследовании мазков на гормональную насыщенность, но категорически недопустимо при исследовании воспалительных процессов и онкоморфологии!). Несколько этапов центрифугирования может приводить к разрушению клеточных комплексов, деформации клеточных структур. Низкая степень автоматизации, соответственно, большой объем ручного труда – до 50% времени.
Существенный объем специальных расходных материалов (большое количество скрытых трат) – сложная система финансового планирования закупок.
3. Фильтрация (ThinPrep):
• Автоматическое перемешивание, фильтрация вакуумом и перенос клеток методом отпечатков с соблюдением стандартов и контроля качества;
• Высокая степень автоматизации (до 70%);
• Имеется система автоматизированного предпросмотра. Минимальное количество расходных материалов;
• Простая система расчета стоимости исследования.
Одним из основных недостатков данной системы является закрытая система штрих-кодирования (в большинстве случаев ее невозможно совместить с внутриклинической (внутрилабораторной) системой ЛИС и/или других компьютерных программ статучета, невозможна работа без штрих-кодов). Большой риск повреждения клеток, особенно разрушения комплексов (применение вакуумной аспирации). Отсутствует возможность приготовления нескольких стекол из одной пробы. Относительная дороговизна системы.
4. Автоматизированная жидкостная цитология – комбинированная технология.
Используется цитологический процессор NOVAPREP ® NPS.
Автоматический метод пассивной фильтрации и двойного осаждения (высокий стандарт качества).
• Специально разработанные виалы, устройство для съема наконечников цитощеток, фильтр для отделения слизи, конус для накопления осажденных клеток.
• Возможность одновременного/ отсроченного приготовления нескольких стекол из одной виалы, 10 режимов для приготовления цитологических препаратов (от скрининга PAP-test до высококонцентрированного для разреженных проб).
• Система приготовления проб для молекулярных исследований (автоматизированный отбор в микропробирки типа Eppendorf).
• Система предотвращения контаминацией вирусами.
• Система приготовления проб для любых дополнительных исследований (автоматизированный отбор в рутинные лабораторные пробирки). Полностью автоматизированный процесс пробоподготовки.
• Снижение доли ручного труда на 90-95%. Ручной труд занимает от 2 до 5 минут на загрузку виал в штатив процессора (5 минут на штатив, около 30 сек на пробу) и выбор режима в компьютерной программе.
• Отсутствие потерь биоматериала (100% в исследовании).
Кардинальное изменение качества тестов и достоверности результатов. Один аппарат пробоподготовки для всех видов исследований (микроскопия, иммуноцитохимия, молекулярные методы). Универсальная система идентификации (открыта для любых систем кодирования – ручное, штрих-кодирование и т.п.).
Недостатки метода: значительная дороговизна системы, технического сопровождения и расходных материалов.
Области применения различных методов жидкостной цитологии
Для целей первичного внедрения в условиях крайне ограниченных ресурсов более всего подходит метод цитоцентрифугирования.
Для целей рутинной скрининговой и клинической, а также научной практики более всего подходит комбинированная технология Novaprep ® .
Для целей научного поиска в цитологической практике служит система клеточного обогащения (SurePath), зарекомендовавшая себя как золотой стандарт качества (при условии наличия персонала для обеспечения функционирования).
Методы окраски цитологических мазков
1. Ручной способ окраски стекол:
а) рельсовый; б) в кюветах.
Классические методы окраски препаратов с применением ручного труда с низким уровнем контроля и стандартов преаналитического этапа.
Характеристики приборов соответствуют различным требованиям диагностических и научных лабораторий, в зависимости от пропускной способности и исследовательского подхода.
Заключение
Общепринятое мнение о лабораторном исследовании, как о качественном исследовании, теряет свой смысл при равнодушном и некомпетентном соблюдении преаналитического этапа. Однако аналитический этап является очень узкой стадией лабораторной работы и не может считаться полноценным при неправильно составленном направлении на исследования, при нарушении правил аспирирования и биопсии, ошибках, допущенныхпри транспортировке биоматериала в лабораторию. В то же время запоздавший отчет о лабораторных исследованиях или неправильно интерпретированные данные лабораторного исследования, могут стать существенной преградой в адекватной диагностике и лечении больного животного.
Представленные методы жидкостной цитологии и автоматизированные системы окраски позволяют добиться высокого уровня преаналитического этапа, способствуют качественному цитологическому исследованию и достижению международных стандартов лабораторной диагностики (ISO 9001, ISO 15189 -2009).
Номенклатура МЗРФ (Приказ №804н): A08.03.001.000.01 "Цитологическое исследование соскоба-отпечатка опухолей, опухолеподобных образований"
Биоматериал: соскоб и отпечатки опухолей и опухолевидных образований
Срок выполнения (в лаборатории): 2 р.д. *
Описание
Клиническая цитология — метод морфологического анализа, основанный на изучении и оценке клеточного материала, полученного различными способами из различных органов и тканей. Основным диагностическим направлением клинической цитологии является онкоцитология. Цитологическое исследование производится, прежде всего, для того, чтобы получить ответ о наличии или отсутствии злокачественного новообразования. В процессе дифференциальной диагностики определяется характер патологического процесса, и выявляются предраковые диспластические поражения, реактивные, воспалительные изменения, а также доброкачественные опухоли. Важной задачей при проведении цитологических исследований является диагностика злокачественных опухолей. Злокачественная опухоль обладает способностью к инфильтрирующему, инвазивному росту, то есть к прорастанию в окружающие ткани, в просвет кровеносных и лимфатических сосудов, создавая предпосылки к метастазированию.
Показания к назначению
- диагностика наличия или отсутствия злокачественного новообразования;
- определение типа опухоли;
- установление воспалительных, экссудативно-пролиферативных или предраковых изменений.
Подготовка к исследованию
Специальная подготовка может быть определена лечащим врачом.
Интерпретация результатов/Информация для специалистов
Заключение по исследуемому материалу выдается врачом.
Взятие биоматериала проводится квалифицированным врачом.
Где сдать анализ?
Адреса медицинских центров, в которых можно заказать исследование, уточняйте по телефону 8-800-100-363-0
Все медицинские центры СИТИЛАБ в г. Москва >>
| Код | Наименование | Срок | Цена | Заказ |
|---|---|---|---|---|
| 11-10-001 | Общий анализ крови (CBC/Diff - 5 фракций лейкоцитов) | от 1 р.д. | 370.00 р. | |
| 25-20-001 | Калий, Натрий, Хлор (К+, Na+, Cl-) (кровь) | от 1 р.д. | 380.00 р. | |
| 36-20-016 | CA 242 | от 5 р.д. | 890.00 р. | |
| 90-40-008 | Цитологическое исследование пунктатов лимфатических узлов | от 2 р.д. | 870.00 р. | |
| A11.12.009.003 | Взятие биоматериала в тарифной зоне "Город" | от 1 р.д. | 700.00 р. |
* На сайте указан максимально возможный срок выполнения исследования. Он отражает время выполнения исследования в лаборатории и не включает время на доставку биоматериала до лаборатории.
Приведенная информация носит справочный характер и не является публичной офертой. Для получения актуальной информации обратитесь в медицинский центр Исполнителя или call-центр.
Клиническая цитология, которая использует достижения теоретической цитологии, а также нормальной и патологической гистологии, имеет своей целью диагностику клеток патологических процессов и прежде всего новообразований.
Перечисленное обусловливает как достоинства цитологического исследования доступность, малую травматичность или полное ее отсутствие при получении материала, простоту, быстроту, сравнительную дешевизну получения важной диагностической информации, так и его ограничения — меньшую, чем при гистологическом исследовании, диагностическую информативность взаимоотношений патологически измененных и нормальных тканей.
Цитологическое исследование предпочтительнее, когда биопсия кусочка ткани и гистологическое исследование невозможны или крайне нежелательны, в случае детального изучения особенностей структур клеток, при необходимости получения быстрого результата, например при обследовании больного в условиях поликлиники, при массовых профилактических осмотрах населения и т. п.

Этот метод дает возможность оценить характер и степень выраженности пролиферации эпителия, выделить группу дисплазнй, что помогает более обоснованно формировать так называемые группы повышенного риска. Динамическое цитологическое наблюдение у лиц этой группы за характером клеточных и тканевых изменений фактически невозможно с помощью других морфологических методов. С помощью цитологического метода исследования возможна диагностика рака и других опухолей.
Цитологический метод позволяет оценить распространенность злокачественного процесса, в ряде случаев — указать на источник метастазирования. Он дает возможность охарактеризовать уровень дифференцировки (степень злокачественности) опухоли, что имеет большое значение для прогнозирования течения заболевания; позволяет оценить чувствительность опухоли к тем или иным лечебным воздействиям (лучевым, химио- и иммуиотерапевтическим и т. д.), что важно при разработке наиболее рациональных методов лечения и может быть использовано для динамического контроля за результатами лечения.
В связи с вышеизложенным в настоящее время нельзя представить хорошо организованное медицинское учреждение, в котором не проводились бы цитологические исследования
В цитологических методах исследования установились 2 основных направления.
Особенно широкое распространение получил метод эксфолиативной цитологии, когда объектами исследований являются клетки, тем или иным путем отторгающиеся во внешнюю среду с поверхности новообразования или другого патологического очага.
При исследовании эксфолиативного материала различают спонтанно слущенные с поверхности эпителия клетки и клетки, удаленные из различных тканей с помощью инструментов.
К эксфолиативным цитологическим исследованиям относят изучение мокроты, мочи, простатического сока, аспиратов, смывов из различных органов во время эндоскопии, а также из шейки н полости матки, выделений из соска молочной железы, соскобов и отпечатков из эрознрованных, язвенных поверхностей, свищей, ран; жидкости из суставных и серозных полостей, спинномозговой и амииотической жидкости.
Автор работы: Пользователь скрыл имя, 19 Мая 2015 в 17:45, реферат
С глубокой древности до XIX века опухоли были редкой патологией из-за распространенности инфекционных заболеваний, которые снижали среднюю продолжительность жизни из-за высокой смертности. В этот период невозможно определить распространенность опухолей, число ими болевших и погибших из-за несовершенных методов диагностики, редкости хирургического лечения и отсутствия вскрытий.
3. Цитологическая характеристика опухолевого процесса…………………..4-5
5. Классификация опухолей………………………………………. ………….7-9
6. Предопухолевые процессы……………………………………………. …9-10
7. Критерии цитологической диагностики………………………………. 10-14
8. Критерий злокачественных и доброкачественных поражений………. 14-15
клин.цитология.docx
Факультативные (необязательные) предраковые состояния - патологическое состояние, на фоне которого может развиться рак. Это хронические воспалительные заболевания и очаги пролиферации, вызванные гормональной перестройкой, рубцы после ожогов, незаживающие язвы, эрозии шейки матки, полипы, старческие кератозы.
Морфологически предрак проявляется очагом избыточной клеточной пролиферации с атипичными клетками, но без инфильтративного роста. Рак на фоне этих изменений развивается в 1-5% случаев. Предраку недостает одного или нескольких признаков, характерных для рака.
Предраковыми состояниями считают атрофический гастрит, язвенную болезнь желудка, полипоз, очаговую фиброзную мастопатию, эрозии шейки матки. Данные о предраковых состояниях позволяют разрабатывать профилактические мероприятия.
Необходимы своевременная диагностика, учет и наблюдение за больными с предраковыми заболеваниями. Больные облигатным предраком должны состоять на учете в онкологическом диспансере и систематически, 1-2 раза в год, подвергаться обследованию для своевременного обнаружения признаков злокачественного роста и радикального лечения.
При факультативном предраке больные также находятся под тщательным наблюдением и при появлении признаков злокачественного роста подвергаются хирургическому лечению. Если атрофическим гастритом больные страдают около 10 лет, рак желудка следует ожидать у 10% больных. Таким образом, чем длительнее хроническое заболевание, тем больше опасность возникновения рака.
7.Критерии цитологической диагностики:
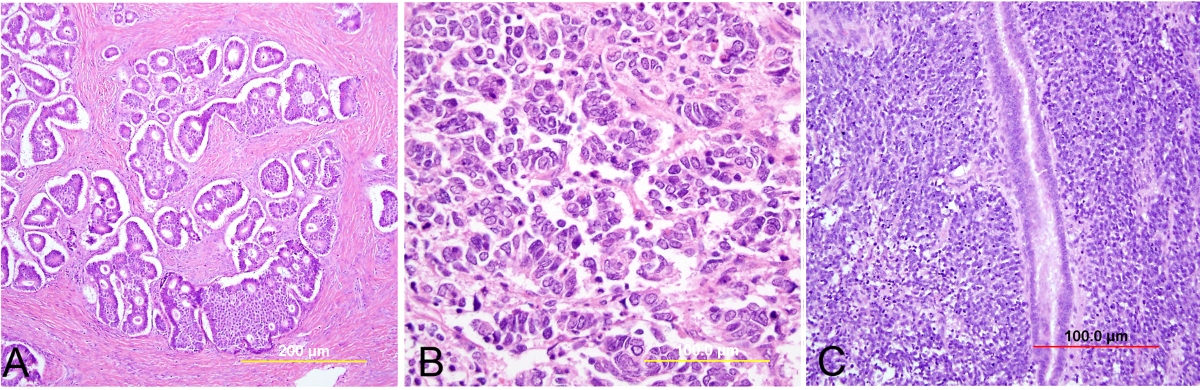
Цитологический анализ включает: обработку присланного материала, приготовление препарата, окраску, микроскопию, трактовку цитологической картины, заключение, в котором дается оценка полученного материала, определяется характер процесса (доброкачественный или злокачественный), при возможности устанавливается нозологическая единица согласно принятым морфологическим классификациям.
Основной задачей указанного метода при исследовании различных органов является установление характера патологического процесса, a также доказательства существования рака при клиническом подозрении на патологию такого характера. Более того, задачей специалиста является достижение такого уровня знаний, когда возможно диагностировать тип опухоли с высокой степенью точности. Отрицательный результат цитологического исследования не исключает наличие рака. Существенную роль для правильного заключения играют быстрота получения, хорошая фиксация и окраска исследуемого материала.
Поскольку методы лечения онкологических заболеваний могут быть весьма агрессивными, при отсутствии убедительных признаков опухоли необходим тщательный контроль в целях предотвращения гипердиагностики. Некоторые сложные спорные случаи требуют гистологического подтверждения диагноза. Следует изучать также и неполноценные препараты, но отрицательное заключение не должно категорически отрицать наличие опухоли.
Цитологическое исследование препаратов должно состоять из подробного описания морфологической картины и заключения, по возможности c указанием характера процесса (доброкачественный или злокачественный) при наличии опухоли, определении тканевой принадлежности, гистологической формы и степени дифференцировки опухоли. Описание цитологической картины должно проводиться по одной схеме и включать осмотр при малом увеличении (обзор) и при иммерсии.
Основу цитологической диагностики составляет изучение клеток, изменения расположения, структуры, строения.
В цитологической диагностике специалист, исследуя препараты под микроскопом, анализирует клеточный и неклеточный состав на основании известных ему критериев цитологической диагностики: количества клеток, присутствия клеток разного типа, их расположения в структурах и разрозненно, характера структур, размера и формы клеток и ядер, структуры ядра и цитоплазмы, ядерно-цитоплазматического соотношения, наличия или отсутствия клеточного и ядерного полиморфизма и других параметров клеток.
О характере патологического процесса судят по степени выраженности отклонения от нормального клеточного состава. Учитывают при этом также фон препарата (элементы крови, бесструктурное вещество, коллоид, жир и пр.).
Расположение клеток, образование комплексов или структур является одним из важных диагностических признаков. Так, для рака характерно образование самых различных комплексов, наряду с разрозненно расположенными клетками. В саркомах клетки располагаются иногда в виде пучков. Розеткоподобные структуры могут определяться в самых различных новообразованиях (опухоль Юинга, аденокарцинома, хемодектома, синовиальная саркома и др.).
Разрозненное расположение означает, что клетки лежат в препаратах поодиночке, отдельно друг от друга; расположение в скоплениях клетки прилегают друг к другу, но достаточно свободно, не образуя структур; расположение в структурах – клетки связаны между собой в образования определенного вида:
• Сосочколодобные (папиллярные) структуры (клетки обволакивают друг друга).
• Железистоподобные структуры (структуры округлые, ядра раслоложены эксцентрически, в центре – секрет, бесструктурное вещество).
• Фолликулярные (фолликулоподобные) – клетки располагаются по периферии, в центре структуры – секрет.
• В виде розеток (однослойная структура, основная часть клеток образует круг, несколько клеток располагаются в центре).
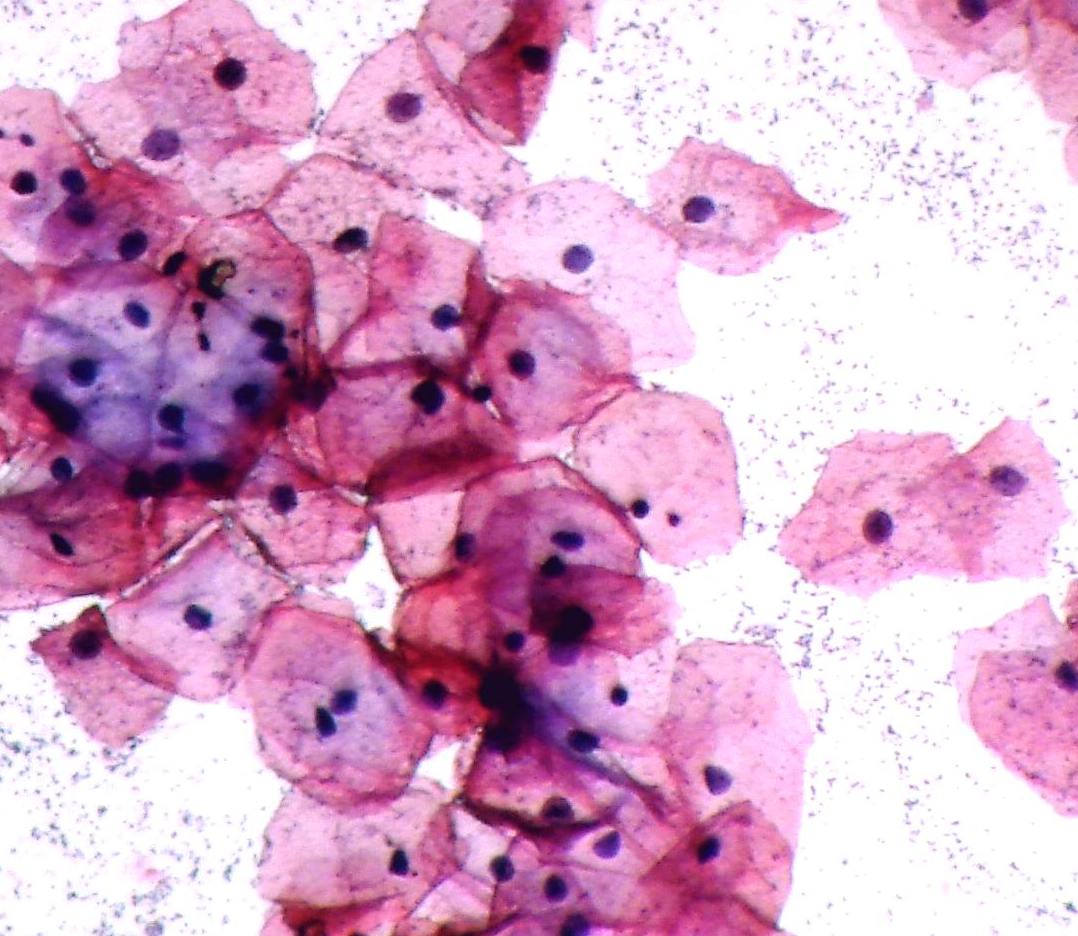
Для доброкачественных поражений характерно правильное, упорядоченное расположение клеток, примерно одинаковое расстояние между ними, сходные размеры клеток и ядер, образующих структуру.
Для злокачественных новообразований характерны структуры, которые называются комплексами (встречаются при раке, опухоли из эпителиальной ткани) или пучками (встречаются при саркоме, опухоли из неэпителиальной ткани – соединительной, мышечной, нервной). Клетки в комплексах нагромождаются друг на друга, отсутствует упорядоченность их расположения.
Размеры клеток обычно оценивают в сравнении с размерами нормальных клеток того же типа. Так, размер зрелой клетки плоского эпителия примерно в 10 раз больше клетки эпителия желудка или молочной или щитовидной железы. Размеры ядер обычно сравнивают с размером эритроцита (в норме достаточно стабильным, приблизительно 7 мкм). Если размер ядер меньше эритроцита, они считаются мелкими, если в 1–1,5–2 раза больше эритроцита - средними, 3–6 – крупными, 7 и более – гигантскими.
Соотношение размера ядра и цитоплазмы (ядерно-цитоплазматическое соотношение) также весьма различно в разных клетках, и при оценке его учитывают степень отклонения соотношения от этого параметра клетки того же типа.
Форма – округлая, овальная, полигональная (неправильная), вытянутая (веретенообразная), бобовидная, в виде перекрученного жгута, булавовидная и др.
Размеры – мелкие (примерно размеры лимфоцита), средних размеров, крупные, гигантские.
Окрашиваемость – гипохромия, гиперхромия.
Сдвиг ядерно-цитоплазматического соотношения в пользу ядра и цитоплазмы.
Строение хроматина – равномерное, регулярное, хроматин тонкодисперсный, мелкозернистый, грубозернистый, глыбчатый (в виде грубых глыбок), конденсация хроматина по краю ядерной мембраны, распределен неравномерно, равномерно, разряжен.
Строение ядерной мембраны – мембрана сохранена, четкие контуры, нечетко очерчена, имеются разрывы, не на всем протяжении прослеживается.
Ядрышки – просматриваются, определяются, не просматриваются, количество, форма – округлая, неправильная, разнообразные по форме и размерам, четкость границ.
Цитоплазма – обильная, умеренная, скудная, цвет голубой, серо-голубой, розовый, розово-фиолетовый и др., окрашена равномерно, неравномерно, стекловидная, включения (зерна, пылевидная зернистость, пенистая цитоплазма и др.), признаки секреции, четкость границ (четкие, неровные, сливаются с фоном), вакуолизация. Существенным признаком является характер цитоплазмы, наличие включений в ней.
Кератоз цитоплазмы значительного количества клеток позволяет думать о плоскоклеточном с ороговением раке, наличие гранул меланина - о меланоме.
Фон препарата часто имеет большое диагностическое значение. Фоном препарата могут быть элементы периферической крови или воспаления, сопровождающего опухолевый процесс, клеточный детрит, межуточное вещество. Фон препарата в виде межуточного вещества может иметь диагностическое значение при определении тканевой принадлежности опухоли (например, хрящеобразующие опухоли) или гистологической формы (например, слизеобразующие аденокарциномы).
Основное назначение цитологического анализа – получить ответ на вопрос о наличии или отсутствии злокачественного новообразования (онкоцитология). В процессе дифференциальной диагностики определяется характер патологического процесса и устанавливаются воспалительные, реактивные, пролиферативные или предраковые поражения, а также доброкачественные опухоли.
Роль морфологических исследований при диагностике опухолей неуклонно возрастает, так как детальная морфологическая характеристика новообразования позволяет более обоснованно выбрать метод лечения (хирургическое, лучевое, химиотерапевтическое и их комбинацию), поскольку опухоли различного строения, происхождения и степени атипии клеток по-разному реагируют на лечение.
8.КРИТЕРИИ ДОБРОКАЧЕСТВЕННЫХ И ЗЛОКАЧЕСТВЕННЫХ ПОРАЖЕНИЙ:
Наиболее часто в цитологической диагностике имеют дело с клетками эпителия. Эпителий – ткань, выстилающая поверхности (кожа, слизистые оболочки внутренних органов, серозные оболочки). Эпителий составляет также основную часть желез. Клетки эпителия при: различных патологических процессах могут претерпевать различные изменения. Это реактивные изменения (при воспалении, гормональных, механических воздействиях и т.п.), фоновые процессы (гиперплазия). Существуют так называемые пограничные состояния (предопухолевые процессы, дисплазии), при которых изменения в клетках достаточно сильно выражены и их трудно отличить от злокачественных. Наиболее отличаются от нормальных клетки злокачественных опухолей.
При реактивных и фоновых поражениях чаще всего увеличивается число клеток (пролиферация), размер ядер, ядра окрашиваются более интенсивно (гиперхромия ядер). Хроматин распределен сравнительно равномерно. В некоторых ядрах, что особенно характерно для железистого эпителия, увеличиваются ядрышки. При некоторых состояниях увеличивается или уменьшается размер клеток, изменяется характер окрашивания цитоплазмы.
При пограничных процессах (состояниях, близких к злокачественным) размер ядер увеличивается значительно, меняется форма ядер, их контуры становятся неровными, ядерная мембрана может неравномерно утолщаться. Хроматин распределен неравномерно, мелкие участки уплотнения чередуются с крупными. Могут увеличиваться ядрышки или появляются множественные мелкие ядрышки. Иногда встречаются многоядерные клетки. Однако, в отличие от злокачественных опухолей, изменения в разных клетках сравнительно одинаковы (мономорфны).
При злокачественных поражениях отмечаются следующие изменения в клеточном составе мазка:
1. Клеточный и ядерный полиморфизм – различие характеристик разных клеток:
• Увеличение и уменьшение размеров клеток (анизоцитоз).
• Увеличение и уменьшение размеров ядер (анизокариоз).
• Изменение формы ядер.
• Неровные контуры ядерной мембраны.
• Неравномерное распределение хроматина.
• Изменение структуры хроматина (грубые глыбки, гранулы разных размеров, нагромождения хроматина, тяжистый, петлистый хроматин, борозды).
• Отличие характера распределения хроматина от распределения в соответствующих доброкачественных клетках.
• Наличие многоядерных клеток, фигур деления (атипичные митозы).
• Изменение характера окрашивания цитоплазмы (неравномерное окрашивание разных участков).
2. Образование комплексов из клеток – структур, отличных от нормальных:
• Разное расстояние между клетками.
• Потеря полярности – ядра клеток ориентированы в разных направлениях.
Читайте также:
- Молекулярно-генетические нарушения как критерии в дифференциальной диагностике редких опухолей почки
- Рак толстого кишечника признаки и симптомы сколько живут
- Можно ли определить по узи злокачественную опухоль
- Дифференциальная диагностика рака прямой кишки таблица
- Патологоанатомический диагноз острый лейкоз

