Аутофлуоресцентная диагностика рака в стоматологии
В данной статье представлено теоретическое обоснование методики флуоресценции, сравнительная характеристика используемого оборудования, рекомендации по клиническому применению, а также примерная форма протокола скринингового обследования стоматологического больного
Материал предоставлен Независимым некоммерческим
стоматологическим образовательными исcледовательским
фондом Gordon J. Christensen Clinicians report™
(www.cliniciansreport.org)
Рак полости рта занимает шестое место по распространенности среди онкологических заболеваний, характеризуется тяжелым клиническим течением и в большинстве случаев приводит к социальной дезадаптации человека (рис. 1).
В 2011г. в США было выявлено около 40 000 новых случаев заболеваемости раком полости рта. К факторам риска возникновения заболевания можно отнести курение, избыточное употребление алкоголя, воздействие ультрафиолетового и ионизирующего излучения и т.д.
Несмотря на то, что протокол обследования стоматологического больного обязательно включает в себя осмотр и пальпацию тканей челюстно-лицевой области, наибольшее внимание, как правило, уделяется диагностике заболеваний зубов, в то время как заболевания мягких тканей выявляются лишь на стадии выраженных изменений.
К дополнительным способам выявления заболеваний мягких тканей челюстно-лицевой области можно отнести методику флуоресценции, преимуществами которой являются: высокая диагностическая точность и простота применения (по сравнению с обработкой слизистой оболочки полости рта различными красителями, а также другими многоэтапными методиками).
В данной статье представлено теоретическое обоснование методики флуоресценции, сравнительная характеристика используемого оборудования, рекомендации по клиническому применению, а также примерная форма протокола скринингового обследования стоматологического больного.
Диагностика рака полости рта с использованием методики флуоресценции основана на различном поглощении и отражении светового излучения атипичными и здоровыми клетками. При обследовании слизистой оболочки полости рта с использованием ультрафиолетового света и специальных флуоресцентных фильтров можно обнаружить, что здоровые ткани излучают волны голубой и зеленой областей спектра, а скопления атипичных клеток, вследствие сниженной излучающей способности, представляют собой темные участки (рис. 2).

Диагностика рака полости рта с использованием методики флуоресценции имеет ряд преимуществ и недостатков.
Преимущества:
– Возможность ранней диагностики злокачественных образований (при отсутствии визуальных симптомов);
– Простота использования (длительность исследования составляет 1-2 мин.), отсутствие инвазивности, одобрение пациентов;
– Возможность задокументировать и сфотографировать выявленные патологические очаги.
Недостатки:
– Низкая излучающая способность клеток выявляется не только в случае их атипизма, но и при воспалении, повышенной васкуляризации, а также диспигментозе. В подобных ситуациях необходимо провести дополнительное исследование патологического очага или биопсию тканей (рис. 3-4);
– Необходимость использования специального источника света и световых фильтров;
– Для подтверждения диагноза требуется проведение биопсии.

Обследование стоматологического пациента должно включать в себя осмотр и пальпацию тканей челюстно-лицевой области и шеи на предмет выявления опухолевых образований. В качестве дополнительного способа диагностики рака полости рта рекомендуется использовать методику флуоресценции.
При выявлении патологического очаг а необходимо провести его цитологическое или гистологическое исследование, а также тщательно задокументировать клинические признаки поражения с использованием фотографии (для последующего динамического наблюдения и направления к профильному специалисту).
Повторный осмотр пациента назначают спустя 2 недели. В случае уменьшения или сохранения размера патологического очага рекомендовано динамическое наблюдение. При увеличении размеров поражения, проводят биопсию и в зависимости от ее результатов направляют пациента на прохождение дальнейшего лечения к профильному специалисту.
Также необходимо удостовериться в том, что пациент обратился к рекомендованному врачу и получает соответствующее лечение.
Протокол скринингового обследования стоматологического больного
– Осмотр и пальпация тканей челюстно-лицевой области и шеи;
– Осмотр мягких тканей полости рта. Для изучения состояния слизистой оболочки основания и боковых поверхностей языка, отведите его в сторону и вперед при помощи марлевой салфетки;
– Проведите исследование мягких тканей полости рта с использованием методики флуоресценции и флуоресцентных фильтров. Скопления атипичных клеток представляют собой темные участки на фоне ярко флуоресцирующих здоровых тканей;
– Изучите состояние патологических участков при дневном свете;
– Задокументируйте состояние и местоположение патологических участков и сфотографируйте исходную клиническую ситуацию;
– Информируйте пациента о наличии патологических очагов и необходимом лечении.
Для диагностики рака полости рта наравне с основными методами (осмотр и пальпация) рекомендуется использовать методику флуоресценции, так как она позволяет выявлять очаги скопления атипичных клеток даже при отсутствии клинической симптоматики. По сравнению с методикой окрашивания слизистой оболочки различными красителями и трансэпителиальной щеточной биопсией данная методика обладает более высокой диагностической точностью, является более простой в применении и позволяет значительно уменьшить временные затраты.
Так как низкая флуоресцирующая способность не является специфическим маркером атипичных клеток, для подтверждения диагноза необходимо провести дополнительные исследования. Золотым стандартом для подтверждения диагноза рака полости рта является хирургическая биопсия. В обязанности врача-стоматолога входит не только лечение заболеваний зубов, но и диагностика и лечение патологий слизистой оболочки полости рта. При каждом обследовании стоматологического больного необходимо проводить осмотр и пальпацию мягких тканей челюстно-лицевой области и шеи на предмет выявления опухолевых образований. Кроме того, врач-стоматолог обязан информировать каждого пациента о необходимости прохождения ежегодного скринингового обследования.
Анализ проведенных эпидемиологических исследований, проведенных в последнее время, в том числе и в Нижегородской области, свидетельствует о том, что одними из распространенных заболеваний слизистой оболочки ртa (СОР) и красной каймы губ (ККГ) являются заболевания, сопровождающиеся гипер- и дискератозом, а именно красный плоский лишай, лейкоплакия, различные формы хейлита. Как известно, эти состояния относятся к факультативным предракам, с частотой озлокачествления от 1,5 до 20-40%. В то время как абразивный преканцерозный хейлит Манганотти относят к облигатным формам предрака с высокой потенциальной злокачественностью (от 9 до 42%). С клинической и патоморфологической точки зрения к предраковым состояниям относят любые хронические заболевания, сопровождающиеся образованием в тканях очагов избыточной пролиферации клеток, на фоне которых может развиться рак. Это требует от врачей – стоматологов, в первую очередь, онкологической настороженности, диагностической точности, знания клинической картины заболеваний, организации онкологической помощи населению, стратегии и тактики ведения данной категории больных [1; 2].
Несмотря на кажущуюся простоту клинической визуализации предраковых изменений СОР и ККГ в связи с наружной локализацией, определение нозологической формы заболевания только на основе данных осмотра и пальпации нередко ведет к диагностическим ошибкам, так как различная степень ороговения или изъязвления патологических элементов делает их сложно дифференцируемыми. Особенно актуальной является ранняя диагностика злокачественной трансформации, поскольку ее клинические признаки появляются позднее реально возникшего процесса [6]. Поэтому необходимо проведение организационно-методической работы и повышения уровня знаний стоматологов о ранних клинических проявлениях предраковых заболеваний тканей и органов полости рта, широкое внедрение быстрых скрининговых методов диагностики заболеваний СОР и ККГ на первичном приеме.
В доступных литературных источниках имеется ряд публикаций, касающихся АФС-диагностики заболеваний СОР, при этом вопросы оценки эффективности лечения предикторных изменений СОР и ККГ с помощью данной методики недостаточно освещены.
В связи с этим целью настоящего исследования явилась оценка эффективности комплексной терапии предраковых заболеваний СОР при помощи аутофлюоресцентной диагностики.
Материал и методы. На базе кафедры пропедевтической стоматологии за 2015-2017 годы обследовано 300 пациентов с заболеваниями в возрасте 31-82 лет. Из них у 94 человек (31,3%) выявлены различные формы предраковой патологии СОР и ККГ: эрозивно-язвенная форма плоского лишая (ПЛ) – у 47 человек (50%), эрозивная форма лейкоплакии – у 20 больных (21,3%), веррукозная лейкоплакия – у 12 человек (12,8%); декубитальная язва – у 12 человек (12,8%), хейлит Манганотти – у 3 пациентов (3,1%).
Обследование больных включало традиционные методы: опрос, сбор анамнеза, визуальный осмотр, пальпацию регионарных лимфатических узлов, осмотр зубных рядов. Особое внимание уделялось исследованию ортопедических конструкций, острых краев зубов, коронок, зубных протезов. Для определения площади патологических очагов проводилось их фотодокументирование и измерение продольного (a) и поперечного размера (b) при помощи пародонтального зонда. Площадь одиночной язвы, эрозии вычислялась по формуле S=a×b, при наличии нескольких патологических элементов рассчитывалась суммарная площадь пораженной поверхности по формуле S= S1+S2+S3+n.
Анализ полученных результатов производился при помощи пакета прикладных программ STATISTICA версия 6.0 (StatSoft, USA) и Microsoft Excel с использованием методов одномерной статистики. Результаты представлялись в виде M±m, где M – среднее арифметическое, m – стандартное отклонение. Различия и связи между показателями считались достоверными и определялись по t–критерию Стьюдента, используя поправку Бонферрони, если уровень значимости р для соответствующего статистического критерия не превышал 0,05.
Большинство обследованных больных предъявляли жалобы на боли при приеме пищи, чистке зубов, перманентное наличие эрозий и язв во рту, нарушение вкуса и чувствительности, повышение либо, напротив, снижение слюноотделения. Начало заболевания 45% пациентов связывали с неудачным протезированием либо с удалением зубов, в остальных случаях пусковым механизмом являлся сильный стресс. По данным анамнеза было выявлено, что 76% больных ранее обращались за стоматологической помощью, но лечение не принесло желаемых результатов. При опросе было выяснено, что при постановке диагноза практикующие врачи других медицинских учреждений в 97,9% проводили только визуальный осмотр. Дополнительные методы исследования, такие как стоматоскопия, флюоресцентная диагностика, ранее не использовались. У 12 (12,5%) больных были ранее обследованы на грибы рода Candida, морфологическое исследование при давности заболевания от нескольких месяцев до нескольких лет было проведено только 2 (2,1%) пациентам.
При анализе сопутствующей патологии у пациентов с факультативными предраковыми поражениями органов и тканей полости рта получены следующие результаты: гипертоническая болезнь служила фоном у 27 человек (71,3%), заболевания желудочно-кишечного тракта – у 48 человек (51,1%), сахарный диабет – 15 человек (15,9%), ревматоидный артрит – 10 (10,6%), заболевания крови имели 2 человека (2,1%). При этом у 84 больных (89,3%) выявлена коморбидная патология, то есть сочетание двух и более заболеваний внутренних органов, чаще всего сердечно-сосудистой и пищеварительной систем. Психоэмоциональное напряжение, канцерофобию и низкую эффективность предшествующей терапии отмечало более половины обследованных.
При объективном осмотре 90 больных с дискератозами имели частичную потерю зубов, средние значения индекса КПУ составили 18,4±0,02. Из них у 59 пациентов (61,5%) имелись некачественные ортопедические конструкции: у 20 человек - штампованно-паянные из нержавеющей стали без напыления, у 10 - те же конструкции с напылением, у 29 пациентов – металлокерамические коронки и мостовидные протезы. Острые края зубов или коронок являлись причиной декубитальной язвы у 12 больных (12,8%). Выявленные нарушения были устранены врачом стоматологом-ортопедом и включали снятие конструкций, временное и постоянное протезирование, а также совместное со стоматологом-терапевтом динамическое наблюдение. Заболевания пародонта в виде хронического гингивита и пародонтита обнаружены в 100% случаев. Синдром Гриншпана, т.е. сочетание плоского лишая СОР, гипертонической болезни и сахарного диабета имело место у 17 человек. Все они были проконсультированы врачами терапевтом и эндокринологом и находились на поддерживающей терапии.
В результате АФС-исследования у трети обратившихся выявлено нарушение аутофлюоресценции мягких тканей полости рта в виде усиления или, напротив, снижения его интенсивности. Так, у 94 человек (31,3%) эндогенное флюоресцентное свечение отличалось от свечения здоровой слизистой оболочки. Из них у 79 больных (84%) с эрозивно-язвенными заболеваниями СОР и ККГ выявлено гашение флюоресценции, которое визуализировало в виде темных участков без видимого свечения. В очагах гиперкератоза, напротив, отмечено усиление флюоресценции в виде ярко-белого свечения. По результатам онкоскрининга у 3 больных выявлено неоднородное ярко-красное или бурое свечение патологических элементов, впоследствии у них был морфологически верифицирован плоскоклеточный рак СОР.
На этапах комплексного лечения проводилась повторная АФС-диагностика и измерение площади патологических элементов на 7, 10, 14, 21-е сутки (рис. 2), что позволило визуализировать динамику эпителизации патологических элементов и оценить эффективность комплексной терапии (табл.).
Динамика эпителизации патологических элементов на этапах комплексного лечения предраковых заболеваний СОР и ККГ при помощи АФС-диагностики
Н.Н. Булгакова, доцент, к.ф.-м.н, руководитель Научно-образовательного Центра Института общей физики имени А.М. Прохорова РАН, Москва Т.И. Познякова, к.м.н., доцент кафедры госпитальной терапевтической стоматологии, пародонтологии и гериатрической стоматологии МГМСУ, Москва; Ю.А. Смирнова, аспирант кафедры госпитальной терапевтической стоматологии, пародонтологии и гериатрической стоматологии МГМСУ, Москва; Е.А. Волков, профессор, д.м.н., заведующий кафедрой госпитальной терапевтической стоматологии, пародонтологии и гериатрической стоматологии МГМСУ, Москва;
Рак слизистой оболочки рта составляет 40% от всей заболеваемости рака головы и шеи (J.Massano et al, 2006) и 1 - 3,5% в структуре всех злокачественных опухолей, занимая второе место после рака гортани. Ежегодно в России первичных больных раком полости рта регистрируется около 6000; в г. Москве – от 360 до 400 пациентов.
Стандартизованный показатель заболеваемости на 100 000 населения в Российской Федерации в 2007 г. составил 2,7 в г. Москве - 2,4. У 70% рак слизистой оболочки рта и отоларингеальной области выявляется в поздних стадиях (А.М. Сдвижков, 2010). Ранняя диагностика позволяет уменьшить смертность от злокачественных новообразований слизистой оболочки рта на 80%, поэтому необходимо использовать скрининговые методы для выявления предраковых заболеваний слизистой оболочки рта (S.Shingaki et al, 2003).
Цель скрининга – активное раннее выявление бессимптомного рака. Большой потенциал в обнаружении ранних форм рака показал метод аутофлуоресцентной диагностики (АФД) (В.В. Чиссов и соавт., 2003). В его основе – различия в интенсивности и спектральном составе эндогенного (аутофлуоресцент ного) излучения между нормальными тканями и очагами патологии при возбуждении в УФ и синей области спектра (N. Ramanujam, 2002; В.В. Тучин. 2007).
Метод АФД применим только для опухолей, локализующихся в поверхностных слоях (эпидермис кожи и поверхностный эпителий слизистой оболочки полых органов). Высокая чувствительность АФД показана в диагностике раннего рака гортани и бронхов, тяжелой дисплазии и раннего рака пищевода Барретта, ранних форм рака желудка, поверхностного рака мочевого пузыря и др. (В.В. Соколов и соавт., 2005; В.И. Чиссов и соавт. 2007; В.В. Соколов и соавт., 2008).
Целью данной работы было исследование спектров лазер-индуцированной аутофлуоресценции (АФ) слизистой оболочки полости рта в норме и при таких фоновых заболеваниях как плоский лишай и веррукозная лейкоплакия, а так-же оценка возможностей аутофлуоресцентной спектроскопии в выявлении предраковых заболеваний слизистой оболочки полости рта.
Материалы и методы
Измерения спектров лазер-индуцированной АФ было проведено у 10 пациентов с диагнозами: веррукозная лейкоплакия (3 пациента) и плоский лишай (эрозивно-язвенная форма) (7 пациентов, из них у 2-х - стадия ремиссии).
Данная установка включала в себя: волоконно-оптическое устройство доставки лазерного и сбора флуоресцентного излучения; спектрометр; персональный компьютер, специализированное программное обеспечение и лазер для возбуждения флуоресценции. В качестве устройства доставки излучения использовали волоконно-оптический катетер, специально разработанный для стоматологического применения. Для возбуждения аутофлуоресценции использовали диодный лазер с длиной волны генерации 407 нм (3 мВт с конца катетера). Спектральный диапазон измерений составлял 410 – 750 нм Измерения проводили in vivo при мягком контакте торца волоконно-оптического катетера и поверхности ткани.
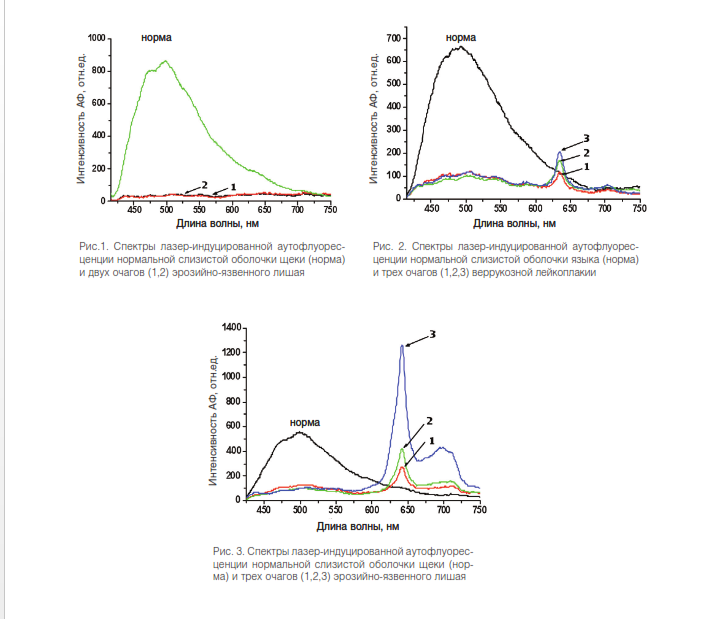
У каждого пациента были измерены спектры АФ из видимых патологических очагов и из симметричных участков без видимой патологии. В ходе исследования каждого пациента записывалось в среднем около 30 спектров. Результаты На рис. 1-3 представлены наиболее характерные примеры спектров, измеренных в нормальных и патологических очагах у 3 пациентов. Как можно видеть из представленных рисунков, спектры АФ излучения нормальной слизистой оболочки и патологических участков имеют ярко выраженные различия. В нормальной слизистой оболочке щеки и языка спектры АФ представлены широкой полосой излучения (420 – 750 нм) с максимумом в районе 500 нм без дополнительных максимумов в красной области (630-700 нм). В очагах веррукозной лейкоплакии и плоского лишая наблюдалось резкое падение (от 5 до 10 раз) интенсивности основной полосы АФ излучения.
Второй отличительной особенностью было присутствие в спектрах дополнительных пиков в красной области (600-700 нм) с максимумом на 635 нм, что однозначно свидетельствовало о наличии в очаге поражения эндогенных порфиринов. Достоверное и воспроизводимое падение интенсивности АФ в очаге патологии регистрировалось у 8 пациентов, у 2 пациентов в стадии ремиссии заболевания такого эффекта не наблюдалось. Что касается дополнительных пиков флуоресценции эндогенных порфиринов, то они регистрировались не во всех очагах поражения. Интенсивность этих пиков значительно варьировала (см. рис.1-3) как от пациента к пациенту, так и между разными пораженными участками у одного пациента.
У пациентов на стадии ремиссии заболевания пики в красной области не регистрировались. Обсуждение и выводы Полученные результаты носят предварительный характер в связи с малочисленностью обследованной группы. Однако они убедительно показывают наличие ярко выраженного контраста между спектрами АФ нормальной слизистой оболочкой полости рта и очагами патологии. Эндогенный контраст, который регистрируется при данном лазерном возбуждении (407 нм), включает различия как в интенсивности АФ излучения, так и в его спектральном составе. Резкое падение интенсивности в очагах веррукозной лейкоплакии и плоского лишая, которое мы наблюдали в данной работе, согласуется с данными мировой и отечественной литературы в области АФД предрака и ранних форм рака.
Как доказано во многих клинических исследованиях, эффект падения интенсивности АФ излучения наблюдается уже на ранних стадиях опухолевой трансформации слизистых оболочек дыхательных путей, ЖКТ, мочевого пузыря (В.И. Чиссов и соавт., 2003,2007; В.В. Соколов и соавт., 2005; В.В. Тучин, 2007; Н.Н.Булгакова и соавт. 2011).
Что касается различий в спектральном составе, которое мы наблюдали в данной работе, то они выражаются в появлении в спектрах АФ патологических очагов характерных полос флуоресценции эндогенных порфиринов различной степени выраженности. Необходимо отметить, что в спектрах АФ злокачественных опухолей флуоресценция эндогенных порфиринов появляется, главным образом, на поздних стадиях развития рака (Русаков и соавт., 2008; Дронова и соавт. 2008).
Полученные результаты подтвердили большой потенциал аутофлуоресцентной спектроскопии в выявлении предраковых заболеваний слизистой оболочки полости рта. Для разработки методики АФД для данной патологии требуется продолжение исследований и дальнейший набор клинического материала.
Источник: "Инновационная стоматология 1/2012"






Будущее за диагностикой: уникальный российский стоматоскоп АФС

Зубов Б.В.: В конце 1990-х произошел резкий скачок в технологиях создании лазерных диодов и сверхмощных светодиодов в спектральном диапазоне от 360 до 950 нм. Понимая огромный потенциал этого направления, особенно в медицинских приложениях, мы стали активно осваивать открывшиеся возможности. Было разработано множество новых аппаратов для фототерапии. Мы были одними из первых в нашей стране, кто создал и внедрил в клиническую практику аппарат на основе лазерных диодов с длиной волны 635 нм для фотодинамической терапии рака. Это был колоссальный прорыв в развитии этого метода, потому что наши лазеры не требовали водяного охлаждения, были компактными и удобными в использовании. Более того, мы первыми в нашей стране разработали и начали серийный выпуск световодов для фотодинамической терапии. Поэтому наши диодные лазеры были оснащены световодами для доставки лазерного излучения во все органы, доступные для эндоскопического применения: гортань, легкие, желудочно-кишечный тракт, мочевой пузырь, матка.
Так вот, уже достаточно давно, более 10 лет назад, мы показали, что наши светодиодные аппараты АФС прекрасно визуализируют экзогенную флуоресценцию всех клинически доступных фотосенсибилизаторов на тех тканях и органах, которые доступны для визуального осмотра. И, конечно, в первую очередь – кожа и полость рта. Поэтому наши аппараты АФС очень востребованы там, где работают с технологиями на основе фотосенсибилизаторов. Их охотно используют и стоматологи, и дерматологи, и гинекологи.
В последние годы сфера применения аппаратов АФС расширилась, наш аппарат стал активно использоваться для онкоскрининга в стоматологии. Этот проект, как отдельное направление нашей деятельности, стартовал в 2013 году по инициативе и под научным руководством нашей коллеги, руководителя научно-образовательного центра ИОФРАН, кандидата физико-математических наук Натальи Николаевны Булгаковой, одного из ведущих специалистов ИОФ РАН в области флуоресцентных методов диагностики.
– Расскажите, пожалуйста, как создалась эта новая ниша применения аппаратов АФС для онкоскрининга в стоматологии?

Булгакова Н.Н: Внедрение аппарата АФС для онкоскрининга стало результатом научного сотрудничества ИОФ РАН им. А. М. Прохорова и МГМСУ им. А. И. Евдокимова, которое началось в 2012 году по инициативе профессора доктора медицинских наук Евгения Алексеевича Волкова, одного из ведущих специалистов по заболеваниям слизистой оболочки полости рта. Базой для этого сотрудничества стал многолетний (с 1992 года) опыт в разработке аппаратуры и методов флуоресцентной диагностики рака, накопленный сотрудниками ИОФАН в результате интенсивного сотрудничества с ведущими медицинскими учреждениями Москвы и РФ и, прежде всего, с МНИОИ им. П. А. Герцена.
Помимо методов фотодинамической диагностики, в которых необходимо присутствие экзогенного фотосенсибилизатора, существует метод ранней диагностики рака, основанный на оптической визуализации эндогенного (или аутофлуоресцентного) свечения ткани, возникающего без введения флуоресцирующих маркеров. Этот метод, который получил название аутофлуоресцентной диагностики рака, показал очень высокую чувствительность в диагностике ранних форм эндобронхиального рака. Для оптической визуализации слизистой оболочки бронхов ведущие производители эндоскопической техники с начала 2000 годов выпускают аутофлуоресцентные бронхоскопы.
В 2013 году в МГМСУ им. А. И. Евдокимова была проведена апробация светодиодного аппарата АФС и аутофлуоресцентной стоматоскопии для выявления раковых и предраковых заболеваний. В заключении кафедры госпитальной терапевтической стоматологии, пародонтологии и гериатрической стоматологии было отмечено, что аппарат АФС может быть рекомендован для онкоскрининга предраковых заболеваний слизистой оболочки полости рта.
Почему он соответствует тем требованиям, которые необходимы для онкоскринига? Прежде всего, это неинвазивность и простота применения, очень короткое время обследования, высокая чувствительность к любым заболеваниям СОР, отсутствие расходных материалов. Проведение аутофлуоресцентной стоматоскопии с аппартом АФС позволяет выявлять патологические очаги, включая очаги воспаления, очаги предраковых заболеваний, а также проявлять онкологическую настороженность в случае выявления очагов, подозрительных на онкопатологию.
– Как работает данная технология?
– Насколько активно происходит внедрение аппарата АФС в широкую практику?
Что касается внедрения аппарата в широкую стоматологическую практику, особо хочется рассказать о Тульской области, где с легкой руки Максимовской Л. Н. аппарат АФС впервые был применен на первичном стоматологическом приеме еще в начале 2015 года. Главный врач Тульской областной стоматологической поликлиники кандидат медицинских наук Эрк А. А. крайне ответственно подошел к внедрению аутофлуоресцентной стоматоскопии для онкоскрининга населения. За 2015-2017 годы в рамках программы ОМС только в этом регионе осмотрены 215 460 человек, выявлены 107 злокачественных новообразований (более 50% из них на 1-2 стадиях), у 375 пациентов диагностированы предраковые заболевания, у 7708 пациентов – воспалительные заболевания пародонта.
– Какие стандарты качества применяются в вашей компании? Есть ли вся необходимая разрешительная документация?
Зубов Б.В.: Конечно, вся наша продукция имеет регистрационные удостоверения и декларации соответствия. У нас очень жесткий контроль качества. Проверяется каждый аппарат. Обязательно наличие серийного номера, даты сборки. Хотя, к чести сказать, аппарат сконструирован настолько логично, что сломать его будет очень тяжело, а срок службы составляет 50 000 часов.
– Есть ли зарубежные аналоги?
Зубов Б.В.: За рубежом есть светодиодные аппараты такого же назначения, они выпускаются в США и Канаде, но их стоимость превосходит во много раз стоимость стоматоскопа АФС. Кстати, ни один из этих аппаратов не зарегистрирован в РФ. Хочу отметить, что судя по данным зарубежной литературы и сайтам производителей, технология аутофлуоресцентной визуализация СОР крайне широко применяется за рубежом! Охват поражает воображение: более сотни миллионов человек были осмотрены в мире с помощью аналогичных светодиодных аппаратов за последнее десятилетие.
В России по нашим оценкам с помощью АФС пока осмотрены около 400 тысяч человек.
– Каковы ваши производственные возможности? Где можно купить аппарат?

Высокий уровень онкологических заболеваний рта, низкие цифры их активного выявления в стоматологических клиниках России приводят к недопустимо высоким показателям запущенности при диагностике новообразований визуальных локализаций. В поздних III-IV стадиях диагностируются 60, 7% опухолей полости рта, и как следствие, смертность в течение одного года данных пациентов составляет более 30%. Современные технологии онкоскриннинга и научные исследования подтверждают, что значительную часть населения можно спасти, если вооружить врачей-стоматологов и гигиенистов стоматологических аппаратом для аутофлуоресцентной стоматоскопии АФС.
В настоящее время показатели активного выявления злокачественных новообразований полости рта в России не соответствуют современным возможностям медицины и свидетельствуют о настоятельной необходимости совершенствования дальнейшей работы в этом направлении. В 2015 году доля активно выявленных больных со злокачественными новообразованиями рта составляла всего 14, 5%. Особая роль в выявлении данных заболеваний отводится врачу-стоматологу и гигиенисту стоматологическому. Тем более, что по данным современных исследований, микроорганизмы рта могут стать причиной возникновения онкологической патологии. У пациентов с низким уровнем гигиены рта определяются более высокие концентрации ацетальдегида (который входит в первую группу канцерогенов) в слюне, чем у пациентов, регулярно проводящих комплекс мероприятий индивидуальной и профессиональной гигиены рта. Поэтому контроль уровня гигиены рта и онкоскриннинг включены в Клинические рекомендации (протоколы лечения) при стоматологических заболеваниях и являются обязательными к выполнению в стоматологических организациях страны. В Программе государственных гарантий в системе обязательного медицинского страхования (ОМС) с целью активного выявления онкологических заболеваний и выполнения задач Государственной программы предусмотрена медицинская услуга – люминесцентная стоматоскопия.

Читайте также:

