Рак определяется до операции
Хирургический метод лечения злокачественных опухолей остается доминирующим, хотя его отдаленные результаты можно считать удовлетворительными лишь в I-II стадии заболевания, а в остальных — операция рассматривается как обязательный компонент специального лечения.
Совершенствование хирургической техники, достижения анестезиологии и реаниматологии, фармакологии и терапии позволили достичь значительного прогресса в хирургической онкологии и значительно уменьшить противопоказания к оперативному лечению.
И вместе с тем, опасность возникновения осложнений не должна заставлять забывать, что злокачественная опухоль есть заболевание с абсолютно смертельным исходом, а, значит, необходимо еще шире ставить показания к выполнению операций.
Так как многие онкологические операции обширны, функционально неблагоприятны (ампутация конечности, мастэктомия, экстирпация прямой кишки), то обязательным является морфологическое подтверждение наличия злокачественной опухоли до оперативного вмешательства.
Классификация хирургических вмешательств
Хирургическое вмешательство в зависимости от степени распространения опухолевого процесса, объема и характера операции может быть радикальным, паллиативным и симптоматическим (рис. 9.3).

Рис. 9.3. Виды оперативных вмешательств, применяемых в онкологии.
К ним относятся такие операции, при которых полностью удаляется опухоль и/ипи все видимые опухолевые очаги вместе с пораженным органом или его частью и зоной возможного регионарного метастазирования при отсутствии клинически диагностируемых отдаленных метастазов.
Вместе с тем, операции при III-IV стадии рака, даже если удалены все обнаруженные опухолевые очаги, относятся к условно-радикальным, требующим дополнительного химиолучевого воздействия.
Следует подчеркнуть, что оперативные вмешательства у онкологических больных существенно отличаются от общехирургических объемом удаляемых органов и тканей, обязательным удалением регионарых лимфоузлов (лимфодиссекция) и зачастую калечащими характером с выраженными функциональными нарушениями в послеоперационном периоде. В свою очередь радикальные операции подразделяются на ряд вариантов.
В хирургической онкологии для всех локализаций злокачественных опухолей разработаны стандартные хирургические операции, предусматривающие yдаление пораженного опухолью органа или его части одним блоком вместе с регионарным лимфатическим аппаратом.
То есть типовая операция — это тот оптимум удаляемых тканей, который необходим для достаточного, радикализма. Причем главным критерием стандартности является выполняемый объем лимфодиссекции, а не удаляемый объем пораженного органа. Типовые радикальные хирургические вмешательства выдержали испытание временем и являются основной базой для практикующих онкологов.
Стремление к максимальному радикализму, как правило, сопряжено с удалением большей части или всего пораженного органа, а также вовлеченных в процесс окружающих тканей и органов.
Поэтому в онкологии существует понятие комбинированной радикальной операции. К комбинированным хирургическим вмешательствам относятся такие операции, при которых удаляют как пораженный новообразованием орган, так и (полностью или частично) соседние органы, на которые распространилась опухоль.
Применение комбинированных операций оправдано в тех случаях, когда имеется только распространение опухоли на соседние анатомические структуры, но нет отдаленных метастазов. В настоящее время подобного типа операции совершенствуются и активно внедряются в клиническую практику.
Современное анестезиологическое обеспечение, достижения химиолучевого, иммуно- и гормонального, а также и других видов дополнительного лечения позволяют с успехом осуществлять эти обширные операции и получать отдаленные результаты лечения, достоверно лучшие, чем при консервативных методах терапии.
Расширенными называются такие операции, при которых в блок удаляемых тканей вынужденно (в связи с юкстарегионарным, метастазированием) или включают дополнительные (за пределами стандартных) группы лимфатических узлов.
Вследствие такого подхода границы резекции органа и главным образом — лимфодиссекции, оказываются значительно шире типичных схем. Расширенные операции, как правило, дополняются адъювантной противоопухолевой терапией.
На уровне современных знаний и достижений в онкологии, но главным образом в связи с развитием методов микрохирургической аутотрансплантации, предусматривающих немедленную, после удаления опухоли, пластическую реконструкцию органа с восстановлением его функции, создались реальные условия для разработки новых типов хирургических операций.
В связи с этим появилась возможность, в рамках улучшения качества и продолжительности жизни больных, использовать в онкологии органосохраняющие и функциональнощадящие операции, отвечающие всем необходимым требованиям онкологического радикализма с минимальным функциональным ущербом [В.И. Чиссов, 1999].
К ним относятся, например, органосохраняющие операции на молочной железе, конечностях и т.д. не только в ранних стадиях, но даже при местно-распространенном опухолевом процессе и рецидивах новообразований. Наиболее оправданы такие операции при облигатных предраковых заболеваниях, карциноме in situ и при I стадии рака некоторых локализаций.
Под эти термином понимают одновременное удаление (радикальное или паллиативное) опухолей различных локализаций, или выполнение онкологической операции в сочетании с операцией по поводу общего заболевания.
По мере повышения качества анестезиологического обеспечения, возможностей сопроводительного лечения и оснащенности современными сшивающими и другими аппаратами, в онкологии будет неуклонно увеличиваться тенденция к выполнению симультанных операций.
Паллиативные операции подразумевают удаление первичной опухоли в объеме радикального вмешательства при наличии отдаленных или неудалимых регионарных метастазов с целью продления жизни больного и улучшения ее качества. При технической доступности и небольших размерах одновременно могут быть удалены и одиночные метастазы.
Следовательно, паллиативные хирургические вмешательства не предполагают полную ликвидацию опухолевого процесса, в организме остаются определимые по локализации одиночные местно-регионарные опухолевые очаги или отдаленные метастазы, подлежащие затем специальной терапии.
Чаще всего показанием к паллиативной резекции служит угроза развития жизненно опасных или уже развившиеся осложнения. Так. например, при небольшом пилороантральном раке со стенозом, с метастазами в печени и лимфатических узлах за пределами регионарного лимфатического коллектора может оказаться более оправданным не наложение обходного гастроэнтероанастомоза, а резекция желудка.
В отдельных случаях при реальной угрозе развития жизненно опасных осложнений (например, перфорации или развитии профузного кровотечения из распадающейся опухоли полого органа и т.д.) также оправдана паллиативная резекция.
Безусловно, в этих ситуациях должно быть чувство меры. Выдающийся онколог Б.Е. Петерсон (1976) указывал, что важным условием выполнения онкологических операций должен быть их минимальный риск.
К паллиативным операциям можно отнести также операции, выполняемые в плане комплексного лечения генерализованных форм гормонозависимых форм рака (например, овариэктомия, адреналэктомия, орхиэктомия). Операции такого рода позволяют приостановить рост, а во многих случаях добиться полного регресса очагов опухоли, восстановить трудоспособность и продлить жизнь больных на многие годы.
Циторедуктивные операции, как разновидность паллиативных операций, рассчитанные в последующем на применение дополнительных методов лечения, показаны при диссеминированных опухолях, чувствительных к лучевым и/или лекарственным методам лечения.
Такие операции оказались, в частности, вполне оправданными при раке яичников, семиноме яичка, распадающейся опухоли молочной железы, ниэкодифференцированных местно-распространенных, рецидивных и метастатических формах сарком мягких тканей, колоректальном раке и др.
В последние годы показания к циторедуктивным хирургическим вмешательствам расширяются, так как существенно возросли возможности дополнительных методов противоопухолевой терапии.
Симптоматические операции производятся чаще всего в неотложном и экстренном порядке и никакого вмешательства по ликвидации опухоли не предусматривают.
Они выполняются для восстановления жизненно важных функций организма (дыхания, кровообращения, питания, отведения содержимого тонкой, толстой кишок, желчных путей), нарушения которых обусловлены отдаленными метастазами или прорастанием опухоли (трахеостомия, гастростомия, гастроэнтеростомия, билиодигестивные анастомозы, наружные кишечные свищи, перевязка сосудов при кровотечениях и т.д.).
Симптоматические операции не продлевают продолжительность жизни, но улучшают ее качество.
Диагностические операции (типа лапаротомий, торакотомий) весьма распространены в онкологии. Они показаны, как заключительный этап диагностики, в случаях, когда исчерпаны все возможности уточнить диагноз иным путем, а также в целях получения материала для морфологической верификации диагноза.
Они также позволяют осуществить полноценную ревизию и наиболее объективно обосновать отказ от радикальной операции или перевести диагностическое вмешательство в лечебную хирургическую операцию.
В ходе диагностических оперативных вмешательств могут быть также решены вопросы целесообразности лекарственной и/или лучевой терапии при отказе от радикальной операции и обозначены клипированием границы полей облучения.
Цель таких операций — полное удаление остаточной опухоли после химиотерапии или лучевого лечения, когда во время первой операции опухоль была неоперабельной или удалена частично.
Second-look операции могут также применяться и как средство контроля эффективности проведенной противоопухолевой лечебной программы и при необходимости — ее коррекции.
Онкологические операции, как правило, являются достаточно травматичными, часто приводят к нарушению функции органов, сопровождаются существенными косметическими дефектами, чем значительно ухудшают качество жизни таких пациентов.
В последние годы, по мере улучшения результатов противорецидивного и противометастатического лечения, появились реальные предпосылки для выполнения в плане осуществления реабилитационной программы в широком смысле так называемых реабилитационных операций. Эти вмешательства направлены на максимальную социальную, психологическую, а подчас и трудовую адаптацию онкологических больных.
Разумеется, эти понятия условны и в каждом конкретном случае требуют индивидуального подхода, глубокого анализа и коллегиального решения.
Операбельность и резектабельность
Операбельность — это возможность выполнения вообще хирургического вмешательства конкретному больному. Операбельным или неоперабельным является пациент, а не опухоль. Оценка операбельности (неоперабельности) — это, по сути, решение вопроса о показаниях (противопоказаниях) к операции.
Операбельность как термин, основывается на распространенности опухоли и функциональном состоянии органов и систем организма конкретного больного.
Различают следующие виды операбельности: техническая — возможность удаления опухоли по условиям ее местного распространения; онкологическая — определяется отсутствием отдаленных метастазов; функциональная — определяется состоянием сердечно-сосудистой, дыхательной систем организма, степенью метаболических расстройств.
В качестве показателя операбельность имеет также определенное значение и в оценке работы онкохирургических стационаров. Если рассчитать отношение (в %) количества оперированных больных к общему числу поступивших в данный стационар, то можно получить достаточно объективную характеристику его работы (в целом и по отдельным, нозологическим формам рака).
Очевидно, что чем выше показатель операбельности, тем выше хирургическая активность, тем выше уровень догоспитального обследования и, вероятно, уровень профессиональной подготовки сотрудников.
В тоже время, высокий уровень операбельности при низкой резектабельности свидетельствует о неоправданном расширении показаний к оперативному лечению и/или низком уровне дооперационного обследования, а возможно — и квалификации хирургов.
Резектабельность — это наличие технической возможности радикального или паллиативного удаления опухоли, что зависит от стадии процесса и общего состояния больного. Невозможность выполнить хирургическое вмешательство, выявляемая во время операции, должна быть подтверждена морфологическим (цитологическим или гистологическим) исследованием.
В тоже время, отношение (в %) числа радикально оперированных больных к общему числу оперированных больных с данным видом опухоли также может характеризовать работу конкретного хирургического онкологического стационара.
В заключение необходимо указать, что хирургические вмешательства при распространенных формах новообразований иногда трудно уложить в какую-либо определенную схему, так как невозможно в каждом конкретном случае предугадать особенности складывающейся клинической и жизненной ситуации.
В связи с этим перед хирургом возникает задача как можно правильнее оценить общее состояние больного, распространенность опухоли, характер ее роста, возможные интра- и послеоперационные осложнения с тем, чтобы избрать наиболее рациональный план и вид хирургического пособия.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
При всех злокачественных опухолях применяются универсальные принципы стадирования, но при каждом типе рака они имеют определенные нюансы. Правильное определение стадии опухоли — одна из первостепенных задач, которая стоит перед онкологом на этапе обследования пациента.
Для чего нужно определять стадию рака?
Определение стадии злокачественной опухоли помогает решать важные задачи:
Стадии злокачественных опухолей TNM
TNM — основная система классификации стадий раковых заболеваний, она была разработана еще в середине прошлого столетия. Последняя, седьмая редакция Классификации TNM была принята в 2009 году. Она останется неизменной до тех пор, пока не накопятся новые технологии диагностики и лечения рака, из-за которых ее придется пересмотреть.
В классификации TNM учитываются три основные характеристики злокачественных опухолей, они соответствуют буквам аббревиатуры:
- T — tumor — характеристики первичной опухоли.
- N — nodus — распространение опухолевых клеток в регионарные лимфатические узлы.
- M — metastasis — наличие отдаленных метастазов.
В зависимости от характеристик конкретной злокачественной опухоли, при определении стадии к каждой букве приписывают цифру или специальное обозначение:
Характеристики первичной опухоли (T)
Если нужно уточнить стадию, к цифре дополнительно добавляют букву. Например, M1a при немелкоклеточном раке легкого означает, что опухолевые клетки распространились во второе легкое, либо присутствуют в плевральном выпоте (жидкости вокруг легких), либо в перикардиальном выпоте (жидкости вокруг сердца).
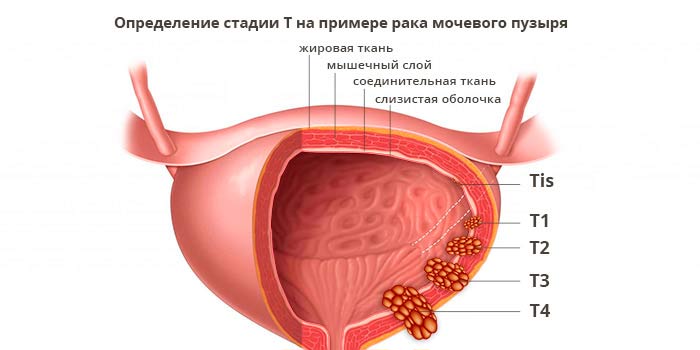
Иногда перед аббревиатурой TNM ставят букву, которая обозначает, каким образом был установлен диагноз:
- p — стадия рака была диагностирована патологоанатомами, после того как опухоль была удалена и оценена под микроскопом;
- c — клинический диагноз, установленный до проведения биопсии по данным обследования.
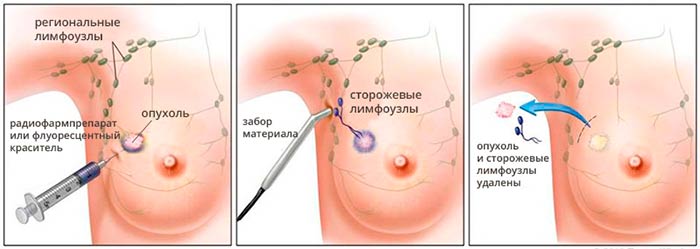
Оценивая результаты сентинель-биопсии, врачи применяют следующие обозначения:
- pNX(sn) — сторожевой лимфоузел не удалось оценить;
- pN0(sn) — в сторожевом лимфоузле не обнаружено метастазов;
- pN1(sn) — в сторожевом лимфоузле обнаружен метастаз.
Другие системы определений стадий опухолевого процесса
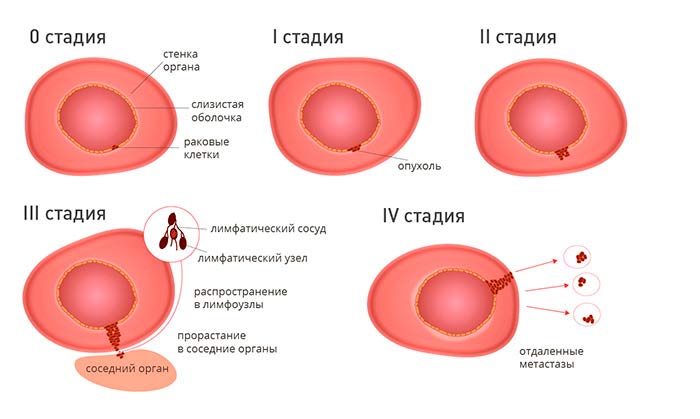
Врачи-онкологи часто используют упрощенную классификацию по стадиям злокачественных опухолевых образований. Она опирается на систему TNM, но в ней выделяют всего пять стадий, которые обозначаются римскими цифрами:
Под микроскопом раковые клетки отличаются от нормальных, и степень этого различия говорит о том, насколько агрессивно они себя ведут. В свою очередь, от этого зависит успешность лечения, вероятность рецидива, прогноз для пациента. Поэтому, наряду с общепринятой классификацией по стадиям, выделяют степени злокачественности рака. Их обозначают буквой G, к которой приписывают соответствующие индексы:
- GX — степень злокачественности онкологического заболевания не удалось оценить.
- G1 — высокодифференцированные опухоли. Опухолевая ткань сильно похожа на нормальную. Такой рак ведет себя наименее агрессивно, редко метастазирует. Прогноз для пациента наиболее благоприятный.
- G2 — умеренно дифференцированная опухоль. Раковые клетки уже довольно сильно отличаются от нормальных и ведут себя более агрессивно.
- G3 и G4 — низкодифференцированные и недифференцированные опухоли. Они отличаются наибольшей степенью злокачественности, ведут себя очень агрессивно, плохо реагируют на лечение.
Для того чтобы оценить, насколько успешно прошло хирургическое лечение рака, иногда онкологи используют специальную постоперационную классификацию:
- RX — сложно проверить, осталась ли опухолевая ткань в организме пациента после хирургического лечения.
- R0 — опухоль в организме пациента после операции отсутствует.
- R1 — обнаружена остаточная опухоль по данным микроскопического исследования.
- R2 — оставшаяся опухоль настолько большая, что обнаруживается при осмотре, без микроскопии.
Некоторые онкологические заболевания не укладываются в рамки общепринятой системы TNM:
- Опухоли у детей — это отдельная категория онкологических заболеваний. Они сильно отличаются от злокачественных опухолей, которые обнаруживаются у взрослых. Для них разработаны специальные системы классификаций, мы не будем их рассматривать в этой статье.
- Рак крови. Такие онкологические заболевания, как лимфома, лейкемия, множественная миелома не могут быть описаны системой TNM, потому что при них чаще всего нет солидной (плотной) опухоли с определенной локализацией. В каждом случае применяется своя специфическая классификация по стадиям.
- Опухоли нервной системы обычно не распространяются за пределы головного и спинного мозга. В настоящее время для них нет единой общепринятой классификации. Чаще всего, определяя стадию при таких онкологических заболеваниях, врачи используют только букву T.
Как определяют стадию онкологического заболевания?
В онкологии применяется много разных методов диагностики. Они обладают разной информативностью, позволяют установить диагноз с разной степенью точности. Соответственно, определить стадию можно тоже разными способами, с разной степенью достоверности. Для этого применяют специальные обозначения:
- C1 — стадия рака определена с помощью стандартных диагностических процедур — осмотра пациента врачом, рентгенографии, эндоскопического исследования. Это наименее точный метод.
- C2 — диагноз установлен на основании специальных, более точных методов диагностики: компьютерной томографии, МРТ, ПЭТ-сканирования, специальных разновидностей рентгенографии, эндосонографии, биопсии и др.
- C3 — выполнено диагностическое хирургическое вмешательство, получен фрагмент патологически измененной ткани, проведено цитологическое и гистологическое исследование.
- C4 — стадия опухоли установлена после полноценного хирургического вмешательства и исследования удаленной опухоли.
Важно понимать: стадия рака не меняется в процессе лечения
Стадию заболевания при раке устанавливают на момент первичного обследования — то есть сразу после того, как диагностировано онкологическое заболевание. Даже если в будущем опухоль уменьшится или, напротив, будет прогрессировать, стадия не изменится. Это важно понимать. Выживаемость и прогноз рассчитываются именно по стадии, которая диагностирована изначально.
Как быстро развивается рак?
За сколько времени рак переходит в 4 стадию? Здесь сроки тоже сильно различаются. Это зависит от агрессивности опухоли, от того, насколько рано больной обратился к врачу, какое проводилось лечение. Например, есть меланома, которая метастазирует очень быстро, а есть базальноклеточный рак кожи — он очень редко дает метастазы.
В онкологии есть такой показатель — время удвоения объема опухоли. Исследования показали, что масса быстрорастущих опухолей легких увеличивается вдвое примерно за 223 дня, а медленнорастущих — за 545 дней. Для аденокарцином этот срок составляет в среднем 303 дня, для плоскоклеточного рака — 77 дней, мелкоклеточного рака легких — 70.
Для того чтобы узнать, за какое время опухоль достигнет объема 1 см3, нужно время удвоения объема умножить на 30. Нехитрые расчеты показывают, что зачастую на это уходят годы.
На какой стадии можно излечиться от рака?
Вероятность ремиссии наиболее высока при стадиях рака 0 и I. Пятилетняя выживаемость таких пациентов приближается к 100%. При II стадии прогноз серьезнее, но у многих пациентов все еще можно добиться ремиссии. При III стадии некоторых больных все еще можно вылечить, остальным показано паллиативное лечение, которое помогает затормозить прогрессирование рака, справиться с мучительными симптомами, продлить жизнь. На IV стадии ремиссия возможна лишь в крайне редких случаях, ее вероятность ничтожно мала. У таких пациентов в основном проводится паллиативное лечение.
Конечно же, это очень обобщенные данные. Всегда нужно говорить не о раке в целом, а о его конкретных типах. Потому что рак бывает разным.

Рецензент материала
Профессор Капранов С.А. — Доктор медицинских наук, дважды Лауреат Государственных Премий Правительства Российской Федерации в области науки и техники, Лауреат Премии Ленинского Комсомола, автор более 350 научных работ по медицине, 7 монографий, и 10 патентов на изобретения по медицине, за 30 лет личного опыта провел более чем 10 000 различных эндоваскулярных операций
В современной онкомедицине активно используют химиотерапию при раке различных форм (в целях лечения или приостановления развития опухолей). Этот метод является комплексным применением медикаментов, преимущественно направленных на уничтожение или блокировку активного размножения раковых клеток. Используются специализированные препараты и при раке молочной железы (РМЖ).
Химиотерапию не применяют как индивидуальную форму воздействия на раковые образования. Чаще всего с её помощью подготавливают опухоли перед операцией, воздействуя на образования комплексом медикаментозных средств, в числе которых, помимо химиотерапевтических, могут применяться, как минимум, гормональные. Далее в статье будет рассказано об особенностях проведения химиотерапии при раке молочной железы на различных стадиях развития заболевания любой формы.
Назначение курса химиотерапии
Пациента, страдающего раком груди, должен осматривать квалифицированный специалист, способный дать грамотное назначение. Химиотерапию при раке молочной железы назначают на основании следующих особенностей заболевания:
- Распространенность опухоли на момент выявления. Важны размерные параметры новообразования в пределах молочной железы и число раковых лимфоузлов в подмышечной части. Исследованием определяется, метастазировала ли опухоль по организму за пределами груди.
- Клеточная гормональная чувствительность образования. Вычисляется доля рецепторов, усваивающих гормоны для клеток (положительный уровень – от 1%).
- Устойчивость рака груди к медикаментозному воздействию. Чрезмерное содержание гена HER2 указывает на гиперэкспрессию, а недостаточное – амплификацию.
Важно! Если рецепторы гормонов в клетках отсутствуют, то положительного результата ждать не приходится, – следует приступать к химиотерапии рака с предварительным подбором оптимального набора препаратов.
Разновидности рака молочной железы
В современной онкомедицине выделяют следующие биотипы рака молочной железы.
- Люминальный – с достаточным содержанием гормональных рецепторов в клеточной структуре образования.
Люминальный тип может быть двух видов:
Высокое содержание ПР свидетельствует о повышенной чувствительности ЭР, а отсутствие определяемого HER2 указывает на то, что бороться с раком молочной железы посредством медикаментов можно и нужно.
- Базальный – отсутствуют рецепторы и HER2, а потому гормональные средства на новообразование в груди не воздействуют. В таком случае однозначно следует приступать к медикаментозной химиотерапии рака, в частности, к использованию цитостатиков (наиболее известная форма антираковых медикаментов).
- Нелюминальный – не имея рецепторов гормонов, он устойчив к лекарственным препаратам за счет содержания HER2. Применение химиотерапии при раке молочной железы данного типа предполагает дополнительное использование веществ, подавляющих ген HER2.
Таким образом, задача специалиста заключается в том, чтобы определить, какое лечение будет актуальным для блокировки или полного удаления образования в грудной железе посредством операции.
Выбор между курсами гормональных и химиотерапевтических препаратов
При раке молочной железы лекарственная терапия назначается в следующих ситуациях:
- на любой стадии развития рака молочной железы, кроме начальной, что позволяет снизить риск рецидива после проведения операции (адъювантные препараты);
- при серьезных поражениях молочной железы с целью уменьшения размеров образования, выявления устойчивости к конкретным действующим веществам, а также для устранения необходимости приёма профилактического курса после операции.
Неоперабельные стадии развития рака молочной железы не предполагают каких-либо альтернативных курсов – используют химиотерапию с постоянным перебором возможных медикаментозных наборов.
Фактически лечение посредством химиотерапевтического курса осуществляется при агрессивно протекающем раке молочной железы, устойчивом к гормональным препаратам. Формально 1% содержания ЭР и ПР достаточно, но надеяться на эффективность эндокринной системы не стоит.
Для лечения нелюминального и базального рака молочной железы используют исключительно химиотерапию. Также она может быть альтернативным методом лечения при люминальном раке молочной железы типа B (назначается по ряду дополнительных исследований злокачественного образования).
Адъювантная химиотерапия рака молочной железы
Практически всегда химиотерапию при раке молочной железистой ткани начинают с курса цитостатиков. Причем химиотерапию с использованием этих веществ не сочетают с гормональными препаратами, поскольку те, в свою очередь, могут понижать уровень чувствительности клеточной структуры молочной железы к медикаментам. Также по завершению химиотерапии рака молочной железы процесс лечения может быть дополнен лучевой терапией.
Начинают химиотерапию спустя 3-4 недели после операционного вмешательства (или раньше при положительном ходе восстановления). Нельзя начинать лечение позднее, т.к. при раке молочной железы возможен рецидив. Если химиотерапию при раке молочной железы проводят с применением HER2 подавляющих веществ, то их применяют 17 раз за год (каждые три недели). Комплекс назначаемых химиотерапевтических средств не зависит от биотипа рака молочной железы.
Важно! Комбинация медикаментов, используемых в лечении, подбирается по принципу наибольшей эффективности. Возникновение побочных эффектов неизбежно, а потому специалисты химиотерапию могут дополнять различными подготовительными и сопроводительными препаратами.
Как и когда проводят предоперационную химиотерапию
Дооперационную химиотерапию при раке молочной железистой ткани проводят во всех случаях, когда хирургическое вмешательство неизбежно. Исключением являются I стадия заболевания и IV неоперабельный этап (операционные методы недоступны даже после химиотерапии метастатического рака молочной железистой ткани).
Польза от химиотерапевтического лечения различных форм рака молочной железы:
- Выявление реального уровня чувствительности клеточной структуры образования железы к препаратам. Можно определить эффективную химиотерапию перед послеоперационным профилактическим этапом, подобрав оптимальные медикаменты.
- Если же новообразование регрессирует, то можно заменить мастэктомию хирургическими методами, сохраняющими молочную железу.
Не используют химиотерапию при раке молочной железистой ткани люминального биотипа. В остальных случаях есть шанс не только уменьшения, но и полного исчезновения образования из молочной железы. Количество введения выбранных препаратов определяется специалистом (возможно разделение лечения на этапы до и после операционного вмешательства).
Лечение при сложных формах образований в молочной железе
Злокачественные образования в молочной железе могут переходить в сложноизлечимые формы, в частности, III стадию (неоперабельная, но без метастазирования), IV стадию (неоперабельная метастазирующая) и распространенный вариант (рецидивный).
- На III стадии используются все доступные методы лечения. Ту же химиотерапию применяют с целью – уменьшить размер образования. Впоследствии можно будет выполнить операционную процедуру по удалению. Чтобы лечение возымело нужный эффект, медикаментозные средства комбинируются в различных вариациях при отсутствии должного результата.
- Распространённая онкология молочной железы допускает рецидив из операционного рубца или вследствие метастазирования. Естественно, при невозможности полноценного лечения или удаления распространившейся по организму болезни, назначают химиотерапию, максимально облегчающую состояние и продлевающую жизнь пациента.
- Химиотерапию в случае неоперабельных форм заболевания ориентируют не на лечение, а больше на стабилизацию состояния больного. Постоянная смена медикаментозных комбинаций позволяет определиться с наиболее подходящим вариантом.
Назначать и контролировать химиотерапию при раке молочной железы должен только профильный специалист. Желательно заниматься лечением под пристальным вниманием медперсонала, соблюдая все режимные и медицинские рекомендации.
Особенности лечения в Центре эндоваскулярной хирургии
Обращаясь к услугам медицинского Центра профессора Капранова, вы гарантированно получите полную информацию о злокачественном образовании в области молочной железы. Опытнейшие специалисты проведут необходимые исследования, чтобы получить максимум данных о заболевании:
- стадия развития опухоли молочной железы;
- степень распространенности (если метастазирует);
- имеется ли возможность применить химиотерапию при раке молочной железы в такой форме для последующего оперативного воздействия и т.д.
Внимательно изучите все разделы нашего сайта, чтобы получить не только контактные сведения, но и понимание того, как именно мы справляемся с лечебным процессом, борясь с тем или иным заболеванием. В частности, прочитайте про направления онкомедицины, реализованные на базе Центра. Техническая база и кадровый состав Центра находятся на достаточном уровне, чтобы провести химиотерапию при раке молочной железы.
Пациентам будут предложены самые современные средства борьбы со злокачественными новообразованиями, в частности, теми, которые локализованы в пределах молочной железы. Читайте отзывы других пациентов Центра, чтобы удостовериться в нашей компетентности и ответственности, а также в технических возможностях учреждения.
Всем обратившимся гарантировано индивидуальное обслуживание, конкурентные расценки и выгодные условия сотрудничества. Мы стараемся сделать всё возможное, чтобы спасти или облегчить жизнь, независимо от текущей стадии заболевания. Более подробный отчет о каждой форме заболевания вы получите от медицинских работников Центра. Записывайтесь на обследование уже сегодня. Будьте здоровы!
Основные направления деятельности центра эндоваскулярной хирургии а также другие популярные материалы:
ЭМА при лечении миомы матки
Где проводят операцию ЭМА в Москве
Проведение эмболизации аденомы
Читайте также:

