Приступы эпилепсии после удаления опухоли головного мозга




Статьи → Тактика ведения пациентов с впервые возникшими эпилептическими приступами в раннем периоде после удаления опухолей больших полушарий: два наблюдения и обзор литературы
Очевидно, что необоснованное назначение противосудорожной терапии значительно снижает качество жизни пациента. Если же впервые развившийся после операции эпилептический приступ является проявлением симптоматической эпилепсии, то отсутствие терапии приведет к развитию осложнений и ухудшит прогноз [2, 3]. Помощь в принятии решения может оказать видеоэлектроэнцефалографический мониторинг (видео-ЭЭГ-мониторинг).
Мы представляем два клинических наблюдения, в которых видео-ЭЭГ-мониторинг повлиял на выбор тактики дальнейшего ведения больных.
Наблюдение 1. У пациентки 70 лет за 2 мес до госпитализации появилась и стала нарастать слабость в левых конечностях, ухудшилась память на текущие события, снизилась критика собственного состояния. При магнитно-резонансной томографии (МРТ) была диагностирована внутримозговая опухоль правой височной доли с зоной перифокального отека (рис. 1).
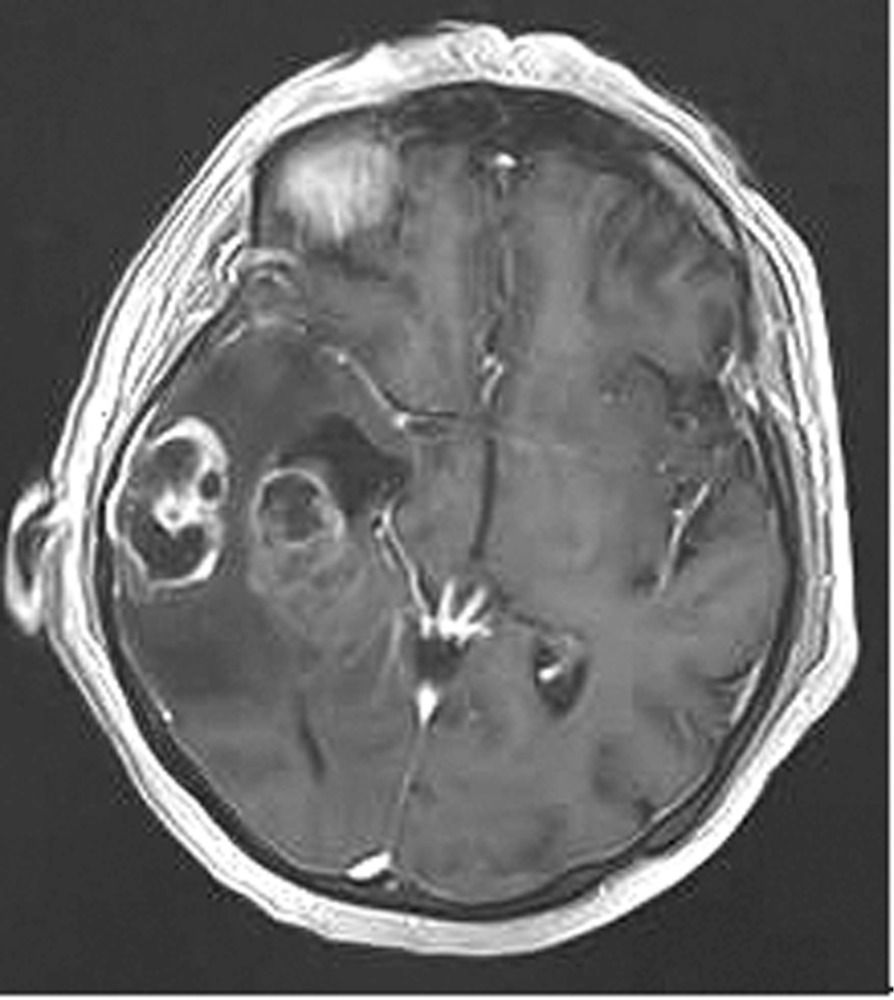
Рис. 1. Наблюдение 1. МРТ перед операцией. Внутримозговая опухоль правой височной доли с зоной перифокального отека. Опухоль, оказавшаяся при гистологическом исследовании глиобластомой (Grade IV), удалена 02.02.16. После операции пациентка была переведена в палату пробуждения отделения реанимации, где спустя 4,5 ч (через 2 ч после экстубации) развился вторичный генерализованный судорожный приступ продолжительностью около 2 мин. Приступ был купирован внутривенным болюсным введением диазепама 10 мг и вальпроевой кислоты (конвулекс) 500 мг. Экстренное КТ-исследование выявило послеоперационные изменения правой височной доли и отсутствие хирургических осложнений (рис. 2).
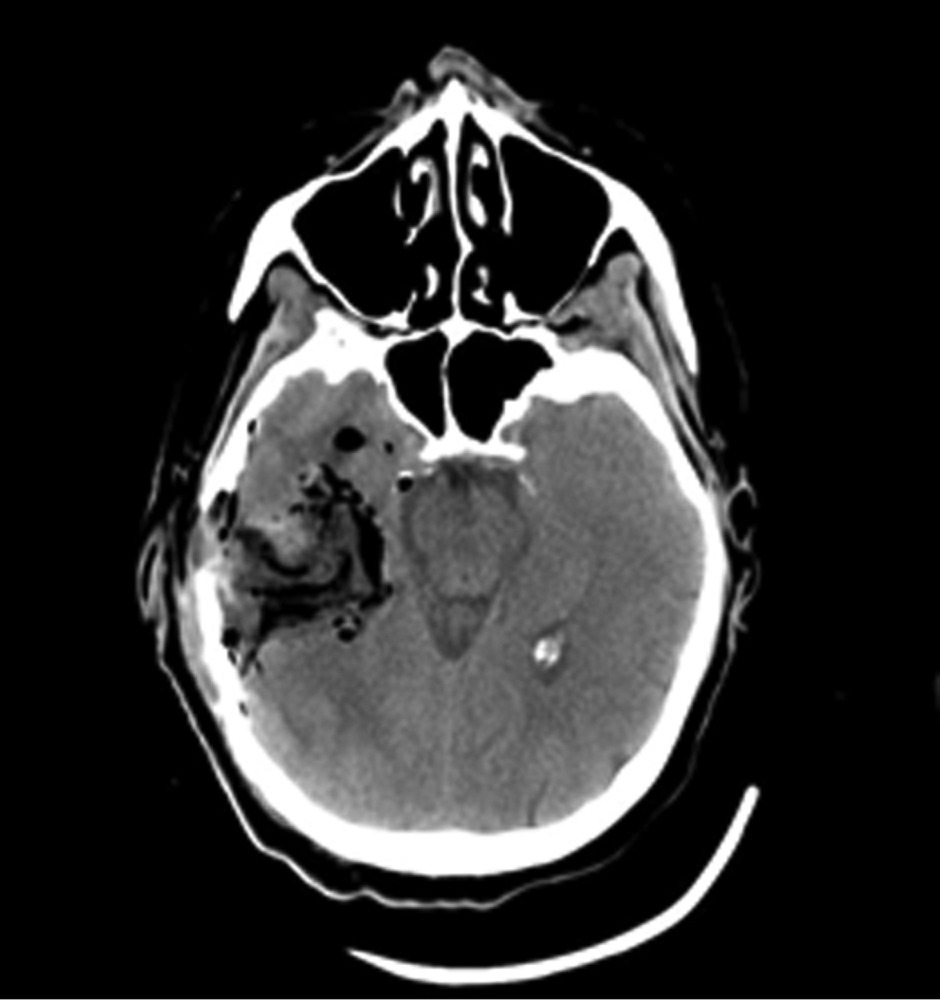
Рис. 2. Наблюдение 1. СКТ в 1-е сутки после удаления опухоли правой височной доли. Выявлены послеоперационные изменения в зоне хирургического вмешательства. Пациентке в 1-е сутки после операции проводился видео-ЭЭГ-мониторинг, где на фоне дезорганизации коркового ритма было выявлено замедление биопотенциалов в правой лобно-височной области (рис. 3). За следующие 13 ч записи было зарегистрировано 7 электроэнцефалографических паттернов длительностью от 2 до 4 мин, сопровождающихся появлением эпилептиформных потенциалов в виде комплексов острая—медленная волна в правой лобно-центрально-височной области (рис. 4). Шесть из семи эпизодов не проявлялись клинически. В 1 случае пароксизмальная симптоматика проявилась кратковременным (около 5 с) тоническим напряжением мышц шеи и поворотом головы вправо.
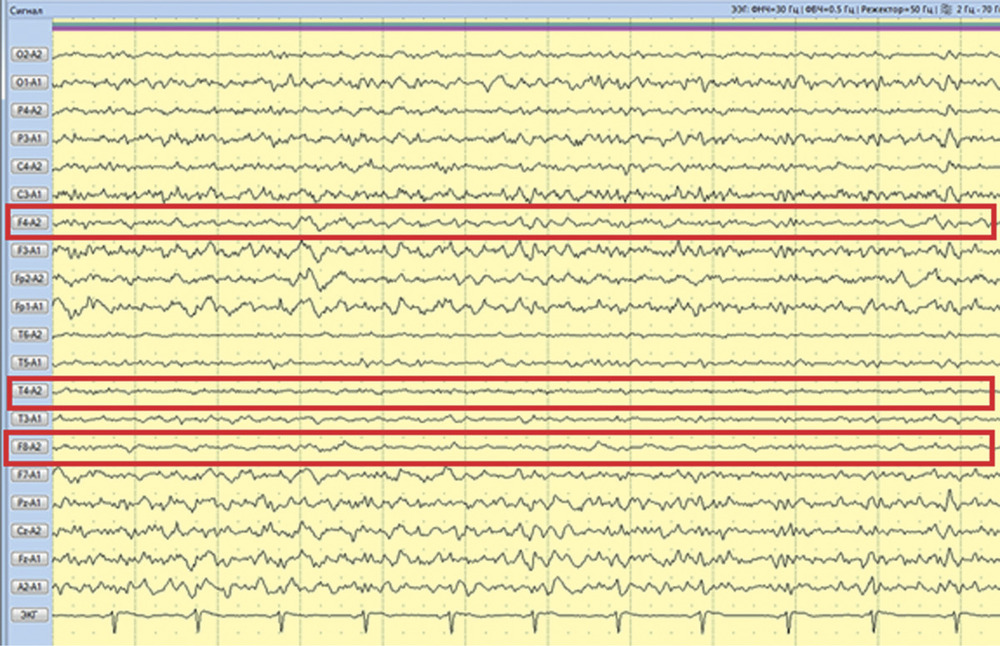
Рис. 3. Наблюдение 1. Фрагмент 13-часового ЭЭГ-мониторинга. Диффузное снижение амплитуды биопотенциалов мозга. Замедление в правой лобно-височной области на дезорганизованном фоне. Типичная эпилептиформная активность не регистрируется.
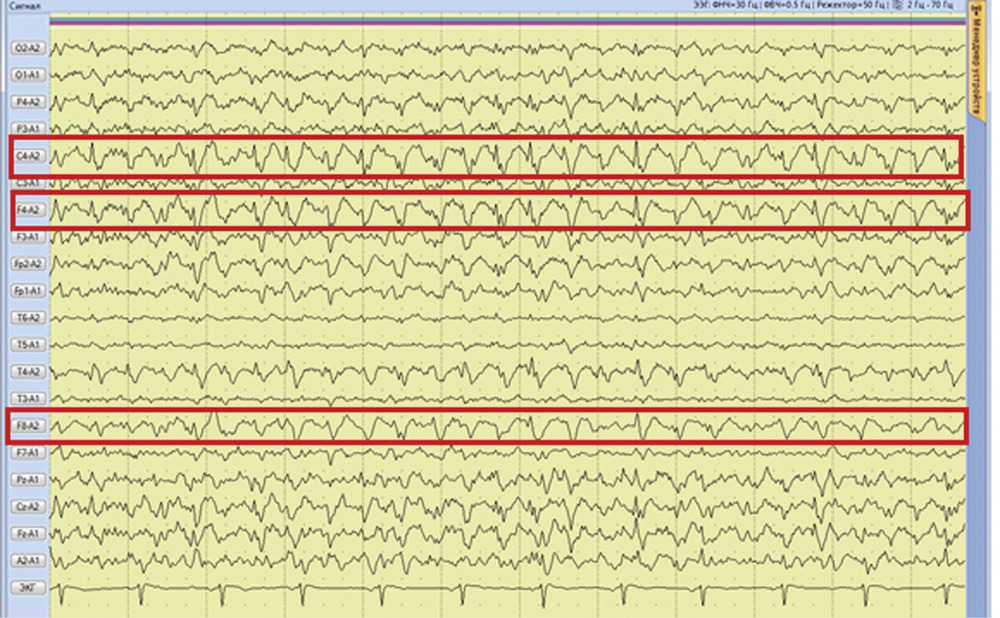
Рис. 4. Наблюдение 1. Фрагмент 13-часового ЭЭГ-мониторинга. Эпилептиформные потенциалы в виде комплексов острая—медленная волна в правой лобно-центрально-височной области. Учитывая данные видео-ЭЭГ-мониторинга, пациентке была назначена противосудорожная терапия в виде внутривенного введения вальпроевой кислоты (конвулекс) через перфузор в дозе 1500 мг/сут. На 2-е сутки после операции эпилептиформная активность на ЭЭГ прекратилась, больная переведена в клиническое отделение, где была продолжена противосудорожная терапия вальпроевой кислотой (конвулекс) в таблетированной форме в дозе 2000 мг/сут. Через 11 дней после операции пациентка в удовлетворительном состоянии выписана из клиники с рекомендацией продолжить прием 1500 мг/сут вальпроевой кислоты под контролем ЭЭГ и концентрации препарата в плазме крови.
Наблюдение 2. Пациентка 64 лет за 10 мес до настоящей госпитализации была оперирована и проходила комбинированное лечение по поводу глиобластомы (Grade IV) левой лобной доли. В течение всего срока заболевания приступов с нарушением сознания или иных пароксизмальных состояний не наблюдалось. Противосудорожную терапию не получала. При контрольной МРТ за 3 нед до госпитализации выявлено увеличение размеров опухоли. Принято решение о повторном хирургическом вмешательстве. После операции 14.03.16 пациентка была переведена в палату пробуждения, где спустя 1,5 ч на фоне выхода из наркозного сна развился вторичный генерализованный судорожный приступ, который самостоятельно купировался в течение 1 мин. Проведенное КТ-исследование выявило послеоперационные изменения и отсутствие хирургических осложнений (рис. 5). В ходе суточного видео-ЭЭГ-мониторинга были выявлены диффузные изменения биопотенциалов в виде умеренновыраженной дезорганизации корковой активности, при отсутствии типичных эпилептиформных потенциалов (рис. 6). Было принято решение не назначать больной противосудорожную терапию и оставить ее на сутки под наблюдением в отделении реанимации. Клинических приступов или иных пароксизмальных проявлений не отмечено, при видео-ЭЭГ-мониторинге эпилептиформная активность не зафиксирована. После перевода в клиническое отделение приступов также не наблюдалось. Спустя 8 дней после операции пациентка в удовлетворительном состоянии выписана для продолжения химиотерапии по месту жительства.
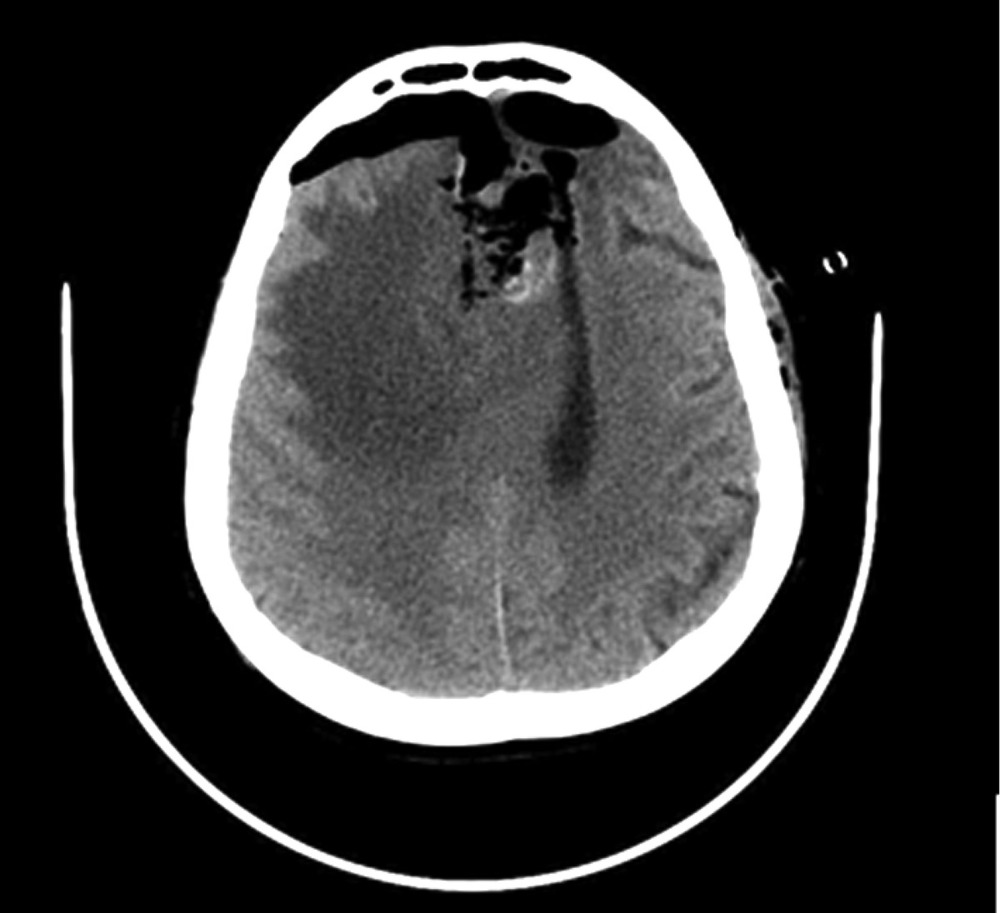
Рис. 5. Наблюдение 2. СКТ в 1-е часы после удаления опухоли левой лобной доли. Послеоперационные изменения с зоной перифокального отека, скопления воздуха и небольшой зоной имбибиции кровью в области операции.
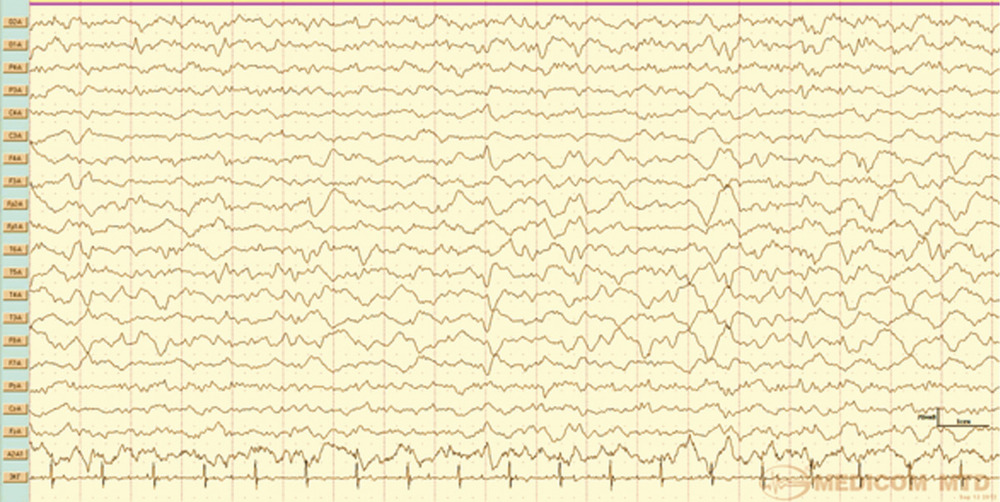
Рис. 6. Наблюдение 2. Фрагмент ЭЭГ-мониторинга. Умеренновыраженный дезорганизованный фон, с преобладанием медленных форм активности и острых потенциалов в лобно-передневисочной области, больше справа. Обсуждение Впервые возникшие эпилептические приступы (de novo) в зависимости от срока их развития после операции разделяют на ранние (acute postoperative seizures) и поздние [6, 7]. К ранним приступам как правило, относят те, которые возникают в течение 48 ч после операции, но ряд авторов считают, что к ранним эпилептическим приступам следует относить все приступы, возникающие в 1-ю неделю после операции [8].
Частота ранних впервые возникших приступов после удаления опухоли мозга варьирует в разных сериях наблюдений от 4,3 до 23,6% [7, 9] и зависит от локализации, гистологического диагноза, удаленного объема, выраженности отека, геморрагической имбибиции мозга, пневмоцефалии и наличия осложнений [6, 9]. В среднем считается, что вероятность возникновения эпилептических приступов после удаления полушарной опухоли составляет 5—10% [7, 9].
Патогенез впервые возникших в раннем после-операционном периоде эпилептических приступов окончательно не установлен. Одним из механизмов может быть раздражение коры мозга компонентами крови и продуктами распада гемоглобина. Возможно также, что накапливающиеся в очаге повреждения перекисные соединения снижают концентрацию гамма-аминомасляной кислоты, которая ингибирует нейрональную активность коры и таламуса [6]. Наконец, в ишемизированной перитуморозной ткани мозга за счет снижения синтетаз АТФ нарушается трансмембранный транспорт воды и ионов, что приводит к изменению потенциала клеточной мембраны [11]. В любом случае патогенез впервые возникших ранних послеоперационных приступов обусловлен механизмами, действие которых, как правило, прекращается в раннем послеоперационном периоде. Соответственно такие приступы, особенно единичные, не дают оснований диагностировать симптоматическую эпилепсию и должны расцениваться как реакция мозга на хирургическое вмешательство [6, 8].
В ряде исследований [6, 11] показано, что ранние впервые возникшие послеоперационные приступы не повышают риск развития симптоматической эпилепсии и не являются поводом для назначения противосудорожной терапии. Менее распространено мнение о том, что приступы в раннем послеоперационном периоде увеличивают риск развития послеоперационной симптоматической эпилепсии [12].
Профилактическое2 назначение противосудорожных средств после нейрохирургических вмешательств широко практиковалось в ХХ веке и сегодня рутинно осуществляется во многих отечественных и зарубежных клиниках. Вопрос о профилактическом применении противосудорожных препаратов в настоящее время остается дискуссионным. Обзор Американской ассоциации нейрохирургов (AANS) за 2005 г. показал, что чаще противосудорожные препараты для профилактики используют длительно практикующие нейрохирурги [13]. Некоторые авторы [14] предлагают для профилактики ранних приступов назначение противосудорожных препаратов в первую неделю после операции. Комитет качества и стандартизации Американской академии неврологов (AAN) в рекомендациях 2000 г. не рекомендует продолжать противосудорожную терапию дольше одной недели после операции, так как медикаментозная профилактика неэффективна для предотвращения развития позднего приступа [15].
Всего, по данным литературы [17], проведено 5 рандомизированных контролируемых испытаний трех противоэпилептических препаратов: фенитоина, фенобарбитала и вальпроатов. Разницы между действием этих средств и плацебо относительно предотвращения первого приступа у пациентов с опухолями головного мозга не выявлено. Более того, в одном исследовании результаты в группе больных, профилактически получавших фенитоин, оказались хуже, чем в группе плацебо (10 и 8% ранних послеоперационных приступов соответственно), причем побочные эффекты препарата отмечены у 18% получавших его пациентов [17]. Следует подчеркнуть, что исследования высшего уровня доказательности проведены только по трем упомянутым препаратам, и нет оснований предполагать аналогичный результат при изучении новых противосудорожных средств.
В литературе [17, 18] доминирует мнение, что побочные эффекты профилактической противосудорожной терапии превосходят возможную пользу и однозначно снижают качество жизни больных. Очевидно, что в определенных ситуациях ранние послеоперационные приступы бывают первым проявлением симптоматической эпилепсии и промедление с назначением соответствующей терапии может иметь негативные последствия. Дифференциальный диагноз между ранними послеоперационными приступами, возникшими как реакция мозга на повреждение, и ранними приступами, являющимися дебютом симптоматической эпилепсии, затруднен, и однозначного алгоритма принятия решения в такой ситуации в современной литературе не представлено.
Методом, помогающим принять верное решение, служит видео-ЭЭГ-мониторинг. Продолженный видео-ЭЭГ-мониторинг более информативен по сравнению с рутинной записью ЭЭГ [3, 19]. Мы использовали рекомендации ESICM (Европейское общество интенсивной терапии) по проведению видео-ЭЭГ-мониторинга в отделениях нейрореанимации [19]. В соответствии с ними видео-ЭЭГ-мониторинг проводили сразу после выявления приступа.
В настоящее время в нашей клинике используется стандарт терапии продолженного эпилептического приступа и эпилептического статуса [18], согласно которому препаратом первой линии (из зарегистрированных в России) являются бензодиазепины (диазепам 0,1—0,3 мг/кг). Препаратами второй линии могут быть вальпроевая кислота или леветирацетам. Вальпроевая кислота (конвулекс) вводится внутривенно болюсно в дозе 15 мг на 1 кг массы тела, а далее через 30 мин, через перфузор в дозе 1 мг/кг/ч (не более 2500 мг/сут). Леветирацетам (кеппра) вводится в дозе 30 мг/кг/сут внутривенно болюсно, дозу разделяют на три приема (не более 3000 мг/сут). При однократно возникшем эпилептическом приступе, даже самостоятельно прекратившемся, проводится видео-ЭЭГ-мониторинг. Части больных, с учетом результатов мониторинга в дальнейшем назначается противосудорожная терапия на срок не менее 1 года, под контролем ЭЭГ и МРТ. Другая часть пациентов без явной эпилептической активности, по данным ЭЭГ-мониторинга, выписывается под наблюдение невролога без назначения противосудорожной терапии, с последующим динамическим МРТ- и ЭЭГ-контролем. При повторно возникающих приступах назначается противосудорожная терапия.
На основании анализа данных литературы можно говорить о том, что развитие эпилептических приступов de novo после нейрохирургических вмешательств — нередкое явление, требующее не только быстрой реакции врача для купирования приступа, но и осмысления ситуации относительно дальнейшего ведения пациента. Развитие симптоматической эпилепсии может привести к ухудшению исходов хирургического лечения, повышению летальности, увеличению срока пребывания пациента в стационаре. С другой стороны, неоправданное использование противоэпилептических препаратов в ситуации, когда единственный приступ является реакцией мозга на операционную травму, существенно снижает в дальнейшем качество жизни пациента. Дискуссия, имеющая место на сегодняшний день в литературе, подтверждает нерешенность этих проблем (это касается и профилактического назначения препаратов, и выбора конкретного противоэпилептического средства, и сроков его использования).
Приведенные нами клинические наблюдения отражают различные варианты подхода к терапии впервые развившихся эпилептических приступов у пациентов после удаления внутримозговой опухоли. По нашему мнению, одним из важных на сегодняшний день критериев для принятия решения о назначении противосудорожной терапии являются данные видео-ЭЭГ-мониторинга, который необходимо проводить после однократно возникшего эпилептического приступа в первую неделю после операции.
Авторы заявляют об отсутствии конфликта интересов.
Авторы приводят два клинических наблюдения. У обеих пациенток после удаления злокачественных опухолей головного мозга развились билатеральные тонико-клонические эпилептические приступы. В первом случае при проведении видео-ЭЭГ мониторинга (ВЭМ) было выявлено региональное замедление, эпилептиформная активность и множественные ЭЭГ паттерны фокальных приступов. Во втором — лишь однократный приступ с отсутствием эпилептиформной активности на ЭЭГ. В первом случае авторы рекомендовали длительный прием антиэпилептических препаратов, во втором — только наблюдение.
Таким образом, главным достоинством публикации является дифференцированный и комплексный подход к данной категории пациентов. На основании данных анамнеза, клиники, нейровизуализации и проведения ВЭМ в раннем послеоперационном периоде, авторы определяют группу пациентов с высоким риском развития эпилепсии, рекомендуя им длительную терапию, и группу с низким риском, оставляя ее без лечения, но под наблюдением. Такой подход позволяет избавить часть пациентов от необходимости необоснованного длительного приема антиэпилептических препаратов, которые являются потенциально токсичными.
Статья написана хорошим научным языком, является актуальной, обе пациентки обследованы современными методами, выводы адекватны. Авторами представлен обзор современной зарубежной литературы по данной тематике.
Единственное пожелание, касающееся этой работы, — проведение хотя бы минимального катамнестического наблюдения за пациентками.

Лечение эпилепсии начинается с медикаментозной терапии. Если она не дает желаемых результатов, врач может назначить хирургическую операцию. Решение о целесообразности такой меры принимается, исходя из типа припадков, которыми страдает человек, а также пораженной области мозга. Обычно врачи избегают проведения операции в участках, отвечающих за жизненно важные функции: речь, слух и других.
Эффективность операции
В 2000-м году было установлено, что оперативное лечение определенных форм эпилепсии (височной, например), приравнивается к дополнительному году консервативной терапии этого заболевания. Кроме того, медикаментозное лечение оказалось в 8 раз менее эффективным по сравнению с хирургическим. 64% пациентов, которые легли на операционный стол, смогли полностью избавиться от приступов.

Если человек соответствует всем показаниям к хирургическому лечению, то приступить к нему нужно в минимальные сроки. Возможным последствием операции может быть также то, что человек оказывается неприспособленным к жизни без припадков. Поэтому оперативное вмешательство нужно проводить вместе с медико-социальной реабилитацией.
Стоит также помнить, что пациент всегда идет на небольшой, но все же риск. Даже если он является идеальным кандидатом на хирургию, возможны личностные изменения или нарушение когнитивных функций. Впрочем, это не аргумент в пользу того, что не надо лечиться. Врач должен выбирать конкретный способ терапии в индивидуальном порядке.
Также не следует полностью отказываться от консервативного лечения. Даже если хирургия дала хороший результат, 2 года надо принимать противоэпилептические препараты. Это нужно, чтобы мозг адаптировался. Хотя в ряде случаев можно пренебречь этим правилом по решению врача.
Показания к операции
Хирургическое лечение эпилепсии назначается только после соответствующей диагностики. Начинается она с теста Вада, цель которого – определить зоны, которые отвечают за речь и память. Для этого в каротидную артерию (то есть, сонную) вводится амобарбитал. Как правило, перед хирургическим вмешательством непосредственно в мозг внедряются электроды, которые позволяют отследить любые изменения в состоянии человека и понять, из какой области мозга начинаются приступы. Такая диагностика показывается значительно лучше результаты, чем классическое ЭЭГ.

Специалисты выделили три вида эпилепсии, при которых показано нейрохирургическое вмешательство:
- Фокальные припадки. Это приступы, которые не выходят за пределы одного участка мозга. Проявления могут отличаться, начиная необъяснимыми эмоциями и заканчивая потерей сознания с сохранением двигательных автоматизмов.
- Припадки, которые начинаются, как фокальные, но потом переходят на другие участки мозга.
- Односторонняя многоочаговая эпилепсия с инфантильной гемиплегией. Это эпилептические приступы у младенцев, которые затрагивают несколько участков мозга.
Впрочем, даже в этих случаях лечение эпилепсии хирургическим путем назначается не сразу, а только если два-три лекарства не помогли или же если можно четко определить пораженную заболеванием область мозга.
Также операция нужна для устранения первопричины, которая вызывает вторичную эпилепсию – патологического новообразования в головном мозге, гидроцефалии и других заболеваний.
Устранение фокуса припадка
Наиболее часто удаляется височная доля. Это самая эффективная разновидность лобэктомии, которая приводит к положительной динамике в 70-90% случаев.
Множественная субпиальная транссекция
Этот вид лечения применяется в тех случаях, когда невозможно безопасно удалить поврежденный участок мозга. В этом случае фокус не удаляется, а на поверхности мозга делаются насечки. Это помогает предотвратить распространение приступа на другие участки. Множественная субпиальная транссекция часто применяется одновременно с резекцией других, более безопасных по последствиям хирургического вмешательства, областей.

Один из примеров этой операции у ребенка – лечение синдрома Ландау-Клеффнера, при котором поражаются области, отвечающие за речь и восприятие.
Проводится операция под общим наркозом. Хирург вскрывает череп и получает доступ к твердой оболочке мозга. Далее на сером веществе наносится несколько параллельных насечек. Операции подвергается тот участок мозга, который определен, как очаг приступов. После этой процедуры твердая оболочка мозга и часть черепа ставятся на место. Эффективность операции – 70% у взрослых, но насколько эти данные достоверны, неизвестно, поскольку этот метод лечения изобрели недавно.
Возможные осложнения после операции:
- Отек мозга.
- Тошнота, головные боли, эмоциональные нарушения (депрессия).
- Нарушения функции речи, памяти.
После операции нужно еще день-два находиться под наблюдением врачей. Восстановление осуществляется где-то в течение полутора месяцев, в течение которых нужно принимать противоэпилептические препараты. Когда приступы прекращаются, можно уменьшить дозировку лекарств или же вовсе их отменить.
Каллозотомия мозолистого тела
Эта форма хирургического вмешательства показана, когда приступ охватывает оба полушария. Суть операции в том, что врач пересекает мозолистое тело (участок мозга, который позволяет полушариям обмениваться информацией между собой). Это делается для того, чтобы эпилептическая активность не могла перейти из одного полушария в другой. Конечно, такое лечение неспособно убрать приступ, но положительный эффект в виде уменьшения его интенсивности все же имеется. Хотя, надо сказать, пересечение путей передачи информации от одного участка ко второму – не самая лучшая идея, но на безрыбье, как говорится, и рак – рыба.

Перед проведением операции показано тщательное обследование пациента с помощью МРТ, ЭКГ, ЭЭГ. В отдельных случаях назначается ПЭТ.
Сама операция проводится под общим наркозом в два этапа:
- Сначала врач пересекает передние две трети мозолистого тела. Это позволяет полушариям обмениваться визуальной информацией между собой.
- Если первый этап не дал эффекта, то тогда пересекается оставшаяся часть мозолистого тела.
Впрочем, сейчас есть более эффективная альтернатива – радиохирургия. Это неинвазивный метод, который не провоцирует осложнения, возможные при оперативном лечении.
Вообще, этот метод далеко неидеален, учитывая неспособность полушарий обмениваться информацией между собой. При дроп-атаках эффективность составляет 50-75%, что довольно мало. Период реабилитации – полтора месяца.
Важно: удаление межполушарных связей приводит к таким симптомам, как уменьшение психомоторной активности, акинетический мутизм (когда пациент немотивированно отказывается вступать в беседу с другими людьми при том, что разговаривать он может и речь понимает. Также он не движется при том, что способен это сделать). Обычно это состояние само проходит через две недели. В 20% случаев наблюдается увеличение частоты парциальных приступов. Но волноваться не стоит, через некоторое время все проходит.
Гемисферэктомия
Гемисферэктомия – удаление части полушария мозга, а также пересекается мозолистое тело. Этот метод показывает довольно неплохую эффективность при частых тяжелых приступах, которые очень тяжело контролировать медикаментозными средствами. Проводится операция похожим на каллозотомию способом. Сначала вскрывается череп, твердая мозговая оболочка, врач убирает часть полушария, которая виновата в возникновении приступов. После этого пересекается мозолистое тело. Фактически эта процедура и совмещает в себе лобэктомию и каллозотомию. Как и с другими методами, реабилитация длится где-то 6-7 недель.
Метод очень эффективен, у 85% больных наблюдается значительное уменьшение тяжести и частоты приступов, а у 60% они полностью проходят. Функциональных проблем не наблюдается, поскольку оставшиеся клетки мозга берут на себя функции отсеченных.
При этом возможны побочные эффекты в виде онемения головы, мышечной слабости половины тела, которая контролировалась отсеченным участком мозга, депрессии, нарушения когнитивных функций. По ходу реабилитации эти неприятные эффекты должны пройти самостоятельно.
Осложнения у этого метода также имеются. Например, у пациента могут быть нарушены ощущения со стороны, противоположной тому участку мозга, который подвергался вмешательству. Также шевелить конечностями, которые находятся на этой части, может быть довольно затруднительно.
Стимулятор блуждающего нерва
Это довольно эффективный метод лечения, который используется, если не работают консервативные методы. Разрешен к использованию в 1997 году. Суть его очень проста – человеку в нижний отдел шеи имплантируется специальный прибор, который, подключившись, стимулирует блуждающий нерв. Этот метод позволяет уменьшить частоту и интенсивность приступов на 20-40%. Как правило, он применяется наряду с консервативными методами, хотя дозировку препаратов в большинстве случаев можно снизить благодаря такому прибору.

Возможные побочные эффекты стимуляции блуждающего нерва – дисфония (охриплость голоса), ангина, боль в ушах, тошнота. Большая часть этих неприятных симптомов может быть убрана за счет коррекции степени стимуляции. Хотя дисфония остается в любом случае. Стоит учитывать и то, что батарейки нужно менять раз в пять лет, для чего нужно проводить небольшую операцию, которую можно сделать даже в амбулаторных условиях.
Эпилепсия после операции на мозге
В некоторых случаях может возникать эпилепсия после операции головного мозга. Можно сказать, это частое явление, которое может возникать по разным причинам как связанным с нейрохирургией, так и нет. Так, судороги могут возникнуть вследствие инфицирования места проведения пластической операции, например. В этом случае воздействовать нужно на первопричину заболевания, поскольку эпилепсия тут является вторичной. Мы же говорим о методах лечения первичной эпилепсии.
Для недопущения эпилепсии после операции на мозге необходимо принимать противосудорожные препараты. Впрочем, если они возникают, дело серьезное, поскольку есть риск гидроцефалии, отека головного мозга, кровопотери, гипогликемии. Также стоит учитывать, что в некоторых случаях судорожный синдром не проявляется, поскольку остаточно действует анестезия. Поэтому врачу нужно очень пристально наблюдать за состоянием пациента.
Лазерная термоабляция
Сначала проводится МРТ для точного определения зоны поражения, после чего в черепе пациента просверливается отверстие, через которое светят лазером и в прямом смысле обжигают фокус припадка. Как следствие, он перестает функционировать. Плюс этой методике в малой инвазивности, относительно коротком периоде реабилитации. Процедура совмещается с медикаментозной терапией.
Выводы
Видим, что даже если медикаментозная терапия не работает, она все равно применяется, просто к ней добавляется еще и хирургия.
Симптоматическая (в новой классификации эпилепсий 2017 — структурная) эпилепсия (повторные непровоцируемые приступы, связанные с эпилептогенным очагом) наблюдается у 2 — 70% больных в раннем послеоперационном периоде после нейро-хирургических операций (например, после удаления опухоли, абсцесса или субдудральной гематомы; по поводу клипирования аневризм сосудов головного мозга; после стереотаксической операции, вентрикулярного дренирования или шунтирующей операции и др.).
читайте также пост: Новая классификация эпилепсий 2017 (на laesus-de-liro.livejournal.com) [читать]
В ряде случаев случаев эпилептические приступы (ЭП) возникают до операции и к моменту ее проведения больные уже получают противосудорожную терапию (ПСТ), которая продолжается и после нейрохирургического вмешательства. При отсутствии приступов в анамнезе профилактическая ПСТ в настоящее время не назначается. Однако в ряде случаев ЭП впервые развиваются (приступы de novo) после нейрохирургической операции. С одной стороны, эти ЭП могут быть спровоцированы самим фактом операции и самостоятельно прекратиться без ПСТ, с другой — могут быть дебютом структурной эпилепсии (СЭ), что требует длительной медикаментозной (антиэпилептической) терапии.
Дифференциальный диагноз между ранними (см. далее) послеоперационными ЭП, возникшими как реакция мозга на повреждение, и ранними приступами, являющимися дебютом СЭ, затруднен, и однозначного алгоритма принятия решения в такой ситуации в современной литературе не представлено. Методом, помогающим принять верное решение, служит видео-ЭЭГ-мониторинг (проводимый в отделениях нейрореанимации сразу после выявления приступа). Продолженный видео-ЭЭГ-мониторинг более информативен по сравнению с рутинной записью ЭЭГ.
ЭП de novo в зависимости от срока их развития после операции разделяют на ранние и поздние. К ранним ЭП (РЭП), как правило, относят те, которые возникают в течение 48 ч после операции (но ряд авторов считают, что к ранним ЭП следует относить все приступы, возникающие в течение 7 дней после операции). РЭП чаще являются генерализованными, т.к. причиной их возникновения, вероятно, является генерализованная дисфункция мозга и/или отек мозга. Обратите внимание: РЭП — это ЭП, которые развиваются в ответ на острое повреждение головного мозга и фактически, как следует из определения эпилепсии, не являются самостоятельным заболеванием, а должны определяться как эпилептический синдром и требовать особого подхода к прогнозу и лечению (см. далее). Поздние ЭП (ПЭП) возникают более чем через двое суток (позднее 48 часов) после оперативного вмешательства. ПЭП преимущественно комплексные парциальные и являются следствием локальной дисфункции мозга. Такие приступы наиболее резистентны к лечению и представляют наибольший риск для развития СЭ в дальнейшем.
Частота возникновения ЭП в значительной мере зависит от характера патологического процесса, его локализации, вида оперативного вмешательства и ряда других факторов. Например, эпилепсия de novo развивается у 70% пациентов, оперированных по поводу интракраниального абсцесса, и фактически не зависит от применяемой нейрохирургической техники. Оперативные вмешательства в области задней черепной ямки приводят к развитию припадков в 1,1% случаев, если не проводилось шунтирование или дренирование, и в 6,7 % при проведении шунтирования, чаще при развитии осложнений. Большинство же эндоскопических операций, введение deep brain stimulating электродов дает риск развития ЭП всего около 1%. В исследованиях на 128 пациентах с хронической субдуральной гематомой ранние постоперационные судороги (до 3-х недель) наблюдались в 5,4%. Частота РЭП после удаления ОГМ варьирует в разных сериях наблюдений от 4,3 до 23,6% и зависит от локализации, гистологического диагноза, удаленного объема, выраженности отека мозга, геморрагической имбибиции мозга, пневмоцефалии и наличия осложнений. В среднем считается, что вероятность возникновения ЭП после удаления полушарной ОГМ составляет 5 — 10%.
Патогенез впервые возникших в раннем послеоперационном периоде ЭП окончательно не установлен. Одним из механизмов может быть раздражение коры мозга компонентами крови и продуктами распада гемоглобина. Возможно также, что накапливающиеся в очаге повреждения перекисные соединения снижают концентрацию гамма-аминомасляной кислоты, которая ингибирует нейрональную активность коры и таламуса. Наконец, в ишемизированной перитуморозной ткани мозга за счет снижения синтетаз АТФ нарушается трансмембранный транспорт воды и ионов, что приводит к изменению потенциала клеточной мембраны.
Обратите внимание! В любом случае патогенез впервые возникших ранних послеоперационных (ПО) ЭП обусловлен механизмами, действие которых, как правило, прекращается в раннем послеоперационном периоде. Соответственно такие ЭП, особенно единичные, не дают оснований диагностировать СЭ и должны расцениваться как реакция мозга на хирургическое вмешательство. В ряде исследований показано, что ранние впервые возникшие ПО ЭП не повышают риск развития СЭ и не являются поводом для назначения ПСТ (менее распространено мнение о том, что приступы в раннем послеоперационном периоде увеличивают риск развития послеоперационной СЭ).
Вопрос о профилактическом применении противосудорожных препаратов (ПСП) в настоящее время остается дискуссионным (единого алгоритма принятия решения не существует). Обзор Американской ассоциации нейрохирургов (AANS) за 2005 г. показал, что чаще ПСП для профилактики используют длительно практикующие нейрохирурги. Некоторые авторы предлагают для профилактики РЭП назначение ПСП в первую неделю после операции. Комитет качества и стандартизации Американской академии неврологов (AAN) в рекомендациях 2000 г. не рекомендует продолжать противосудорожную терапию дольше одной недели после операции, так как медикаментозная профилактика неэффективна для предотвращения развития ПЭП ([. ] профилактическое применение ПСП эффективно в отношении РЭП и неэффективно для ПЭП).
читайте также пост: Превентивные технологии в ведении больных со структурной эпилепсией (на laesus-de-liro. livejournal.com) [читать]Подробнее об ЭП de novo в следующих источниках:
Судороги после нейрохирургических операций. Лечение и профилактика
Судорожный синдром довольно частое явление после нейрохирургических операций на головном мозге. Точные данные варьируют в зависимости от хирургических заболеваний, вида операции и наличия судорожных эпизодов в анамнезе. Перед клиницистами встают два вопроса:
• Назначать ли профилактически введение антиконвульсантов, а если назначать, то какие?
• Как вести судорожный синдром в послеоперационном периоде? Судорожный синдром связан С ухудшением послеоперационного состояния пациента. Спутанность сознания может возникать и по другим причинам: окклюзия шунта, остро возникшая гидроцефалия, отек мозга, внутричерепное кровотечение.
• Примерно у 60% пациентов с опухолями головного мозга после проявления клинической картины заболевания развиваются судорожные приступы.
• Судороги возникают у 20% пациентов с САК, обычно в первые 24 часа.
• Судороги после травматического повреждения мозга возникают относительно часто как в остром периоде ( Источник
М.Р. ЯРМУХАМЕТОВА1,2
1Казанский государственный медицинский университет, 420012, г. Казань, ул. Бутлерова, д. 49
2Республиканская клиническая больница МЗ РТ, 420064, г. Казань, Оренбургский тракт, д. 138
Ярмухаметова Миляуша Рифхатовна ― кандидат медицинских наук, ассистент кафедры и неврологии, врач-невролог, тел. +7-917-283-92-35, e-mail: [email protected]
Обследованы 75 пациентов с симптоматической фокальной эпилепсией, развившейся после оперативного лечения по поводу опухоли головного мозга. Диагноз эпилепсии был установлен на основании клинической картины приступов, данных электроэнцефалографии, магнитно-резонансной томографии головного мозга. У 20% (n=15) пациентов имели место простые парциальные приступы, у 10,7% (n=8) ― сложные парциальные приступы, у 50,7% (n=38) ― простые парциальные приступы с вторично генерализацией, у 18,6% (n=14) ― сложные парциальные приступы с вторично генерализацией. Cтойкая клиническая ремиссия была достигнута проведением монотерапии депакином хроносферы у 42% (n=31) пациентов, карбамазепином ― у 22% (n=17), топираматом ― у 18% (n=14) пациентов. У 17,3% (n=13) пациентов стойкая клиническая ремиссия была достигнута проведением политерапии из двух противоэпилептических препаратов, один из которых депакин хроносфера, а вторым противоэпилептическим препаратом являлся топирамат в 4% (n=3) случаев, карбамазепин ― 4% (n=3), ламотриджин ― 9,3% (n=7) случаев. У всех пациентов отмечено стабильное течение заболевания. Высокая эффективность депакина хроносферы как в монотерапии, так и в политерапии получена у пациентов с симптоматической фокальной эпилепсии, развившейся после оперативного лечения по поводу опухоли головного мозга.
Ключевые слова: факторы риска, эпилепсия, течение.
M.R. YARMUKHAMETOVA1,2
1Kazan State Medical University, 49 Butlerov Str., Kazan, Russian Federation, 420012
2Republic Clinical Hospital of the MH of RT, 138 Orenburgskiy Trakt, Kazan, Russian Federation, 420064
Yarmukhametova M.R. ― Cand. Med. Sc., Assistant of the Department of Neurology and Rehabilitation, neurologist, tel. +7-917-283-92-35, e-mail: [email protected]
75 patients were examined with symptomatic focal epilepsy which developed after operative treatment of a brain tumor. The diagnosis of epilepsy was made basing on the clinical picture of attacks, electroencephalography data, magnetic-resonance tomography of brain. 20% (n=15) of the patients suffered from focal epilepsy with simple partial seizures, 10.7% (n=8) ― complex partial seizures, 50.7% (n=38) ― simple partial seizures with secondary generalization, 18.6% (n=14) ― complex partial seizures with secondary generalization. Stable clinical remission was achieved in 42% (n=31) patients by monotherapy with depakine chronosphere, in 22% (n=17) ― with carbamazepine, in 18% (n=14) ― with topiramat. In 17.3% (n=13) patients stable clinical remission was achieved with polytherapy of two anti-epilepsy drugs, one of which was depakine chronosphere, and the second one was topiramat in 4% (n=3) cases, carbamazepine ― in 4% (n=3), lamotridgin ― in 9.3% (n=7) cases. In all patients stable course of disease was marked. The high efficiency of depakine chronosphere in both momotherapy and polytherapy was proved for the patients with symptomatic focal epilepsy which developed after operative treatment of a brain tumor.
Key words: risk factors, epilepsy, course.
Эпилепсия ― это хроническое заболевание головного мозга различной этиологии, характеризующееся повторяющимися приступами, обусловленными чрезмерными разрядами церебральных нейронов, ассоциированными с разнообразными клиническими и лабораторными проявлениями [1]. Течение и исход эпилепсии весьма разнообразны. В зависимости от темпа нарастания пароксизмальной активности и углубления психических изменений различают медленно и остро текущие формы; медленный, подострый, непрерывно-прогредиентный, ремиттирующий и стабильный типы течения [2]. Тяжесть эпилептической болезни определяется взаимодействием факторов трех основных групп: 1) локализацией и активностью эпилептического очага; 2) состоянием защитных и компенсаторных свойств организма, его индивидуальной и возрастной реактивностью; 3) влиянием внешней среды [3].
Целью данного исследования явилось изучение течения симптоматической фокальной эпилепсии, развившейся при структурных изменениях в головном мозге.
Материал и методы
В исследование были включены 75 пациентов с симптоматической фокальной эпилепсией, развившейся после оперативного лечения по поводу опухоли головного мозга. Средний возраст обращения пациентов составлял у женщин 28,3±1,75 лет, у мужчин ― 32,4±1,4 лет, средний возраст дебюта эпилепсии 14,5±1,72 года у женщин, 19,7 ±2,2 года ― у мужчин, длительность заболевания 12,2±1,21 и 10,1±1,2 лет соответственно. Диагноз эпилепсии был установлен на основании клинической картины приступов, данных электроэнцефалографии, магнитно-резонансной томографии головного мозга. Тип эпилептических приступов и форма (синдромы) эпилепсии определялись согласно классификации эпилептических приступов (ICES I) Международный лиги по борьбе с эпилепсией (ILAE) 1981 г. и классификации эпилепсий и эпилептических синдромов (ICE 2) ILAE 1989 г., также учтена современная классификация приступов и эпилепсий, установленные ILAE 2001 году.
Результаты
Все пациенты с симптоматической фокальной эпилепсией перенесли оперативное лечение по поводу опухоли головного мозга. 25,3% (n=19) пациентов перенесли удаление астроцитомы: лобной доли (8%, n=6), височной области (5,3%, n=4), теменной доли (6,6%, n=5), лобно-теменного стыка (2,6%, n=2), левого бокового желудочка (1,3%, n=1), центральной извилины правого полушария и края мозолистого тела (1,3%, n=1). 20% (n=15) пациентов перенесли удаление глиомы: лобной доли (5,3%, n=4), височной доли (5,3%, n=4), теменной доли (4%, n=3), затылочной доли (2,6%, n=2), теменно-затылочной областей (1,3%, n=1), лобно-височной областей (1,3%, n=1). 46,6% (n=35) пациентов перенесли удаление менингиомы: лобной доли (12%, n=9), височной доли (4%, n=3), теменной доли (9,3%, n=7), теменно-височной области (1,3%, n=1), лобно-теменной области (4%, n=3), височно-теменно-затылочной области (4%, n=3), лобно-височной области (2,6%, n=2), основания средней черепной ямки (1,3%, n=1), левой сильвиевой борозды (1,3%, n=1), медиального отдела правого большого крыла основной кости (1,3%, n=1), крыльев основной кости слева (1,3%, n=1), передней черепной ямки (2,6%, n=2), правого полушария (1,3%, n=1). Отмечались простые парциальные приступы с вторичной генерализацией после удаления краниофарингиомы (1,3%, n=1), олигоденроглиомы (1,3%, n=1), супратенториальной части петроклиновидной менингиомы слева (1,3%, n=1), фалькс менингиомы в проекции 1/2 и 2/3 сагитального синуса (1,3%, n=1), конвеситальной менингиомы (2,6%, n=2). У 20% (n=15) пациентов имели место простые парциальные приступы, 10,6% (n=8) ― сложные парциальные приступы, 42,6% (n=32) ― простые парциальные приступы с вторично генерализацией, 18,6% (n=14) ― сложные парциальные приступы с вторичной генерализацией. При оценке неврологического статуса выявлены отклонения следующего характера: поражение черепных нервов ― 20% случаев (n=15), двусторонняя пирамидная недостаточность ― 10,6% (n=8), односторонняя пирамидная недостаточность — 10,6% (n=8), гемигипестезия ― 20% (n=15), гемипарез легкой степени ― 12% (n=9), гемипарез умеренной степени ― 9,3% (n=7). При проведении электроэнцефалографии в межприступном периоде на фоне общемозговых нарушений были зафиксированы: очаговая эпилептиформная активность (комплексы острая-медленная волна, острая волна) в 100% (n=75) случаев. При проведении магнитно-резонансной томографии (МРТ) головного мозга были выявлены кистозно-глиозные изменения следующих отделов головного мозга: лобной области (34,6%, n=26), теменной области (22,6%, n=17), височной доли (18,6%, n=14), затылочной области (2,6%, n=2), лобно-теменной области (6,6%, n=5), теменно-височной доли (6,6%, n=5), теменно-затылочной области (1,3%, n=1), лобно-височной доли (2,6%, n=2), височно-теменно-затылочной области (4%, n=3). По локализации эпилептогенного очага наблюдалась: лобно-долевая эпилепсия у 34,6% пациентов (n=26), височно-долевая у 18,6% (n=14), теменно-долевая у 22,6% пациентов (n=17), лобно-теменно-долевая у 6,6% (n=5), затылочно-долевая у 2,6% (n=2), теменно-затылочно-долевая у 5,3% (n=4), лобно-височно-долевая у 2,6% (n=2), височно-теменно-долевая эпилепсия у 6,6% пациентов (n=5). Стойкая клиническая ремиссия была достигнута проведением монотерапии депакином хроносферы у 42% (n=31) пациентов, карбамазепином у 22% (n=17), топираматом у 18% (n=14) пациентов. У 17,3% (n=13) пациентов стойкая клиническая ремиссия была достигнута проведением политерапии из двух противоэпилептических препаратов, один из которых депакин хроносфера, а вторым противоэпилептическим препаратом являлся топирамат в 4% (n=3) случаев, карбамазепин ― 4% (n=3), ламотриджин ― 9,3% (n=7) случаев.
Обсуждение
В литературе много сообщений о неблагоприятном течении и прогнозе при симптоматической фокальной эпилепсии. К основным факторам, определяющим прогноз эпилепсии, относятся: форма эпилепсии, характер приступов, возраст дебюта заболевания, наличие структурных изменений в головном мозге, а также своевременность и адекватность терапии, проводимой противоэпилептическими препаратами [4]. При анализе терапии 75 случаев фокальной симптоматической эпилепсии, развившейся после оперативного лечения по поводу опухоли головного мозга, был отмечен адекватный выбор режима противоэпилептической терапии в 82,7% (n=62) пациентов. У 17,3% (n=13) пациентов, получающих политерапию, лечение противоэпилептическими препаратами начато несвоевременно и стартовым препаратом был фенобарбитал в субтерапетических дозах.
Вывод
Во время исследования 75 случаев симптоматической фокальной эпилепсии, развившейся после оперативного лечения по поводу опухоли головного мозга, было отмечено стабильное течение заболевания. Отмечена высокая эффективность депакина хроносферы как в монотерапии, так и в политерапии у пациентов с симптоматической фокальной эпилепсии, развившейся после оперативного лечения по поводу опухоли головного мозга.
- 1. Wold Health Organisation (1973). Dictionary of Epilepsy. WHO, Geneva.
- Киссин М.Я. Клиническая эпилептология. ― М., 2009. ― 252 с.
- Мухин К.Ю., Петрухин А.С. Эпилептические синдромы. Диагностика и стандарты терапии. ― М., 2005. ― 143 с.
- Wolf P. Determinants of outcome in childhood epilepsy // Acta Neurol. Scand. ― ― Vol. 112. ― P. 5-8.
Читайте также:

