Остаточная опухоль после операции что это такое
Отеки после операции - это распространенное явление после хирургического вмешательства на любой части тела. Отечность образуется по причине скапливания большого количества лимфы в поврежденных тканях. Данный процесс является ответом иммунной системы, которая старается обеспечить нормальное функционирование организма человека, даже несмотря на недавнее оперативное вмешательство. Рассмотрим в статье более подробно причины появления отечности, способы снятия отеков и методы лечения.
Почему появляется отечность?
После повреждения мягких тканей отек появляется практически всегда, однако может иметь разную выраженность. На степень проявления отечности после операции оказывают влияние следующие факторы:
- образ жизни пациента;
- индивидуальные особенности организма;
- состояние здоровья;
- придерживается ли пациент всех рекомендаций врача;
- состояние лимфатической и иммунной систем пациента.
В большинстве случаев уменьшение отека на лице после операции напрямую зависит от того, какие усилия прилагает больной после операции для восстановления здоровья в реабилитационный период. Соблюдение всех предписаний врача позволит улучшить состояние здоровья в минимально короткие сроки. Заниматься самолечением в данной ситуации не рекомендуется, это может привести к ухудшению состояния.

Виды отеков
Отеки условно делятся на несколько видов:
- местные или локальные, которые образуются в определенных участках тела;
- общего кровообращения, что образуются в разных местах одновременно из-за нарушений в работе внутренних органов.
Почему после операции отек появляется около пораженного участка кожи, подскажет только квалифицированный врач.
Продолжительность
Сколько времени отекает рука после операции или нога, напрямую зависит от масштабности и сложности хирургического вмешательства. С целью минимизации риска появления воспалительной реакции пациенты в послеоперационный период должны находиться под постоянным наблюдением врача.
Согласно медицинской статистике, отечность после снятия повязки остается еще 14-21 день. После операции важно постоянно наблюдаться до момента заживления раны не только у лечащего врача, но и у нефролога.
Чем опасен отек
Даже после самой незначительной операции может сформироваться отечность, однако никакой опасности для здоровья пациента она не несет. Согласно медицинской статистике, отекать нога после операции или рука может уже через 24-48 часов после операции, и так же после такого же промежутка времени симптоматика исчезает, при этом не оставляя никаких следов.
Не стоит паниковать в случаях, если:
- припухлость имеет небольшие размеры;
- оттекла только та часть тела, где ранее была выполнена операция;
- набухла та травмированная конечность, на которую была оказана большая нагрузка.
Бить тревогу нужно, если одновременно с появлением отека после операции наблюдаются сбои в работе печени, почек и сердца. В данной ситуации стоит немедленно обратиться к врачу.
Осложнения
В период проведения оперативного вмешательства организм пациента поддается сильной нагрузке, поэтому отечность может сопровождаться тромбозом, застоем крови и межклеточной жидкости. Рассмотрим более детально типы осложнений.
Тромбоз после операции возникает преимущественно у пациентов преклонного возраста. Опасна эта патология тем, что не имеет видимых симптомов, поэтому диагностировать его на первой стадии развития довольно сложно. В тяжелых случаях может возникнуть тромфоэмболия легочной артерии. Обнаружить заболевание можно только с помощью проведения УЗИ.
О застое крови и межклеточной жидкости свидетельствует отечность шеи, конечностей и области вокруг глаз, которая может появляться как после операции, так и в виде самостоятельной патологии. Если у пациента были проблемы с сердцем или с почками, то после хирургического вмешательства имеющиеся заболевания могут усугубиться.
Основные принципы терапии послеоперационных отеков
Эффективное устранение отечности напрямую зависит от строгого соблюдения принципов лечения. Симптоматическая терапия включает следующие мероприятия:
- уменьшение количества потребляемой воды;
- снижение употребления пищи с большим содержанием соли;
- проведение контроля суточного диуреза;
- прием мочегонных средств с целью выведения излишка жидкости в организме;
- проведение контроля уровня электролитов в крови, а особенно калия.
Рекомендации врачей
Как снять отек после операции, посоветуют квалифицированные врачи. Конечно же, нужно ограничить прием теплой ванны или душа. Вместо этого разрешается принимать контрастный душ или же ополаскивать определенные участки тела прохладной водой. Это позволит избавить ткани от скопления жидкости.
В обязательном порядке рекомендован отдых и покой после операции. Голову во время сна следует приподнять с помощью подушек. В период реабилитации нужно отказаться от долгих просмотров телевизора и чтения книг, чтобы не перенапрягать организм.
Во время заживления отека после операции не рекомендуется употреблять алкогольные напитки, соленую и жареную пищу, острые блюда. Следует отказаться от кофе и газированных напитков, так как они усиливают отечность, задерживая воду в организме.
Уменьшить боль, которая сопровождает отечность
Для уменьшения болевых ощущений, которые в большинстве случаев могут сопровождать патологию, врачи рекомендуют прикладывать холодные компрессы или пузырь со льдом. Длительность процедуры 10-15 минут, после чего воспаление и отечность уменьшаются. В некоторых случаях можно использовать прохладные компрессы на основе отваров лекарственных трав, например, зверобоя или подорожника. Такие процедуры не только уменьшат отеки, но и значительно ускорят процесс заживления послеоперационных ран. Применять вышеупомянутые методы в восстановительной терапии можно только после согласования с лечащим врачом. В ином случае может возникнуть аллергическая реакция, которая только усугубит состояние пациента.
Медикаментозная терапия
Уменьшить отечность вполне возможно с помощью разных лекарственных препаратов, которые применяются только по назначению врача. Отличным вариантом станет использование мазей и гелей, основное действие которых направлено на ускорение оттока лимфы и минимизации гематомы. Могут быть прописаны противовоспалительные средства, противоотечные компрессы, а также наружные препараты с экстрактом медицинской пиявки.
Как убрать отечность с помощью народных средств
После операции сильные отеки можно убрать не только с помощью медикаментозной терапии, но и благодаря средствам народной медицины. Основная цель применения собственноручно приготовленных отваров — это выведение лишней жидкости, которая скапливается в мягких тканях. Действенными методами можно считать следующие рецепты:
- Чтобы снять отечность с нижних конечностей, используется настой ромашки или зверобоя. В мягкие ткани можно втирать оливковое масло или накладывать компрессы на основе уксуса. Также снять воспаление поможет настой валерианы, которым протираются пораженные участки кожи.
- Отеки после операции на лице в домашних условиях можно убрать с помощью протирания кожи кусочками льда из настоя ромашки или чая. Уменьшить послеоперационный отек можно с помощью прикладывания сырого картофеля и огурца к воспаленным местам.
- Можно также применять настой на основе спорыша. Сухая смесь травы заливается крутым кипятком. Настаивается отвар несколько часов, после чего принимается внутрь несколько раз в сутки.
- Достаточно популярным средством является сок алоэ, который быстро и эффективно снимает воспаление и болевые ощущения. К пораженному участку прикладываются разрезанные листки алоэ и выдерживаются 2-3 часа.

Снять отечность после операции с лица
Чтобы избавиться от послеоперационного отека, который возник на лице, стоит легко массировать пострадавшие участки кубиками льда из ромашкового чая. Отличным вариантом станет применение масок из сырого картофеля и огурца. Протирание лица отваром из листьев зеленого чая позволит не только убрать отечность, но и быстро тонизировать кожные покровы.
На самом деле в большиестве случаев отеки после хирургического вмешательства не представляют опасности для здоровья человека, но все-таки от них стоит быстрее избавиться. Перед тем как использовать средства народной медицины, следует проконсультироваться с лечащим врачом. Это позволит избежать появления аллергической реакции или ухудшения общего состояния здоровья.
Новому росту опухоли, как правило, предшествует период ремиссии. Ее длительность зависит от того, как долго организм будет восстанавливаться. Рецидив злокачественной опухоли может быть ранним (образование раковой опухоли происходит через 2-4 месяца после окончания основного курса лечения) и поздним (вторичное онкологическое поражение диагностируется спустя 2-4 года).
- Очень важно, чтобы операция по удалению опухоли была выполнена профессионально, - говорит онколог Алексей Дикарев. - Рецидив рака может быть связан с проведением неполноценного или некачественного лечения, что провоцирует вторичные проявления заболевания.

Сложнее всего онкологам лечить пациентов с так называемыми запущенными формами рака, где опухоль начала прорастать.

- На разных этапах онкологического заболевания требуется оценить эффективность лечения, степень распространенности процесса. Поэтому очень важно, чтобы пациент своевременно проходил обследования – современная медицина располагает высокотехнологичными инструментами диагностики.
Мультидисциплинарный подход к лечению больных обеспечивает не только качественную диагностику и правильно подобранный курс процедур, но и постклиническую реабилитацию, социальную адаптацию и помощь профессионального психотерапевта. Задача наших специалистов – победить болезнь и бороться за качество жизни российских онкологических больных.
У пожилых людей, замечено, рецидивы рака случаются чаще.
Медики отмечают, что очень важно, чтобы первый этап лечения был выполнен профессионально.


После того, как человек побеждает рак, велика вероятность впадения в крайности. В еде это отражается на кардинальной смене рациона. На столах появляется много высококалорийной пищи, ввиду необходимости набора веса. Во втором варианте рацион изобилует теми продуктами, которые якобы борются с раком. Вся эта пища потребляется бесконтрольно и в ущерб всему остальному.
Однако онкопациенту нужно придерживаться принципов правильного питания, что и остальным людям. Упор на овощи и фрукты, больше продуктов, содержащих клетчатку, меньше мяса и больше рыбы, ограничить животные жиры, мясную кулинарию, выпечку, свести до минимума потребление соли.
Также нужно держать свой вес. Особенно надо избегать полноты и лишнего веса. Кроме того, не стоит зацикливаться в поисках специфических продуктов с якобы противоопухолевой активностью. Эффект их, как правило, сомнителен, а вот неумеренное потребление может оказаться проблематичным.


Регулярные и умеренные физические нагрузки способствуют укреплению иммунитета и помогают избежать рецидива онкологии.
- Многочисленные исследования доказывают — даже самому ослабленному пациенту (не обязательно онкологическому), даже прикованному к кровати посильные регулярные физические нагрузки улучшают прогноз и качество жизни! Пока есть силы шевелиться, надо это делать! - советует доктор Александр Мясников. - Что же касается подавляющего числа людей, перенесших онкологическое лечение, к ним относится общий постулат всех докторов: каждый должен посвятить какому-то виду физической нагрузки минимум полчаса в день пять раз в неделю!
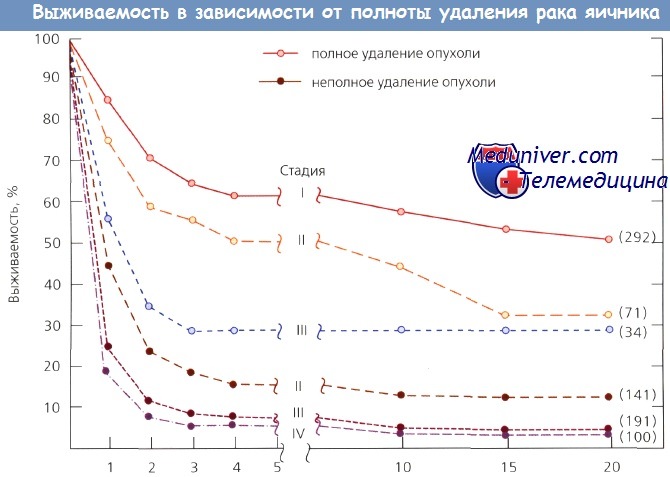
Необходимость удаления максимально возможного объема опухоли во время первой операции по поводу диссеминированного рака яичника (РЯ) стала аксиомой для многих онкогинекологов. Известно, что значительное снижение опухолевой нагрузки дает выраженный паллиативный эффект. По данным Munnell, 5-летняя выживаемость больных после операций в максимально возможном объеме составляла 28 %, после частичной резекции — 9 %, а после биопсии — 3 %. Для 14 выживших пациенток операция в максимально возможном объеме включала гистерэктомию с двусторонней аднексэктомией и оментэктомию.
Aure и соавт. отметили существенное улучшение выживаемости пациенток с III стадией рака яичника (РЯ) после удаления всей видимой опухоли. Griffiths и соавт. получили аналогичные результаты при использовании линейного уравнения множественной регрессии выживаемости в качестве зависимой переменной для одновременного контроля множества терапевтических и биологических факторов, влияющих на исход заболевания у отдельных пациенток.
Самыми важными факторами были гистологическая степень дифференцировки и наибольший размер остаточной опухоли после первичного хирургического лечения. Операция улучшает выживаемость только в том случае, если максимальный размер остаточной опухоли составляет менее 1,6 см.
Так называемые циторедуктивные операции (debulking operation) получили значительное распространение при лечении рака яичника (РЯ). Цель хирургического вмешательства заключается в уменьшении объема новообразования для оптимальной эффективности адъювантной терапии. Все формы дополнительного лечения наиболее эффективны при минимальном объеме остаточной опухоли. Это особенно касается истинного рака яичника (РЯ) — солидных опухолей, наиболее чувствительных к химиотерапии (XT). Часто аккуратный и терпеливый хирург может удалить крупные опухолевые очаги, которые на первый взгляд казались неоперабельными.
При использовании бессосудистых зон забрюшинного пространства можно выделить воронкотазовую связку, мочеточник и изолировать сосуды, кровоснабжающие яичник. После их перевязки и пересечения ретроградное удаление больших опухолей яичников выполнить проще и безопаснее. Выделение мочеточников проводят с максимальной осторожностью, однако их повреждение бывает даже у самых опытных хирургов. Конгломераты большого сальника при раке яичника (РЯ) удаляют через бессосудистую зону поперечно-ободочной кишки после лигирования правой и левой желудочно-сальниковых артерий. Удаление больших новообразований яичников и метастатически пораженного сальника часто уменьшает общий объем опухоли на 80—99 %.
Сравнение выживаемости пациенток при полном и неполном удалении опухоли в зависимости от стадии рака яичников
Теоретическим обоснованием рассматриваемых операций (debulking procedures) служит концепция о повышении эффективности адъювантной терапии после существенного снижения числа опухолевых клеток. Кроме того, при солидных опухолях, к которым относят рак яичника (РЯ), элиминация большой популяции клеток в фазе покоя (G0) может вызывать переход оставшихся клеток в уязвимую для цитостатиков и облучения фазу пролиферации. Несколько скрупулезных ретроспективных исследований продемонстрировало увеличение выживаемости больных, у которых с помощью хирургического метода лечения удалось добиться статуса минимального опухолевого носительства. Большой опыт, накопленный в M.D. Anderson Hospital and Tumor Institute, свидетельствует о существенном повышении эффективности XT второй линии при II и III стадиях рака яичника (РЯ), если после первой операции не оставались макроскопические остаточные новообразования или диаметр единичной остаточной опухоли не превышал 1 ем.
При этом 2-летняя выживаемость пациенток со II стадией без остаточных опухолей составила 70 %, а при отдельных узлах диаметром до 1 см — 50 %.
Эти показатели хорошо согласуются с часто публикуемыми цифрами общей выживаемости при раке яичника (РЯ). GOG проводила детальный анализ результатов хирургического лечения больных с поздними стадиями заболевания для определения концепции первичной циторедуктивной операции. На первом этапе сравнили выживаемость пациенток с III стадией рака яичника (РЯ) с опухолью в брюшной полости до 1 см (1-я группа) и 1 см и более (2-я группа); больным 2-й группы опухоли уменьшили до 1 см и менее.
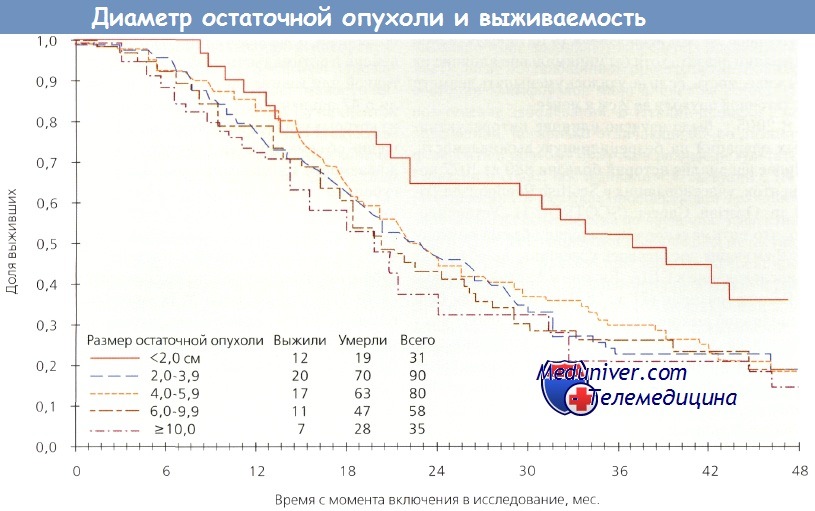
Если хирургическая операция — единственный важный фактор, как рассуждали исследователи, то выживаемость в обеих группах должна быть одинаковой. Однако на самом деле этого не произошло. Больные с небольшим размером опухоли 1-й группы жили дольше по сравнению с пациентками, у которых благодаря хирургической циторедукции достигнут малый размер опухоли (2-я группа). Этот феномен свидетельствует о том, что биологические свойства новообразования имеют важное прогностическое значение. На следующем этапе исследователи GOG оценили влияние наибольшего диаметра остаточной опухоли на выживаемость пациенток после субоптимальных циторедуктивных операций. Они обнаружили, что циторедукция до 2 см и менее значительно увеличивала выживаемость, но при любых остаточных опухолях диаметром более 2 см этот показатель был одинаковым. Следовательно, если остаточную опухоль нельзя уменьшить до 2 см и менее, то выживаемость не зависит от величины диаметра остаточной опухоли.
При исследовании оптимальной и субоптимальной циторедукции эксперты GOG выделили три группы: микроскопическая остаточная опухоль, диаметр остаточной опухоли менее 2 см или более 2 см. В 1-й группе 4-летняя выживаемость составила примерно 60 %, во 2-й — 35 % и в 3-й — менее 20 %. Самое удивительное — это неспособность циторедуктивной операции оказать хотя бы минимальное влияние на выживаемость, если не удалосьуменьшитьдиаметр остаточной опухоли до 2 см и менее.
Выживаемость в зависимости от максимального диаметра остаточной опухоли
В 2005 г. было изучено влияние циторедуктивных операций на безрецидивную выживаемость. Проведен анализ историй болезни 889 из 1077 пациенток, участвовавших в Scottish Randomised Trial in Ovarian Cancer (SCOTROC-1). Установлено, что оптимальное уменьшение объема опухоли ( 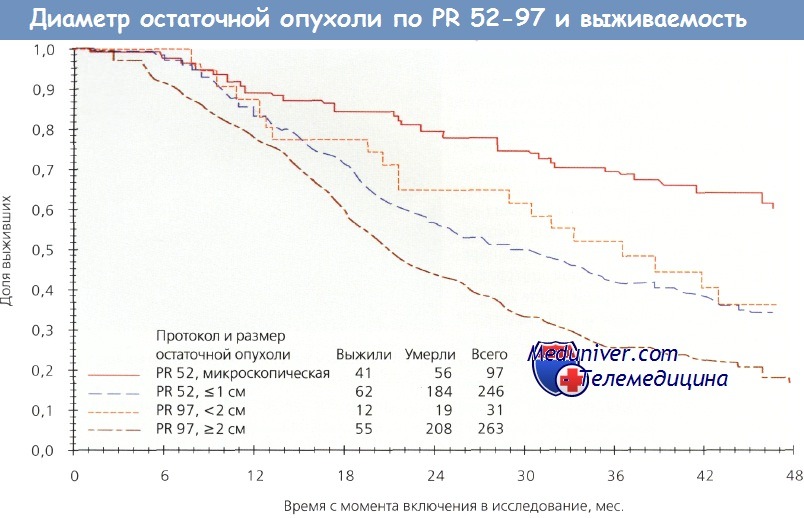
Выживаемость в зависимости от максимального диаметра остаточной опухоли, согласно 52-му и 97-му протоколам (PR) Gynecologic Oncology Group
Эксперты Southwest Oncology Group и GOG исследовали эффективность интраперитонеальной и внутривенной ХТ у пациенток с III стадией РЯ после оптимальных циторедуктивных операций и установили, что при микроскопической остаточной опухоли, остаточном поражении до 0,5 или 0,5—2,0 см медиана выживаемости составила 76, 42 и 32 мес. соответственно. Eisenkop и соавт. сообщили о 163 пациентках с IIIс и IV стадиями РЯ; полную циторедукцию можно было выполнить в 86 % случаев. Медиана выживаемости для всей группы составила 54 мес, а для больных с оптимальной циторедукцией — 62 мес.
Целесообразность выполнения лимфаденэктомии при поздних стадиях рака яичника (РЯ) продолжает оставаться предметом обсуждения. Во всех исследованиях обнаружено обширное поражение лимфоузлов при поздних стадиях заболевания (> 50 %). Вопрос заключается в том, влияет ли лимфаденэктомия на выживаемость. Burghardt один из первых высказал мнение о ее терапевтической пользе. По его данным, даже при наличии метастазов в лимфоузлах, выживаемость пациенток с поздними стадиями РЯ, которым выполнили хирургическое стадирование, а следовательно, и лимфаденэктомию, выше, чем без такого вмешательства. Некоторые авторы считают, что метастазы в лимфоузлах в отличие от интраперитонеальных не так хорошо поддаются XT, поэтому их необходимо удалять. Противники утверждают, что рецидивы значительно чаще возникают в пределах брюшной полости, но не в забрюшинном пространстве, поэтому состояние лимфоузлов мало влияет на естественное течение заболевания.
В Италии провели 2 исследования, несколько отличающихся по дизайну, и, вероятно, поэтому получили разные результаты. Parazzini и соавт. обследовали 456 женщин с III и IV стадиями РЯ в рамках проспективного рандомизированного исследования по изучению эффективности XT. У 161 пациентки обнаружены метастазы в лимфоузлах, причем при низкодифференцированных опухолях (G3) чаще, чем при высоко- и умереннодифференцированных (G1 и G2). Авторы не выявили отличий в показателях выживаемости между больными с метастатическими и интактными лимфоузлами. Следовательно, положительное влияние удаления метастатических лимфоузлов на выживаемость не установлено. Scarabelli и соавт. выполнили лимфаденэктомию 98 больным РЯ IIIс—IV стадии, у которых не было макроскопических остаточных опухолей; в группу контроля вошло 44 пациентки, которым лимфаденэктомия не проводилась. Выживаемость больных, которым выполнили лимфаденэктомию, была значительно лучше (анализ Кокса). Результаты этого исследования показали, что лимфаденэктомия обеспечивает потенциальный терапевтический эффект, но в определенной группе пациенток. Ранее обсуждались аналогичные выводы клинического испытания SCOTROC-1.
Мы обязательно выполняем стандартную тазовую и парааортальную лимфаденэктомию, но при условии оптимального уменьшения объема опухоли. Эффективность лимфаденэктомии при большом объеме остаточной опухоли, по нашему мнению, сомнительна. При поздних стадиях РЯ показано удаление всей опухоли, если это технически возможно. Для этого разработано много способов. Некоторые врачи используют хирургический УЗ-аспиратор, другие предлагают электрохирургическую резекцию с помощью электрокоагулятора с аргоновой приставкой, третьи все еще убеждены, что резекция диафрагмальной брюшины или мышцы играет важную роль в циторедукции. Влияние всех этих методов на выживаемость окончательно не определено. Следует с осторожностью относиться к успешному применению той или иной методики в руках отдельных энтузиастов и подождать весомого подтверждения в публикациях.
Растет число сторонников проведения лапароскопии вместо лапаротомии. Технически это возможно, но целесообразность удаления больших объемных образований придатков матки с помощью лапароскопа сомнительна. В публикациях описаны случаи возникновения метастазов в местах введения троакаров. Феномен рецидива рака в области послеоперационного рубца хорошо известен, однако удивительно, что даже при большой интраабдоминальной опухоли это редкость. Wang и соавт. провели обзор литературы для определения факторов риска ранних рецидивов в местах установки портов. Из всех злокачественных опухолей женских половых органов метастазы в местах введения троакаров чаще всего возникают при раке яичника (РЯ), независимо от того, имеется асцит или нет, стадии заболевания (ранней или поздней), появления после диагностических или паллиативных операций.
Такие метастазы обнаруживали и при опухолях низкой степени злокачественности. Чаще они возникают при асците и канцероматозе брюшины. Наименьший промежуток времени между лапароскопией и появлением метастаза в месте установки порта составил 8 дней. По этому поводу предложили несколько теорий: имплантация раковых клеток при травматической диссеминации во время удаления первичной опухоли, прямая имплантация инструментами, создание градиента давления при пневмоперитонеуме с последующим выходом газа (через порты), который привел опухолевые клетки во флотирующее состояние. Лапароскопия больше подходит для удаления доброкачественных образований придатков матки. При подозрении на РЯ мы предпочитаем лапаротомный доступ. Если во время лапароскопии обнаруживают РЯ, необходимо немедленно перейти на лапаротомию.
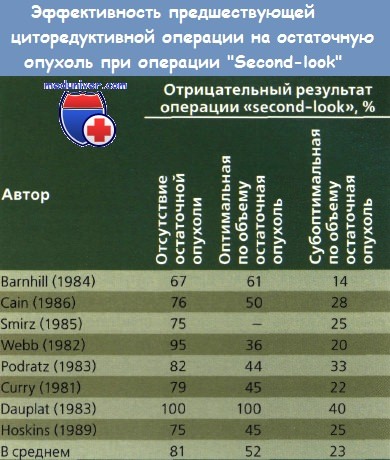
Группа EORTC сообщила о собственном опыте циторедуктивных операций при поздней стадии рака яичника (РЯ). Пациентки получили 3 курса цисплатина и циклофосфамида, и затем их разделили случайным образом на две группы: одним выполнили циторедуктивную операцию, другим — нет. Все женщины получили 6 курсов XT. Среди 278 пациенток медиана выживаемости составила 26 и 20 % (операция и без операции; р = 0,012). Многофакторный анализ показал, что циторедуктивная операция была независимым прогностическим фактором. После учета всех факторов прогноза оказалось, что хирургическое вмешательство снизило риск смерти на 33 % (р = 0,008).
В 2004 г. GOG сообщила о проведении аналогичного исследования, в которое было включено 550 больных. При неоптимальной первичной цито-редуктивной операции (остаточная опухоль более 1 см) назначали 3 цикла паклитаксела с цисплатином. После этого пациенток рандомизировали на две группы: одним продолжили XT, а другим выполнили вторую циторедуктивную операцию и продолжили XT. Промежуточная (дополнительная) между курсами XT операция не привела ни к улучшению безрецидивной выживаемости, ни к снижению относительного риска смерти. Авторы предполагают, что разница в результатах может быть обусловлена более агрессивным выполнением хирургических вмешательств у пациенток в исследовании GOG по сравнению с EORTC. Если суммировать оба исследования, можно сделать следующее заключение: пациенткам с поздними стадиями рака яичника (РЯ) показана хотя бы одна циторедуктивная операция, но с максимально возможным уменьшением объема опухоли, лучше, если се проведет онкогинеколог.
Нет сомнений, что тщательно выполненная первичная циторедуктивная операция — основной фактор, определяющий отдаленную выживаемость. Выбор времени для проведения хирургического вмешательства, целью которого служит удаление максимально возможного объема опухоли, остается предметом обсуждения. При относительных противопоказаниях (возраст, сопутствующие заболевания, плевральный или перикардиальный выпот) и распространенном злокачественном процессе в брюшной полости успешную циторедуктивную операцию осуществить невозможно, поэтому настоятельно рекомендуется рассмотреть вопрос о назначении неоадъювантной XT. Хороший клинический ответ после 2—4 циклов XT часто дает возможность выполнить эффективную циторедуктивную операцию с небольшой частотой осложнений. До начала XT нужно точно установить локализацию рака (яичник, маточная труба или брюшина), используя для этого цитологическое исследование или малоинвазивное хирургическое вмешательство. На сегодня неоадъювантная XT с последующей циторедуктивной операцией представлена в нескольких небольших ретроспективных исследованиях, включающих от 20 до 90 пациенток. Результаты указанной терапии аналогичны таковым при первичном хирургическом вмешательстве с последующей XT.
В текущем клиническом исследовании, проводимом EORTC и Национальным институтом рака (NCI) в Канаде, принимает участие более 700 больных, набор которых закончен в 2006 г. Ожидают, что это исследование даст подробную информацию о показаниях к неоадъювантной XT с последующей операцией и результатах такого комбинированного лечения.
У пациенток после обширного хирургического вмешательства увеличен риск расхождения краев раны, поэтому нужно использовать методики ушивания передней брюшной стенки через все слои. Однако в ситуациях выпячивания отечных петель кишечника из брюшной полости во избежание прорезания фасции и снижения риска несостоятельности рубца лучше наложить узловые швы с отсроченным их затягиванием.
Удаление остаточной опухоли в средостении.
Мой диагноз- ЛГМ средостения, 2 -А стадия, нодулярный склероз. Объем опухоли был 15 см. Удалены левый и правы надключичные лимфоузлы. Часть опухоли брали на гистологию.
Лечилась с мая 2012 по декабрь 2012. Приняла 6 "красных" химий, 14 лучей. Ответ на лечение был хороший. В марте 2013г. сделала КТ. Размер опухоли стал немножко увеличиваться.Плохо себя почувствовала. Отекала шея. Такое состояние, что мешает щитовидка. Предположили, что это фиброз. В апреле мне была сделана торакальная операция (стернотомия).
Удалена остаточная опухоль средостения, убраны очаги фиброза, кальциноза. После операции КТ показало значительное сужение левой плече головой вены. Если я поняла верно она не действует вообще. После операции была жидкость в легком. 500мл. Убрали + курс антибиотиков. Результат гистологии фиброза- атипичные клетки отсутствуют. Теперь наблюдаюсь. Чувствую себя не очень хорошо. Немножко отекает левая часть лица. Бывают боли в сердце при хорошем давлении и кардиограмме, тянет грудину, слабость, болит спина. Очень хотелось бы пообщаться с тем кто прошел через это. Услышать мнение врачей - как восстанавливаться после стернотомии? Возможно ли развитие фиброза на месте иссечения опухоли? Если да, то опять операция?Останется ли венозная сетка? Заранее благодарна за ответы!
Тромбоз плечеголовной и яремной вен.
После операции по удалению остаточной опухоли в средостении обнаружили тромбоз плече головной и яремной вены.Назначили клексан 0,4 ) 7 дней и детролекс *14 дней. Облегчение минимальное.Тянущая боль от уха к шее. Ощущение остановки сердца. При этом давление и пульс нормальный. Чувство сильного давления в голове. Отекло лицо. Сколько может продлится курс лечения? Какой правильный образ жизни вести. Подвижный или нет? есть ли специальная гимнастика? Заранее благодарна за ответы.
Большое спасибо,что ответили.
Постлучевой фиброз легких.
Диагноз ЛГМ средостения 2-а стадия, нодулярный склероз. Лечение 6 химий с доксорубином, 14 лучей - по 40грей. Лечение закончено в декабре 2012г. После второй химии пульмонит. После прохождения КТ в описании - пост лучевой фиброз легких. Не всегда удается вздохнуть полной грудью. Может ли фиброз уменьшится за счет принятия каких-то препаратов, лечебной гимнастики и т.д.? Влияет ли изменение погоды на общее состояние при наличии фиброза? Заранее благодарна за ответ.
Любые постлучевые изменения именно тем отличаются от различных воспалительных процессов, что с годами только усугубляются. Но приостановить этот процесс и (чем черт не шутит) даже слегка облегчить его можно с помощью ингаляционной терапии. Используются гормоны (кортикостероиды) и димексид. Но конкретную рецептуру я не знаю, надо искать.
В России в Обнинске есть онкологический центр, где было единственное когда-то на страну отделение постлучевых осложнений (кажется, оно и сейчас единственное). Там накоплен богатый опыт. Попробуйте обратиться к ним.
Читайте также:

