Операция по удалению рака дна полости рта
Злокачественное новообразование представляет собой длительно незаживающую язву эпителиального слоя слизистой оболочки рта и ретромолярной области.
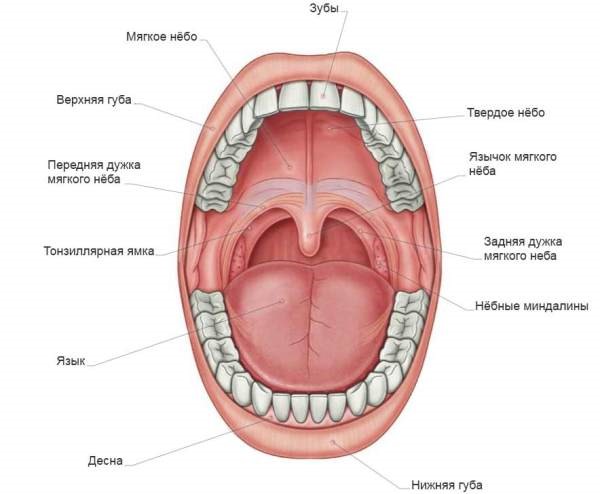
Анатомическое строение
Полость рта – это начальный отдел пищеварительного тракта, в котором пережевывается пища, вырабатывается слюна для переваривания пищи. Он задействован в процессе дыхания, глотания, артикуляции и речи.
В состав ротовой полости входит:
- преддверие (губы, передняя сторона зубов, внутренняя поверхность щек);
- десны;
- дно, на котором лежит язык;
- две трети языка;
- зубы;
- позадимолярный треугольник – пространство на нижней челюсти позади третьего моляра;
- твердое и мягкое небо.
Классификация
Рак полости рта подразделяется на три вида:
- папиллярный. Узелок в слизистой оболочке увеличивается в размере и свисает в полость рта. Новообразование медленно прогрессирует;
- инфильтративный. Уплотнение на розоватой слизистой отличается белесым цветом, четкими контурами и формой, истончением оболочки вокруг. При пальпации со стороны щеки чувствуется плотный инфильтрат. Опухоль склона к быстрому росту. Больной жалуется на невыносимую боль;
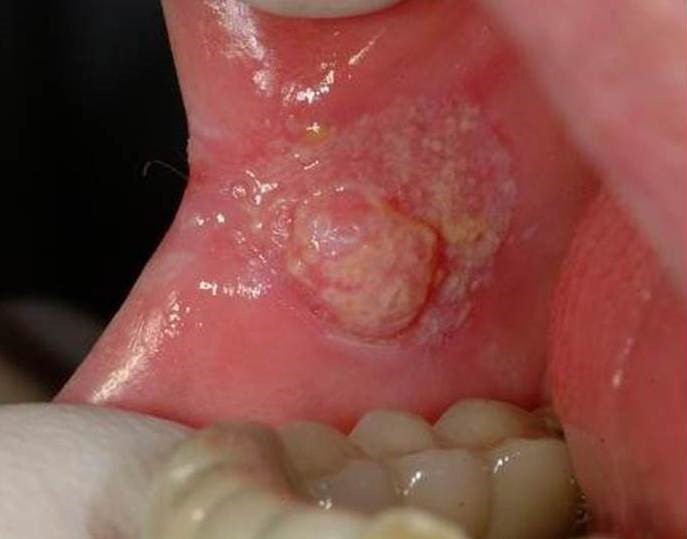
- язвенный. Наиболее распространенная форма заболевания. Язвочки на слизистой не заживают, разрастаются, а кайма вокруг них краснеет. Контур рваный, а его края кровоточат.

Метастазы опухоли появляются быстро. Злокачественные клетки прорастают в подбородочные, подчелюстные, глубокие яремные лимфатические узлы. На этот процесс влияет толщина и глубина опухоли. Так, при углублении новообразования на 4-5 мм метастазы возникают в 98% случаев. На Т1-стадии онкологии метастазирование выявляется в половине случаев, а при достижении Т4-стадии отдаленное распространение раковых клеток наблюдается в 85% случаев.
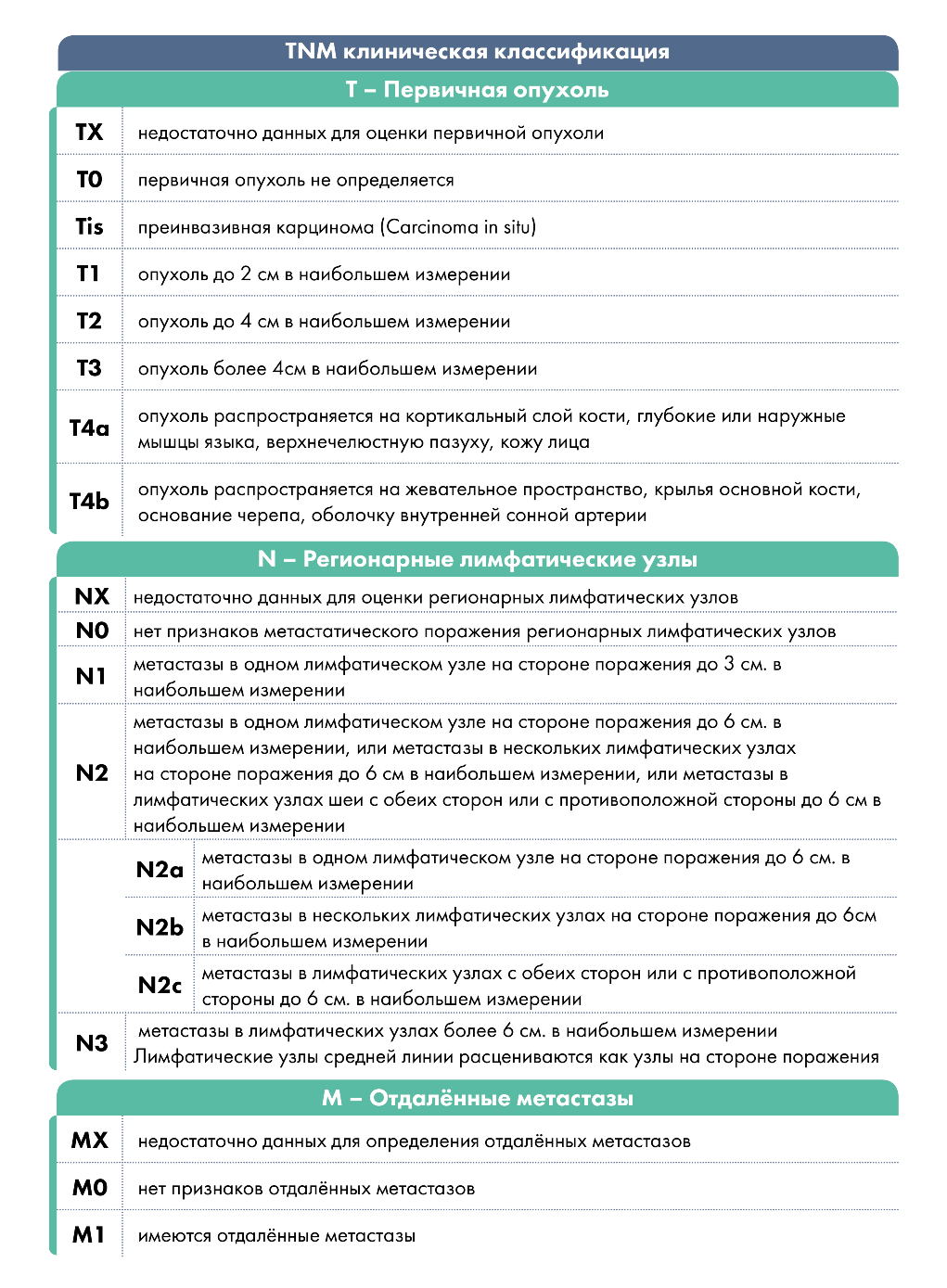
Классификация TNM
Причины возникновения
Распространенность рака полости рта растет и на сегодняшний день диагностируется у 2% больных среди общего числа заболевших. Начиная с 2009 года, заболеваемость выросла на 25%, при этом в основном выявляется плоскоклеточный рак и только в единичных случаях – аденокарцинома.
Большинство очагов онкологии наблюдается на языке. Чуть меньше злокачественных образований на дне полости рта. Рак мягкого и твердого неба, десен и щек выявляется в 20% случаев. Гораздо реже диагностируется поражение альвеол нижней челюсти – 4%, дужек неба, ретромолярной области и преддверия – 3%.
Исходя из практики, онкологии полости рта больше подвержены мужчины, чем женщины. Это связано с вредными привычками, например, злоупотребление сигаретами или разжевывание тонизирующих смесей усиливает выработку слюны, которая вымывает полезные элементы со слизистой. В группу риска входят больные ВПЧ, пожилые люди, работники вредных производств, больные красным плоским лишаем, люди, у которых систематически травмируется слизистая рта пломбой, протезом, металлическими предметами.
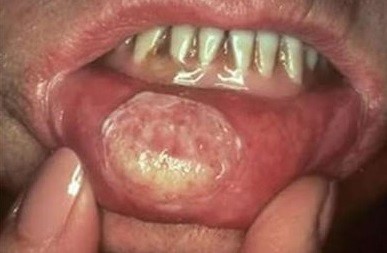
Симптомы
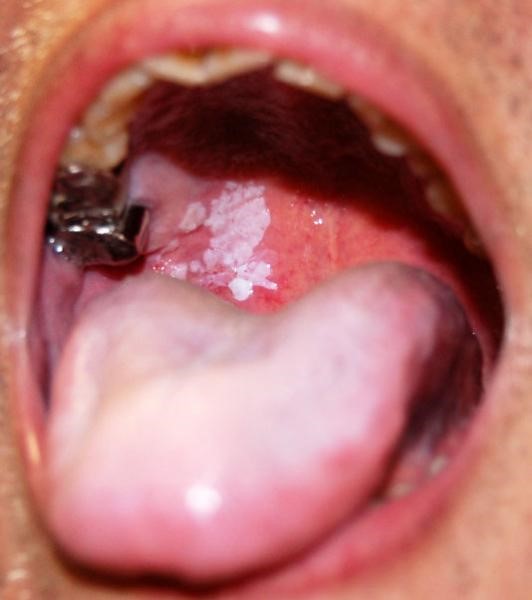
Идентифицировать злокачественную язву от обычного стоматита во рту можно по отеку и припухлости щек, болезненности и постоянному дискомфорту даже в состоянии покоя. Насторожить должно длительное незаживление раны и ее кровоточивость.
По мере развития заболевания признаки усиливаются:
- отек нарастает и распространяется на шею;
- усиливается красное или белое пятно на слизистой рта;
- неприятные ощущения при пережевывании и глотании;
- трудности при разговоре из-за трения слизистой о зубы при движении челюсти;
- появление неприятного запаха изо рта;
- чувство инородного предмета в горле;
- анемия рта.
 |  |
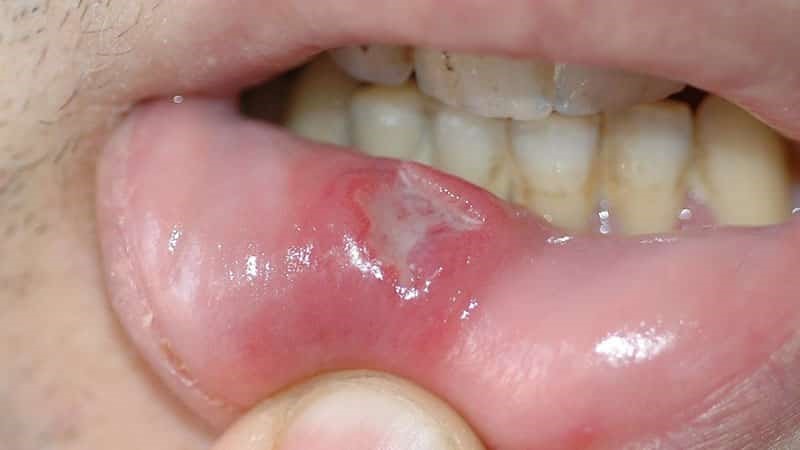 |
На поздней стадии рака выпадают зубы, стремительно снижается масса тела.
Диагностика
На первичной консультации врач осматривает полость рта, рассматривает язвы, эрозии, повреждения слизистой, а затем берет мазок для исследования. Для подтверждения воспалительного процесса больной направляется на общий и биохимический анализ крови.
Диагноз подтверждается по результатам обследования:
- при подозрении на метастазы проводится аспирационная биопсия тонкой иглой лимфатических узлов под подбородком, под челюстью и в верхней трети шеи;
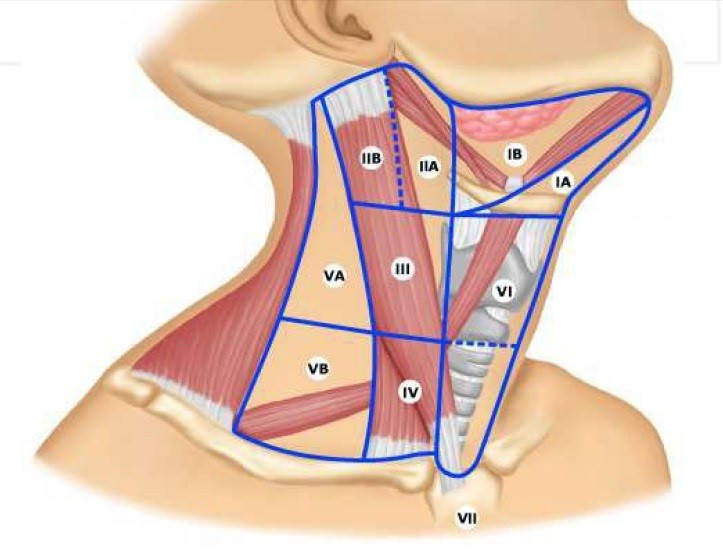
- позитронно-эмиссионная томография. Показывает глубину залегания опухоли, а также ранние метастазы;
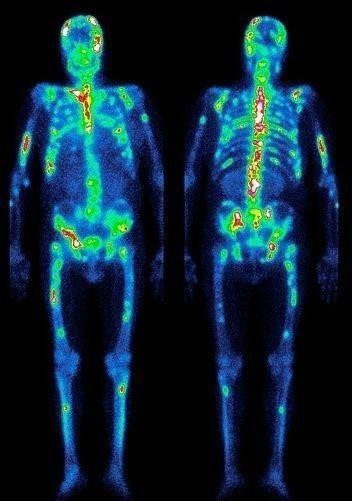
- остеосцинтиграфия. Исследуются кости скелета для поиска перемещенных раковых клеток;
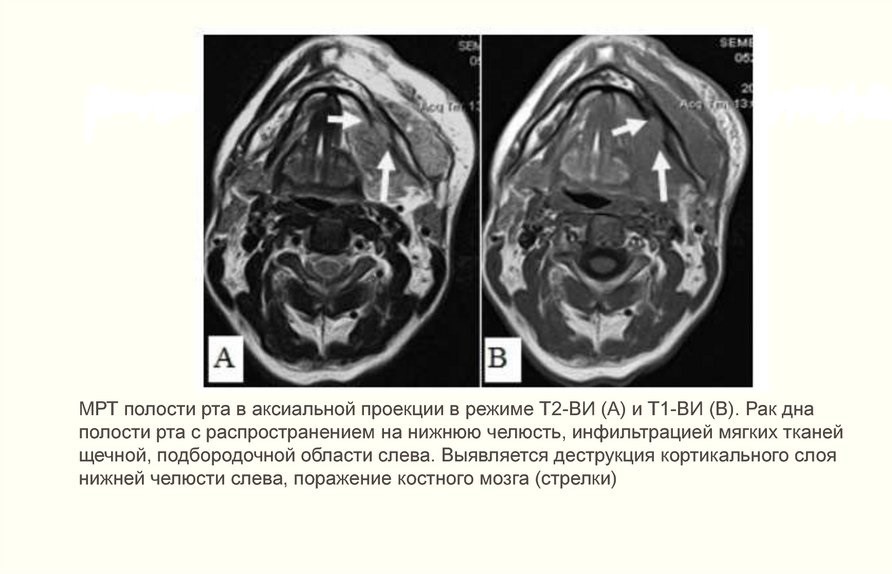
- КТ костей лица с контрастом. Снимки показывают прорастание опухоли в шейные сосуды, челюсть или основание черепа.
Лечение
Выбор тактики лечения зависит от стадии и распространенности новообразования. При быстром разрастании опухоли методы терапии комбинируются.
Принцип хирургического вмешательства врач определяет после определения стадии опухоли и ее распространения. Если раковые клетки проникли в надкостницу и окружающие ткани, проводится клиновидная, плоскостная или сагиттальная резекция челюсти. Если при обследовании выявлено прорастание раковых клеток напрямую в кость или дефект замечен уже во время операции, осуществляется сегментарная резекция нижней челюсти. Врач на месте оценивает поражение и определяет толщину иссекаемого слоя.
Следующий этап операции – это частичное или полное иссечение шейных лимфатических узлов для предотвращения метастазов при условии толщины опухоли более 4 мм или расположении очага опухоли в дне полости рта или на языке. Если новообразование расположено на срединной линии, то шейные лимфатические узлы иссекаются с двух сторон. Операция завершается одномоментным замещением поврежденных тканей.
После удаления опухоль отправляется на гистологическое исследование. Оценивается ее размер, толщина, глубина, края. На дальнейшее лечение влияет прорастание клеток за границы капсулы удаленного лимфатического узла, расхождение раковых клеток на соседние органы.
Облучение после операции назначается при диагностировании Т3, Т4, N2, Т3 стадий болезни не позже чем через шесть недель после удаления опухоли. Необходимость в лучевой терапии возрастает при периневральной инвазии в лимфатических сосудах. Суммарная очаговая доза за все сеансы – 60 гр, а разовая очаговая доза за один сеанс – 2 гр. При выявлении метастазов на шее СОД повышается до 66 гр, а при отсутствии риска метастазирования СОД уменьшается до 50 гр.
В качестве основного лечения лучевая терапия используется в суммарной очаговой дозе 60-70 гр. Процедура проводится пять дней в неделю, при этом она комбинируется с химиотерапией. Каждые три недели вводится 100 мг цисплатина.
Противоопухолевые препараты назначаются перед хирургическим вмешательством или одновременно с лучевой терапией для уменьшения размера новообразования. Иногда терапия назначается одновременно с операцией.
Лечение предполагает использование схемы 5-фторацила вкупе с цисплатином или иные средства – карбоплатин, метотрексат, блеомицин. Они вызывают ряд побочных явлений, например, рвоту или тошноту, выпадение волос, снижение аппетита, повышение кровоточивости. Симптомы исчезают после прохождения курса лечения, но после приема цисплатина иногда фиксируется стойкое нарушение слуха.
Прогноз рака полости рта зависит от стадии, на которой выявлена болезнь. Если лечение начато на нулевой стадии, то болезнь купируется. Стоит отметить, что курение провоцирует рецидив или перерождение опухоли, поэтому может потребоваться повторная операция или облучение. Оперирование на первой стадии повышает выживаемость до 80-85%, а комбинация лучевой терапии с операцией на второй стадии на 60-80%. Уже на последующих стадиях развития рака выживаемость не более 50%, при этом применяются все три метода лечения одновременно.
Диспансерное наблюдение
Поскольку опухоль может рецидивировать и дать метастазы, после пройденного курса лечения больной встает на учет в онкодиспансер. Первый год следует посещать врача каждый месяц, второй год профилактический осмотр проводится каждые 4-6 месяцев, а далее раз в год или при каких-либо недомоганиях. Осмотр предполагает прохождение обследования – УЗИ и контрастное МРТ мягких тканей шеи, ПЭТ, остеосцинтиграфию. Обязательна консультация отоларинголога, стоматолога и онколога. Доктор может сократить срок диспансеризации при высоком риске рецидива.
Список литературы по теме:
Полость рта является основным и единственным инструментом вербального общения между представителями человеческого вида. Однако кроме речевой функции, она имеет множество дополнительных, но не менее важных подфункций, в том числе подготовки и образования болюса (комка пищи, предназначенного для глотания), формирования вкуса и процесса глотания.
Целостность полости рта в целом необходима для предотвращения аспирации, сохранения правильной речи. Поэтому лечение различных форм рака ротовой полости опасно нарушением целостности этой области тела. Зачастую после таких операций проводят восстановительную физиотерапию и, при необходимости, реконструкцию части лица, челюсти, десны.
Рак дна полости рта может иметь разрушительные последствия. Начинается заболевание обычно с образования безболезненного узлового или язвенного поражения, которые могут быть незаметными для пациента. Опухолевые новообразования дна полости рта располагаются вне зоны постоянного наблюдения. Из-за этого многие больные обращаются к врачу на продвинутой стадии рака. Как правило, в этот период опухоль или язва уже становится болезненной и вызывает функциональные нарушения.
Строение дна ротовой полости
Дно полости рта представляет собой подковообразную полость под языком. Оно простирается от передней внутренней стороны (язычной поверхности) нижней десны и альвеолярного отростка нижней челюсти в боковом направлении по отношению к передней части языковой миндалины. Эта поверхность ограничена свободной нижней поверхностью языка. Её вогнутость имеет решающее значение для эффективного глотания слюны.
Спереди дно ротовой полости разделено на две части язычной уздечкой. Кроме того, на этом участке находится подъязычная складка, покрытая слизистой оболочкой с многослойным плоским эпителием. Под поверхностью слизистой оболочки располагаются две большие слюнные железы. Подъязычные и подчелюстные железы впадают в дно полости рта, проходя через канал бартолиновой железы и вартонов проток. Расстояние между сублингвальными железами и подбородочноязычной мышцей составляет около 5 см.

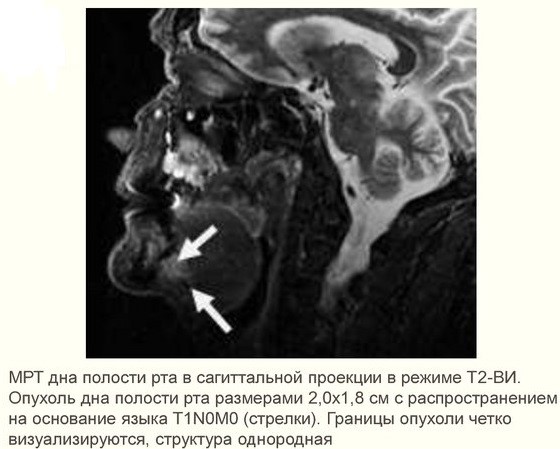
Рис. 1. Схема расположения раковой опухоли дна ротовой полости
В средней линии дна полости рта подбородочноязычная мышца отделяет подъязычные слюнные железы. Подъязычная железа имеет несколько мелких отверстий в дополнение к бартолиновому протоку, расположенному в подъязычной складке.
Мировая статистика заболеваемости раком ротовой полости, факторы риска
По статистике, рак головы и шеи занимает 15% от общего количества случаев рака всего тела. Встречается такое заболевание с частотой 9,5 случаев на 100 тысяч населения. Злокачественные опухоли полости рта составляют примерно 30% от общего числа опухолей головы и шеи. Например, в США 5% всех случаев рака занимают именно случаи рака полости рта и различных частей рта. Рак дна полости рта составляет около 35% от этих случаев.
По всему миру уровень заболеваемости значительно колеблется. В Индии, например, раком полости рта болеют 50% населения от всего числа людей, имеющих злокачественные опухоли. Это различие обусловлено принципиально разным подходом к гигиене рта и зубов, а также жеванием бетеля. Рак ротовой полости чаще встречается у мужчин, чем у женщин (примерно 3:1).
Предрасположенность к раку дня полости рта может быть семейной, генетической или приобретенной (иммуносупрессия, сифилис, синдром Пламмера-Винсона, хронический кандидоз). Эти факторы риска и основной патогенез не исчезают после хирургического иссечения или лучевой терапии рака. Органы остаются чувствительными. Если пациент продолжает пить, курить и подвергаться воздействию других раздражителей, риск развития вторичной опухоли возрастает на 40%. Кроме того, уменьшается ответ организма на лучевую терапию.
Диагностика и симптомы злокачественной опухоли дна ротовой полости
Диагностика рака дна полости рта проводится при полном осмотре ротовой полости: языка, зубов, десен, внутренней стороны щек. Дно полости рта врач пальпирует рукой для оценки расположения, размера и степени первичной опухоли. Бимануальная экспертиза также позволяет оценить вовлечение в злокачественный процесс органов и тканей подчелюстного треугольника. Осмотр головы и шеи проводится с учетом ушей, носа, ротоглотки и пальпации шеи.
Наиболее частым видом опухоли дна полости рта является безболезненная язва с плохо очерченными краями. В 20% случаев в окружающих тканях наблюдается лейкоплакия (ороговение слизистого эпителия). Она может предшествовать появлению язвы или появиться уже после неё. Небольшие язвы или узловые поражения могут оставаться бессимптомным в течение длительных периодов времени, так что пациент может не обращаться за медицинской помощью. Болевые симптомы слизистой оболочки могут быть связаны с афтозными язвами. Менее чем в половине случаев язва локализуется лишь на половине дна ротовой полости. Если же пациент пренебрегает первичными признаками заболевания, опухоль может распространиться на всю область дна полости рта с метастазами в шею или другие органы.
Злокачественные опухоли полости рта быстро растут, для них характерно частое и раннее метастазирование в окружающие регионарные лимфатические узлы. Наличие региональных метастазов в лимфоузлах на момент первоначального клинического обследования составляет 30-35%. Клинические симптомы вызываются ростом поражения и вторжением его в глубокие слои тканей. Края злокачественного новообразования становятся более нечеткими, основание язычка и лингвальная часть альвеолы могут быть также поражены.
Основные симптомы злокачественной опухоли дна полости рта:
- неприятный запах изо рта;
- боль в ухе (воздействие на язычный нерв);
- кровотечение;
- некроз краев язвы;
- тошнота, потеря веса, рвота, отсутствие аппетита;
- нарушение двигательной активности языка;
- трудности с глотанием, жеванием, потеря чувствительности языка;
- отсутствие вкуса ранее знакомых блюд.
Лечение рака дна ротовой полости
Выбор метода лечения основывается на оценке индивидуальных потребностей пациента и клинических показателей заболевания, а также опыта врачей. Хирургическая резекция или лучевая терапия, как правило, эффективны для лечения I и II стадий рака. По отдельности эти методы неэффективны на III и IV стадии. Таким образом, в большинстве случаев для лечения поздних стадий рака применяется комбинация двух и более методов.
Химиотерапия и облучение обычно используются для лечения крупных опухолей. Препараты могут помочь в послеоперационный период, когда есть необходимость щадящего воздействия на орган. Предоперационная лучевая терапия хороша в управлении крупными опухолями. В любом случае первичные опухоли следует рассматривать радикально, с тщательной оценкой состояния лимфатических шейных узлов.
Радикальный и наиболее часто используемый метод лечения – хирургическое иссечение. Популярна и криотерапия, лазерное удаление, а также комбинация нескольких способов. В каждом конкретном случае лечение зависит от анатомического расположения, размера и степени развития первичной опухоли, наличия или отсутствия метастазов в области шеи, возраста пациента и общего состояния здоровья до заболевания.
Профилактические меры:
- отказ от алкоголя, курения, жевания табака;
- противораковая диета (больше свежих овощей, зелени и фруктов, рыбы, орехов и сырых масел, меньше жареной пищи, мяса и рафинированных продуктов, фастфуда);
- разумные нагрузки, употребление необходимого количества жидкости;
- регулярные профилактические осмотры, анализы крови;
- соблюдение гигиены полости рта.
Боль в животе, вздутие и рвота могут быть признаками предынфарктного состояния
В декабре у папы,1950г.р., диагностировали рак слизистой дна полости рта, умеренно дифференцированный плоскоклеточный с наклонностью к ороговению Т3Н1М0. С 11.01.11 по 28.02.11 прошел химеолучевую терапию в Герцена по радикальной программе, СОД 50 грей. 10 марта сделали МРТ и УЗИ. МРТ: На серии Т1 иТ2-взвешанных томограмм лицевого отдела черепа в видимых отделах головного мозга очаговые изменения не выявлены. Субарахноидальные пространства не расширены. Стволовые структуры без особенностей. При контрольном МР исследовании ранее визуализируемая зона патологического сигнала в передних отделах дна полости рта, с распространением на боковые отделы справа и слева при настоящем исследовании отчетливо не визуализируется. Справа, между нижней челюстью и челюстно подъязычной мышцей сохраняется образование гиперинтенсивного сигнала с достаточно четкими ровными контурами, размерами 11-10мм. В подчелюстных областях увеличенные л. размерами до 12мм. По ходу грудинно-ключичного сосцевидной мышцы справа и слева размерами до 10мм. Заключение: При сравнении с МР данными от18.12.2010 выраженная положительная динамика опухолевого процесса. В виде полной резорбиции опухолевого пр-сса?? Регионарная лимфоаденопатия.
Узи В полости дна рта, языка четкие очаговые изменения не визуализируются. На шее четкие суспициозные л.у. не визуализируются. Определяются постлучевые отечные явления в правой подчелюстной мышце и в области корня языка.
При пальпации под подбородком врачи что-то находят, похожее на опухоль, а в пораженном лимфоузле,наоборот образование не прощупывается. На консилиуме направляют на операцию по удалению лимфаузлов во время которой собираются делать обширную биопсию дна полости рта(вырезать большой объем с захватом здоровых тканей) для принятия решения(насколько я поняла прямо во время опрерации) по объему операции. Множественную(. ) пункцию брать не хотят чтобы не разносить опухоль.Во время нахождения на лечении в радиологии(результатов МРТ и УЗИ не было) на консилиуме была предложена операцию с полной резекцией языка, потому что опухоль близко подходит к корню(после которой, как сказали, папа не сможет говорить.
Вопросы:
1.Что такое гиперинтенсивный сигнал(на МРТ) с достаточно четкими ровными контурами, размером 11-10мм?
2. Нельзя ли до операции определить ее объем?
3.Почему есть опасность "разнесения" опухоли при пункции, если он получил большую дозу облучения. При операции ее, что нет?(учитывая, что злокачественность под вопросом)
3. Как во время операции можно сделать биопсию?(это же требует времени). Больше всего меня, конечно, волнует удаление языка полностью. Я читала, что при подобных операциях удаляется половина и речь потом восстанавливается частично или даже полностью. Как во время операции можно определить насколько плотно опухоль (если она вообще есть) подходит к корню языка?
Заранее большое спасибо. И простите за возможно неправильно поставленные вопросы. Просто как-то старшно идти на операцию, не имея никаких представлений о ее объеме.
1.Что такое гиперинтенсивный сигнал(на МРТ) с достаточно четкими ровными контурами, размером 11-10мм?
Описание картинки, получаемой на магнитном томографе. На основании этой картинки рентгенолог пишет заключение. Для того, чтобы вникнуть в проблему, нужно выучиться по специальности "лучевая диагностика". Врачам и пациентом достаточно прочитать заключение.
2. Нельзя ли до операции определить ее объем?
Можно, но при подобной локализации весьма приблизительно. Поэтому согласие перед операцией берут на максимальный объем. Вы же понимаете, что во время наркоза пациента не будят для того, чтобы спросить, согласен ли он, если уберут больше, чем планировали.
3.Почему есть опасность "разнесения" опухоли при пункции, если он получил большую дозу облучения. При операции ее, что нет?(учитывая, что злокачественность под вопросом)
Злокачественность не под вопросом, к сожалению. Это злокачественная опухоль без вариантов. И как окончательный этап лечения выполняется хирургическое лечение. Бывает, что при операции опухоль сильно разрушена после предыдущего лечения, или вообще отсутствует. Это хороший прогностический признак. Но до операции этого узнать нельзя.
3. Как во время операции можно сделать биопсию?(это же требует времени). Больше всего меня, конечно, волнует удаление языка полностью. Я читала, что при подобных операциях удаляется половина и речь потом восстанавливается частично или даже полностью. Как во время операции можно определить насколько плотно опухоль (если она вообще есть) подходит к корню языка?
Для этого существует экспресс-биопсия. Она требует от 15 до 30 минут.
Определить можно руками, инструментами, экспресс-биопсией. Хирурги работают не только руками, но и головой.
Обсуждать объем планируемой операции виртуально нет смысла. Все равно окончательное решение принимается только во время операции.
Больной М, 42 лет, находился в отделении опухолей головы и шеи Молдавского НИИ онкологии со 2.03 по 10.06.1979 г. по поводу рака слизистой оболочки дна полости рта, IIIб стадии, T3N1M0. Болеет с декабря 1978 г., когда под языком появилась опухолевая язва, быстро увеличивающаяся в размерах. При обследовании установлен вышеуказанный диагноз.
В плане комбинированного лечения с 6.03.1979 г. проведена предоперационная дистанционная гамма-терапия на область первичного очага и зоны регионарного метастазированпя в суммарной очаговой дозе 52 Гр с незначительным уменьшением опухоли. На втором этапе лечения, 8.05.1979 г., под интратрахеальным ГОМК-морфиновым наркозом произведены широкое электронссечеине тканей дна полости рта, языка с резекцией фронтального отдела нижней челюсти, верхнее фасциально-футлярное иссечение шейной клетчатки. Пластика дефекта дельтопекторальным лоскутом. Трахеостома.
Описание операции. Под местной пнфпльтрацпонной анестезией 0,5% раствором новокаина наложена средняя трахеостома, через которую введена интубационная трубка и начат наркоз. На передней поверхности грудной клетки справа заготовлен дельто-пекторальный лоскут на медиальной ножке.
Произведен дугообразный разрез, начиная от задних краев грудино-ключично-сосцевидных мышц параллельно нижнему краю нижней челюсти, отступив от него на 2 см. Отсепарованы кожные лоскуты, осуществлено верхнее фасциально-футлярное иссечение шейной клетчатки с двух сторон.
Клетчатка акцессорной зоны, подчелюстного и подбородочного треугольников вместе с подчелюстными слюнными железами отсепарованы к средней линии, и препарат фиксирован к подбородочной области. После отсепаровки кожно-мышечный лоскут приподнят кверху, что позволило получить хороший обзор операционного поля.

Рак дна рта
Пилой Джильи справа на уровне 3 зуба, а слева — на уровне 4 пересечено тело нижней челюсти. Электроножом произведено широкое иссечение тканей передней трети языка, дна полости рта, отступив от края на 2,5 см. Препарат удален в едином блоке. Тщательный гемостаз.
Дефект слизистой оболочки дна полости рта к передних отделов языка замещен дпстальным участком дельто-пекторального лоскута. Кожа последнего подшита отдельными шелковыми швами к краям дефекта слизистой оболочки.
Сегменты нижней челюсти закрыты мягкими тканями. Ушита рана подчелюстной области. Питающая ножка лоскута сшита в виде круглого стебля. Аспирационный дренаж введен в подчелюстную область. В линии шва материнской половины дельто-пекторального лоскут - резиновые выпускники.
Асептическая повязка. В трахею вставлена трахеотомическая трубка № 5. Заживление раны первичным натяжением. Результат гистологического исследования послеоперационного препарата №215065-076 — плоскоклеточнып ороговевающий рак, прорастающий мышечную ткань, слюнные железы, дно полости рта п язык. В лимфоузлах и подчелюстных слюнных железах клеток опухолевого роста не найдено, имеются разрастания склерозпрованной фиброзной ткани. Прорастания опухоли в кость не отмечено. 23.07.1979 г. произведено отсечение питающей ножки дельто-пекторального лоскута. Окончательно сформировано дно полости рта.
Выписан в удовлетворительном состоянии. В настоящее время признаков рецидива и метастазов нет.
Проведенные исследования дают основание говорить о целесообразности использования дельто-пекторального лоскута для первичной пластики и формирования дна полости рта после расширенных и комбинированных операций в области слизистой оболочки полости рта.
Общие сведения о реабилитации
В настоящее время реабилитация онкологических больных приобретает все большее значение в связи с увеличивающимся числом излеченных больных (Герасименко В. Н., 1977).
Необходимо отметить, что выживаемость больных при раке далеко не равноценна полному выздоровлению.
Обширные хирургические операции, интенсивная лучевая, цитостатическая и гормональная терапия, используемые в онкологической практике, приводят к серьезным нарушениям различных функций организма.
Больной может считать себя здоровым только в том случае, если он сохраняет способность к нормальной жизни и работе. Конечной целью лечения является оказание помощи больному с тем, чтобы он снова мог занять свое прежнее положение в семье и обществе. Реабилитация онкологического больного должна рассматриваться как итог, достигнутый в области профилактики, диагностики и лечения злокачественного заболевания.
За последнее десятилетие накоплен значительный опыт в лечении больных злокачественными опухолями головы и шеи. Развитие методов комбинированного лечения привело к продлению жизни больных на многие годы. Как уже было отмечено, основным методом лечения больных с местнораспространенными злокачественными опухолями головы и шеи является комбинированный, где расширенное хирургическое вмешательство занимает ведущее положение.
Расширенные и комбинированные оперативные вмешательства в хирургии рака головы и шеи связаны с определенными трудностями, обусловленными прежде всего образованием послеоперационных дефектов, возможность закрытия которых местными тканями ограничена.
Кроме того, после расширенных операций по поводу местнораспространенных злокачественных опухолей головы и шеи возникают обезображивающие изъяны, ведущие к нарушению ряда важных функций, в частности, акта глотания, жевания, речи, дыхания. Поэтому удаление местнораспространенных злокачественных опухолей головы и шеи — это только один из этапов лечения больных.
Другой, не менее важной и ответственной задачей, является реабилитация этих больных, возвращение их к обычному образу жизни и труду, что достигается различными путями. С одной стороны, разрабатываются способы устранения послеоперационных дефектов с помощью лицевого (эктопротезы) и зубного протезирования (Чуйков В. М., 1976).
Это в известной мере позволяет уменьшить степень наносимых операцией функциональных и косметических нарушений. С другой стороны, имеются попытки устранения дефектов посредством косметических и функциональных пластических операций (Матякин Г. Г., 1977; Клим К. И., 1979).
Большинство авторов при удалении злокачественных новообразований считают целесообразным производить пластические операции, включающие наименьшее число этапов. В пользу преимущества первичных восстановительных операций высказываются Н. Н. Блохин (1956), Н. М. Михельсон (1962), П. В. Наумов (1966), А. Т. Аббасов (1967), И. А. Сорочан (1971), Б. М. Втюрин, К. И. Клим (1976), Н. Н. Блохин, Б. Е. Петерсон (1979).
В настоящее время продолжается поиск наиболее эффективных методов первичной пластики дефектов кожи и слизистой оболочки после расширенных и комбинированных операций в области головы и шеи.
Это ключ к хирургической реабилитации больных после расширенных операций. В этом плане мы на протяжении нескольких лет изучали возможность реабилитации больных с опухолями головы и шеи.
Поскольку расширенные и комбинированные операции по поводу местнораспространенных злокачественных опухолей слизистой оболочки полости рта, гортани и щитовидной железы приводят не только к обезображивающим дефектам, но и к нарушению функции глотания, дыхания, жевания и речи, мы решили осветить вопросы медицинской реабилитации больных с указанной локализацией опухоли.
Операции на слизистой оболочке органов полости рта
Первичная пластика послеоперационных дефектов слизистой оболочки органов полости рта
Первичную пластику послеоперационных дефектов слизистой оболочки органов полости рта мы выполняли при помощи шейного и дельто-пекторального кожно-фасциальных лоскутов на питающей сосудистой ножке. Первичная пластика шейным лоскутом применена у 22 больных, дельто-пекторальным лоскутом — у 7.
Шейный кожный лоскут на ножке выкраивается на боковой поверхности шеи в проекции грудино-ключично-сосцевидной мышцы с основанием в зачелюстной области. Такое расположение лоскута позволяет включить в него наиболее крупные артериальные сосуды кожи шеи, что обеспечивает хорошее кровоснабжение, высокую жизнеспособность его тканей, а непосредственная близость к ожидаемому дефекту позволяет восстановить поверхность образовавшегося изъяна в самых оптимальных условиях.
В отличие от других авторов, мы в подкожную клетчатку лоскута включаем и наружную яремную вену. Это значительно увеличивает жизнеспособность шейного лоскута. Заготовленный кожный лоскут имеет удлиненную языкообразную форму с округленными краями на конце. Ширина ножки лоскута составляет 5-7 см, длина — 10-14 см (рис. 64, а).

Рис. 64. Первичная пластика послеоперационных дефектов слизистой оболочки полости рта: а — разрез кожи и выкраивание шейного лоскута: б — этап перемещения шейного лоскута к дефекту; в — окончательный вид послеоперационной рамы. Формирование оростомы в зачелюстной области
Опрокидывание кверху выкроенного лоскута и широкая мобилизация кожи обеспечивают хороший обзор операционного поля, а также создают оптимальные условия для проведения операции на лимфатических путях шеи.
Наряду с этим опрокидывание лоскута и перегиб его питающем ножки на 180° на время выполнения основного этапа операции — удаления первичной опухоли и клетчатки шеи — позволяют оценить состояние его кровоснабжения. При адекватном кровоснабжении мы перемещали лоскут и пришивали его к краям дефекта тканей (рис. 64, б). В области основания питающей ножки формировали временную оростому (рис. 64, в).
Изучение особенностей заживления ран после 22 подобных операций (табл. 35) показывает, что полное приживление перемещенного лоскута отмечено у 10 больных. Некоторое натяжение трансплантата, которое наблюдалось при закрытии дефекта бокового отдела дна полости рта и языка, при закрытии изъянов, расположенных в области переднего отдела дна полости рта, привело к расстройству кровообращения с последующим краевым или более распространенным некрозом лоскутов.
При заживлении ран первичным натяжением с полным приживлением шейного лоскута реабилитация функций глотания и дыхания наступала в среднем в течение 1,5 месяца. В противном случае лечение затягивалось на более продолжительное время (в среднем 0,5 года).
На основании собственных наблюдений мы считаем, что показанием к использованию шейного лоскута на ножке являются дефекты слизистой оболочки отделов средней, задней трети и корня языка, дна полости рта, щек и ретромолярного пространства, а также большие кожные изъяны околоушно-жевательной, щечной, подчелюстной областей и сонного треугольника шеи.
Опыт показывает, что не следует использовать этот лоскут для замещения дефектов тканей переднего отдела дна полости рта, нижней губы и подбородка при сохранении непрерывности нижней челюсти, так как в результате натяжения тканей и перегиба питающей ножки возникает нарушение кровообращения в дистальном отделе лоскута.
Нецелесообразно использование шейного лоскута для пластики изъянов, если его питающая ножка до операции попадала в зону облучения. Примером успешной пластики шейным лоскутом может служить следующее клиническое наблюдение.
Больная П., 56 лет, находилась в отделении опухолей головы и шеи НИИ онкологии с 5.11.1977 г. по 12.01.1978 г. по поводу рака слизистой оболочки альвеолярного отростка нижней челюсти справа, IIIа стадии, T3N0M0. Биопсия № 180097 — плоскоклеточный ороговевающий рак.
Послеоперационное течение гладкое. Заживление раны первичным натяжением. 4.10.1977 г. под местным обезболиванием с помощью 20,0 мл 0,25% раствора новокаина произведено закрытие оростомы. В настоящее время здорова. Срок наблюдения — 8 лет.
Пластика дельто-пекторальным лоскутом
Возмещение послеоперационных дефектов слизистой оболочки дна полости рта, значительной части языка может быть успешно проведено дельто-пекторальным кожным лоскутом на медиальной питающей ножке.
После радикального удаления злокачественной опухоли с резекцией переднего сегмента нижней челюсти дистальный участок выкроенного лоскута вводят в полость рта через разрез тканей в подчелюстной области и помещают так, чтобы кожная поверхность его восполняла дефект слизистой оболочки дна полости рта и языка (рис. 66, а).

Рис. 66. Методика пластики дефектов мягких тканей слизистой оболочки дна полости рта и языка дельто-пекторальным лоскутом: а — раневая поверхность и дефекты тканей после удаления злокачественной опухоли; б — замещение дефекта мягких тканей слизистой оболочки дна полости рта кожей — дистальным участком дельто-пекторального лоскута на медиальном основании; в — окончательный вид послеоперационной раны. Формирование оростомы в подчелюстном треугольнике и застебление питающей ножки лоскута
Подкожную клетчатку лоскута по краям и среднюю часть его фиксируют несколькими узловатыми кетгутовыми швами к мышцам языка и жировой клетчатки кожи подчелюстной области. Затем накладывают узловатые шелковые швы между краями лоскута и дефекта слизистой оболочки полости рта, формируя культю языка, дно полости рта и подбородочную область (рис. 66, б).
В подчелюстном треугольнике у места введения дельто-пекторального лоскута в полость рта формируют оростому путем сворачивания лоскута в форме трубки эпидермисом внутрь. У основания лоскуту придается вид круглого кожного стебля (рис. 66, в).
Наши наблюдения позволяют говорить о том, что с целью создания контура дна полости рта следует использовать формирующие тампоны из быстротвердеющей пластмассы, покрытые йодоформной марлей. Ими закрывают участок кожного лоскута, восполняющий дефект тканей между слизистой оболочкой нижней губы и нижней поверхностью культи языка.
Тампон фиксируют лигатурами. Оростому закрывают турундой с ксероформом на ближайшие 2-3 недели, до полного приживления кожного трансплантата. После приживления лоскута в полости рта питающую ножку отсекают под местной анестезией.
Необходимо отметить, что, несмотря на благоприятное расположение сосудов в лоскуте, протяженность застебленной питающей ножки следует сократить до минимума, с тем чтобы предупредить перегибы, отрицательно отражающиеся на кровоснабжении трансплантата. Недопустимо также натяжение ножки. Избежать этих ошибок можно путем тщательного планирования пластической операции.
Описанный метод пластики послеоперационных дефектов мягких тканей переднего отдела слизистой оболочки дна полости рта и языка нами был использован у 7 больных (табл. 36) и у 2 — с дефектами щеки. Полное приживление лоскута имело место в четырех наблюдениях (рис. 67, а-в). Нарушение кровообращения в виде краевого некроза отмечено у трех больных.
Таблица 36. Непосредственные результаты пластики дельто-пекторальным лоскутом на медиальном основании


Рис. 67. Больной Л. со злокачественной опухолью дна полости рта. Блок удаленных тканей. Кратерообразная опухолевая язва охватывает ткани дна полости рта. языка, фронтальной и горизонтальной ветви нижней челюсти
В двух случаях — частичный некроз лоскута из-за присоединения банальной инфекции в подлоскутном пространстве. Иссечение некротизированных участков лоскута производили на 8-10-е сутки. К этому времени жизнеспособный участок лоскута срастался с подлежащими тканями и тем самым уменьшались возможность попадания слюны и инфекции под лоскут и его дальнейшее отторжение.
Следует отметить, что из двух больных, которым дефект слизистой щеки был возмещен дельто-пекторальным лоскутом, в обоих случаях было нарушение кровообращения в виде краевого и частичного некроза лоскута. Поэтому мы считаем, что дельто-пекторальный лоскут может с успехом применяться только при первичной пластике дефектов переднего отдела слизистой дна полости рта и языка.
Таким образом, наши наблюдения показали, что применение дельто-пекторального лоскута расширяет показания к хирургическому лечению и способствует реабилитации утраченных функций дыхания, глотания и речи в среднем в течение 1,5-2 мес у больных с местнораспространенными опухолями слизистой оболочки дна полости рта.
Из 30 больных, подвергшихся расширенным и комбинированным операциям по поводу местнораспространенного рака слизистой оболочки полости рта, которые жили 3 года и более, 13 занимались умственным трудом, 5 — физическим. Остальные 12 пациентов находились на II группе инвалидности.
Читайте также:

