Эндоскопические операции при раке
Перезвоним Вам в течении 1 минуты
Москва, Балаклавский проспект, дом 5
диагностическая процедура, направленная на исследование пищевода, желудка и двенадцатиперстной кишки
Медицинское обследование внутренних органов с помощью эндоскопа
Гистологическое исследование помогает с высокой точностью определить наличие опасных клеток и новообразований
Гастроскопия – один из наиболее объективных и точных способов исследования слизистой оболочки желудка
Анализы на ЗППП – это комплекс лабораторных исследований, позволяющий выявить возбудителей заболеваний, передающихся половым путем
Гастроскопия (эзофагогастродуоденоскопия, ЭГДС) — это осмотр слизистой пищевода, желудка
Одним из самых современных методов борьбы как с доброкачественными, так и со злокачественными новообразованиями является эндоскопический метод, использование которого стало возможным благодаря развитию современных технологий в области медицины.
Эндоскопическое удаление опухоли любого рода имеет ряд основных преимуществ перед другими методами, которые широко применяются в медицинской практике: Практически полное отсутствие болезненных ощущений, что дает возможность использовать минимальное количество анестезирующих средств. Соответственно, данный метод является наиболее оптимальным для лиц, у которых существует опасность возникновения разного рода аллергических реакций на сильнодействующие препараты, являющиеся обезболивающими. В случае, если пациенту проведена такая операция, как эндоскопическое удаление опухоли, время нахождения его в стационаре для осуществления наблюдения за ним медицинского персонала весьма ограничено и занимает короткий промежуток времени.
Благодаря тому, что инструменты, используемые при эндоскопическом оперативном вмешательстве минимальны, разрезы, сквозь которые проводятся необходимые манипуляции, являются минимальными и практически не оставляют различных рубцовых образований и шрамов.
Весь процесс проводимых манипуляций осуществляется под постоянным контролем современного оборудования, что практически во всех случаях обеспечивает успешный исход операции. Однако, при большом количестве плюсов метод удаления различных образований эндоскопическим путем, имеет и некоторые минусы, к основным из которых относятся: Высокая стоимость. Благодаря тому, что эндоскопическое оборудование - одна из новейших разработок в области медицины и, соответственно, является дорогостоящим, цена на данные услуги достаточно велика. Однако, учитывая все плюсы этого вида оперативного вмешательства, в данном случае цена является показателем высочайшего уровня качества.
Ограниченное количество клиник и других медицинских учреждений, располагающих возможностью проведения эндоскопических операций. Данная ситуация возникла также благодаря высокой стоимости оборудования.
Эндоскопические манипуляции по удалению доброкачественных, либо злокачественных опухолей проводятся в несколько основных этапов: Осуществление обезболивания. В большинстве случаев применяется местная анестезия, что позволяет осуществить минимальное воздействие на организм пациента.Однако, в ряде некоторых особенных случаев возможно применение общего наркоза.
Далее на месте образования опухоли делается небольшой надрез. Обычно величина его составляет не более, чем несколько миллиметров, в зависимости от размера новообразования и его локализации. После этого в надрез вводятся тонкие полые трубки, на которых закреплены как источники освещения, так и соответствующие инструменты, применение которых необходимо в ходе той или иной операции. При помощи данного оборудования врач производит удаление необходимого участка измененной ткани. Данный процесс полностью проходит под осуществлением контроля современного высокотехнологичного оборудования, что позволяет минимизировать риск травматизации здоровых тканей и слизистой, а также практически во всех случаях обеспечить успешный исход операции. Далее на поврежденные в ходе процедуры удаления опухоли участки тканей накладываются, в случае необходимости, швы.
После проведения операции пациент остается под наблюдением медицинского персонала в течении необходимого количества времени. После выписки из медицинского учреждения пациентам рекомендуется на некоторое время ограничить выполнение тяжелых физических работ, так как данные действия могут привести к появлению осложнений различного характера. Также в ряде случаев необходим прием различных лекарственных препаратов, назначенных лечащим врачом. Для обеспечения успешного исхода в лечении как доброкачественных, так и злокачественных опухолей, любому пациенту рекомендуется принимать во внимание советы и рекомендации лечащего врача и неукоснительно соблюдать их.
Роль эндоскопии в лечении рака толстой кишки сводится к следующим трем функциям:
• эндоскопическому удалению раковой опухоли на ранней стадии;
• наблюдению за больным после резекции опухоли;
• паллиативной помощи при раке на далеко зашедших стадиях.
Все эндоскопические операции при раке толстой кишки на ранней стадии можно свести к двум типам: плановому удалению опухоли при уже установленном диагнозе и удалению полипа, в котором при гистологическом исследовании неожиданно выявлены раковые клетки. Недостаток эндоскопического удаления злокачественных опухолей состоит в том, что после него риск метастазов в регионарных лимфатических узлах выше.
Иначе говоря, при удалении рака на ранней стадии должна быть уверенность в том, что метастазов в регионарные лимфатические узлы нет.
Риск метастазов возрастает при больших размерах опухоли, а также при инфильтрации ею подслизистой основы. Эндоскопическое удаление опухоли допустимо при глубине инфильтрации не более 1000 мкм. При уплощенных или плоских аденомах риск глубокой инфильтрации подслизистой основы, вплоть до мышечной оболочки толстой кишки, выше.
Эндоскопическое удаление раковой опухоли на ранней стадии должен выполнять лишь врач, обладающий достаточным опытом. Больных с такой опухолью следует оперировать в специализированных центрах.
Низкодифференцированный рак толстой кишки, инфильтрация лимфатических сосудов опухолевыми клетками, отсутствие уверенности в полном удалении опухоли (т.е. в соответствии полноты удаления опухоли категории R0), а также в том, что первичная опухоль соответствует степени Т1, требуют наличия еще одного фактора для выполнения дополнительной хирургической резекции с соблюдением онкологических принципов: знания путей оттока лимфы и особенностей кровоснабжения.
При раке сигмовидной кишки это означает резекцию всего сегмента кишечника, который кровоснабжается нижней брыжеечной артерией.
Критерии ведения больных после эндоскопического или хирургического удаления раковой опухоли соответствуют риску развития рецидива. Наиболее важной является стадия опухолевого процесса. Для эндоскопического удаления опухоли критерии иные. Вообще, ежегодного выполнения колоноскопии не требуется. А возможность отступления от рекомендуемых сроков выполнения контрольной колоноскопии в каждом ее случае рассматривают индивидуально.
Контрольные исследования не исключают развития рецидивов опухоли. У больных старческого возраста эндоскопия может сыграть существенную роль в паллиативном лечении. Наряду с устранением кишечной непроходимости, при эндоскопическом исследовании можно также остановить кровотечение из опухоли.
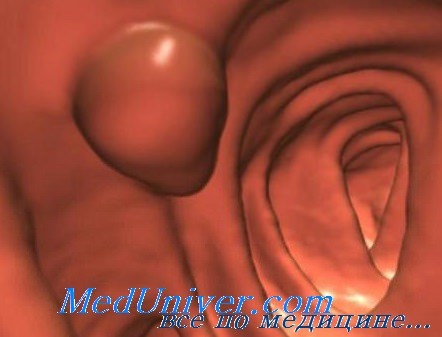
Показания к локальному паллиативному вмешательству могут быть разные; иногда оснований для выполнения такого вмешательства бывает несколько, и они могут отличаться по своей значимости. Обычно в каждом случае вмешательство бывает направлено на то, чтобы обеспечить больному приемлемое качество жизни.
Схема послеоперационного ведения больного:
1. Эндоскопическое удаление опухоли (полнота удаления R0, низкий риск [G1, G2, L0]):
• Контрольная эндоскопия через 6 мес.
• Контрольная эндоскопия через 2 года.
2. Резекция кишки при опухоли, соответствующей I стадии по классификации Международного противоракового союза (Т1Я2, N0):
• Диспансерное наблюдение не требуется, особенно при опухоли, соответствующей стадии Т1 и степени дифференцировки G1 и G2.
• Отклонение от этой тактики при степени дифференцировки опухоли G3 или прорастании ее в лимфатические или кровеносные сосуды, а также при стадии опухоли Т2.
3. Резекция кишки при опухоли, соответствующей II-II стадии по классификации Международного противоракового союза:
• Колоноскопия через 6 мес. (если не планируется операция).
• Сигмоидоскопия (только в тех случаях рака прямой кишки, когда после операции неоадъювантная или адъювантная химиолучевая терапия не проводится):
- через 6 мес;
- через 12 мес;
- через 18 мес;
- через 2 года.
• Колоноскопия через 3 года (при отсутствии опухоли следующую колоноскопию выполняют через 5 лет).
Рекомендательные положения не являются жестким предписанием. Тем не менее, если врач не следует им, он должен обосновать почему. Особенно часто приходится отклоняться от разработанных рекомендаций при наблюдении за пациентами пожилого и старческого возраста. В этих случаях решение, принимаемое врачом, должно основываться не столько на общепринятых принципах, сколько на индивидуальных особенностях больного.
Для паллиативной аблации опухоли существует два метода: лазерная аблация и аргоноплазменная коагуляция. Внедрение в клиническую практику аргоноплазменной коагуляции привело к тому, что метод лазерной деструкции несколько утратил свое значение. В принципе с помощью лазера можно эффективно разрушить опухоль, при этом он не вызывает существенного обугливания здоровой ткани.
Лазерным световодом управляют под контролем зрения, с помощью пилотного луча определяют границы опухолевой ткани, которая будет подвергнута аблации. Сам лазерный луч, вызывающий деструкцию опухолевой ткани, не виден. При выполнении лазерной аблации в принципе возможна перфорация стенки кишки, особенно когда снижение качества стекловолокна настолько ослабляет конвергенцию пилотного луча, что управление лазерным лучом становится невозможным.
С помощью аргоноплазменной коагуляции риск перфорации стенки кишки меньше. Управляют процессом коагуляции под контролем зрения. При использовании аппаратов коагуляции последнего поколения мощность, достаточная для аблации, составляет 30-40 Вт. Для коагуляции значительного объема опухолевой ткани можно использовать и большую мощность.
Для повторной коагуляции каких-либо установленных временных интервалов нет. В зависимости от тенденции к росту контрольное исследование, а заодно и повторную коагуляцию можно выполнить через 4 нед. В среднем интервал между коагуляциями равен 6-8 нед.
Для остановки кровотечения достаточно использования меньшей мощности. В таких случаях необходима не столько аблация опухоли, сколько поверхностная коагуляция сосуда.
Применение аргоноплазменной коагуляции при протяженном и резко выраженном стенозе неэффективно или дает плохой результат. Кроме того, с учетом угрозы развития полной кишечной непроходимости, в этих случаях необходимы еще и дополнительные меры. В качестве эффективной паллиативной меры таким больным можно выполнить стентирование стенозированного участка. Однако несмотря на преимущество этого метода, состоящее в восстановлении кишечной проходимости, хотя и на относительно непродолжительный период, стентирование имеет целый ряд недостатков: стент может мигрировать, вызвать кровотечение или перестать функционировать.
Причиной дисфункции стента является его обтурация каловыми массами или быстро растущей опухолью. Кроме того, возможен перегиб кишки в области ректосигмоидного перехода при глубоком введении стента, а также боли в животе. В связи с этими особенностями стентирование остается последним средством при выборе паллиативного лечения.

Заболеваемость раком желудка не снижается, причём неуклонно, ежегодно больных раком желудка в России становится на 33 тысячи больше, а проживут год чуть более половины. Больные с метастазами — четвёртая стадия, что бы ни делалось в медицине, по-прежнему, как и двадцать лет назад в структуре рака желудка занимают 41,2% от всех. Но отрадно, что доля I–II стадии медленно, но подрастает, составив суммарно 29,6%, и уже перекрыли III стадию — 25,8%.
При раннем раке желудка метастазы в ближайших к желудку лимфатических узлах находят в 10–15%, если опухолевые клетки не вышли за пределы слизистой, то поражение лимфоузлов выявляется у трёх из сотни оперированных. Видимое только под микроскопом распространение опухолевых клеток из слизистой в подслизистый слой, приводит к семикратному увеличению процента поражённых раковыми клетками лимфатических узлов.

Где развивается рак желудка?
Рак развивается в эпителии слизистой оболочки желудка. Толщина всей слизистой оболочки от полутора до двух миллиметров, и это вместе эпителий, лежащая под ним собственная пластинка, пронизанная сосудиками, и мышечная пластинка из трёх рядов гладкомышечных клеток. Вот и вся слизистая, под которой находится подслизистый слой.
Что же такое ранний рак желудка?
Это маленькая опухоль, которую можно увидеть. Когда рак локализуется только в эпителии слизистой, не просочился через пластинки — без инвазии, и вообще ещё даже не имеет собственной сосудистой сети, это 0 стадия рака, которая раньше обозначалась как рак in situ.
Стадия I считается ранним раком желудка, который делится на два варианта: стадия Т1а — опухоль занимает только слизистую оболочку, стадия Т1b — опухоль просочилась в подслизистый слой. Это уже рак видимый глазом, он может быть поверхностным или плоским, но не должен быть более 2 см в диаметре, и, конечно же, не вовлекать в раковый процесс ничего кроме слизистой с подлежащим слоем.
Ранний рак обнаруживают, как правило, плановом профилактическом осмотре. Так делают в Японии, жители которой весьма подвержены раку желудка. В России, к примеру, при диспансерном наблюдении или по поводу обострения у язвенника или у пациента с хроническим анацидным гастритом во время эндоскопии выявляется новообразование или берётся биопсия из давней язвы, а там уже рак. Внедряемая Минздравом система диспансеризации населения предусматривает расширенное обследование некоторых категорий населения, но пока проблема скрининга рака желудка остаётся глубоко личной.
Обязательные обследования при раннем раке
Для чего выделяется такая форма как ранний рак? Преимущественно для минимизации лечения, чтобы выполнить сохраняющую орган, оптимальную операцию. С тех пор, как научились оперировать желудок, человечество познакомилось и с весьма тягостными болезнями оперированного желудка, возникающими из-за значительного уменьшения объёма органа и слишком быстрого прохождения пищи по нему. И проблему значительных анатомо-физиологических нарушений не ликвидируешь, принимая пищу малыми порциями.
Не подготовленная из-за недостаточной обработки желудочным соком пища попадает в тонкую кишку, где вызывает огромный биохимический сбой с выбросом биологически активных веществ, стремительным всасыванием углеводов и избыточной выработкой инсулина. Страдания больных с маленьким желудком тягостны и пожизненны. Поэтому хирурги-онкологи готовы бороться буквально за каждый миллиметр, сохраняя желудок, чтобы в дальнейшем пациент не мучился демпинг-синдромом или пептическими язвами оставшейся культи желудка.

При гарантии действительной локальности опухолевого процесса возможно вмешательство небольшого объёма, и прежде всего, это эндоскопическая операция. Только детальное и всестороннее обследование позволяет гарантировать минимальность опухолевого поражения для возможного выбора эндоскопического вмешательства. Поэтому при планировании эндоскопического лечения выполняется эндосонография — совмещённая с УЗИ эндоскопия желудка. С одной стороны эндоскопом исследуется слизистая желудка, с другой — ультразвуком удаётся изучить всю толщину стенки желудка вокруг опухоли, можно увидеть лимфатические узлы и вовлечение других тканей конкретно в проекции патологического очага. Выполняется биопсия из всех подозрительных на неблагополучие мест.
Дополнительно проводится хромоэндоскопия — обработка слизистой желудка специальным красящим веществом, позволяющим лучше видеть патологию. А современная специальная эндоскопическая оптика делает возможной практически микроскопию участка, планируемого на удаление. Ну и сегодня невозможно обойтись без компьютерной томографии брюшной полости, способной рассмотреть самые укромные уголки организма.
Какие больные могут претендовать на эндоскопическое лечение
Во-первых, существует два варианта эндоскопической резекции: это только удаление слизистой и удаление одним блоком слизистой и подслизистой. Второй вариант используется при вовлечении в процесс подслизистого слоя и при опухоли большего размера у пациентов с высоким риском хирургического вмешательства, что следует понимать как наличие у больного тяжёлых сопутствующих заболеваний, ограничивающих возможности оперативного лечения и наркоза. Но соблюдается главное условие — эндоскопическая операция проводится при раке I стадии, без изъязвлений.
Во-вторых, в отборочные критерии, позволяющие не просто попасть на это весьма привлекательное по минимальности операционной травмы, лечение, но и получить надежду на долгую и здоровую жизнь, внесена степень злокачественности опухоли желудка. Степень злокачественности определяется дифференцировкой клеток. Чем меньше клетки опухоли похожи на нормальные клетки эпителия, тем агрессивнее рак. Подпадают под критерии отбора на органосохраняющую операцию высокодифференцированные и умеренно дифференцированные опухоли. Естественно, что метастазы в лимфатические узлы являются противопоказанием.
Когда ранний рак желудка не подходит для эндоскопического лечения, то есть либо большая протяжённость поражения, либо слишком глубокое проникновение в подслизистый слой, либо высокая степень злокачественности, а то и всё сразу, выполняется стандартная операция. Правда, удаляются только самые близкие к желудку лимфатические узлы. Кстати, результаты лапароскопических операций обнадёживают не меньше традиционных вмешательств через брюшную стенку.
Как и всякая операция, даже такое небольшое вмешательство не свободно от осложнений. Поскольку операция ограничена слизистой оболочкой, то могут быть кровотечения и перфорация, то есть прободение — сквозной дефект стенки, открывающийся в брюшную полость. Как правило, осложнения ликвидируют при эндоскопии, а после назначают лекарственную терапию как при обострении язвенной болезни желудка.
Наша команда врачей, проводящих эндоскопические вмешательства
Эндоскопическая хирургия в лечении онкологических пациентов требует от хирурга высокой точности, виртуозного владения методиками и немалого опыта.
Коллективом врачей Европейской онкологической клиники под руководством руководителя отделения эндоскопии, д.м.н. М. С. Бурдюкова выполнено:
- Более 1000 эндоскопических операций на желчных протоках;
- Более 200 эндоскопических стентирований при опухолях пищевода;
- Более 100 стентирований при опухолях желудка;
- Более 150 стентирований по поводу опухолей двенадцатиперстной кишки;
- Более 100 стентирований при опухолях толстой кишки;
- Более 50 эндоскопических операций у пациентов, ранее перенесших серьезное хирургическое вмешательство.
Эндоскопическое лечение отличает высокая эффективность с минимумом осложнений. Пациенты максимально быстро восстанавливаются, существенно улучшается качество их жизни, а функции стентируемого органа сохраняются.
Рак пищевода — один из наиболее агрессивных типов злокачественных опухолей. Он занимает восьмое место среди причин смертности от онкологических заболеваний во всем мире. Прогноз напрямую зависит от ранней диагностики. Основной, наиболее радикальный метод лечения, который позволяет добиваться ремиссии — хирургическое удаление пораженной части органа.

При выборе тактики лечения врач должен учитывать стадию рака пищевода, локализацию опухоли (противопоказание к радикальной операции — поражение шейного отдела пищевода), общее состояние здоровья пациента, его возраст, сопутствующие заболевания.
В клинике Медицина 24/7 решения о лечении пациентов со злокачественными опухолями пищевода принимаются на профессиональных врачебных консилиумах, в которые входят клинические онкологи, хирурги, химиотерапевты, радиотерапевты и другие специалисты.
Эндоскопическая хирургия при ранних стадиях рака пищевода
удаляет опухоль в пределах слизистой оболочки или подслизистого слоя и отправляет на гистологическое исследование. Важно оценить край резекции, то есть выяснить, есть ли опухолевые клетки возле линии разреза. Позитивный край резекции говорит о том, что новообразование могло быть удалено не полностью.
Хирургическое лечение рака пищевода на стадиях A
Радикальная операция возможна у большинства пациентов при следующих стадиях рака пищевода:
- Стадия I: злокачественная опухоль прорастает до уровня собственной, мышечной пластинки слизистой оболочки или в подслизистый слой, не вторгается в мышечный слой стенки органа, нет очагов поражения в регионарных лимфатических узлах и отдаленных метастазов.
- Стадия IIA: опухоль прорастает в мышечный слой или в наружный слой (адвентицию).
Чаще всего выполняют трансторакальную субтотальную резекцию пищевода с внутриплевральной пластикой желудка или толстой кишкой с билатеральной двухзональной медиастинальной лимфодиссекцией из комбинированного лапаротомного и правостороннего торакотомного доступов.
При таком варианте хирургического вмешательства пораженный опухолью участок пищевода удаляют через разрезы на животе и груди:
- Если опухоль находится в нижней части пищевода или на границе с желудком, удаляют часть пищевода с захватом участка выше опухоли 8–10 см и часть желудка. Оставшуюся часть желудка соединяют с пищеводом.
- При опухолях в верхней части пищевода удаляют большой участок органа и подтягивают к его оставшейся верхней части желудок, накладывают анастомоз.
Если большого дефекта не удается соединить пищевод с желудком, используют сегмент кишки.
При небольших опухолях на ранних стадиях резекция пищевода может быть выполнена малоинвазивным способом через проколы вместо разреза. Проколы выполняют в области груди и живота (торакоскопия + лапароскопия), возможны комбинированные вмешательства одновременно через разрез и прокол (торакотомия + лапароскопия или лапаротомия + торакоскопия). В некоторых клиниках проводят операции.
Удаленные во время операции ткани отправляют на биопсию. К негативным факторам прогноза после хирургического лечения относят:
- Низкую степень дифференцировки (G3 и выше). При этом опухолевые клетки практически полностью утрачивают черты нормальных. Такой рак ведет себя более агрессивно, склонен к быстрому распространению в окружающие ткани, метастазированию.
- Позитивный край резекции. Это говорит о том, что в пищеводе могли остаться раковые клетки.
- Сосудистая, периневральная, лимфатическая инвазия — когда опухолевая ткань прорастает в сосуды и нервы.
- Вторжение в подслизистую основу стенки пищевода.
Хирургическое лечение может быть дополнено химиотерапией и лучевой терапией, это помогает снизить риск рецидива.
Оставьте свой номер телефона
Лечение рака пищевода на стадиях
При стадиях IIB и III злокачественная опухоль сильнее прорастает в стенку пищевода и может распространяться в регионарные лимфатические узлы. В таких случаях одно только хирургическое лечение недостаточно эффективно, после него сохраняется высокий риск рецидива и отмечаются низкие показатели пятилетней выживаемости. Поэтому операции всегда дополняют адъювантной и неоадъювантной химиотерапией или химиолучевой терапией.
При неоперабельных опухолях (например, в шейном отделе пищевода) и противопоказаниях к операции основным методом лечения становится химиолучевая терапия.
В клинике Медицина 24/7 работают ведущие хирурги. В операционных, оснащенных современным оборудованием от ведущих производителей, выполняются хирургические вмешательства на пищеводе любой сложности.
Паллиативные операции при раке пищевода
Наиболее распространенное осложнение при раке пищевода — нарушение проходимости органа сужения опухолью, которое затрудняет питание и приводит к сильному истощению больного. В таких случаях может быть выполнено стентирование. В заблокированный участок пищевода устанавливают стент — короткую трубку с сетчатой стенкой из металла или пластика. После этого проходимость сразу восстанавливается, и пациент снова может нормально питаться.
Другие методы лечения опухолевого стеноза пищевода:
- Эндоскопические процедуры: деструкция (разрушение) опухоли электрокоагулятором или лазером, фотодинамическая терапия, баллонная дилятация — когда в заблокированный участок вводят специальный спущенный баллон и раздувают внутри, тем самым расширяя просвет органа. Эти методы дают лишь временный эффект, обычно их применяют перед операцией.
- Лучевая терапия: внешнее облучение, или брахитерапия — когда источник излучения помещают прямо в пищевод. Помимо нарушения глотания, лучевую терапию применяют для борьбы с такими симптомами рака пищевода, как боль и кровотечение.
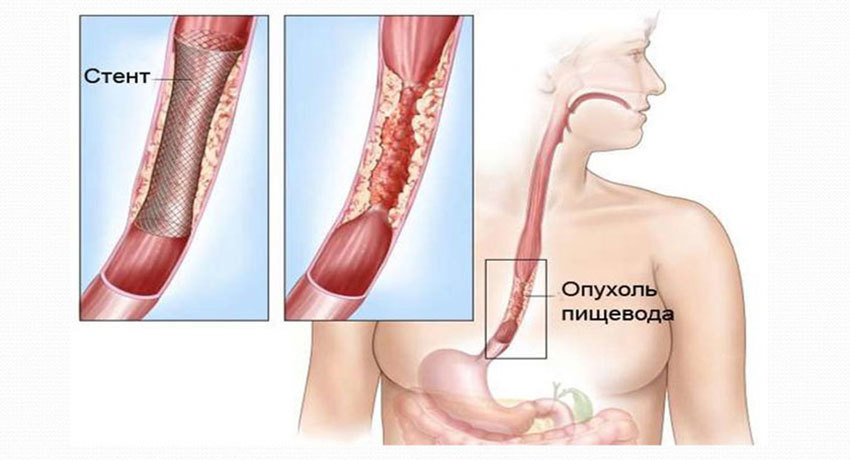
В некоторых случаях злокачественная опухоль приводит к формированию свищей — отверстий, которые соединяют пищевод с бронхами, средостением. Для борьбы с этим осложнением применяют специальные покрытые стенты, которые прижимаются к отверстию и закрывают его. Эта процедура эффективна в 70–100% случаях.

Показания к операции
Данное хирургическое вмешательство выполняется в случае диагностирования рака, который ограничен пределами органа. Предварительно делается биопсия простаты либо микроскопическое исследование биологического материала.
При раке предстательной железы лечение может быть разным. Во внимание обязательно принимаются пожелания больного. Альтернативой являются такие методы, как брахитерапия и терапия лучевая, которые проводятся дистанционно.
Подготовка к лапароскопической простатэктомии
Доктор оценивает общее состояние пациента. При принятии медикаментов, разжижающих кровь, требуется консультация кардиолога. Накануне вмешательства пациента осматривает анестезиолог.
Ход вмешательства
Пациенту делают общий наркоз. Операция длится 120-180 минут. Обязательно даются антибактериальные медикаменты.
Сквозь проколы вводят специальные инструменты. Весь процесс протекает под контролем видеокамеры. Предстательная железа отсекается. Устанавливается специальная резиновая трубка, которая выходит наружу.
Непосредственно после вмешательства пациент должен сделать следующее:
- рассказать медперсоналу о болевых ощущениях;
- узнать, что нельзя делать;
- задавать все интересующие вопросы.
Сутки пациент находится в реанимации. Затем его переводят в палату. Самостоятельно мочеиспускание возможно на 7-10 день.
Осложнения возникают крайне редко, но исключать их полностью нельзя.
В периоде после вмешательства может случиться следующее:
- рост температуры тела, озноб;
- болевые ощущения в области разреза;
- кровотечение;
- повреждение других органов.
Также пациент может столкнуться с недержанием мочи и с эректильной дисфункцией.
Пациенту нужно сделать следующее.
- Проконсультироваться у доктора.
- Узнать, когда можно заниматься спортом, работать, водить авто и заниматься иными привычными делами.
- Взять у доктора телефон, чтобы в случае возникновения непонятных ощущений незамедлительно с ним связаться.
- Узнать, когда будут готовы результаты микроскопического исследования.
Швы снимаются, в среднем, на девятый-десятый день. Можно уже принимать водные процедуры. Если пациент желает посетить баню, то предварительно ему нужно проконсультироваться с доктором.
При выписке пациенту выдаётся эпикриз, в котором указываются все важные сведения. Его нужно предоставить доктору, которого пациент посещает после операции.
Внимание! В случае возникновения озноба, жара, болевых ощущений, выделений из области надрезов следует незамедлительно обратиться к врачу.
Чему нужно придать значение
Спустя 10-14 дней будут известны итоги микроскопического исследования предстательной железы, удалённой в ходе хирургического вмешательства. Нужно получить консультацию у специалиста.
Некоторые больные нуждаются в восстановлении в течение двух недель. Начать работать лучше не раньше чем через три-четыре недели.
Лапароскопическая радикальная простатэктомия признана самым действенным способом лечения данного заболевания. Это хорошая альтернатива классическому вмешательству. Удаётся минимизировать разрезы и сократить количество травм. В число других преимуществ такого вмешательства входят:
- малоинвазивность,
- минимальные потери крови,
- раннее удаление уретрального катетера,
- минимальное время в стационаре.
В брюшной полости пациента делается пять маленьких отверстий. Все манипуляции проводятся под общим наркозом. В случае такой операции большое значение имеют особенности здоровья пациента и опыт доктора.
Читайте также:





