E по удалению опухоли
Перезвоним Вам в течении 1 минуты
Москва, Балаклавский проспект, дом 5
Многочисленные виды новообразований на коже бывают как совсем безопасными для здоровья, так и способными нанести вред окружающим тканям и даже создать угрозу для жизни человека
Метод, который носит название ударно-волновой терапии, применяется для лечения костно-мышечных заболеваний и любого заболевания опорно-двигательного аппарата
процесс взятия клеток или ткани из организма для дальнейшего микроскопического исследования на проверку наличия онкологических заболеваний

Опухолью называют патологический рост изменившейся ткани организма. Характер её может быть доброкачественным и злокачественным.
К доброкачественным опухолям относят липомы, миомы, фибромы. В организме их развитие происходит медленно, помимо этого они могут не разрастаться в течение многих лет. Хирургические методы удаления опухоли вместе с её оболочкой, приводит к излечению пациента.
А вот о злокачественных опухолях этого сказать нельзя. Их рост намного стремительней. Злокачественное образование может быть двух видов: рак и саркома.
Раковая опухоль имеет эпителиальную природу, а саркома – производственную. Все новообразования в организме, за исключением 10% это раки. Именно поэтому, обнаружив злокачественное образование, называют его раковым, а лечение противораковым.
Диагностика заболевания
В медицинской практике считается, что чем раньше выявлена опухоль, тем раньше будет начато лечение, а это может привести к положительным результатам. Особенно это относится к онкологии. Благодаря современным диагностическим способам, таким как:
Злокачественные опухоли обнаруживаются на ранних стадиях развития, а это позволяет начать терапию вовремя и получить хорошие результаты.
На сегодняшний день хирургические методы удаления опухоли наиболее популярны.
Но есть и другие способы терапии. Однако их выбор зависит от многих факторов. Чтоб определить, какой именно способ подходит в том или ином случае, необходимо чётко изучить все показания и противопоказания к операции. Помимо этого рассмотреть все альтернативные способы лечения. Только полное удаление большой опухоли может гарантировать успех терапии.
Однако перед оперативным вмешательством, обычно проводят лучевую или химиотерапию. Вне зависимости от возраста пациента, её проводят, чтоб размер опухоли уменьшился, либо чтоб избавится от метастаз. Если рассматривать такую терапию в общем, то она во многом увеличивает успех на выздоровление после проведения хирургического удаления.
Также неплох метод лапароскопии. С его помощью операция проводится с малым травматизмом для организма. Но при этом удаляется не только сама опухоль, но и близлежащая область тканей, где мог развиться опухолевый процесс.
При опухолях проводят биопсию, чтоб определить их характер. Выглядит это как обычная хирургическая манипуляция по получению тканей опухоли, чтоб в дальнейшем провести исследование. Биопсия может быть закрытой и открытой.
Закрытую биопсию проводят с помощью тонкой иглы. Но этот метод применяют только при некоторых видах опухоли. Просто такой способ имеет свои недостатки, так как материала берётся мало, возможна погрешность в результатах исследования. А ещё, так как ткани взято мало, иногда нельзя правильно рассчитать способ лечения. Закрытая биопсия хороша только тем, что не сильно травмирует организм пациента.
Есть ещё такой способ взятие ткани на анализ, как трепанобиопсия. Для этого используется специальная игла. Но такой метод грозит кровотечениями, прободением органа и другими проблемами. Но с другой стороны, с его помощью можно взять достаточно ткани, чтоб провести все необходимые исследования.
А вот открытую биопсию можно разделить на два вида: тотальную и частичную. Если опухоль маленькая и находится в удобном для удаления месте, тогда применяют тотальную. А когда новообразование не имеет определённых краёв, помимо этого оно слишком большое, применяют частичную биопсию.
На сегодняшний день всё чаще применяют эндоскопическую биопсию. Во время её проведения травматичность мала, а информации можно получить намного больше. Также её можно применять для органов грудной полости.
Для хирургического удаления применяются и новые методы, хотя необходимо сказать, что они не новые и применяются уже давно. Просто они начали применяться чаще, а соответственно происходит их постоянное развитие.
Также необходимо сказать о трансплантации стволовых клеток. Но такое оперативное вмешательство применяется в основном в детской онкологии.
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
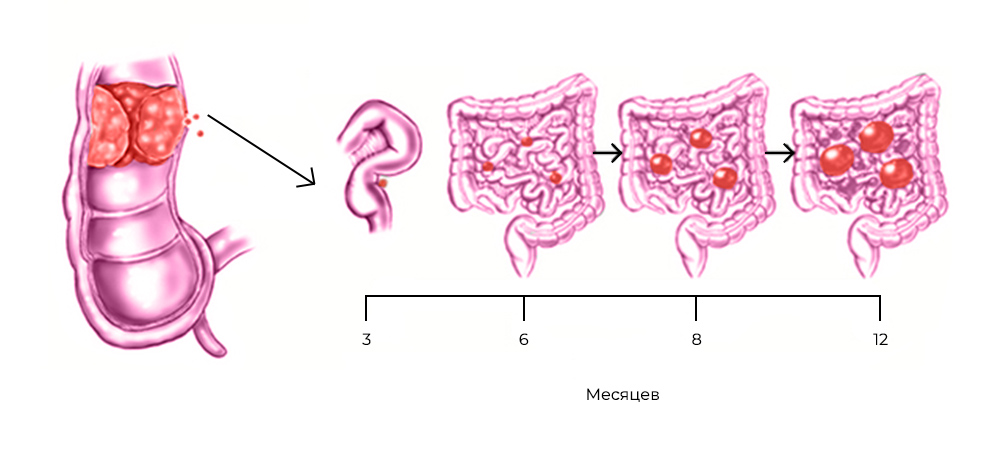
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
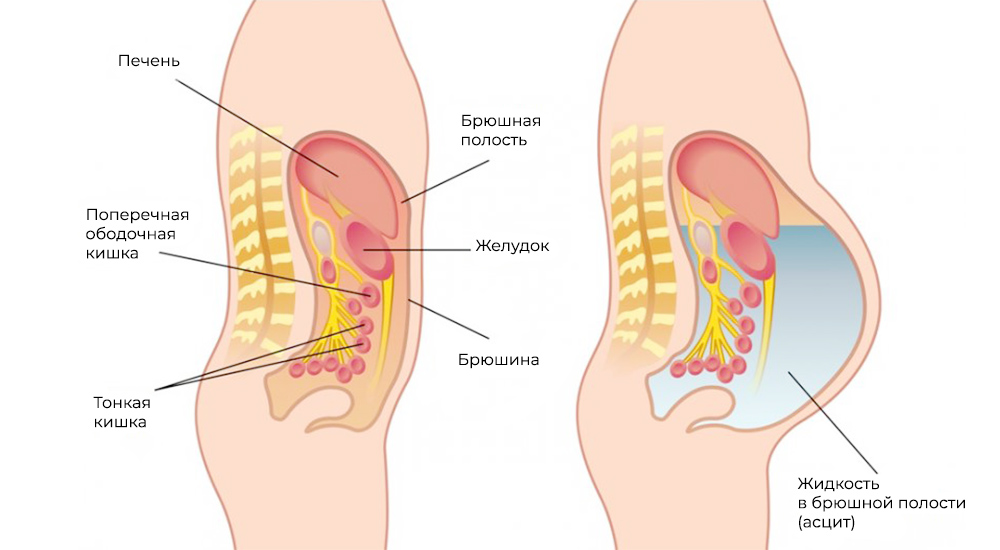
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
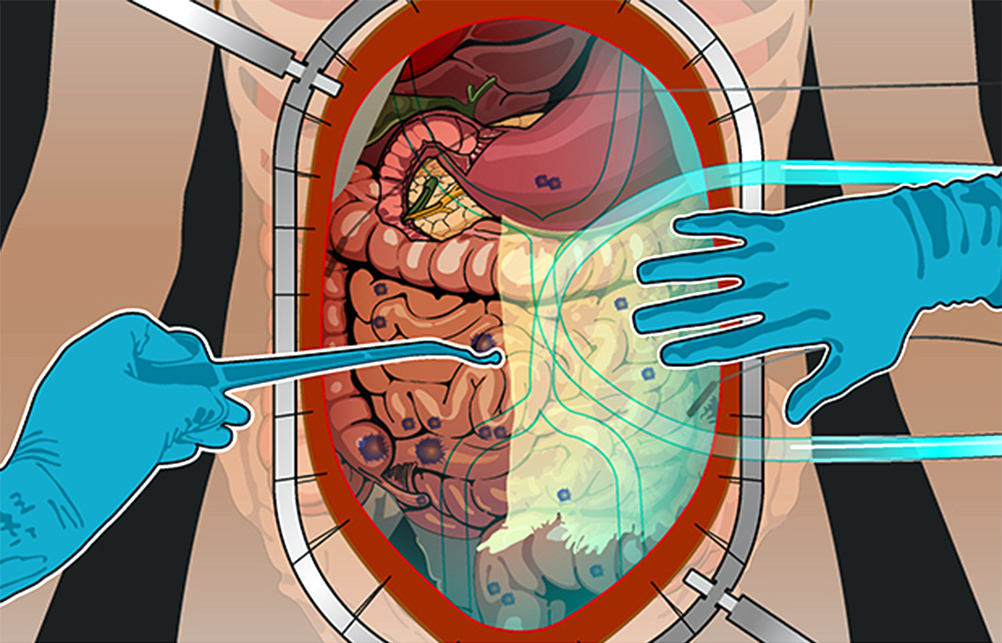
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
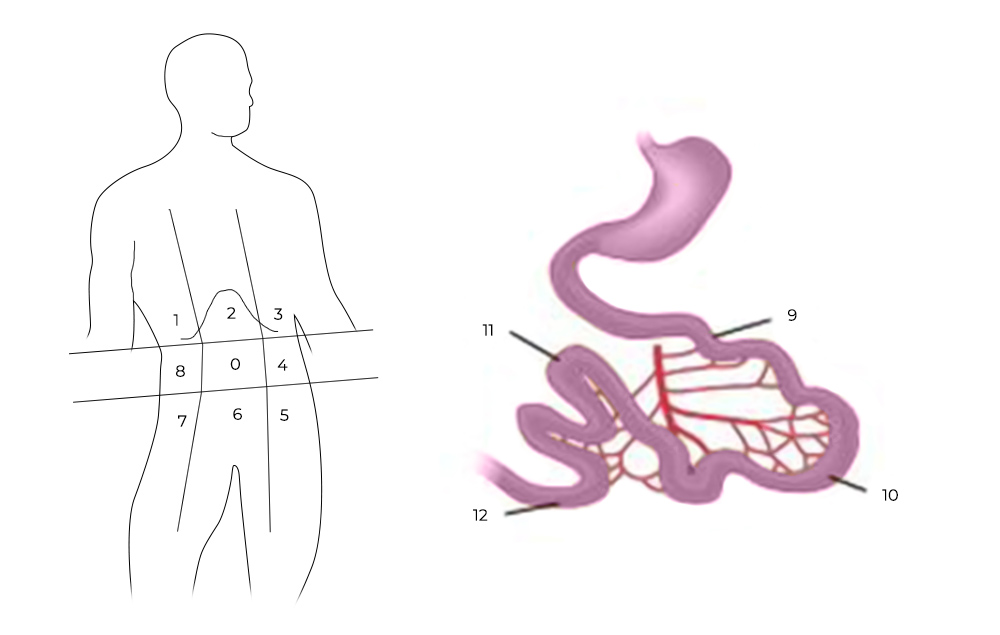
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
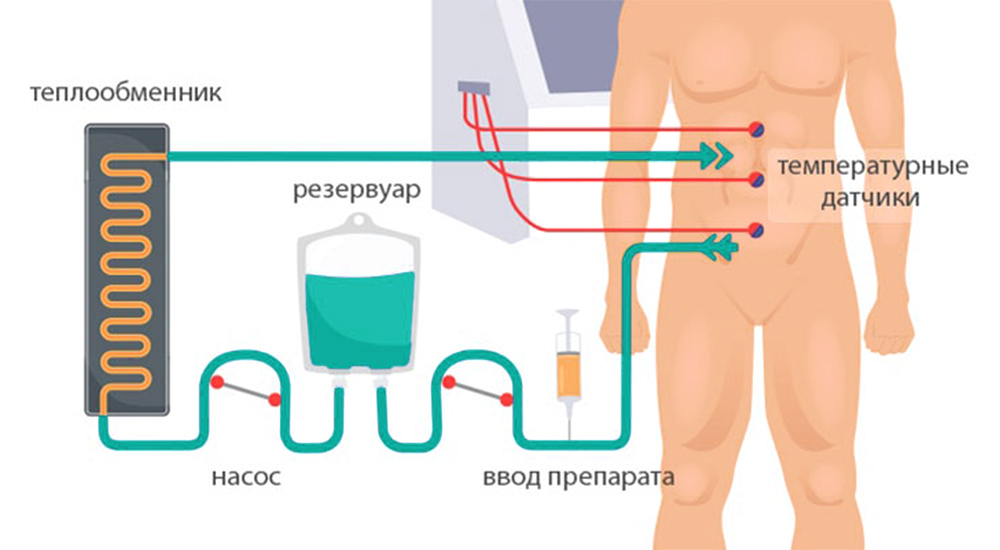
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.

фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко

фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко


фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко
фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко
Глиома — это аномальное разрастание опухолевой структуры в мозговой ткани человека. Это образование представлено совокупностью очень разных клеток, это "гетерогенная опухоль" по терминологии ученых. Особенностями глиомы считают ее отличное от других опухолей происхождение и отсутствие метастазирования. Однако ее опухолевые клетки обладают способностью мигрировать в здоровую ткань мозга, что значительно усложняет ее лечение. Глиобластома — самая агрессивная стадия глиомы.
Традиционные подходы: хирургическое удаление опухоли, лучевой метод и химиотерапия, к сожалению, не очень продлевают жизнь пациентам. Хирургическое вмешательство не позволяет полностью удалить опухолевые клетки, так как, во-первых, нейрохирург не может удалить лишнее, щадя жизненно важные ткани мозга; во-вторых, опухоль представляет собой неровную структуру без четких границ, и неизвестно, сколько опухолевых клеток уже проникло в ткани здорового мозга. Лучевое лечение и химиотерапия способны лишь притормозить рост опухоли, но не остановить его.
Развитие молекулярных методов позволило изучить глиомы на уровне генов. Результатом исследований явилось изменение классификации Всемирной организации здравоохранения в 2016 году, куда вошли понятия о ключевых для развития глиом мутациях нескольких генов. Классификация стала более четкой и основанной не на визуальных особенностях клеток опухоли, а на их молекулярных характеристиках.
Но и это не очень продвинуло терапию заболевания и не улучшило перспективы пациентов. Ученые во всем мире создают международные консорциумы для поиска решения.
Она объединила специалистов в области медицины, биологии, химии, физики и биоинформатики, которые разрабатывают новые подходы к диагностике и лечению глиомы. Физики, химики, биологи и медики активно ищут отличия между различными формами злокачественности глиомы.
Предполагается, что успех может быть достигнут при трех условиях: 1) максимально ранней диагностике, 2) усовершенствовании технологий, позволяющих четко визуализировать опухоль и максимально полно удалить ее, 3) индивидуальной терапии для целевого подавления опухолевых клеток на основе анализа молекулярных характеристик опухоли.
Демаркация границ опухоли
При хирургическом удалении опухоли крайне важно не затронуть жизненно важные зоны мозга. Одна из передовых технологий — это операция на головном мозге с пробуждением пациента во время удаления опухоли. В мозге нет болевых рецепторов, и достаточно местного обезболивания. Врач во время операции разговаривает с пациентом и просит его решать простые задачки. Нарушение поведения пациента говорит о том, что врач вторгся в опасную зону. Подобный подход позволяет оперировать опухоли, которые раньше считались неоперабельными.
К успешным достижениям в этой области можно отнести разработку российских нейрохирургов и физиков, которые используют методику интраоперационной нейровизуализации глиом. Перед операцией пациенту вводят перорально 5-аминолевулиновую кислоту (5-АЛК), которая совершенно безопасна для человека, поскольку является промежуточным продуктом обмена в организме. Эта кислота превращается во флуоресцирующее вещество протопорфирин IX.
«Одна из задач, поставленных перед наукой руководством России,— найти эффективные способы диагностики, обнаружения и лечения онкологических заболеваний, среди которых выделяются глиомы головного мозга человека. Российский фонд фундаментальных исследований в кратчайшее время создал соответствующее направление в своей работе: за несколько месяцев был сформирован рубрикатор, собран пул экспертов, проведены конкурсы и открыто финансирование.
Удивительным кажется тот факт, что это флуоресцирующее вещество накапливается именно в опухоли, делая ее видимой при использовании нейрохирургами специальной приставки к операционному микроскопу. Подобная технология позволяет максимально полно удалить опухоль.
На сегодня самый значительный технический прорыв наблюдается в области дооперационной диагностики опухоли. Магнитно-резонансная томография (МРТ) позволяет охарактеризовать расположение и объем опухоли еще до операции. Используют МРТ с контрастным усилением в трех проекциях и в трех режимах.
Также используют МРТ-спектроскопию для оценки метаболизма в опухоли и установки степени анаплазии (потеря клеткой внешних характеристик, по котором ее можно отнести к какому-нибудь типу), а МРТ-перфузию — для определения объема крови, проходящего через опухоль.
Появилось очень важное для пациента исследование — функциональное МРТ-картирование, которое необходимо для определения близости двигательных, речевых, зрительных зон мозга к опухоли. Это необходимо для того, чтобы нейрохирург мог рассчитать, как ему удалить опухоль, нанеся минимальный урон пациенту.
Всемирная организация здравоохранения в 2007 году ввела принцип классификации глиом, разбив их по степени злокачественности и по характеристикам клеток опухоли на четыре группы, которые назвали степенями (Grade). Самая доброкачественная I Grade, самая агрессивная IV Grade, или по-другому — глиобластома. Классификация использовала гистологические характеристики опухолевых клеток. В 2016 году ВОЗ вводит новую классификации глиом, которая требует при постановке диагноза опираться не только на гистологические особенности клеток опухоли, но и на результаты иммуногистохимии и FISH-анализа и секвенирования. Требуется оценивать мутации IDH1/2 и ТР53, делеции ATRX и ко-делеции 1p/19q.
Молекулярный паспорт опухоли
Но одних этих достижений оказывается недостаточно. Опухоли сильно отличаются друг от друга на генетическом уровне. Современные молекулярные подходы позволили характеризовать глиомы по ряду маркеров, однако ученые находят все новые генетические нарушения, которые влияют на чувствительность опухоли к терапии. Вполне вероятно, что через некоторое время ВОЗ предложит новую классификацию опухолей, основанную на большей выборке генетических нарушений и более приближенную к индивидуальной медицине.
Кроме того, растет понимание, что важны не только мутационные исследования генома пациента, но также нужно обратить внимание на транскриптом (результат прочтения генов в данном организме) и протеом опухолевых клеток (набор белков в них, синтезированных в результате прочтения их генома). Они сильно меняются и могут служить как диагностическим фактором, так и терапевтической мишенью. Так, например, обнаружено, что в опухоли часто изменяются транскрипты (молекула РНК) известных генов, подобное нарушение может приводить к продуцированию измененного белка или вовсе к тому, что белок не будет продуцироваться. Эти изменения могут служить для диагностики степени злокачественности, а также могут войти в панель прогностических признаков.
Новые направления в лекарственной терапии глиомы



Фото: предоставлено проф. А,В Головиным
Фото: предоставлено проф. А,В Головиным
Фото: предоставлено проф. А,В Головиным
Современные препараты химиотерапии стимулируют гибель опухолевых клеток. Но они также уничтожают и нормальные активно делящиеся клетки организма, что ухудшает общее состояние пациента. При этом не достигается полная гибель опухолевых клеток глиомы. Подобное лечение не позволяет продлить жизнь пациенту на длительный срок. Нужно искать новые подходы. Один из векторов таких исследований — это таргетная терапия, которая увеличивает вероятность доставки терапевтических молекул-киллеров непосредственно к клеткам опухоли. Например, есть разработки по использованию наночастиц, которые позволяют доставлять к клеткам глиомы пониженные дозы токсических веществ.
Как определить, преобладание какого типа клеток наблюдается в той или иной глиоме? Как понять, какое лекарство на нее подействует и насколько оно будет эффективно? Можно поставить еще много вопросов, ответы на которые можно дать, получив клеточные культуры из опухолевой ткани пациента. По ним мы можем проанализировать состав опухоли, оценить маркеры, характерные именно для этой опухоли, оценить способность клеток мигрировать и охарактеризовать их. Все современные технологии и новые лекарства могут быть проверены на клеточных культурах глиомы человека. Наконец, можно подобрать вариант терапии (условия лучевой терапии, химиотерапию), которые будут лучшими именно для этого пациента, а это большой шаг к индивидуальной терапии для каждого пациента.
Другой подход предполагает использование онколитических вирусов, которые могут как стимулировать апоптоз (образно говоря, принуждение к самоубийству) опухолевых клеток, так и вызывать иммунный ответ, который также приводит к гибели клеток опухоли. Несмотря на ряд недостатков этой терапии, известно, что некоторые из подобных вирусов уже проходят первую и вторую фазы клинических испытаний.
Появилось новое направление по применению структурированных малых молекул ДНК и РНК, называемых аптамерами, которые предполагают использовать в терапии глиом вместо антител, а также для диагностики опухолей. И такие разработки ведутся у нас в стране. Выбирается мембранный белок, наиболее характерный для опухолевой клетки, и подбирается к нему высокоточный аптамер (как ключ к замку). Подобный аптамер может служить для терапии, диагностики, а также для таргетной доставки другого лекарства.
Нельзя не упомянуть развитие иммунотерапии опухоли, за что была вручена Нобелевская премия по медицине 2018 года. Разрабатываются антитела, которые способны заставить клетки собственно иммунной системы пациента узнавать опухоль и уничтожать ее, как все чужеродное.
Понять происхождение глиом
Он не бессмертен.
Галина Павлова, доктор биологических наук, профессор РАН, заведующая лабораторией нейрогенетики и генетики развития Института биологии гена РАН
PDF-версия
- 18
- 19
- 20
Читайте также:

