Циторедуктивная операция при раке яичников что это такое
Необходимость удаления максимально возможного объема опухоли во время первой операции по поводу диссеминированного рака яичника (РЯ) стала аксиомой для многих онкогинекологов. Известно, что значительное снижение опухолевой нагрузки дает выраженный паллиативный эффект. По данным Munnell, 5-летняя выживаемость больных после операций в максимально возможном объеме составляла 28 %, после частичной резекции — 9 %, а после биопсии — 3 %. Для 14 выживших пациенток операция в максимально возможном объеме включала гистерэктомию с двусторонней аднексэктомией и оментэктомию.
Aure и соавт. отметили существенное улучшение выживаемости пациенток с III стадией рака яичника (РЯ) после удаления всей видимой опухоли. Griffiths и соавт. получили аналогичные результаты при использовании линейного уравнения множественной регрессии выживаемости в качестве зависимой переменной для одновременного контроля множества терапевтических и биологических факторов, влияющих на исход заболевания у отдельных пациенток.
Самыми важными факторами были гистологическая степень дифференцировки и наибольший размер остаточной опухоли после первичного хирургического лечения. Операция улучшает выживаемость только в том случае, если максимальный размер остаточной опухоли составляет менее 1,6 см.
Так называемые циторедуктивные операции (debulking operation) получили значительное распространение при лечении рака яичника (РЯ). Цель хирургического вмешательства заключается в уменьшении объема новообразования для оптимальной эффективности адъювантной терапии. Все формы дополнительного лечения наиболее эффективны при минимальном объеме остаточной опухоли. Это особенно касается истинного рака яичника (РЯ) — солидных опухолей, наиболее чувствительных к химиотерапии (XT). Часто аккуратный и терпеливый хирург может удалить крупные опухолевые очаги, которые на первый взгляд казались неоперабельными.
При использовании бессосудистых зон забрюшинного пространства можно выделить воронкотазовую связку, мочеточник и изолировать сосуды, кровоснабжающие яичник. После их перевязки и пересечения ретроградное удаление больших опухолей яичников выполнить проще и безопаснее. Выделение мочеточников проводят с максимальной осторожностью, однако их повреждение бывает даже у самых опытных хирургов. Конгломераты большого сальника при раке яичника (РЯ) удаляют через бессосудистую зону поперечно-ободочной кишки после лигирования правой и левой желудочно-сальниковых артерий. Удаление больших новообразований яичников и метастатически пораженного сальника часто уменьшает общий объем опухоли на 80—99 %.
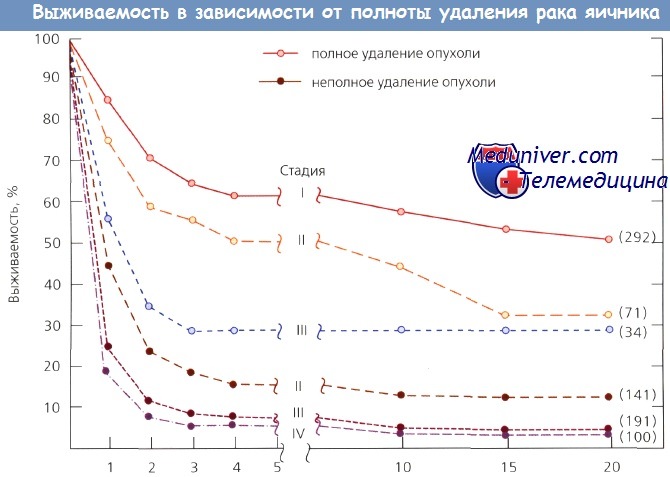
Сравнение выживаемости пациенток при полном и неполном удалении опухоли в зависимости от стадии рака яичников
Теоретическим обоснованием рассматриваемых операций (debulking procedures) служит концепция о повышении эффективности адъювантной терапии после существенного снижения числа опухолевых клеток. Кроме того, при солидных опухолях, к которым относят рак яичника (РЯ), элиминация большой популяции клеток в фазе покоя (G0) может вызывать переход оставшихся клеток в уязвимую для цитостатиков и облучения фазу пролиферации. Несколько скрупулезных ретроспективных исследований продемонстрировало увеличение выживаемости больных, у которых с помощью хирургического метода лечения удалось добиться статуса минимального опухолевого носительства. Большой опыт, накопленный в M.D. Anderson Hospital and Tumor Institute, свидетельствует о существенном повышении эффективности XT второй линии при II и III стадиях рака яичника (РЯ), если после первой операции не оставались макроскопические остаточные новообразования или диаметр единичной остаточной опухоли не превышал 1 ем.
При этом 2-летняя выживаемость пациенток со II стадией без остаточных опухолей составила 70 %, а при отдельных узлах диаметром до 1 см — 50 %.
Эти показатели хорошо согласуются с часто публикуемыми цифрами общей выживаемости при раке яичника (РЯ). GOG проводила детальный анализ результатов хирургического лечения больных с поздними стадиями заболевания для определения концепции первичной циторедуктивной операции. На первом этапе сравнили выживаемость пациенток с III стадией рака яичника (РЯ) с опухолью в брюшной полости до 1 см (1-я группа) и 1 см и более (2-я группа); больным 2-й группы опухоли уменьшили до 1 см и менее.
Если хирургическая операция — единственный важный фактор, как рассуждали исследователи, то выживаемость в обеих группах должна быть одинаковой. Однако на самом деле этого не произошло. Больные с небольшим размером опухоли 1-й группы жили дольше по сравнению с пациентками, у которых благодаря хирургической циторедукции достигнут малый размер опухоли (2-я группа). Этот феномен свидетельствует о том, что биологические свойства новообразования имеют важное прогностическое значение. На следующем этапе исследователи GOG оценили влияние наибольшего диаметра остаточной опухоли на выживаемость пациенток после субоптимальных циторедуктивных операций. Они обнаружили, что циторедукция до 2 см и менее значительно увеличивала выживаемость, но при любых остаточных опухолях диаметром более 2 см этот показатель был одинаковым. Следовательно, если остаточную опухоль нельзя уменьшить до 2 см и менее, то выживаемость не зависит от величины диаметра остаточной опухоли.
При исследовании оптимальной и субоптимальной циторедукции эксперты GOG выделили три группы: микроскопическая остаточная опухоль, диаметр остаточной опухоли менее 2 см или более 2 см. В 1-й группе 4-летняя выживаемость составила примерно 60 %, во 2-й — 35 % и в 3-й — менее 20 %. Самое удивительное — это неспособность циторедуктивной операции оказать хотя бы минимальное влияние на выживаемость, если не удалосьуменьшитьдиаметр остаточной опухоли до 2 см и менее.
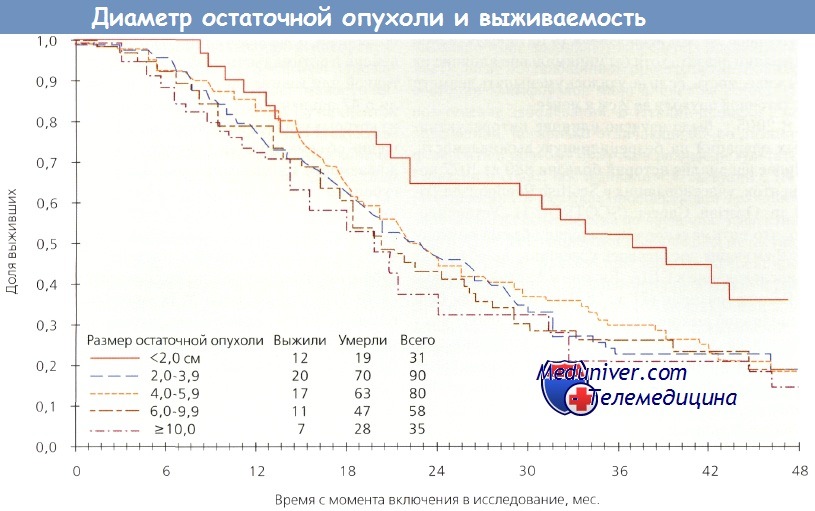
Выживаемость в зависимости от максимального диаметра остаточной опухоли
В 2005 г. было изучено влияние циторедуктивных операций на безрецидивную выживаемость. Проведен анализ историй болезни 889 из 1077 пациенток, участвовавших в Scottish Randomised Trial in Ovarian Cancer (SCOTROC-1). Установлено, что оптимальное уменьшение объема опухоли ( 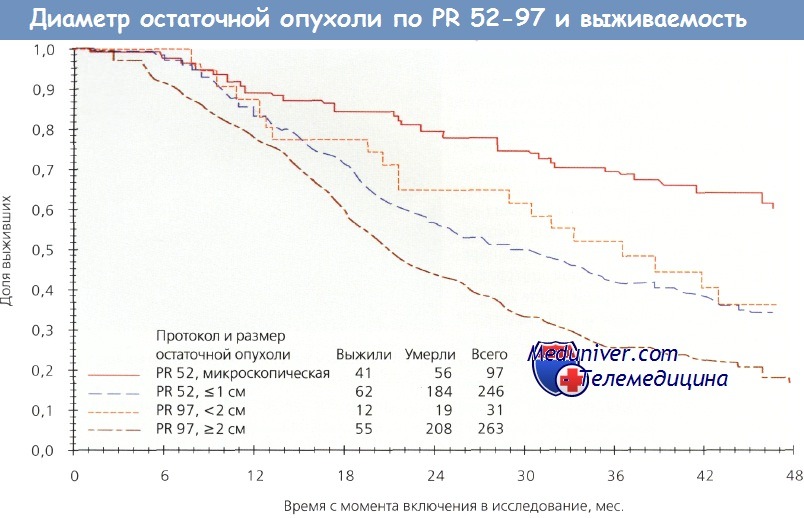
Выживаемость в зависимости от максимального диаметра остаточной опухоли, согласно 52-му и 97-му протоколам (PR) Gynecologic Oncology Group
Эксперты Southwest Oncology Group и GOG исследовали эффективность интраперитонеальной и внутривенной ХТ у пациенток с III стадией РЯ после оптимальных циторедуктивных операций и установили, что при микроскопической остаточной опухоли, остаточном поражении до 0,5 или 0,5—2,0 см медиана выживаемости составила 76, 42 и 32 мес. соответственно. Eisenkop и соавт. сообщили о 163 пациентках с IIIс и IV стадиями РЯ; полную циторедукцию можно было выполнить в 86 % случаев. Медиана выживаемости для всей группы составила 54 мес, а для больных с оптимальной циторедукцией — 62 мес.
Целесообразность выполнения лимфаденэктомии при поздних стадиях рака яичника (РЯ) продолжает оставаться предметом обсуждения. Во всех исследованиях обнаружено обширное поражение лимфоузлов при поздних стадиях заболевания (> 50 %). Вопрос заключается в том, влияет ли лимфаденэктомия на выживаемость. Burghardt один из первых высказал мнение о ее терапевтической пользе. По его данным, даже при наличии метастазов в лимфоузлах, выживаемость пациенток с поздними стадиями РЯ, которым выполнили хирургическое стадирование, а следовательно, и лимфаденэктомию, выше, чем без такого вмешательства. Некоторые авторы считают, что метастазы в лимфоузлах в отличие от интраперитонеальных не так хорошо поддаются XT, поэтому их необходимо удалять. Противники утверждают, что рецидивы значительно чаще возникают в пределах брюшной полости, но не в забрюшинном пространстве, поэтому состояние лимфоузлов мало влияет на естественное течение заболевания.
В Италии провели 2 исследования, несколько отличающихся по дизайну, и, вероятно, поэтому получили разные результаты. Parazzini и соавт. обследовали 456 женщин с III и IV стадиями РЯ в рамках проспективного рандомизированного исследования по изучению эффективности XT. У 161 пациентки обнаружены метастазы в лимфоузлах, причем при низкодифференцированных опухолях (G3) чаще, чем при высоко- и умереннодифференцированных (G1 и G2). Авторы не выявили отличий в показателях выживаемости между больными с метастатическими и интактными лимфоузлами. Следовательно, положительное влияние удаления метастатических лимфоузлов на выживаемость не установлено. Scarabelli и соавт. выполнили лимфаденэктомию 98 больным РЯ IIIс—IV стадии, у которых не было макроскопических остаточных опухолей; в группу контроля вошло 44 пациентки, которым лимфаденэктомия не проводилась. Выживаемость больных, которым выполнили лимфаденэктомию, была значительно лучше (анализ Кокса). Результаты этого исследования показали, что лимфаденэктомия обеспечивает потенциальный терапевтический эффект, но в определенной группе пациенток. Ранее обсуждались аналогичные выводы клинического испытания SCOTROC-1.
Мы обязательно выполняем стандартную тазовую и парааортальную лимфаденэктомию, но при условии оптимального уменьшения объема опухоли. Эффективность лимфаденэктомии при большом объеме остаточной опухоли, по нашему мнению, сомнительна. При поздних стадиях РЯ показано удаление всей опухоли, если это технически возможно. Для этого разработано много способов. Некоторые врачи используют хирургический УЗ-аспиратор, другие предлагают электрохирургическую резекцию с помощью электрокоагулятора с аргоновой приставкой, третьи все еще убеждены, что резекция диафрагмальной брюшины или мышцы играет важную роль в циторедукции. Влияние всех этих методов на выживаемость окончательно не определено. Следует с осторожностью относиться к успешному применению той или иной методики в руках отдельных энтузиастов и подождать весомого подтверждения в публикациях.
Растет число сторонников проведения лапароскопии вместо лапаротомии. Технически это возможно, но целесообразность удаления больших объемных образований придатков матки с помощью лапароскопа сомнительна. В публикациях описаны случаи возникновения метастазов в местах введения троакаров. Феномен рецидива рака в области послеоперационного рубца хорошо известен, однако удивительно, что даже при большой интраабдоминальной опухоли это редкость. Wang и соавт. провели обзор литературы для определения факторов риска ранних рецидивов в местах установки портов. Из всех злокачественных опухолей женских половых органов метастазы в местах введения троакаров чаще всего возникают при раке яичника (РЯ), независимо от того, имеется асцит или нет, стадии заболевания (ранней или поздней), появления после диагностических или паллиативных операций.
Такие метастазы обнаруживали и при опухолях низкой степени злокачественности. Чаще они возникают при асците и канцероматозе брюшины. Наименьший промежуток времени между лапароскопией и появлением метастаза в месте установки порта составил 8 дней. По этому поводу предложили несколько теорий: имплантация раковых клеток при травматической диссеминации во время удаления первичной опухоли, прямая имплантация инструментами, создание градиента давления при пневмоперитонеуме с последующим выходом газа (через порты), который привел опухолевые клетки во флотирующее состояние. Лапароскопия больше подходит для удаления доброкачественных образований придатков матки. При подозрении на РЯ мы предпочитаем лапаротомный доступ. Если во время лапароскопии обнаруживают РЯ, необходимо немедленно перейти на лапаротомию.
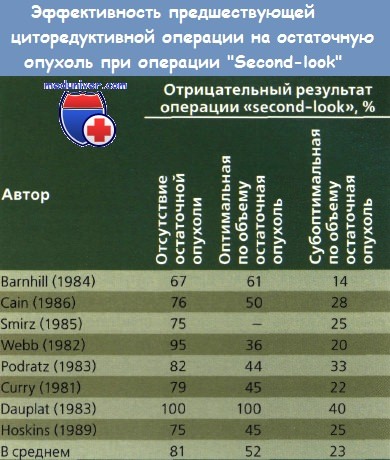
Группа EORTC сообщила о собственном опыте циторедуктивных операций при поздней стадии рака яичника (РЯ). Пациентки получили 3 курса цисплатина и циклофосфамида, и затем их разделили случайным образом на две группы: одним выполнили циторедуктивную операцию, другим — нет. Все женщины получили 6 курсов XT. Среди 278 пациенток медиана выживаемости составила 26 и 20 % (операция и без операции; р = 0,012). Многофакторный анализ показал, что циторедуктивная операция была независимым прогностическим фактором. После учета всех факторов прогноза оказалось, что хирургическое вмешательство снизило риск смерти на 33 % (р = 0,008).
В 2004 г. GOG сообщила о проведении аналогичного исследования, в которое было включено 550 больных. При неоптимальной первичной цито-редуктивной операции (остаточная опухоль более 1 см) назначали 3 цикла паклитаксела с цисплатином. После этого пациенток рандомизировали на две группы: одним продолжили XT, а другим выполнили вторую циторедуктивную операцию и продолжили XT. Промежуточная (дополнительная) между курсами XT операция не привела ни к улучшению безрецидивной выживаемости, ни к снижению относительного риска смерти. Авторы предполагают, что разница в результатах может быть обусловлена более агрессивным выполнением хирургических вмешательств у пациенток в исследовании GOG по сравнению с EORTC. Если суммировать оба исследования, можно сделать следующее заключение: пациенткам с поздними стадиями рака яичника (РЯ) показана хотя бы одна циторедуктивная операция, но с максимально возможным уменьшением объема опухоли, лучше, если се проведет онкогинеколог.
Нет сомнений, что тщательно выполненная первичная циторедуктивная операция — основной фактор, определяющий отдаленную выживаемость. Выбор времени для проведения хирургического вмешательства, целью которого служит удаление максимально возможного объема опухоли, остается предметом обсуждения. При относительных противопоказаниях (возраст, сопутствующие заболевания, плевральный или перикардиальный выпот) и распространенном злокачественном процессе в брюшной полости успешную циторедуктивную операцию осуществить невозможно, поэтому настоятельно рекомендуется рассмотреть вопрос о назначении неоадъювантной XT. Хороший клинический ответ после 2—4 циклов XT часто дает возможность выполнить эффективную циторедуктивную операцию с небольшой частотой осложнений. До начала XT нужно точно установить локализацию рака (яичник, маточная труба или брюшина), используя для этого цитологическое исследование или малоинвазивное хирургическое вмешательство. На сегодня неоадъювантная XT с последующей циторедуктивной операцией представлена в нескольких небольших ретроспективных исследованиях, включающих от 20 до 90 пациенток. Результаты указанной терапии аналогичны таковым при первичном хирургическом вмешательстве с последующей XT.
В текущем клиническом исследовании, проводимом EORTC и Национальным институтом рака (NCI) в Канаде, принимает участие более 700 больных, набор которых закончен в 2006 г. Ожидают, что это исследование даст подробную информацию о показаниях к неоадъювантной XT с последующей операцией и результатах такого комбинированного лечения.
У пациенток после обширного хирургического вмешательства увеличен риск расхождения краев раны, поэтому нужно использовать методики ушивания передней брюшной стенки через все слои. Однако в ситуациях выпячивания отечных петель кишечника из брюшной полости во избежание прорезания фасции и снижения риска несостоятельности рубца лучше наложить узловые швы с отсроченным их затягиванием.
Тактику лечения рака яичника во многом определяет стадия заболевания, а также учитываются и другие факторы. За исключением опухолей, выявленных на ранней стадии, обычно при раке яичников используется комбинация хирургического вмешательства, химиотерапии, таргетной терапии. А также пациентам может быть предложено участие в клинических исследованиях. Существуют свои подходы к лечению рецидивирующего рака яичника и выявленного у беременных.
Стадия заболевание во многом определяет тактику лечения рака яичников, как правило, применяют комбинацию различных вариантов циторедуктивной операции и химиотерапии.
Чаще всего рак яичников выявляет или, по крайней мере, подозревает акушер-гинеколог, или врач общей практики (семейный врач). После чего пациенту рекомендуется проконсультироваться с гинекологом-онкологом. Только этот врач должен заниматься дальнейшей диагностикой и разработкой плана лечения совместно с другими специалистами. Помимо гинеколога-онколога, следующие специалисты могут входить в штат мультидисциплинарной команды: врач-химиотерапевт, абдоминальный хирург, патолог (рассматривает под микроскопом ткани, удаленные во время операции), врач паллиативной помощи (занимается устранением симптомов, связанных с раком) и специалист по фертильности.
Существует два базовых подхода к лечению рака яичников:
Большинство женщин с эпителиальным раком яичников в своём плане лечения будут иметь комбинацию этих способов изъятия из организма злокачественных клеток. Иногда, например, при герминогенных или стромальных опухолях яичников, или при эпителиальной карциноме стадии IA используется только хирургическое лечение.
Хирургическое лечение
Оперативное вмешательство в настоящее время является основой лечения рака яичников. Операция может выступать как самостоятельный метод лечения или как важнейший этап комплекса лечебных мероприятий. Исследования показали, что, когда хирургическое вмешательство выполняется гинекологом-онкологом, то результаты, как правило, намного лучше, чем в ситуации ее выполнения врачами других хирургических специальностей.
Объем хирургического вмешательства при раке яичника во многом зависит от распространения злокачественной опухоли и от общего состояния здоровья пациентки.
Довольно часто эти опухоли выявляются на ранних стадиях у молодых пациенток, поэтому обычно ограничиваются удалением только пораженного яичника (овариоэктомия), что позволяет сохранить другой яичник и матку. Такая операция показана при эпителиальной карциноме, если она выявляется на очень ранней стадии.
В ситуации удаления обоих яичников существует несколько вариантов сохранения фертильности, например, замораживание эмбрионов. Если пациентка заинтересована в этом, то до начала лечения по поводу рака яичников необходимо проконсультироваться с врачом, который специализируется на сохранении фертильности.
Около 80% всех эпителиальных карцином яичников диагностируется на поздних стадиях (стадия III и стадия IV). В отличие от рака молочной железы и легких (хирургическое вмешательство при стадии IV не увеличивает общую выживаемость) при 4 стадии рака яичников выполнение операции позволяет продлить жизнь. Она также позволяют улучшить результаты проводимой в последующем химиотерапии.

Циторедуктивная операция является стандартным методом лечения рака яичников. Цель хирургического вмешательства — как можно больше удалить опухолевой массы, иссечь все опухолевые узлы диаметром более 1 сантиметров.
Возможные результаты этой операции:
- Полная циторедукция : весь видимый рак удален.
- Оптимальная : рак сохраняются в виде очагов диаметром менее 1 см.
- Субоптимальная : остаются очаги рака диаметром более 1 см.
Помимо удаления яичников и маточных труб (двусторонняя сальпингоофорэктомия), матки (гистерэктомия), циторедуктивная операция при эпителиальном раке яичников предусматривает иссечение и других тканей. Например, часто удаляется сальник (широкая и протяженная по длине складка внутренностной брюшины), — производится оментэктомия.
А также выполняется множественная биопсия: удаляются некоторые лимфоузлы (лимфодиссекция), участки ткани с поверхности органов малого таза и брюшной полости, таких как мочевой пузырь, кишечник, печень, селезенка, желудок, желчный пузырь и поджелудочная железа. Как правило, удаляется аппендикс.
Если во время операции хирург обнаруживает, что рак яичников распространился на кишечник, то удаляют пораженный участок кишки.
Кровотечение, инфекции и реакции на анестезию — наиболее частые осложнения хирургического лечения рака яичника.
Химиотерапия
При раке яичников практически невозможно удалить всю опухолевую массу. Даже если во время операции удается резецировать все видимые диссеминаты (скопление раковых клеток), то, несмотря на это, частота рецидивов сохраняется очень высокой — около 80 процентов — это означает, что в организме остаётся множество микроскопических скоплений злокачественных клеток. Поэтому химиотерапия, как правило, показана всем женщинам с эпителиальным раком яичников. Она также необходима при злокачественных герминогенных опухолях 4 и 3 стадии.
Обычно используется комбинация следующих химиопрепараты:
- Препараты платины : параплатин (карбоплатин) или платинол (цисплатин).
- Таксаны : таксол (паклитаксел) или таксотер (доцетаксел).
Также используют и другие химиотерапевтические средства, например, доксил (липосомальный доксорубицин) и гемзар (гемцитабин).
При герминогенных опухолях схемы химиотерапии состоят из комбинации платинола (цисплатин), VP-16 (этопозид) и блеомицина.
Существуют следующие способы введения химиопрепаратов:
- Внутривенный (в / в): внутривенная химиотерапия обычно проводится каждые три-четыре недели и состоит из трех-шести циклов. Доставка цитостатиков в кровь может осуществляться после установки внутривенного катетера или с помощью инфузионной порт-системы для химиотерапии.
- Внутрибрюшинная химиотерапия : процедура предусматривает установку катетера непосредственно в брюшную полость, после чего туда водится цитостатик.
Внутривенное введение используют чаще, тем не менее в последнее время внутрибрюшинной химиотерапии при раке яичников уделяется больше внимания. Многие специалисты считают, что её роль при лечении рака яичников недооценена.
В обзоре исследований, проведенном в 2016 году, было подтверждено, что выживаемость при проведении внутрибрюшинной химиотерапии выше, чем при внутривенной. В одном из исследований было установлено, что при внутрибрюшинной химиотерапии чаще встречаются проблемы со стороны пищеварительного тракта, чем при внутривенном введении цитостатиков, а ототоксичность (нарушения слуха) наблюдаются реже.
Внутрибрюшинная химиотерапия противопоказана, если есть дисфункция почек или спаечная болезнь брюшной полости, на данный момент она обычно рекомендуется женщинам с раком яичника IV стадии и тем, у кого была произведена субоптимальная циторедукция.
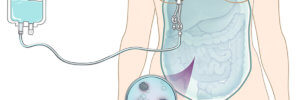
По сравнению с внутривенным введением, внутрибрюшинная химиотерапия позволяет в несколько раз увеличить концентрацию лекарственного средства в брюшной полости. Кроме того, клинические исследования продемонстрировали преимущество внутрибрюшинной химиотерапии, при ее проведении перед циторедуктивной операции.
Цитостатики препятствуют делению клеток, что приводит к гибели быстрорастущих клеток, в том числе и злокачественных. К сожалению, химиотерапия действует и на нормальные клетки, вызывая нежелательные эффекты.
Наиболее часто при проведении химиотерапии рака яичников наблюдаются следующие побочные эффекты:
- Тошнота и рвота : их терапия и предотвращение значительно улучшилось в последние годы, современные противорвотные средства позволяют проходить химиотерапию под полным контролем этих побочных эффектов.
- Подавление костного мозга приводит к снижению количества лейкоцитов, эритроцитов и тромбоцитов. Лейкопения (мало лейкоцитов), вызванная химиотерапией, предрасполагает к развитию инфекционных заболеваний.
- Повышенная усталость .
- Временная алопеция (потеря волос).
К поздним токсическим проявлениям химиотерапии относят: периферическую невропатию (покалывание, боль и онемение в конечностях) и ототоксичность. Существует также небольшой риск развития вторичного рака. Побочные эффекты и осложнения химиотерапии несопоставимы с преимуществами выживания при ее применении.
Таргетная терапия
Таргетная терапия позволяет блокировать определенные этапы роста рака. Поскольку таргетные препараты направлены конкретно на раковые клетки, то при их использовании наблюдается меньше побочных эффектов, чем при химиотерапии. При раке яичника используются следующие таргетные препараты:
- Ингибиторы ангиогенеза : злокачественная опухоль для нормального развития должна создать себе новые пути кровоснабжения. Ингибиторы ангиогенеза угнетают этот процесс, они подавляют создание новых кровеносных сосудов. Авастин (бевацизумаб) замедляет рост рака яичников, но при его использовании встречается серьезные побочные эффекты, такие как кровотечение, тромбообразование и перфорация кишечника.
- Ингибиторы PARP : первый ингибитор PARP был одобрен для лечения рака яичников в 2015 году. В отличие от химиотерапии эти препараты применяют перорально (в виде таблеток). Ингибиторы PARP блокируют пути метаболизма клеток с мутацией гена BRCA, вызывая их гибель. На сегодняшний день из ингибиторов PARP доступны Lynparza (олапариб), Rubraca (рукапраиб) и Zejula (нирапариб).
Помимо использования ингибиторов PARP, при выявлении мутации BRCA, Lynparza и Zejula может назначаться женщинам без данной мутации с целью лечения рецидивов рака яичников после химиотерапии. Побочные эффекты: боль в суставах и мышцах, тошнота и анемия, как правило, они переносятся лучше, чем при химиотерапии. Существует также небольшой риск (такой же как и при химиотерапии) возникновения вторичных раковых заболеваний, например, лейкоза.
Другие методы лечения
Препараты гормональной терапии чаще используются при раке молочной железы, чем при раке яичников. Лекарственные средства, которые подавляют яичник, такие как тамоксифен и ингибиторы ароматазы могут применяться при лечении стромальных опухолей и редких типов эпителиальных раком яичника (муцинозного, эндометриоидного). Лучевая терапия обычно не используется при этом раке, ее могут применять в случае обширного метастазирования в брюшной полости.
Клинические исследования
В настоящее время проводится множество клинических испытаний, в которых рассматриваются комбинации вышеуказанных методов лечения, а также новые методы лечения как для впервые выявленного рака яичников, так и для рецидива.
Иногда единственный способ получить более новый и эффективный вариант лечения — это участвовать в одном из этих исследований.
Комплементарная медицина (КМ)
На сегодняшний день нет данных, которые бы подтверждали, что комплементарная медицина может помочь справиться с раком яичников. Отказ от традиционных методов лечения в пользу таких вариантов фактически вредит пациенткам, снижают их шансы на выживание.
Тем не менее некоторые методики комплементарной терапии могут помочь справиться с симптомами рака, улучшить качество жизни. Многие онкологические центры сейчас предлагают различные альтернативные методы лечения. Иглоукалывание, медитация, йога, музыкальная терапия подтвердили свою пользу в нескольких исследованиях.
Поговорите с вашим онкологом, прежде чем использовать какие-либо витаминные или минеральные добавки. Все они метаболизируются печенью или почками и, поэтому теоретически могут повлиять на фармакокинетику химиотерапевтических препаратов. Особого внимания заслуживает использование витамина Е, он увеличивает вероятность возникновения кровотечения во время или после операции. Другие добавки повышают риск появления нарушений сердечного ритма при проведении общего наркоза.
Считается, что омега-3 жирные кислоты могут быть полезны при лечении рака яичников. Они способны помочь сохранить мышечную массу у пациенток с раковой кахексией, которая наблюдается у 80% женщин с раком яичника в поздней стадии.
Лечение рецидивов
К сожалению, около 80 процентов случаев рака яичников, которые лечатся с помощью стандартной терапии, описанной выше, рецидивируют. Подход к лечению рецидива зависит от сроков его возникновения:
- Рецидив сразу же после окончания лечения. Такие случаи считаются платинорезистентными (устойчивые к химиотерапии платиной). Варианты: повторная химиотерапия с теми же лекарствами (хотя это обычно приводит к плохому результату), использование другого режима химиотерапии (существует несколько альтернативных схем) или участие в клинических исследованиях.
- Рецидив в течение шести месяцев после лечения: такие варианты также считается устойчивыми к платине. Применяются альтернативные схемы химиотерапии. Операция обычно не рекомендуется.
- Рецидив через шесть месяцев или более после завершения лечения : если первоначальная химиотерапия включала препараты платины (платинол или карбоплатин), то опухоль считается чувствительной к ним. При данном варианте обычно рекомендуется повторная циторедукция с последующей химиотерапией, содержащей платину, или альтернативные режимы.
Лечение во время беременности
В большинстве случаев раки яичников ассоциированные с беременностью представлены опухолями стромы или полового тяжа. Чаще поражается только один яичник, что позволяет выполнить операцию по его удалению во время беременности (оптимальный срок хирургического вмешательства считается второй триместр).

Дисгерминома чаще всего диагностируется у беременных женщин (до 30%), как правило, на ранних стадиях, имеет медленный рост и обладают низкой степенью злокачественности..
Циторедуктивная операция показана беременным женщинам с эпителиальным раком яичников и злокачественными новообразованиями стромы или полового тяжа на поздних стадиях. Оперативное вмешательство стараются выполнить как можно раньше. Химиотерапия относительно безопасна после первого триместра и обычно начинается примерно через 16 недель. При эпителиальной карциноме обычно используют комбинацию параплатины (карбоплатин) и таксола (паклитаксел), а схемы, содержащие платинол (цисплатин), вельбану (винбластин) и блеомицин, применяют при неэпителиальных опухолях.
Читайте также:

